修回日期: 2015-08-30
接受日期: 2015-09-21
在线出版日期: 2015-10-18
目的: 对Tribbles相关蛋白3(Tribbles related protein 3, TRB3)及CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)在高脂高糖饮食诱导的大鼠非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)中的表达变化进行研究并探讨他们在NAFLD中的作用.
方法: 将30只Wistar大鼠随机分为正常组和NAFLD模型组, 每组各15只. 模型组大鼠采用高脂高糖饮食诱导NAFLD, 正常组大鼠则给予普通饲料喂养, 造模时间总计为16 wk. 血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)的含量采用全自动生化分析仪进行检测; 应用PCR技术对肝脏中TRB3及CHOP mRNA水平的改变进行检测; 应用免疫组织化学技术对肝脏中TRB3及CHOP蛋白水平的改变进行检测; 采用流式细胞仪检测细胞凋亡改变.
结果: 模型组大鼠血清中TC、TG和LDL含量较正常组大鼠显著升高(P<0.05), 而HDL则明显低于正常组(P<0.05); 与正常组相比, 模型组大鼠肝脏中TRB3及CHOP mRNA水平均显著增加(P<0.05或P<0.01); 免疫组织化学结果显示模型组大鼠肝脏中TRB3及CHOP蛋白表达水平较正常组大鼠显著升高(P<0.01); 此外流式细胞仪对大鼠肝细胞凋亡进行检测发现, 模型组大鼠肝细胞凋亡与正常组相比明显增多.
结论: TRB3和CHOP在基因及蛋白水平表达上调可能与高脂高糖诱导的NAFLD的发生发展有关.
核心提示: 课题组前期研究发现非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)时存在持续的内质网应激(endoplasmic reticulum stress, ERS), 但是ERS介导肝细胞损伤的具体机制尚不十分清楚. 本次研究从ERS相关信号分子Tribbles相关蛋白3(Tribbles related protein 3, TRB3)和CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)的表达变化入手, 初步证实在NAFLD过程中TRB3和CHOP表达上调可促进细胞凋亡, 从而介导肝细胞损伤的发生.
引文著录: 王欢, 胡晓霞, 路华. Tribbles相关蛋白及CCAAT/增强子结合蛋白同源蛋白在非酒精性脂肪肝中的表达变化. 世界华人消化杂志 2015; 23(29): 4636-4642
Revised: August 30, 2015
Accepted: September 21, 2015
Published online: October 18, 2015
AIM: To investigate the changes of Tribbles related protein 3 (TRB3) and CCAAT/enhancer-binding protein homologous protein (CHOP) expression in nonalcoholic fatty liver disease (NAFLD) in rats.
METHODS: Thirty Wistar rats were randomly divided into a normal control group and an NAFLD group. The rats of the NAFLD group were given a high-fat, high-glucose diet for 16 weeks to induce NAFLD, while the normal control group was given an ordinary diet. The levels of total cholesterol (TC), triglyceride (TG), low-density lipoprotein (LDL) and high-density lipoprotein (HDL) were detected with an automatic biochemical analyzer. The expression of TRB3 and CHOP mRNAs in the liver was detected by real-time quantitative PCR. The expression of TRB3 and CHOP proteins in liver tissue was detected by immunohistochemistry. Cell apoptosis was detected by flow cytometry.
RESULTS: The levels of TC, TG, and LDL in the NAFLD group were significantly higher than those in the normal control group (P < 0.05), while the level of HDL was lower than that in the normal control group (P < 0.05). Compared with the normal group, levels of TRB3 and CHOP mRNAs and proteins in the NAFLD group were significantly increased (mRNA: P < 0.05 or P < 0.01; protein: P < 0.01). Flow cytometry analysis showed that the apoptosis in the NAFLD group was higher than that in the normal control group.
CONCLUSION: The changes of TRB3 and CHOP expression may play important roles in the development of NAFLD.
- Citation: Wang H, Hu XX, Lu H. Changes of TRB3 and CHOP expression in nonalcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4636-4642
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4636.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4636
近年来随着人们饮食结构的改变及生活水平的提高, 非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的患病率呈逐年上升趋势[1,2]. NAFLD对人体健康有严重危害, 可导致肝纤维化、肝硬化, 严重时甚至可导致肝功能衰竭的发生[3,4]. 我们在前期研究[5]中发现高脂高糖饮食诱导NAFLD过程中大鼠肝组织中内质网应激标志蛋白葡萄糖调节蛋白78(glucose regulated protein 78, GPR78)表达显著升高, 说明NAFLD发生过程中存在明显的肝细胞内质网应激(endoplasmic reticulum stress, ERS)反应. 此外, 研究中还发现NAFLD发生过程中肝细胞凋亡显著增加, 说明NAFLD时可能通过ERS反应促进细胞凋亡从而加重肝组织的损伤, 但是其具体的信号通路尚不十分清楚. 本次研究从ERS相关信号分子TRB3和CHOP在NAFLD过程中的表达变化入手, 探讨他们在高脂高糖饮食诱导的NAFLD中的可能作用.
健康清洁级Wistar大鼠30只, 雌雄不限, 体质量160-170 g(贵州医科大学实验动物中心, 许可证号SCXK-黔2002-0001); 蔗糖(成都金山化学试剂有限公司); 胆固醇(北京索莱宝科技有限公司); TRB3、CHOP一抗(Bioworld公司); 免疫组织化学二抗试剂盒及二氨基联苯胺(diaminobenzidine, DAB)显色剂(武汉博士德公司); 流式检测试剂盒(南京碧云天公司); 荧光染料SYBR Green及逆转录试剂(大连宝生物公司); 内参照TRB3、CHOP、β-actin引物(大连宝生物公司). TRB3: 上游引物: 5'-TCAAGTTGCGTCGATTTGTCTTC-3'; 下游引物: 5'-CAGTCATCACACAGGCATCCTC-3'. CHOP: 上游引物: 5'-CCTCGCTCTCCAGAT TCCA-3'; 下游引物: 5'-CTCATTCTCCTGC TCCTTCTCC-3'. β-actin: 上游引物: 5'-TCCTCCTGAGCGCAAGTACTCT-3'; 下游引物: 5'-GCTCAGTAACAGTCCGCCTAGA-3'.
1.2.1 NAFLD动物模型: 30只大鼠适应性喂养1 wk后随机分为正常对照组和NAFLD组, 每组各15只. 正常对照组大鼠给予普通饲料喂养; NAFLD组大鼠给予高脂高糖饲料喂养, 饲料中含78%基础饲料、15%猪油、5%蔗糖及2%胆固醇, 造模时间为16 wk. 16 wk末所有大鼠采用乙醚麻醉后股动脉放血处死, 采集大鼠血清及肝脏标本.
1.2.2 病理检查及血清生化检测: 肝组织病理切片采用HE染色后在光学显微镜下观察肝组织的病理形态学变化. 采用Siemens全自动生化分析仪检测血清中总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)含量.
1.2.3 肝组织免疫组织化学检测: 肝组织石蜡切片经常规脱蜡水化后, 经3%H2O2封闭内源性过氧化物酶; 通过微波修复抗原后, 滴加封闭液室温放置20 min, 甩掉多余的封闭液后滴加兔抗大鼠TRB3、CHOP一抗(工作浓度为1:200), 置于4 ℃冰箱内孵育过夜. 次日早上PBS洗3次后滴加二抗, 37 ℃孵育30 min后用PBS洗4次, DAB显色, 苏木素复染. 阴性对照用PBS代替一抗. 在显微镜高倍镜视野下观察肝细胞TRB3、CHOP阳性表达定位并计算阳性细胞百分率.
1.2.4 实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)检测: 取0.1 g肝组织提取总RNA, 逆转录合成cDNA后进行qRT-PCR检测: cDNA模板2.0 μL, 10 μmol/L上游引物1.0 μL, 10 μmol/L下游引物1.0 μL, 2×SYBR Green I 12.5 μL, DEPC H2O补足总体积至25.0 μL. 反应条件为95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 1 min, 最后2步重复40个循环. 采用目的基因与β-actin基因循环值的比值代表该目的基因的相对表达水平.
1.2.5 细胞凋亡检测: 取1 g新鲜大鼠肝组织, 置于预冷的PBS中, 用剪刀剪碎, 多次PBS悬浮、洗涤后用400目滤网过滤, 得到悬浮肝细胞. 取含1×105-5×105细胞的细胞悬液, 1000 r/min离心5 min, 弃上清, 加入195.0 μL结合液轻轻重悬细胞. 加入5.0 μL Annexin V-FITC, 轻轻混匀; 再加入10.0 μL碘化丙啶, 轻轻混匀. 室温避光孵育15 min后采用流式细胞仪进行检测.
统计学处理 用SPSS17.0进行统计分析, 计量资料采用mean±SD表示, 两两比较采用t检验, P<0.05为差异具有统计学意义.
各实验组大鼠血清中TC、TG、HDL、LDL浓度如表1. 从表1中可见, NAFLD组大鼠血清中TC、TG、LDL浓度较正常对照组大鼠均显著增加, 而HDL浓度则较正常对照组大鼠明显下降, 差异具有统计学意义.
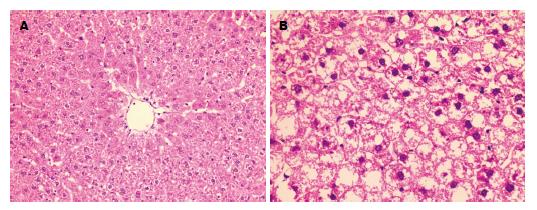
正常大鼠肝组织经常规切片、HE染色后在显微镜下观察发现, 肝小叶结构完整, 肝细胞围绕中央静脉呈放射状排列, 肝窦排列整齐, 汇管区结构清晰, 未见肝细胞变性、坏死及炎症细胞的浸润. NAFLD组大鼠肝组织切片在显微镜下观察发现, 正常肝小叶结构遭到破坏, 肝细胞肿大, 肝细胞胞浆内有大量圆形脂滴, 肝细胞空泡样变性较为明显(图1).
经qRT-PCR检测发现, 高脂高糖饮食喂养大鼠16 wk后, NAFLD组大鼠肝脏内TRB3和CHOP在基因水平的表达较正常组大鼠增多, 差异具有显著性. 肝脏中TRB3和CHOP mRNA的表达如表2.
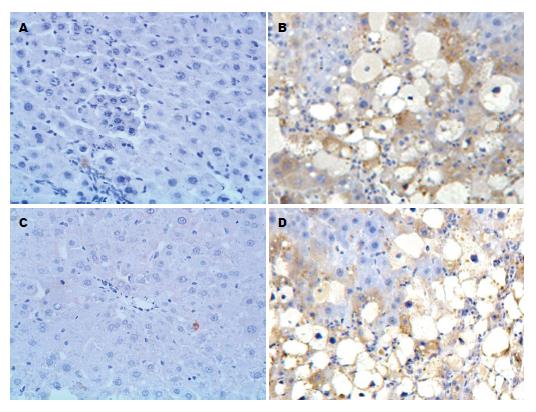
从图2中可见TRB3和CHOP在正常组大鼠肝脏中表达较少, 而NAFLD模型组大鼠肝脏内可见大量TRB3和CHOP阳性表达细胞, 表达量较正常组显著增加. 各组大鼠肝脏中TRB3和CHOP表达情况如表2.
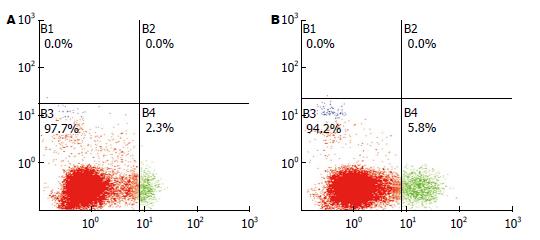
如图3所示, 流式细胞仪检测大鼠肝脏内细胞凋亡发现, 经高脂高糖饮食诱导16 wk, NAFLD组大鼠肝组织中细胞凋亡率较正常组明显增多(0.058±0.0130 vs 023±0.009), 差异具有统计学意义(P<0.05).
NAFLD是代谢综合征在肝脏的表现, 其疾病谱包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎及肝纤维化, 严重的患者甚至发展为肝硬化和肝癌[6-8]. 内质网是细胞内重要的膜性细胞器, 肝细胞含有丰富的内质网, 肝细胞的许多重要功能, 如脂质的代谢、蛋白质合成、糖代谢、毒物及药物代谢均在内质网进行, 因此内质网功能正常是肝细胞存活的必要条件[9-11]. 在缺氧、药物、病毒感染、自由基损伤等病因的作用下, 可使内质网的正常功能被打乱并通过相应的信号通路引发细胞内一系列的反应, 称为ERS[12-14]. 课题组前期研究发现, 高脂高糖饮食喂养大鼠16 wk后, 大鼠肝脏内GRP78 mRNA及蛋白的表达均显著增多, 说明高脂高糖饮食可诱发肝细胞发生ERS反应[5].
轻度的ERS可通过未折叠蛋白反应减轻有害因素对细胞的不良影响, 而持久或严重的ERS反应则通过不同的机制引起细胞凋亡[15-17], 其中ATF6-CHOP信号通路是其中重要的一条信号通路[18-20]. 未发生ERS反应时, ATF6与内质网分子伴侣GRP78结合处于无活性状态; 发生ERS时, ATF6则与GRP78解离并活化, 活化的ATF6可移位至细胞核并与CHOP启动子上的ERS反应元件结合, 直接促进CHOP表达[21-23]. 研究[24,25]发现, CHOP表达上调与ERS介导的细胞凋亡有关. 如CHOP基因敲除的小鼠能抵抗ERS诱导的肾小管上皮细胞凋亡; 而CHOP过表达则可促进细胞凋亡的发生. TRB3是果蝇Tribbles蛋白的哺乳动物同源蛋白, 在ERS通路中, TRB3属于下游基因[26,27]. ERS时表达上调的CHOP可以与TRB3启动子区域的一段33 bp重复序列结合, 从而促进TRB3基因的表达[28]. 近年来有研究[29-31]发现TRB3表达水平上调与细胞凋亡程度呈正相关, 相反利用RNA干扰技术抑制TRB3的表达, 则可以显著减少大麻素等诱导的细胞凋亡, 提示TRB3可能在CHOP介导的细胞凋亡过程中发挥重要作用.
通过本次研究发现, 大鼠经高脂高糖饮食喂养16 wk后血清中TG、TC、LDL水平明显高于正常组, 而HDL水平则较正常组明显减少, 说明NAFLD组大鼠发生了明显的脂质代谢紊乱. 此外, 病理形态学检查发现NAFLD组大鼠肝脏出现单纯性脂肪肝改变, 表明我们成功制备了NAFLD动物模型. 此外, 高脂高糖饮食喂养16 wk后, 大鼠肝组织中CHOP和TRB3基因的表达水平显著增高, 同时, 免疫组织化学检测结果发现肝脏内CHOP和TRB3蛋白的表达也较正常大鼠明显增加. 进一步研究发现, NAFLD组大鼠肝细胞凋亡率较正常组大鼠显著升高. 从上述结果中可以看出NAFLD过程中CHOP和TRB3 mRNA及蛋白表达趋势与肝细胞凋亡率一致, 因此我们推测高脂高糖饮食诱导NAFLD过程中可能通过上调CHOP和TRB3的表达促进肝细胞凋亡, 从而参与NAFLD的发生发展.
在我国非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的发病率呈明显上升趋势, 已成为我国慢性肝病的重要原因之一. 因此进一步深入阐明NAFLD的发生机制, 为临床NAFLD的治疗提供新的药物靶点迫在眉睫.
朱传武, 教授, 主任医师, 苏州市第五人民医院肝病科
NAFLD是代谢综合征在肝脏的表现, 近年来关于内质网应激(endoplasmic reticulum stress, ERS)与代谢综合征的研究十分广泛, 但是关于ERS在NAFLD发生机制中的作用报道较少, 尤其是NAFLD过程中ERS介导肝细胞凋亡的具体机制仍未完全阐明.
有研究发现CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein, CHOP)基因敲除的小鼠能抵抗ERS诱导的肾小管上皮细胞凋亡, 而CHOP过表达则可促进细胞凋亡的发生. 此外还有研究证实Tribbles相关蛋白3(Tribbles related protein 3, TRB3)表达水平上调与细胞凋亡程度呈正相关, 提示CHOP和TRB3可能在细胞凋亡过程中发挥重要作用.
本次研究证实NAFLD过程中CHOP和TRB3在基因及蛋白水平表达上调, 且与肝细胞凋亡趋势一致, 说明NAFLD过程中可能通过促进CHOP和TRB3的表达加速肝细胞凋亡, 从而介导肝细胞损伤的发生.
ERS是NAFLD发生机制中的一个重要环节, 减少ERS介导的细胞凋亡有望成为治疗NAFLD的有效途径. 因此针对ERS信号通路中关键信号分子来寻找新的药物治疗靶点成为可能.
本研究发现, NAFLD模型组大鼠肝脏中TRB3和CHOP在基因转录和翻译水平上显著高于正常组大鼠, 并且发现其表达与肝细胞凋亡呈一致性关系. 研究结果对NAFLD的发病机制具有参考价值. 本研究进一步丰富了NAFLD的基础研究.
编辑:于明茜 电编:都珍珍
| 2. | Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol. 2009;50:204-210. [PubMed] [DOI] |
| 3. | 白 纪红, 梁 志清, 赵 日红, 刘 艳华, 林 秋香, 赵 雪. 银杏黄酮对非酒精性脂肪肝小鼠肝脏Toll样受体-4和核因子-KB表达的影响. 实用医学杂志. 2015;31:1091-1095. |
| 6. | Kim CH, Younossi ZM. Nonalcoholic fatty liver disease: a manifestation of the metabolic syndrome. Cleve Clin J Med. 2008;75:721-728. [PubMed] |
| 9. | Hosoi T, Ozawa K. Endoplasmic reticulum stress in disease: mechanisms and therapeutic opportunities. Clin Sci (Lond). 2010;118:19-29. [PubMed] [DOI] |
| 10. | Malhi H, Kaufman RJ. Endoplasmic reticulum stress in liver disease. J Hepatol. 2011;54:795-809. [PubMed] [DOI] |
| 11. | Zhang N, Lu Y, Shen X, Bao Y, Cheng J, Chen L, Li B, Zhang Q. Fenofibrate treatment attenuated chronic endoplasmic reticulum stress in the liver of nonalcoholic fatty liver disease mice. Pharmacology. 2015;95:173-180. [PubMed] [DOI] |
| 15. | Liu Y, Wang J, Qi SY, Ru LS, Ding C, Wang HJ, Zhao JS, Li JJ, Li AY, Wang DM. Reduced endoplasmic reticulum stress might alter the course of heart failure via caspase-12 and JNK pathways. Can J Cardiol. 2014;30:368-375. [PubMed] [DOI] |
| 16. | Lakshmanan AP, Thandavarayan RA, Palaniyandi SS, Sari FR, Meilei H, Giridharan VV, Soetikno V, Suzuki K, Kodama M, Watanabe K. Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice. Eur J Pharm Sci. 2011;44:627-634. [PubMed] [DOI] |
| 17. | Guo G, Meng Y, Tan W, Xia Y, Cheng C, Chen X, Gu Z. Induction of Apoptosis Coupled to Endoplasmic Reticulum Stress through Regulation of CHOP and JNK in Bone Marrow Mesenchymal Stem Cells from Patients with Systemic Lupus Erythematosus. J Immunol Res. 2015;2015:183738. [PubMed] [DOI] |
| 18. | Hirsch I, Weiwad M, Prell E, Ferrari DM. ERp29 deficiency affects sensitivity to apoptosis via impairment of the ATF6-CHOP pathway of stress response. Apoptosis. 2014;19:801-815. [PubMed] [DOI] |
| 19. | Liu L, Liu C, Lu Y, Liu L, Jiang Y. ER stress related factor ATF6 and caspase-12 trigger apoptosis in neonatal hypoxic-ischemic encephalopathy. Int J Clin Exp Pathol. 2015;8:6960-6966. [PubMed] |
| 20. | Karali E, Bellou S, Stellas D, Klinakis A, Murphy C, Fotsis T. VEGF Signals through ATF6 and PERK to promote endothelial cell survival and angiogenesis in the absence of ER stress. Mol Cell. 2014;54:559-572. [PubMed] [DOI] |
| 21. | Guo FJ, Xiong Z, Lu X, Ye M, Han X, Jiang R. ATF6 upregulates XBP1S and inhibits ER stress-mediated apoptosis in osteoarthritis cartilage. Cell Signal. 2014;26:332-342. [PubMed] [DOI] |
| 22. | Sano R, Reed JC. ER stress-induced cell death mechanisms. Biochim Biophys Acta. 2013;1833:3460-3470. [PubMed] [DOI] |
| 23. | Lee WS, Sung MS, Lee EG, Yoo HG, Cheon YH, Chae HJ, Yoo WH. A pathogenic role for ER stress-induced autophagy and ER chaperone GRP78/BiP in T lymphocyte systemic lupus erythematosus. J Leukoc Biol. 2015;97:425-433. [PubMed] [DOI] |
| 24. | Yang X, Du T, Wang X, Zhang Y, Hu W, Du X, Miao L, Han C. IDH1, a CHOP and C/EBPβ-responsive gene under ER stress, sensitizes human melanoma cells to hypoxia-induced apoptosis. Cancer Lett. 2015;365:201-210. [PubMed] [DOI] |
| 25. | Nam DH, Han JH, Lee TJ, Shishido T, Lim JH, Kim GY, Woo CH. CHOP deficiency prevents methylglyoxal-induced myocyte apoptosis and cardiac dysfunction. J Mol Cell Cardiol. 2015;85:168-177. [PubMed] [DOI] |
| 26. | Yan Q, Zhu H, Wang FH, Feng JY, Wang WQ, Shi X, Zhou YP, Zhang X, Sun XD. Inhibition of TRB3 Protects Photoreceptors against Endoplasmic Reticulum Stress-Induced Apoptosis after Experimental Retinal Detachment. Curr Eye Res. 2015; Aug 19. [Epub ahead of print]. [PubMed] |
| 27. | Rodrigues Bde A, Pauli LS, DE Souza CT, DA Silva AS, Cintra DE, Marinho R, DE Moura LP, Ropelle EC, Botezelli JD, Ropelle ER. Acute Exercise Decreases Tribbles Homolog 3 Protein Levels in the Hypothalamus of Obese Rats. Med Sci Sports Exerc. 2015;47:1613-1623. [PubMed] |
| 29. | Wang W, Cheng J, Sun A, Lv S, Liu H, Liu X, Guan G, Liu G. TRB3 mediates renal tubular cell apoptosis associated with proteinuria. Clin Exp Med. 2015;15:167-177. [PubMed] [DOI] |
| 30. | Yan W, Wang Y, Xiao Y, Wen J, Wu J, Du L, Cai W. Palmitate induces TRB3 expression and promotes apoptosis in human liver cells. Cell Physiol Biochem. 2014;33:823-834. [PubMed] [DOI] |
| 31. | Humphrey RK, Ray A, Gonuguntla S, Hao E, Jhala US. Loss of TRB3 alters dynamics of MLK3-JNK signaling and inhibits cytokine-activated pancreatic beta cell death. J Biol Chem. 2014;289:29994-30004. [PubMed] [DOI] |