修回日期: 2022-01-17
接受日期: 2022-02-22
在线出版日期: 2022-02-28
原发于十二指肠和直肠的促结缔组织增生性小圆细胞肿瘤临床罕见, 病变发展快, 浸润性强, 目前尚无标准治疗方案, 预后较差, 确诊需依靠病理及免疫组化.
本文病例1临床表现为腹痛, 曾被误诊为十二直肠癌, 术后病理最终确诊, 给予手术切除和化疗后仍出现体内多发转移. 本文病例2临床表现为便秘, 曾被误诊为直肠癌, 给予手术切除, 术后病理最终确诊.
通过分析结直肠促结缔组织增生性小圆细胞肿瘤的临床特点、影像表现及病理特征, 有利于对肠道不典型占位性病变的更全面思考, 综合考虑诊断, 尽早评估病情, 尽早治疗, 同时可以让临床医生更全面了解此病.
核心提要: 收集郑州大学第一附属医院2例分别原发于十二指肠和直肠的促结缔组织增生性小圆细胞肿瘤患者的临床资料, 总结其临床、病理与影像特征, 让临床医生更全面了解此病.
引文著录: 黄文鹏, 李莉明, 高剑波. 十二指肠、直肠促结缔组织增生性小圆细胞肿瘤2例报告. 世界华人消化杂志 2022; 30(4): 212-216
Revised: January 17, 2022
Accepted: February 22, 2022
Published online: February 28, 2022
Primary desmoplastic small round cell tumor of the duodenum and rectum is rare, with rapid progression and strong infiltration. At present, there is no standard treatment scheme for this disease, and the prognosis is poor. The diagnosis depends on pathology and immunohist-ochemistry.
The clinical manifestation of Case 1 was abdominal pain, which was misdiagnosed as duodenal cancer. The final diagnosis was made by postoperative pathology. Multiple metastases still occurred after surgical resection and chemotherapy. The clinical manifestation of Case 2 was constipation. It was misdiagnosed as rectal cancer and surgical resection was performed. The final diagnosis was made by postoperative pathology.
Analyzing the clinical, imaging, and pathological features of desmoplastic small round cell tumor of the duodenum and rectum is conducive to more comprehensive understanding of atypical intestinal space occupying lesions and early diagnosis, early evaluation, and early treatment of the disease.
- Citation: Huang WP, Li LM, Gao JB. Desmoplastic small round cell tumor of the duodenum and rectum: Report of two cases. Shijie Huaren Xiaohua Zazhi 2022; 30(4): 212-216
- URL: https://www.wjgnet.com/1009-3079/full/v30/i4/212.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i4.212
促结缔组织增生性小圆细胞肿瘤(desmoplastic small round cell tumor, DSRCT) 是一种高度侵袭性恶性软组织肿瘤, 多发生于男性儿童和青少年的腹、盆腔, 位于结直肠更为罕见, 国内外鲜有报道. 本文报道2例原发于十二指肠和直肠处的DSRCT, 介绍其诊疗经过及影像学表现, 以期对临床诊治提供帮助.
患者男, 22岁, 因"腹痛2天"于2018-02-19至郑州大学第一附属医院急诊外科就诊. 患者2天前无明显诱因出现腹痛, 右上腹为著, 呈持续性钝痛, 伴恶心、干呕, 合并发热, 最高体温39 ℃; 既往乙肝病史, 青霉素过敏史, 无家族性遗传病史. 自发病以来精神、食欲、睡眠欠佳, 大便未排, 小便正常, 体重无明显变化. 体格检查: 腹稍膨隆, 腹肌紧, 腹部压痛、反跳痛, 以右上腹为著, 未触及明显包块, 肠鸣音2次/分, 无过水声. 实验室检查: 白细胞计数14.20×109/L, 中性粒细胞计数12.43×109/L, 单核细胞计数0.78×109/L, D-二聚体0.94 mg/L, 乙肝病毒DNA 8.41×102, 肿瘤异常蛋白凝聚物面积147.77 μm2, 肿瘤标志物未见明显异常.
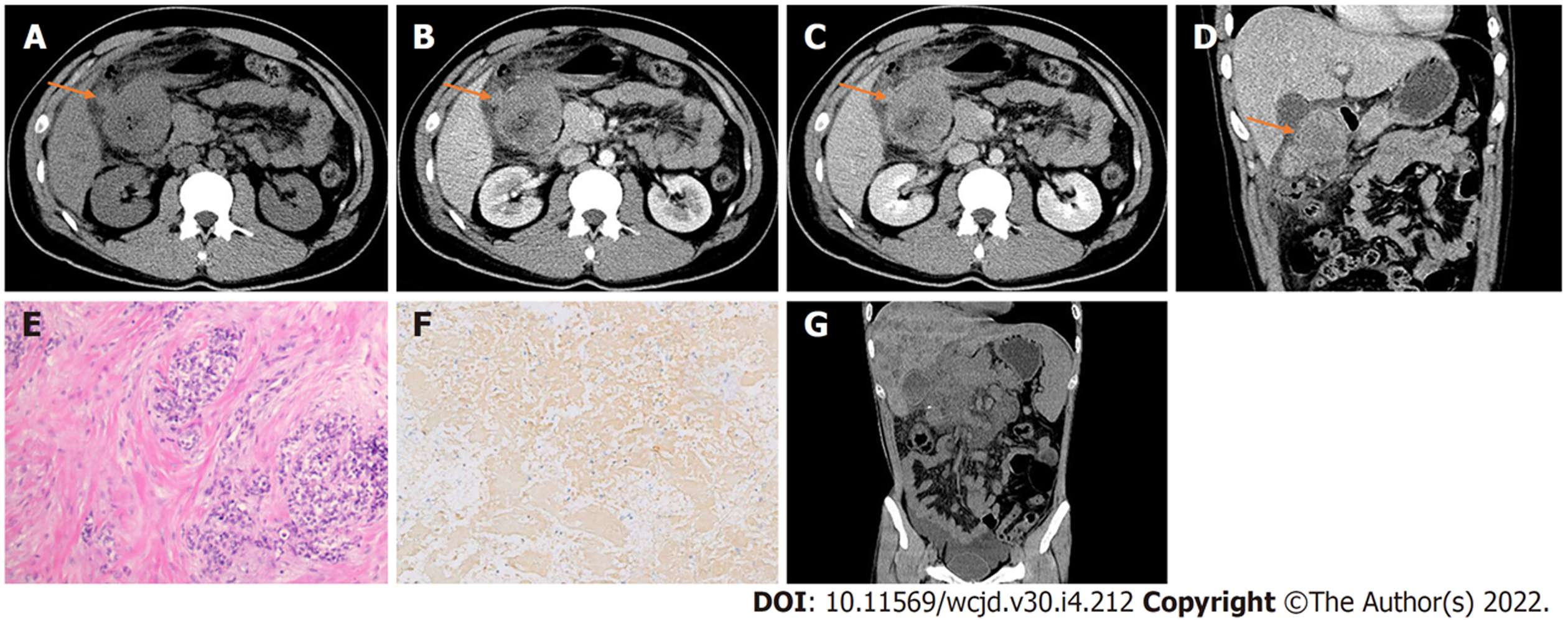
腹部CT检查: 十二指肠球部见不规则软组织密度影, 密度不均匀, 边界不清, 平扫CT值约35 HU(图1A), 最大截面约6.3 cm×5.4 cm, 增强扫描后动脉期CT值约54 HU(图1B), 静脉期CT值约58 HU(图1C), 内见囊变坏死(CT值约13 HU), 增强呈不均匀轻度持续性强化, 病变与胃幽门和十二指肠降部分界不清, 周围见少许积液(图1D). 腹腔内脂肪间隙模糊, 邻近网膜呈污垢样改变并腹膜局限性增厚, 腹膜后见增大淋巴结.
患者男, 38岁, 因"间断性便秘3月余"于2020-09-04至郑州大学第一附属医院结直肠肛门外科就诊. 患者3月前无明显诱因出现便秘、排便困难; 既往体健, 阿莫西林过敏史, 无家族性遗传病史. 自发病来精神、食欲、睡眠、大小便正常, 体重无明显变化. 体格检查: 肛诊(KC位)未见明显异常. 实验室检查: 肿瘤标志物未见明显异常.
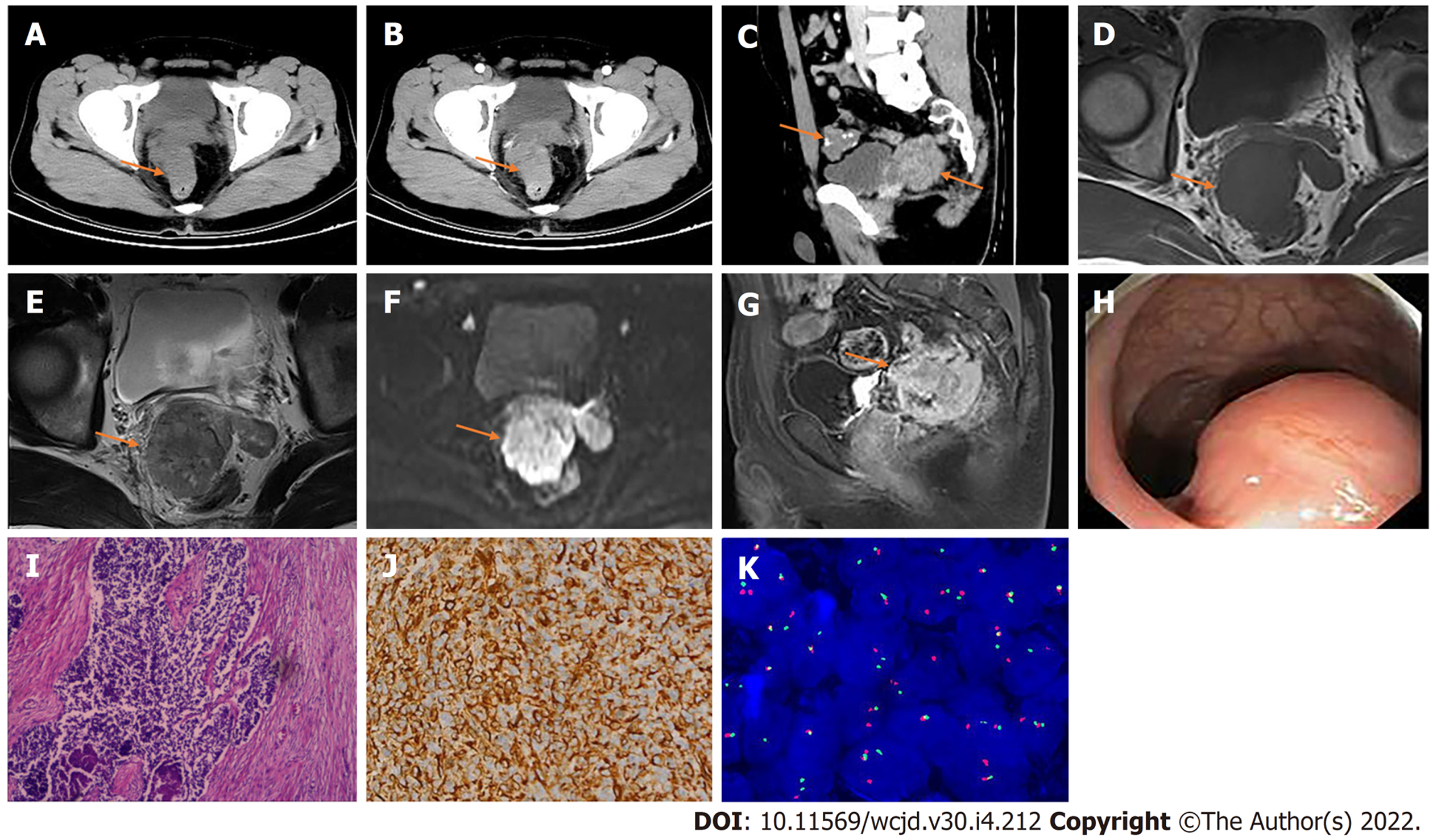
CT检查: 直肠壁不均匀增厚, 厚度约3.8 cm, 累及肠管长度约7.6 cm, 平扫CT值约47 HU(图2A), 增强扫描后动脉期CT值约74 HU(图2B), 静脉期CT值约75 HU, 呈不均匀中度持续性强化; 盆腔见多发团块状软组织影, 部分内见钙化, 局部与直肠壁分界不清(图2C), 最大截面约5.4 cm×4.5 cm, 增强呈不均匀轻度强化. MRI检查: 直肠病灶在T1WI上呈等信号(图2D), T2WI上呈混杂稍高信号(图2E), DWI上呈混杂高信号(图2F), 静脉注入Gd-DTPA后, 病灶呈不均匀明显强化(图2G), 盆腔内多发病灶与直肠病灶信号相似. 电子肠镜检查: 直肠隆起性病变(图2H).
2例患者结合形态学和免疫组化, 最终病理诊断符合促结缔组织增生性小圆细胞肿瘤(desmoplastic small round cell tumor, DSRCT).
患者1全麻后行剖腹探查术, 术中见腹腔内大量淡黄色恶臭脓液, 吸净积液后见大网膜被覆脓苔, 水肿并黏连成团, 于十二指肠球部见大小约10 cm×8 cm×8 cm质硬肿块, 无活动度, 外侵明显, 上方侵及胃幽门部, 向下包绕十二指肠降部并侵犯横结肠系膜, 向左包绕胰头. 十二指肠降部下段见肿块破溃, 形成瘘道, 见消化液流出, 尝试缝合破口因组织高度水肿质脆而失败, 切除部分外侵肿瘤快速送病理, 探查肝、脾、小肠、结肠未见明显异常, 依据上述探查行"胃肠Roux-en-Y吻合术+十二指肠置管肠减压术".
患者2全麻后行腹腔镜直肠恶性肿瘤根治术+左侧侧方淋巴结清扫术+腹腔转移瘤切除术, 术中见直肠来源巨大肿块, 切面灰黄, 质中, 边界不清, 大小约7.1 cm×5.3 cm×4.8 cm, 肉眼观侵及外膜层, 腹腔内大量淡黄色清亮腹水, 大网膜见大小约3 cm×3 cm肿块, 盆壁、腹壁、余大网膜见散在苍白结节, 考虑直肠恶性肿瘤腹盆腔广泛转移.
患者1术后病理组织学检查: 光学显微镜下见小圆形细胞致密排列, 核小, 深染, 核分裂象易见, 内有不同程度的坏死, 周围见明显增生纤维结缔组织, 伴炎细胞浸润, 肿瘤组织穿透浆膜(图1E); 免疫组化检测: Desmin(核旁+), SDHA(+), SDHB(+), CD34(血管+)(图1F), CD117(部分弱+), Ki-67 (15%+). 术后40天后排除化疗禁忌行"环磷酰胺+阿霉素+长春新碱"方案化疗6周期, 口服安罗替尼靶向治疗, 期间规律随访, 2019-05, CT复查示肿块较前增大, 腹膜后、网膜后多发肿大淋巴结较前增大、增多, 改行"依托泊苷+异环磷酰胺"方案化疗3周期, 2019-08改行"多西他赛+顺铂"化疗方案2周期, 口服阿帕替尼靶向治疗. 2019-09行CT引导下肿瘤射频消融术+放射性粒子植入术, 12月CT复查示肝内弥漫性结节状转移灶, 肿块较前增大, 内见多发高密度粒子, 病灶周围、腹膜后、髂血管旁、腹腔系膜间隙多发淋巴结较前增大, 腹、盆腔内多发渗出积液(图1G). 目前仍在随访中.
患者2术后病理组织学检查: 光学显微镜下小圆形细胞实性巢状排列, 核分裂象可见, 核仁不清, 周围围绕显著增生的致密纤维结缔组织, 伴有透明样变性(图2I); 腹壁结节、大网膜、小肠系膜结节均见肿瘤累及, 清扫出15枚淋巴结未见肿瘤累及. 免疫组化检测: AE1/AE3(+), CK8/18(+), CD56(灶+), Desmin(+), Vimentin(+)(图2J), CAM5.2(+), CD99(+), Ki-67(50%+); 荧光免疫杂交检检测: 计数100个肿瘤细胞, 阳性细胞数为52%, 根据判读标准, 本病例发生Ewsr1基因断裂(图2K). 目前仍在随访中.
DSRCT于1989年由Gerald和Rosail首次报道[1], 年发病率约为0.2/100万-0.5/100万[2], 是一种高度侵袭性恶性软组织肿瘤, 多发生于男性儿童和青少年, 也有老人和年轻女性的报道[3-6]. 发病部位多见于腹、盆腔, 常发生远处转移, 如肺、肝转移等, 其他罕见部位包括胸膜、睾丸旁、后颅窝、卵巢、子宫、腮腺、肺、鼻腔等[6,7]. 原发于十二指肠和直肠处更为罕见, 本文2例出现腹膜及网膜播散, 发生实质性脏器和淋巴结的转移. DSRCT临床表现、实验室检查不典型, 与发病部位产生局部症状有关, 本例表现为腹痛和便秘, 文献报道可伴有消瘦、发热、贫血等恶病质表现及肠梗阻表现[8].
既往研究认为DSRCT起源于原始间皮细胞或具有多潜能分化的原始间叶细胞和中胚叶母细胞[9], 2020年WHO软组织肿瘤分类中将其分为起源未定肿瘤类别. DSRCT病理特征典型, 镜下表现为硬化性纤维结缔组织间质大量增生, 包绕并分割上皮样小圆细胞巢, 小圆细胞组织起源未定, 巢状或梁索状排列紧密, 核圆形, 深染, 不同区域肿瘤和间质的比例不同[7,10-11]. 免疫组化具有多种阳性表达, 上皮源性、神经源性及间叶源性标志物如单克隆抗体AE1/AE3、波形蛋白、NSE和Desmin核旁往往呈强阳性表达[6,12], 本文2例免疫组织化学具有多向分化的特点, 与文献报道相符. DSRCT组织学上需与胚胎性或腺泡状横纹肌肉瘤、原始神经外胚层肿瘤、小细胞型神经母细胞和淋巴瘤等其他恶性小细胞肿瘤鉴别; 本例发生于十二指肠及直肠, 还需与肠道恶性肿瘤相鉴别.
关于肠道DSRCT的影像表现报道罕见, 本文2例病灶较大, 呈实性, 边界不清, 形态不规则, 平扫密度略低于肌肉, 可见坏死、钙化, 病变发展快, 浸润性强, 检查时已出现周围脏器侵犯, 腹、盆腔种植转移, 恶性腹水等征象. DRSCT病理表现为大量基质反应和新生血管形成[5], 本文2例增强为不均匀轻中度强化, 内见低密度坏死, 可能与肿瘤生长过快、血管坏死以及纤维结缔组织显著增生有关. 病例2在T1WI上呈等信号, T2WI上呈混杂稍高信号, Gd-DTPA增强效果更佳, 呈明显强化. CT是DSRCT术前的主要检查手段, 术前单纯依靠影像学检查虽不能明确性质, 但可反映病变的范围和形态大小, 有助于提示临床分期, 在评估DSRCT远处转移情况等方面, 尤其是对腹膜、网膜及肠系膜转移灶的术前探查中具有优势, 对手术方案的制定及治疗效果的判断有一定的临床意义, 但确诊仍需依靠病理及免疫组化.
DSRCT目前尚无标准治疗方案, 由于其高度侵袭性, 病情发展迅速, 临床就诊时常已多发转移. 治疗策略包括最大限度减瘤术、高强度全身化疗、靶向治疗、腹腔热化疗及局部放疗等多模式治疗方式[5,13]. 发生于肠道常因弥漫浸润生长、腹腔多发转移而治疗效果欠佳, 总体预后较差, 持久的缓解率较低[10]. 本文病例1经过放射性粒子植入术、化疗、靶向治疗, 仍出现远处转移, 预后差, 病例2手术切除后仍在随访中, 术后进行相关随访和复查是必要的. Hayes-Jordan等[14]研究认为无腹腔外转移的DSRCT患者中, 完全切除或接近完全切除的患者中位生存期为31.4个月, 术后残留病灶>2.5 cm患者的中位生存期为7.1个月, 因此早期发现, 尽早治疗, 争取最大限度减瘤手术是延长DSRCT患者生存率的关键[5]. 目前有文献报道DSRCT患者对抗血管及阻断血小板衍生生长因子受体的靶向药物如安罗替尼、帕唑帕尼耐受性较好[13,15,16]. 由于DSRCT发病罕见, 尚需更多的临床研究探索最优治疗策略.
综上所述, 通过分析结直肠DSRCT的临床特点、影像表现及病理特征, 认识与学习来源于结直肠的DSRCT, 有利于对肠道不典型占位性病变的更全面思考, 综合考虑诊断, 尽早评估病情, 尽早治疗, 同时可以让影像科医生更全面了解此病.
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Gerald WL, Rosai J. Case 2. Desmoplastic small cell tumor with divergent differentiation. Pediatr Pathol. 1989;9:177-183. [PubMed] [DOI] |
| 2. | Lettieri CK, Garcia-Filion P, Hingorani P. Incidence and outcomes of desmoplastic small round cell tumor: results from the surveillance, epidemiology, and end results database. J Cancer Epidemiol. 2014;2014:680126. [PubMed] [DOI] |
| 3. | Bulbul A, Fahy BN, Xiu J, Rashad S, Mustafa A, Husain H, Hayes-Jordan A. Desmoplastic Small Round Blue Cell Tumor: A Review of Treatment and Potential Therapeutic Genomic Alterations. Sarcoma. 2017;2017:1278268. [PubMed] [DOI] |
| 8. | Shen XZ, Zhao JG, Wu JJ, Liu F. Clinical and computed tomography features of adult abdominopelvic desmoplastic small round cell tumor. World J Gastroenterol. 2014;20:5157-5164. [PubMed] [DOI] |
| 10. | 唐 京京, 汤 静燕, 潘 慈, 高 怡瑾, 韩 亚丽, 胡 文婷, 张 婧, 周 敏, 殷 敏智. 儿童促结缔组织增生性小圆细胞肿瘤8例并文献复习. 中华实用儿科临床杂志. 2021;36:1108-1110. [DOI] |
| 11. | 张 俊, 郑 建明, 潘 心宇. 促结缔组织增生性小圆细胞肿瘤的临床病理分析. 临床医药文献电子杂志. 2018;5:113-114. [DOI] |
| 12. | 郭 修玉, 付 浩, 郭 崴, 孙 龙, 吴 华, 陈 皓鋆. 精索促结缔组织增生性小圆细胞肿瘤18F-FDG PET/CT显像一例. 中华核医学与分子影像杂志. 2018;38:695-696. [DOI] |
| 14. | Hayes-Jordan A, Green H, Lin H, Owusu-Agyemang P, Mejia R, Okhuysen-Cawley R, Cortes J, Fitzgerald NE, McAleer MF, Herzog C, Huh WW, Anderson P. Cytoreductive surgery and Hyperthermic Intraperitoneal Chemotherapy (HIPEC) for children, adolescents, and young adults: the first 50 cases. Ann Surg Oncol. 2015;22:1726-1732. [PubMed] [DOI] |
| 15. | Chen HM, Feng G. Use of anlotinib in intra-abdominal desmoplastic small round cell tumors: a case report and literature review. Onco Targets Ther. 2019;12:57-61. [PubMed] [DOI] |
| 16. | Menegaz BA, Cuglievan B, Benson J, Camacho P, Lamhamedi-Cherradi SE, Leung CH, Warneke CL, Huh W, Subbiah V, Benjamin RS, Patel S, Daw N, Hayes-Jordan A, Ludwig JA. Clinical Activity of Pazopanib in Patients with Advanced Desmoplastic Small Round Cell Tumor. Oncologist. 2018;23:360-366. [PubMed] [DOI] |