修回日期: 2012-11-15
接受日期: 2012-12-03
在线出版日期: 2012-12-18
目的: 研究粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony- stimulating factor, GM-CSF)编码基因对丙型肝炎病毒(hepatitis C virus, HCV)核心(core, C)蛋白编码基因重组质粒诱导的免疫应答有无增强作用.
方法: 人工合成HCV核心蛋白基因至克隆载体pUC119上, 酶切后与真核表达质粒pCMH6K连接, 测序正确后将重组质粒pCMH6K/HCV-C转染中华仓鼠卵巢(China hamster ovary, CHO)细胞. 免疫荧光检测转染的CHO细胞中HCV C蛋白分布与表达. 将已构建成功的GM-CSF编码基因重组子(pGM-CSF)联合pCMH6K/HCV-C肌注免疫Balb/c鼠, ELISA法检测免疫小鼠血清抗HCV C特异性抗体水平, 经流式细胞仪检测不同免疫原免疫鼠后脾T淋巴细胞亚群及Th细胞内细胞因子[干扰素-γ(interferon-γ, IFN-γ)、白介素-4(interleukin-4, IL-4)]变化, LDH法测定CTL活性.
结果: pCMH6K/HCV-C经鉴定构建正确. 所编码的蛋白主要分布于胞膜, 少量分布于胞浆. pGM-CSF+pCMH6K/HCV-C联合免疫组和pCMH6K/HCV-C单独免疫组均产生抗HCV C特异性抗体, 两组间比较差异无统计学意义; 联合免疫组CD4+T淋巴细胞比例为44.90%±5.99%, 明显高于其他组(P<0.05). 不同免疫组CD8+T细胞比例变化不大, 与空载体pcDNA3.1(+)组比较, 差异无统计学意义(P>0.05). 联合免疫组CTL活性为56.48%±4.68%, 明显高于其他组(P<0.05). 联合免疫组IFN-γ/IL-4比值为18.20±2.36, 明显高于其他组(P<0.05).
结论: GM-CSF编码基因可增强HCV C基因DNA疫苗的细胞免疫应答, 并能够诱导Th1型免疫应答.
引文著录: 翟永贞, 王岩, 冯国和. GM-CSF基因增强HCV核心蛋白基因DNA疫苗的免疫应答. 世界华人消化杂志 2012; 20(35): 3424-3430
Revised: November 15, 2012
Accepted: December 3, 2012
Published online: December 18, 2012
AIM: To study the effect of granulocyte-macrophage colony-stimulating factor (GM-CSF) genetic adjuvant on immune response induced by plasmid DNA encoding the hepatitis C virus (HCV) core (C) protein.
METHODS: The gene encoding the HCV C protein was amplified by PCR from HCV 1b genotype and inserted into the pUC119 vector. The HCV C gene was then subcloned into the pCMH6K eukaryotic vector, and the resulting plasmid was named pCMH6K/HCV-C. The recombinant vector was confirmed by restriction enzyme analysis and DNA sequencing, and transfected into China hamster ovary (CHO) cells with Lipofectamine 2000. Distribution of the HCV C protein in transfected CHO cells was detected by immunofluorescence. Balb/c mice were vaccinated with the recombinant plasmid with or without the GM-CSF gene. HCV C-specific antibody in serum was measured by ELISA. The changes in T lymphocyte subsets and levels of Th cell intracellular cytokines interferon-γ (IFN-γ) and interleukin-4 (IL-4) in splenic cell suspension from immunized mice were evaluated by flow cytometric analysis. CTL activity was assessed by LDH assay.
RESULTS: Restrict enzyme digestion and DNA sequencing indicated that the recombinant pCMH6K/HCV-C was successfully constructed. The expression of plasmid-encoded protein was mainly distributed in membrane and scarcely in cytoplasm of transfected CHO cells. The percentage of CD4+ T cells in spleen cells in the pCMH6K/HCV-C+pGM-CSF co-vaccination group was significantly higher than those in other groups (all P < 0.05). The percentage of CD8+ T cells showed no significant differences among each group (P > 0.05). CTL activity induced by GM-CSF DNA co-vaccination was significantly higher than that immunized with the same amount of other naked DNA (P < 0.05). The ratio of IFN-γ to IL-4 in spleen cells from GM-CSF DNA co-vaccination group was significantly higher than those in other groups (all P < 0.05).
CONCLUSION: GM-CSF DNA could enhance the immune stimulatory effects of HCV DNA vaccine and induce Th1-type immune response.
- Citation: Zhai YZ, Wang Y, Feng GH. Granulocyte-macrophage colony-stimulating factor genetic adjuvant enhances the immune stimulatory effects of plasmid DNA encoding the hepatitis C virus core protein. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3424-3430
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3424.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3424
丙型肝炎病毒(hepatitis C virus, HCV)侵入机体常引起慢性持续性感染[1-5], 严重威胁人类健康. 目前还没有针对HCV的有效疫苗, 在抗HCV保护性疫苗研究中, 发现核心(core, C)蛋白氨基酸序列上有多个B、CTL和Th细胞的抗原表位, 能诱导不同病毒株的交叉免疫应答. HCV核心区是HCV进行基因和血清分型的靶基因区, 也是从基因水平上治疗HCV感染和进行疫苗研究的重要区域[6-11], 深入研究HCV C蛋白分子生物学特性, 研发新型丙型肝炎生物疫苗, 对丙型肝炎的预防和治疗具有重要意义[12].
粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony- stimulating factor, GM-CSF)能够募集抗原提呈细胞到达抗原合成部位, 并能够刺激树突状细胞的成熟, 其编码基因作为DNA免疫佐剂并用于DNA疫苗增强效应的研究[13-17].
本研究旨在探究GM-CSF编码基因重组子与HCV C基因DNA疫苗联合肌注免疫Balb/c鼠所致的体液和细胞免疫应答强度和特征, 为HCV DNA疫苗的深入研究提供实验依据.
本实验室构建的含GM-CSF蛋白基因重组质粒被命名为pGM-CSF. 克隆载体pUC119[Code No. D3219]购自Takara公司, 用于HCV C蛋白编码基因测序. 丙型肝炎核心蛋白真核载体pCMH6K由感染科实验室保存, 用于HCV C蛋白编码基因重组子的构建. 中华仓鼠卵巢(China hamster ovary, CHO)细胞购自中国科学研究院上海细胞库, 生长于37 ℃, 5%CO2及含10%胎牛血清(fatal calf serum, FCS)的D-MEM(dulbecos modified eagle medium)中, 脂质体(Lipofectamine 2000)购自Invitrogen公司, 分别用于转染实验中受体细胞及转染试剂; 质粒小剂量提取试剂盒(Takara, product No. DV801A), 大肠杆菌JM109与DH5α, 限制性内切酶BamHⅠ及EcoRⅠ等均购自Takara公司, 用于重组质粒构建、转化及酶切鉴定; 鼠源性抗HCV C蛋白单克隆抗体[Code No. sc-69937]、山羊抗鼠GM-CSF以及FITC标记的山羊抗鼠IgG[Code No. sc-2010]均购自Santa公司, 用于重组质粒转染后的免疫荧光检测; 乳酸脱氢酶(lactate dehydrogenase, LDH)测定试剂盒购自美国Promega公司; 荧光标记的抗体(CD3-PerCP, CD4-FITC, CD8-PE, IFN-γ-FITC, IL-4-APC)、小鼠细胞表面Fc受体抗体CD16/CD32均购自美国BD公司.
1.2.1 GM-CSF编码基因的构建和转染分析: 从Balb/c鼠脾脏获取细胞总RNA, 采用套式-RT-PCR法扩增GM-CSF CDS区域序列(471 bp). 反转录引物: 5'-CAGGCACAAAAGCAGCAGTC-3'; PCR外引物: 上游引物为5'-CAGAGAGAAAGGCTAAGGTC-3', 下游引物为上述反转录引物; PCR内引物: 上游引物为5'-GAATTCGGTGGAGGCGGTTCAGGTGGAGGTGGTTC AGGAGGAGGTGGATCGATGTGGCTGCAGAATTTAC-3', 下游引物为5'-GCGGC CGCTCATTTTTGGCCTGGTTTTTTG-3', 用于PCR内引物的上游引物和下游引物的5'端分别引入EcoRⅠ和NotⅠ酶切位点. 1%琼脂糖凝胶电泳并回收最终PCR产物, 后者与pMD19-T simple连接构建重组子pMD-GM-CSF, 转化大肠埃希菌JM109, 筛选阳性克隆并送至大连宝生物工程公司测序鉴定. 将上述测序正确的目的基因亚克隆至pcDNA3.1(+), 形成重组子pGM-CSF. 脂质体法转染pGM-CSF于CHO细胞[13], 6孔组织培养板培养pGM-CSF转染的CHO细胞, 待细胞密度达到70%时, 4%多聚甲醛固定细胞1 h, 0.1%Triton-100打孔10 min, 10%BSA封闭1 h, 山羊抗鼠GM-CSF 4 ℃温育过夜, FITC标记的兔抗山羊CD32 37 ℃避光温育1 h, 荧光显微镜检测质粒转染的CHO细胞内编码蛋白的分布与表达.
1.2.2 HCV C蛋白编码基因重组子的构建: 根据 GenBank中登录的HCV 1b基因型核心基因序列片段, 以扩增出核心蛋白1-573共573 bp的碱基. 引物设计P1: 5'-CCGGGATCCTATGAGC ACAAATCCAAAAC-3', P2: 5'-CGGAATTCCAGACCTTACCCAAATTACGC-3', 下划线者分别为BamHⅠ和EcoRⅠ的酶切位点. 使用DNA片断纯化试剂盒(Takara, product No. DV807)对扩增的DNA片段进行纯化, 使用琼脂糖凝胶DNA纯化试剂盒(Takara, product No. DV805)进行切胶回收DNA, 按照DNA连接试剂盒(Takara, product No. D6023)说明书要求, 合成至pUC119载体上(pUC119HCV-C), 转化大肠埃希菌JM109. 质粒小剂量提取试剂盒(Takara, product No. DV801A)提取重组质粒并经BamHⅠ/EcoRⅠ进行酶切鉴定, 采用ABIPRSMTM 310Genetic Analyzer(Pekin-Elmer/Applied)及引物M13对重组质粒进行测序分析. 将测序正确的目的基因经BamHⅠ/EcoRⅠ双酶切并亚克隆到真核表达载体pCMH6K, 将此重组子命名为pCMH6K/HCV-C.
1.2.3 HCV C蛋白编码基因重组质粒瞬时转染CHO细胞: 采用脂质体转染法将pCMH6K/HCV-C转染CHO细胞, 同时设空载体pCMH6K转染细胞为阴性对照, 方法见文献[17].
1.2.4 免疫荧光检测: 6孔组织培养板培养pCMH6K/HCV-C转染的CHO细胞, 待细胞密度达到60%-70%时, 4%多聚甲醛固定细胞1 h, 0.1% Triton-100打孔10 min, 10%BSA封闭1 h, 鼠源性抗HCV C蛋白单克隆抗体4 ℃过夜孵育, FITC标记的山羊抗鼠IgG于37 ℃避光孵育1 h, 50%甘油封片后于荧光显微镜下观察转染的CHO细胞内编码蛋白的分布与表达.
1.2.5 动物免疫: 每组5只Balb/c鼠(购自中国医学科学院实验动物研究所)共4组. 分别将溶于100 μL灭菌PBS的不同免疫原鼠后肢肌内注射, 包括: pCMH6K/HCV-C(100 μg)+pGM-CSF(50 μg)、pCMH6K/HCV-C(100 μg)、pGM-CSF(50 μg)、pcDNA3.1(+)(100 μg), 共免疫4次, 间隔2 wk.
1.2.6 免疫小鼠血清中抗体水平的测定: 最后一次免疫结束, 同时剪尾取血, 离心后收集上清作为检测标本, 按ELISA试剂盒操作说明, 检测免疫鼠血清抗HCV C抗体的表达水平.
1.2.7 脾CD3+CD4+/CD3+CD8+T淋巴细胞亚群检测: 流式细胞仪直接免疫荧光法测定免疫后Balb/c鼠CD3+CD4+/CD3+CD8+T淋巴细胞亚群变化. 方法见文献[13].
1.2.8 脾Th细胞内细胞因子IFN-γ和IL-4分泌水平的检测: 最后一次免疫结束, 取脾制备淋巴细胞悬液, 调整细胞浓度为4×107/mL. 取25 μL脾细胞悬液, 加入4 μL佛波脂(1 mg/L), 2 μL离子酶素(500 mg/L), 1 μL莫能菌素以及710 μL RPMI-10%FBS至终体积为1 mL, 37 ℃、5%CO2温育5 h, 按照胞内因子测定试剂盒说明书进行操作, 利用CellQuest软件对获得的数据进行分析.
1.2.9 CTL杀伤活性的测定: 采用LDH释放实验试剂盒检测CTL活性, 方法见文献[13].
统计学处理 数据以mean±SD表示, 各组间是否存在差异有统计学意义采用单因素方差分析, 进一步两组之间比较用最小显著差值法. P<0.05为差异有统计学意义.
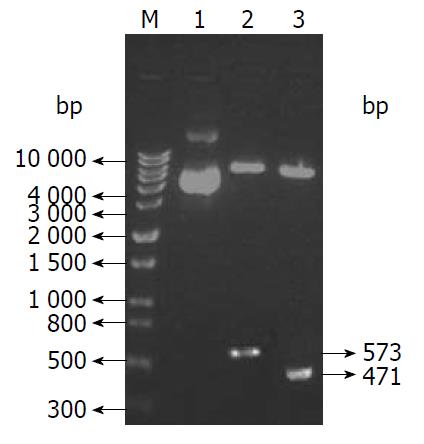
经0.8%琼脂糖凝胶电泳显示, 重组表达质粒pCMH6K/HCV-C约为5.0 kb , 重组质粒经EcoRⅠ和EcoRⅠ双酶切可见1条约573 bp的DNA片段, 与目的基因大小一致(图1 2泳道), 重组质粒经测序后证实与目的基因序列一致. 套式RT-PCR法获得的GM-CSF基因测序分析与发表的GM-CSF CDS区域序列相符合, pGM-CSF经EcoRⅠ/NotⅠ酶切释出插入子, 与GM-CSF基因(471 bp)大小相一致(图1 3泳道).
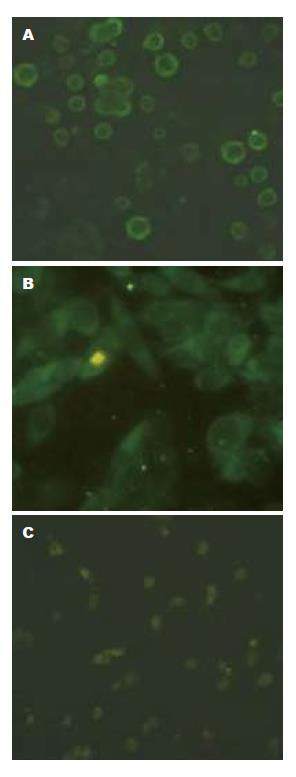
pCMH6K/HCV-C转染的CHO细胞可见较显著的绿色荧光标记, 主要分布在胞膜, 也可见于胞浆(图2A), pGM-CSF转染的CHO细胞可见较显著绿色荧光标记, 主要分布在胞质, 也可见于胞膜(图2B), 空载体转染的CHO细胞中未见特异性绿色荧光标记, 仅见散在的无特异性绿色荧光杂质(图2C).
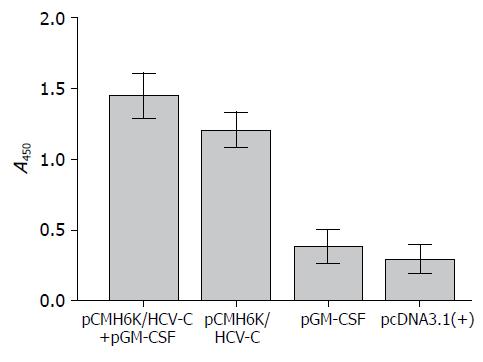
联合免疫组pC-MH6K/HCV-C+pGM-CSF和单独免疫组pCMH6K/HCV-C均具有较强的免疫活性. 两个实验组产生的抗HCV C特异性抗体(A450值)明显高于pcDNA3.1(+)对照组(P<0.05), 进一步研究发现, pCMH6K/HCV-C+pGM-CSF和pCMH6K/HCV-C两组之间无显著性差异(P>0.05, 图3).
pCMH6K/HCV-C+pGM-CSF组CD3+CD4+T淋巴细胞比例为44.90%±5.99%, 明显高于其他组(P<0.05); pcDNA3.1(+)组CD3+CD4+T淋巴细胞比例为12.99%±2.32%, 低于其他组(P<0.05); pCMH6K/HCV-C组CD3+CD4+T淋巴细胞比例为30.70%±0.51%, 高于pGM-CSF组18.11%±1.23%(P<0.05). pCMH6K/HCV-C+pGM-CSF、pCMH6K/HCV-C组CD3+CD8+T淋巴细胞比例较pcDNA3.1(+)组升高, 两组间差异无统计学意义(P>0.05), pcDNA3.1(+)组、pGM-CSF组CD3+CD8+T淋巴细胞比例低于其他各组(P<0.05), 两组间无显著性差异(P>0.05, 表1).
| 分组 | CD3+CD4+(%) | CD3+CD8+(%) | CD4+ IFN-γ(%) | CD4+IL-4(%) | Th1/Th2 |
| pCMH6K/HCV-C+pGM-CSF | 44.90±5.99ac | 13.47±0.28d | 45.50±2.09ef | 2.50±0.03g | 18.20±2.36 |
| pCMH6K/HCV-C | 30.70±0.51abc | 13.06±0.18d | 25.17±1.39e | 3.68±0.07g | 6.84±1.50h |
| pGM-CSF | 18.11±1.23ab | 9.15±0.66 | 2.34±0.35 | 23.29±1.06 | 0.10±0.02h |
| pcDNA3.1(+) | 12.99±2.32b | 8.30±0.24 | 5.54±0.13 | 26.84±2.36 | 0.21±0.06h |
pCMH6K/HCV-C+pGM-CSF和pCMH6K/HCV-C组均可诱导CD4+T淋巴细胞产生相对高的IFN-γ水平, 高于pcDNA3.1(+)与pGM-CSF组(P<0.05), 两组间比较联合免疫组更能促进IFN-γ的分泌(P<0.05); CD4+T淋巴细胞分泌的IL-4在pGM-CSF与pcDNA3.1(+)两组间无显著性差异(P>0.05), 其余各组间均有显著性差异(P<0.05); IFN-γ/IL-4的比值在pCMH6K/HCV-C+pGM-CSF组为(18.20±2.36), 较其余各组有显著性意义(P<0.05, 表1).
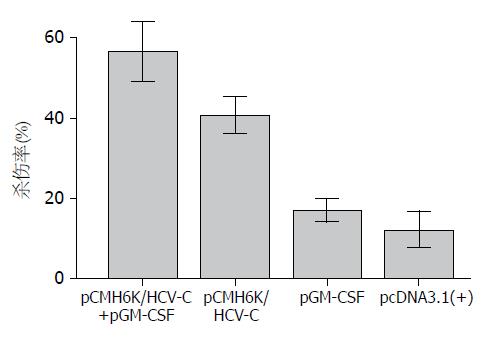
当效/靶细胞比例为10:1时, pCMH6K/HCV-C+pGM-CSF和pCMH6K/ HCV-C组中CTL的杀伤率均较pGM-CSF、pcDNA3.1(+)对照组明显增高(P<0.05), 两组之间比较有显著性差异(P<0.05, 图4).
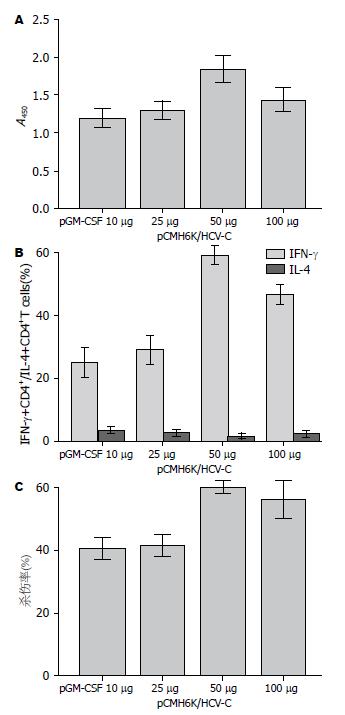
为进一步明确GM-CSF编码基因表达水平与HCV C蛋白编码基因重组子诱导的免疫应答之间的关系, 我们将不同剂量pGM-CSF(10、25、50、100 μg)分别联合HCV C蛋白编码基因重组子免疫Balb/c鼠. 结果表明, pGM-CSF接种剂量与目的基因诱导的抗体水平、IFN-γ/IL-4比值以及CTL活性存在相关性, pCMH6K/HCV-C+pGM-CSF(50 μg)免疫组明显促进IFN-γ分泌, 并能抑制IL-4的表达, 获得了最高的抗原特异性CTL活性(均P<0.05). pCMH6K/HCV-C+pGM-CSF(50 μg)免疫组诱导产生最高的抗HCV C蛋白抗体水平, 各组间比较差异无统计学意义(均P>0.05, 图5).
HCV特异性T细胞免疫应答在HCV感染的控制中发挥了关键作用. 慢性HCV感染者体内存在一系列免疫缺陷, 包括T细胞不能有效活化、单核细胞炎症反应过度级联放大以及树突状细胞功能的改变等[18-22]. 由于单用核心蛋白基因不能产生有效的保护性抗体反应[23-26], 因此近年的研究有采用C抗原基因加膜抗原基因, 或与乙型肝炎病毒(hepatitis B virus, HBV)表面抗原基因融合, 以及HCV DNA与表达Th1样细胞因子基因结合构建的疫苗免疫小鼠后, 既可产生高滴度的抗体反应, 又可诱导明显的脾细胞对HCV抗原增值反应和CTL杀伤活性[27,28], 本研究采用GM-CSF编码基因重组子联合pCMH6K/HCV-C肌注免疫Balb/c鼠探究GM-CSF编码基因免疫佐剂效应.
本实验将HCV C蛋白编码基因亚克隆至真核表达载体pCMH6K中, pCMH6K/HCV-C经酶切释出的插入子符合预期片段大小, DNA测序证明目的基因在真核表达载体中正常连接, 提示pCMH6K/HCV-C构建成功. 在pCMH6K/HCV-C转染的CHO细胞内, 免疫荧光法检测到阳性的绿色荧光标记主要分布在胞膜, 说明真核表达载体编码的HCV C蛋白可在CHO细胞表达.
体液免疫研究结果表明, pGM-CSF+pCMH6K/HCV-C联合免疫组与pCMH6K/HCV-C单独免疫组均能够诱导产生抗HCV-C蛋白特异性抗体, 明显高于pGM-CSF对照组及pcDNA3.1(+)空载体组, 进一步研究发现GM-CSF编码基因并没有增强抗HCV-C蛋白特异性抗体水平, Alekseeva等[29]为明确HCV C基因疫苗接种剂量对HCV C蛋白表达水平以及HCV DNA疫苗免疫应答的影响程度, 将相同剂量的HCV C蛋白编码基因重组子单次或分成多次肌注免疫Balb/c鼠, 结果发现多次免疫接种方式并没有增强HCV C蛋白特异性免疫应答, 相反能够下调HCV C蛋白特异性抗体和细胞因子表达水平. Zhu等[6]通过对HCV C蛋白基因不同区段研究发现, HCV核心蛋白本身可能抑制DNA疫苗诱导的免疫应答. 相反, 剪切的HCV C蛋白基因疫苗能够显著增强细胞免疫和抗HCV C蛋白特异性抗体应答. 据此推测, HCV C蛋白基因不同区段的选取以及免疫接种方式均能够影响HCV C蛋白基因疫苗诱导的体液免疫应答, GM-CSF编码基因对HCV DNA疫苗诱导的体液免疫应答可能没有影响.
已有研究表明CD4+T细胞在增强CTL杀伤活性方面起着关键作用[30,31]. 我们的研究表明pGM-CSF+pCMH6K/HCV-C免疫组获得了较理想的CD3+CD4+T细胞比例和HCV特异性CTL杀伤活性, CD3+CD4+T细胞比例与HCV特异性CTL杀伤活性有相关性. 此外, 我们的研究也发现CD3+CD8+T细胞比例与CTL活性缺乏一致性, 各组间CD3+CD8+T细胞比例无明显差异, 但各组所致HCV特异性CTL杀伤活性各不相同. 本项研究提示GM-CSF编码基因可显著增加抗原特异性CD4+T细胞比例、增强CTL杀伤活性.
基于活化的CD4+T细胞分泌的细胞因子能够改变Th1/Th2细胞因子平衡; DNA疫苗免疫鼠脾CD4+T细胞内细胞因子IFN-γ、IL-4的水平能够分别反应Th1与Th2细胞数量. 本实验我们通过检测免疫鼠脾CD4+T细胞内细胞因子IFN-γ和IL-4的水平探究了GM-CSF基因佐剂对HCV C基因疫苗免疫应答的影响. 我们的实验结果表明, 单独免疫组能够促进IFN-γ和IL-4的分泌水平, 联合免疫组能够明显促进IFN-γ的分泌水平、抑制IL-4的产生, 诱导产生Th1型免疫应答.
Chen等[32]最近研究表明, GM-CSF编码基因能够明显抑制乙型脑炎DNA疫苗诱导的特异性抗体和Th1型细胞因子分泌水平, 进一步研究发现, 此种抑制作用与GM-CSF编码基因表达水平有关, 呈剂量依赖性, 我们的研究也发现, 随pGM-CSF接种剂量增加, pCMH6K/HCV-C+pGM-CSF(100 μg)免疫组并没有进一步增强HCV C蛋白特异性细胞免疫和体液免疫应答水平, 相反明显抑制细胞免疫和体液免疫相关指标, 据此推测GM-CSF生物活性以及GM-CSF基因佐剂的多样性应用于DNA疫苗有待深入研究.
本项研究提示GM-CSF编码基因能够增强HCV DNA疫苗诱导的细胞免疫应答, 并能够改变Th免疫应答平衡, 随GM-CSF基因表达水平的增加, 抗HCV C蛋白特异性细胞免疫和体液免疫水平呈现先升高后抑制的趋势. 我们的研究为进一步探究HCV感染的致病机制及相关治疗方案提供了理论基础, 为研发HCV DNA疫苗提供实验依据.
丙型肝炎病毒(HCV)感染是严重危害人类健康的公共卫生问题, 是导致肝硬化、肝癌的重要原因, 目前还没有有效的丙肝疫苗问世. 因此, 对丙肝疫苗的研究, 非常具有现实意义.
丙型肝炎病毒(HCV)感染是严重危害人类健康的公共卫生问题, 是导致肝硬化、肝癌的重要原因, 目前还没有有效的丙肝疫苗问世. 因此, 对丙肝疫苗的研究, 非常具有现实意义.
HCV感染的控制和清除与有效持久的免疫应答相关, 特别是针对相对保守的核心蛋白Core的细胞免疫应答. 由于单用核心蛋白基因不能产生有效的保护性抗体反应. 因此近年研究有采用C抗原基因加膜抗原基因, 或与乙型肝炎病毒(HBV)表面抗原基因融合, 以及HCV DNA与细胞因子编码基因结合构建的疫苗免疫小鼠.
Chen等最近研究表明, GM-CSF编码基因能够明显抑制乙型脑炎DNA疫苗诱导的特异性抗体和Th1型细胞因子分泌水平, 此种抑制作用与GM-CSF编码基因的表达水平有关, 呈剂量依赖性. HCV与乙型脑炎病毒均属于黄病毒属, 深入研究GM-CSF基因在HCV DNA疫苗中的作用特点有重要意义.
本文首次将GM-CSF编码基因应用于HCV C基因DNA疫苗研究, 并揭示GM-CSF编码基因作为基因佐剂的复杂性、多样性, 为进一步探究HCV感染的致病机制及相关治疗方案提供了理论基础, 为研发HCV DNA疫苗提供实验依据.
慢性HCV感染者体内存在一系列免疫缺陷, 包括T细胞不能有效活化、单核细胞炎症反应过度级联放大以及树突状细胞功能的改变等, 深入探究GM-CSF编码基因在HCV DNA疫苗中的作用机制以及免疫学特征, 将为抗HCV疫苗的研发和创新提供理论和实验依据.
GM-CSF: 一种促进正常造血细胞增殖和分化的多肽类激素, 对粒细胞和单核/巨噬细胞的生成起主要作用. 此外, GM-CSF能够募集树突状细胞到达注射部位, 促进树突状细胞的分化与成熟, 在维持外周免疫耐受方面发挥重要作用.
研发抗HCV保护性疫苗对于治疗和预防HCV感染具有重要意义. 该文选题明确, 创新性可, 统计分析恰当, 具有一定应用价值.
编辑:田滢 电编:闫晋利
| 1. | Alberti A, Vario A, Ferrari A, Pistis R. Review article: chronic hepatitis C--natural history and cofactors. Aliment Pharmacol Ther. 2005;22 Suppl 2:74-78. [PubMed] [DOI] |
| 3. | Manea I, Manea CN, Miron N, Cristea V. Immunological aspects in viral hepatitis B and C infection. Roum Arch Microbiol Immunol. 2011;70:97-100. [PubMed] |
| 4. | Negro F. HCV infection and metabolic syndrome: which is the chicken and which is the egg? Gastroenterology. 2012;142:1288-1292. [PubMed] [DOI] |
| 5. | Hsu CS, Kao JH. Hepatitis C infection and metabolic syndrome. J Formos Med Assoc. 2010;109:403-407. [PubMed] [DOI] |
| 6. | Zhu W, Chang Y, Wu C, Han Q, Pei R, Lu M, Chen X. The wild-type hepatitis C virus core inhibits initiation of antigen-specific T- and B-cell immune responses in BALB/c mice. Clin Vaccine Immunol. 2010;17:1139-1147. [PubMed] [DOI] |
| 7. | Nguyen H, Sankaran S, Dandekar S. Hepatitis C virus core protein induces expression of genes regulating immune evasion and anti-apoptosis in hepatocytes. Virology. 2006;354:58-68. [PubMed] [DOI] |
| 8. | Echeverria I, Pereboev A, Silva L, Zabaleta A, Riezu-Boj JI, Bes M, Cubero M, Borras-Cuesta F, Lasarte JJ, Esteban JI. Enhanced T cell responses against hepatitis C virus by ex vivo targeting of adenoviral particles to dendritic cells. Hepatology. 2011;54:28-37. [PubMed] [DOI] |
| 9. | Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection. Nat Rev Immunol. 2005;5:215-229. [PubMed] [DOI] |
| 10. | Alvarez-Lajonchere L, Dueñas-Carrera S. Advances in DNA immunization against hepatitis C virus infection. Hum Vaccin. 2009;5:568-571. [PubMed] [DOI] |
| 11. | Thimme R, Neumann-Haefelin C, Boettler T, Blum HE. Adaptive immune responses to hepatitis C virus: from viral immunobiology to a vaccine. Biol Chem. 2008;389:457-467. [PubMed] [DOI] |
| 13. | Zhai YZ, Li XM, Zhou Y, Ma L, Feng GH. Intramuscular immunization with a plasmid DNA vaccine encoding prM-E protein from Japanese encephalitis virus: enhanced immunogenicity by co-administration of GM-CSF gene and genetic fusions of prM-E protein and GM-CSF. Intervirology. 2009;52:152-163. [PubMed] [DOI] |
| 14. | Wang J, Snider DP, Hewlett BR, Lukacs NW, Gauldie J, Liang H, Xing Z. Transgenic expression of granulocyte-macrophage colony-stimulating factor induces the differentiation and activation of a novel dendritic cell population in the lung. Blood. 2000;95:2337-2345. [PubMed] |
| 15. | Fischer HG, Frosch S, Reske K, Reske-Kunz AB. Granulocyte-macrophage colony-stimulating factor activates macrophages derived from bone marrow cultures to synthesis of MHC class II molecules and to augmented antigen presentation function. J Immunol. 1988;141:3882-3888. [PubMed] |
| 16. | Chang CH, Furue M, Tamaki K. B7-1 expression of Langerhans cells is up-regulated by proinflammatory cytokines, and is down-regulated by interferon-gamma or by interleukin-10. Eur J Immunol. 1995;25:394-398. [PubMed] [DOI] |
| 18. | Szabo G, Chang S, Dolganiuc A. Altered innate immunity in chronic hepatitis C infection: cause or effect? Hepatology. 2007;46:1279-1290. [PubMed] [DOI] |
| 19. | Bode JG, Brenndörfer ED, Häussinger D. Hepatitis C virus (HCV) employs multiple strategies to subvert the host innate antiviral response. Biol Chem. 2008;389:1283-1298. [PubMed] [DOI] |
| 20. | Irshad M, Khushboo I, Singh S, Singh S. Hepatitis C virus (HCV): a review of immunological aspects. Int Rev Immunol. 2008;27:497-517. [PubMed] [DOI] |
| 21. | Hiroishi K, Ito T, Imawari M. Immune responses in hepatitis C virus infection and mechanisms of hepatitis C virus persistence. J Gastroenterol Hepatol. 2008;23:1473-1482. [PubMed] [DOI] |
| 22. | Moriya K, Koike K. [Chronic hepatitis C: virologic and immunologic aspects]. Nihon Rinsho. 2004;62 Suppl 7:405-407. [PubMed] |
| 23. | Tokushige K, Wakita T, Pachuk C, Moradpour D, Weiner DB, Zurawski VR, Wands JR. Expression and immune response to hepatitis C virus core DNA-based vaccine constructs. Hepatology. 1996;24:14-20. [PubMed] [DOI] |
| 24. | Hu GJ, Wang RY, Han DS, Alter HJ, Shih JW. Characterization of the humoral and cellular immune responses against hepatitis C virus core induced by DNA-based immunization. Vaccine. 1999;17:3160-3170. [PubMed] [DOI] |
| 25. | Lagging LM, Meyer K, Hoft D, Houghton M, Belshe RB, Ray R. Immune responses to plasmid DNA encoding the hepatitis C virus core protein. J Virol. 1995;69:5859-5863. [PubMed] |
| 26. | Shirai M, Okada H, Nishioka M, Akatsuka T, Wychowski C, Houghten R, Pendleton CD, Feinstone SM, Berzofsky JA. An epitope in hepatitis C virus core region recognized by cytotoxic T cells in mice and humans. J Virol. 1994;68:3334-3342. [PubMed] |
| 27. | Ip PP, Nijman HW, Wilschut J, Daemen T. Therapeutic vaccination against chronic hepatitis C virus infection. Antiviral Res. 2012;96:36-50. [PubMed] [DOI] |
| 28. | Geissler M, Gesien A, Tokushige K, Wands JR. Enhancement of cellular and humoral immune responses to hepatitis C virus core protein using DNA-based vaccines augmented with cytokine-expressing plasmids. J Immunol. 1997;158:1231-1237. [PubMed] |
| 29. | Alekseeva E, Sominskaya I, Skrastina D, Egorova I, Starodubova E, Kushners E, Mihailova M, Petrakova N, Bruvere R, Kozlovskaya T. Enhancement of the expression of HCV core gene does not enhance core-specific immune response in DNA immunization: advantages of the heterologous DNA prime, protein boost immunization regimen. Genet Vaccines Ther. 2009;7:7. [PubMed] [DOI] |
| 30. | Wild J, Grusby MJ, Schirmbeck R, Reimann J. Priming MHC-I-restricted cytotoxic T lymphocyte responses to exogenous hepatitis B surface antigen is CD4+ T cell dependent. J Immunol. 1999;163:1880-1887. [PubMed] |
| 31. | Ahmed KA, Wang L, Munegowda MA, Mulligan SJ, Gordon JR, Griebel P, Xiang J. Direct in vivo evidence of CD4+ T cell requirement for CTL response and memory via pMHC-I targeting and CD40L signaling. J Leukoc Biol. 2012;92:289-300. [PubMed] [DOI] |