修回日期: 2011-09-08
接受日期: 2011-10-02
在线出版日期: 2011-10-08
目的: 探讨羽扇豆醇对人胰腺癌细胞SW1990及γδT细胞生长的影响.
方法: 采用本实验室体外扩增人外周血γδT细胞, 用四甲基偶氮唑蓝(MTT)法检测不同浓度的羽扇豆醇在不同时间段对人γδT细胞和人胰腺癌细胞SW1990生长的影响. 本实验分3组: 空白对照组、溶剂对照组和实验组, 时间段分24、48、72 h组.
结果: 羽扇豆醇浓度在0.4-200 μg/mL时羽扇豆醇对人胰腺癌细胞SW1990在24、48、72 h各组与空白对照组和溶剂对照组相比差异有统计学意义(P<0.05). 而24、48、72 h3组比较差异无统计学意义. γδT细胞培养7 d从扩增前的3.61%增加到80.2%, 羽扇豆醇对γδT细胞在24、48、72 h随浓度的增加先增值后抑制作用. 24 h与空白对照组和溶剂对照组比较差异无统计学意义. 48、72 h各组与空白对照组和溶剂对照组相比差异有统计学意义(P<0.05).
结论: 羽扇豆醇对人胰腺癌细胞SW1990有抑制作用, 对γδT细胞随着浓度增加有先促进后抑制作用.
引文著录: 罗冠琴, 朱炳喜, 陈复兴, 刘军权, 黄菲, 吕小婷. 羽扇豆醇对胰腺癌细胞株SW1990及γδT细胞生长的影响. 世界华人消化杂志 2011; 19(28): 2958-2962
Revised: September 8, 2011
Accepted: October 2, 2011
Published online: October 8, 2011
AIM: To explore the effect of lupeol on the grow-
th of human pancreatic cancer SW1990 cells and γδT cells.
METHODS: Peripheral blood γδT cells, expanded in vitro, were used in our study. After SW1990 and γδT cells were incubated with different concentrations of lupeol for different durations (24, 48 and 72 h), cell growth was determined by MTT assay. A blank control and a solvent control were run simultaneously.
RESULTS: The Lupeol at doses of 0.4-200 μg/mL, there are significant differences of growth human pancreatic cancer cell line SW1990 cells between the groups of 24, 48, 72 h and blank control group, the solvent control group (P < 0.05), however, no difference had been observed in each groups of three separated times. Harvested 7 d, γδT cells had expanded to 80.2% from 3.61%. in the groups of 24, 48 and 72 h, the effects turned to be advantageous and then depressed as the dose was increasing. there are no differences between the groups of 24 h and blank control group, the solvent control group. there are significant differences between the groups of 48, 72 h and blank control group, the solvent control group (P < 0.05).
CONCLUSION: Lupeol suppressed the growth of SW1990 cells, but produced a facilitative effect first and then inhibitory effect on the growth of γδT cells.
- Citation: Luo GQ, Zhu BX, Chen FX, Liu JQ, Huang F, Lv XT. Effect of lupeol on the growth of human pancreatic cancer SW1990 cells and γδT cells. Shijie Huaren Xiaohua Zazhi 2011; 19(28): 2958-2962
- URL: https://www.wjgnet.com/1009-3079/full/v19/i28/2958.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i28.2958
胰腺癌是恶性程度极高的消化系肿瘤, 大约80%胰腺癌在确诊时已经失去手术机会[1], 这部分患者只能采取包括化疗、放疗、生物治疗、支持治疗等各种综合治疗手段来延长患者的生存时间, 近年来肿瘤的生物治疗成为研究的热点. 羽扇豆醇是一种三砧类化合物, 在多种水果, 蔬菜以及某些植物中能提取, 如芒果、藕节、夹竹桃、马齿觅、榕树皮中可以提取. 随着对羽扇豆醇生物活性研究的深入, 其在医药领域获得了广泛的重视[2]. 近年来羽扇豆醇抗肿瘤作用被国外学者重视并用于研究, 国内研究甚少. 本文重点研究羽扇豆醇对人胰腺癌细胞SW1990和人γδT细胞的生长的影响, 探讨其抗胰腺癌作用.
人胰腺癌癌细胞株SW1990(中国科学院上海细胞所, 本室传代); 羽扇豆醇(lupeol)(Sigma公司); RPMI 1640培养基、小牛血清、胰蛋白酶(Gibco公司); 四甲基偶唑蓝(MTT)、二甲基亚砜(DMSO)(Sigma公司); 抗人TCR-γδ-FITC购自杭州联科生物(immunotech, France); 恒温CO2培养箱公司、倒置显微镜(德国Wilovert公司); 超净工作台、低温离心机 (北京希亚克技术有限公司).
1.2.1 羽扇豆醇原液配制: 羽扇豆醇纯度≥95%购于Sigma公司. 用温无水乙醇和二甲基亚砜(DMSO)按1:1比例混匀, 配制原液浓度为10 g/L, 放入-20 ℃冰箱储存, 以备使用.
1.2.2 γδT细胞的培养、鉴定和纯度检测: 按本实验室[3]建立的方法进行, 将培养第5天的DC用终浓度为10 μmol/L的唑来膦酸预处理48 h后收集DCs,生理盐水洗涤1次,用含IL-2 400 U/mL、10%小牛血清的RPMI 1640培养基将DCs配成1×103/mL的细胞悬液, 与用相同培养基配成1×104/mL的自身PBMC等体积混合(细胞比例为1:10), 于37 ℃, 50 mL/L CO2细胞培养箱中培养,每2 d半量换培养基1次, 同时调整细胞密度至1×105/mL. 收集不同培养时间的γδT细胞进行相关功能检测.
1.2.3 人胰腺癌细胞株SW1990的培养: 将复苏后的细胞配成2×105/mL的细胞悬液, 置于细胞培养瓶中, 在37 ℃, 50 mL/L CO2条件下培养, 2-3 d更换细胞培养液, 细胞达80%瓶底时, 以0.02% EDTA消化脱壁. 收集细胞, 800 r/min离心3 min, 弃去上清备用.
1.2.4 羽扇豆醇对人胰腺癌细胞SW1990和人γδT细胞生长的影响: 将收集的对数生长期胰腺癌细胞SW1990配成3×104/mL的细胞悬液, 接种于96孔板中, 0.2 mL/孔, 加入羽扇豆醇(浓度分别为200、100、50、25、12.5、6.25、3.2、1.6、0.8、0.4 mg/L). 人γδT细胞配成1×105/mL的细胞悬液, 接种于96孔板中, 0.2 mL/孔, 加入羽扇豆醇(浓度分别为400、200、100、50、25、12.5、6.25、3.2、1.6、0.8 mg/L). 同时设空白和溶剂(每孔加入与溶解羽扇豆醇的等量溶剂)对照组, 每组设5个复孔. 继续孵育24、48、72 h后每孔加人MTT(5 g/L)液20 μL,37 ℃孵育4 h后弃上清, 每孔加入DMSO 150 μL,轻轻震荡10 min使甲瓒充分溶解, 在540 nm波长酶标仪上测定各孔吸光度值(A). 每试验重复3次. 求其平均值. 细胞生长抑制率IR(%) = (对照A)-(实验A值)/(对照A)×100%, 增殖率 = 实验A值-对照A值/对照A值×100%.
统计学处理 采用SPSS16.0软件, 进行统计学处理, 计量资料使用mean±SD表示, 采用单因素方差分析(One-way ANOVA), 两两比较使用S-N-K法或者Duncan法, 检验水准α = 0.05, P<0.05为差异有统计学意义.
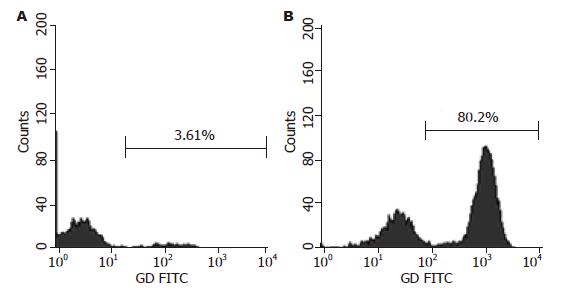
人外周血单个核细胞(PBMC)在γδT细胞培养基中培养24 h即可见贴壁生长, 48 h后集落开始变大, 培养7 d可见大的集落和单个贴壁生长细胞, 单个细胞可见细胞呈条梭状, 也有少量浮悬生长细胞. 收集培养7 d时的细胞进行流式细胞术检测并分析结果. PBMC未培养前γδT细胞数为3.61%, 培养7 d的γδT细胞数为80.2%(图1).
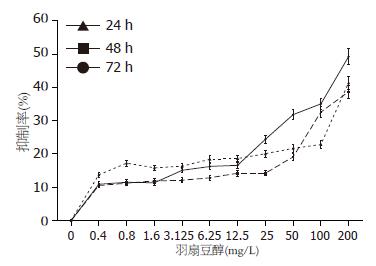
羽扇豆醇浓度在0.4-200 mg/L时能够显著抑制SW1990细胞的生长, 且随着浓度的增加抑制率呈上升趋势, 24、48、72 h 3个时间段羽扇豆醇对SW1990细胞的抑制率无明显统计学差异(图2). 24、48、72 h各组的A值与空白对照组和溶剂对照组相比较均具有统计学意义(P<0.05).空白对照与溶剂对照组比较无统计学意义(表1).
| 羽扇豆醇浓度(µg/L) | SW1990细胞A值 | ||
| 24 h | 48 h | 72 h | |
| 空白对照组 | 0.1627±0.0025 | 0.1353±0.006 | 0.1425±0.0049 |
| 溶剂对照组 | 0.1653±0.032 | 0.1360±0.041 | 0.1419±0.003 |
| 0.4 | 0.1450±0.003a | 0.1283±0.002a | 0.1230±0.0015a |
| 0.8 | 0.1440±0.005a | 0.1273±0.0015a | 0.1180±0.0045a |
| 1.6 | 0.1433±0.0051a | 0.1263±0.0025a | 0.1200±0.002a |
| 3.125 | 0.1427±0.0025a | 0.1260±0.003a | 0.1193±0.0025a |
| 6.25 | 0.1363±0.002a | 0.1250±0.001a | 0.1163±0.025a |
| 12.5 | 0.1357±0.003a | 0.1230±0.002a | 0.1160±0.001a |
| 25 | 0.1230±0.001a | 0.1230±0.0036a | 0.1140±0.004a |
| 50 | 0.1110±0.001a | 0.1160±0.003a | 0.1117±0.002a |
| 100 | 0.1057±0.006a | 0.1067±0.0035a | 0.1100±0.001a |
| 200 | 0.0827±0.0116a | 0.0880±0.005a | 0.0837±0.032a |
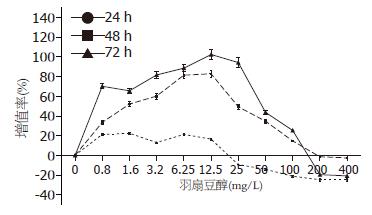
羽扇豆醇对人γδT细胞24、48、72 h浓度从0.8-12.5 mg/L时对人γδT细胞的生长呈促进作用, 随着浓度的升高增值率升高; 在浓度12.5-100 mg/L时对促进人γδT细胞的生长现象逐渐减弱. 羽扇豆醇浓度在100-400 mg/L时对人γδT细胞生长起抑制作用. 图示48、72 h浓度为12.5 mg/L时其增值率最高(图3). 羽扇豆醇对人γδT细胞MTT测得A值分析, 24 h与空白对照组比较无统计学意义, 48、72 h与空白对照组比较有统计学意义(P<0.05), 48与72 h比较无统计学意义, 空白对照组与溶剂对照组比较无统计学意义(表2).
| 羽扇豆醇浓度(µg/L) | γT细胞A值 | ||
| 24 h | 48 h | 72 h | |
| 空白对照组 | 0.0850±0.0210 | 0.0753±0.0095 | 0.0867±0.0068 |
| 溶剂对照组 | 0.0880±0.0450 | 0.0761±0.0122 | 0.0834±0.0356 |
| 0.4 | 0.1033±0.0069 | 0.1003±0.0101 | 0.1480±0.0170a |
| 0.8 | 0.1047±0.0015 | 0.1140±0.0140a | 0.1440±0.0400a |
| 1.6 | 0.0960±0.0144 | 0.1200±0.0070a | 0.1580±0.0300a |
| 3.125 | 0.1033±0.0196 | 0.1360±0.0220a | 0.1760±0.0800a |
| 6.25 | 0.0993±0.0286 | 0.1370±0.0240a | 0.1640±0.0300a |
| 12.5 | 0.0770±0.0200 | 0.1117±0.0225 | 0.1760±0.0800a |
| 25 | 0.0730±0.0050 | 0.1013±0.0127 | 0.1690±0.0200a |
| 50 | 0.0667±0.0176 | 0.0863±0.0015 | 0.1093±0.0104 |
| 100 | 0.0640±0.0199 | 0.0740±0.0195 | 0.0700±0.0098 |
| 200 | 0.0673±0.1069 | 0.0730±0.0173 | 0.0690±0.0020 |
羽扇豆醇是一种三砧类天然植物提取物, 既往研究表明, 羽扇豆醇在抗炎止痛、抗氧化等方面有很好的药理作用, 而且毒性很低, 具有良好的临床应用潜力, 受到国内外学者的广泛关注[2]. 近几年其抗肿瘤作用受到重视, 有研究表明羽扇豆醇对黑色素瘤、前列腺癌、皮肤癌、肝癌都有抗癌作用[4]. 对于羽扇豆醇抗胰腺癌的作用, 国内外报道较少. 本研究用四甲基偶氮唑蓝(MTT)法检测不同浓度的羽扇豆醇在不同时间段对人胰腺癌细胞SW1990生长的影响, 实验表明羽扇豆醇浓度在0.4-200 mg/L时能够显著抑制胰腺癌细胞SW1990的生长, 且随着浓度的增加抑制率呈上升趋势, 24、48、72 h各组的A值与空白对照组和溶剂对照组相比较均具有统计学意义(P<0.05). 本实验提示羽扇豆醇对人胰腺癌细胞SW1990有抑制作用, 其机制可能与羽扇豆醇下调cFLIP的表达、增加caspase-8蛋白的活性、 增强TRAIL对胰腺癌细胞的促凋亡作用有关[5].
人γδT细胞在PBMC淋巴细胞中仅占0.5%-5.0%, 大多为CD4-CD8-. γδT细胞主要分布于皮肤、小肠、食管、肺、生殖器官及皮下组织. 外周血中的γδT细胞约占人体总γδT细胞的90%以上, 他识别磷酸化抗原和一些应激分子以及激蛋白的同源分子, 他识别抗原分子不受MHC分子限制, 在固有免疫中发挥重要作用[6,7]. 近年来γδT细胞是免疫学的一个研究热点, 国内外学者对其分化和功能进行了广泛深入的研究[8,9]. 对其功能研究多集中在抗感染和抗肿瘤等方面[10,11], γδT细胞的抗肿瘤功能与细胞表达的穿孔素、颗粒酶B和NKG2D受体及γδT细胞分泌的细胞因子有关. 在诱导机体固有免疫应答和在肿瘤细胞的预治方面具有重要的作用[12]. Kobayashi等[13]用自身γδT细胞治疗7例晚期肾癌, 结果证明治疗是安全的, 治疗后能明显增加血中γδT细胞数量和诱发抗肿瘤反应. γδT细胞识别谱广泛, 对肿瘤细胞的识别不需要抗原提呈细胞加工处理, 没有MHC限制性. 因此, γδT细胞已成为肿瘤患者过继免疫治疗的一个新的候选效应细胞. 研究已证实, 在直肠癌、肾癌、肝癌和乳腺癌等实体瘤的肿瘤浸润淋巴细胞(TIL)中存在有γδT细胞并具有抗肿瘤作用[14,15]. Bani等[16]研究发现羽扇豆醇对T细胞生长有抑制作用, Balb/c小鼠每日口服羽扇豆醇12.5-200 mg/kg, 可抑制CD4+和CD8+细胞数量. 随着研究的不断深入, 发现培养的外周血γδT细胞在体外同样具有较强的广谱抗肿瘤作用[17-19], 羽扇豆醇对γδT细胞的作用国内外未有研究. 本实验采用体外扩增人外周血γδT细胞, 探讨不同浓度的羽扇豆醇在不同时间段对人γδT细胞的影响, 发现羽扇豆醇在24、48、72 h浓度从0.8-12.5 mg/L时对γδT细胞的生长呈促进作用, 随着浓度的升高增值率升高; 在浓度12.5-100 mg/L时对促进γδT细胞的生长现象逐渐减弱. 所以羽扇豆醇对γδT细胞的增殖作用有浓度和时间的关系.本实验结果显示羽扇豆醇对γδT细胞的最佳增殖作用在72 h 12.5 mg/L时. 关于羽扇豆醇是否增强γδT细胞的杀伤活性, 及其对γδT细胞的信号通路的机制将在今后的研究中深入探讨.
本研究表明羽扇豆醇有促进人γδT细胞体外增殖的作用, 羽扇豆醇具有抗胰腺癌的作用. 通过本研究现象, 我们推测可在体外培养胰腺癌患者γδT细胞时选择适当浓度羽扇豆醇和培养一定时间以增加免疫细胞数量和功能, 再回输给胰腺癌患者, 可提高肿瘤生物治疗的效果. 本研究为羽扇豆醇在胰腺癌患者生物免疫治疗中的应用提供了一定的理论依据, 羽扇豆醇治疗胰腺癌的确切机制及体内实验结果仍需进一步研究.
近年来研究发现γδT细胞以MHC非限制方式杀伤肿瘤细胞在免疫监视中具有重要作用, γδT细胞识别谱广泛, 对肿瘤细胞的识别不需要抗原提呈细胞加工处理.因此, γδT细胞已成为肿瘤患者过继免疫治疗的一个新的候选效应细胞. 国外研究表明, 羽扇豆醇抗胰腺癌的作用, 但是对γδT细胞作用尚无报道. 因此, 本课题组研究羽扇豆醇对γδT细胞生长的影响及杀伤胰腺癌细胞株SW1990作用的影响.
刘超, 副教授, 中山大学孙逸仙纪念医院肝胆胰外科; 吴泰璜, 教授, 山东省立医院肝胆外科
γδT细胞以MHC非限制性方式杀伤肿瘤细胞, 现已报告用扩增的自身γδT细胞对人胃癌、淋巴瘤和晚期肾癌进行了治疗, 初步结果是安全有效地. 因此, 如何在体内外大量快速扩增, 重点是增强γδT细胞杀伤活性, 深入探讨其作用机制是目前致力于研究的问题.
陈复兴等研究发现体外培养的γδT细胞对多种消化系肿瘤人胃癌、胰腺癌、肝癌细胞株均有较强的杀伤作用. 且γδT细胞杀伤肿瘤主要通过颗粒酶、穿孔素、Fas/FasL途径起作用. Corvaisier等发现γδT细胞对自身肿瘤细胞和异体肿瘤细胞均有杀伤活性, 而对自身正常细胞无杀伤作用, 这种杀伤是MHC非依赖性的, 并与γδTCR刺激物的产生和ICAM-1表达密切相关.
本文研究发现羽扇豆醇在体外能够促进γδT细胞的增殖, 有益于羽扇豆醇应用于肿瘤的过继免疫治疗, 并提供了临床治疗肿瘤的用药依据.
本文分析合理, 条理分明, 参考文献恰当, 研究有一定意义.
编辑:曹丽鸥 电编:何基才
| 1. | Loos M, Kleeff J, Friess H, Büchler MW. Surgical treatment of pancreatic cancer. Ann N Y Acad Sci. 2008;1138:169-180. [PubMed] [DOI] |
| 2. | Fernández MA, de las Heras B, García MD, Sáenz MT, Villar A. New insights into the mechanism of action of the anti-inflammatory triterpene lupeol. J Pharm Pharmacol. 2001;53:1533-1539. [PubMed] [DOI] |
| 5. | Murtaza I, Saleem M, Adhami VM, Hafeez BB, Mukhtar H. Suppression of cFLIP by lupeol, a dietary triterpene, is sufficient to overcome resistance to TRAIL-mediated apoptosis in chemoresistant human pancreatic cancer cells. Cancer Res. 2009;69:1156-1165. [PubMed] [DOI] |
| 6. | Beetz S, Wesch D, Marischen L, Welte S, Oberg HH, Kabelitz D. Innate immune functions of human gammadelta T cells. Immunobiology. 2008;213:173-182. [PubMed] [DOI] |
| 7. | Kabelitz D, Glatzel A, Wesch D. Antigen recognition by human gammadelta T lymphocytes. Int Arch Allergy Immunol. 2000;122:1-7. [PubMed] [DOI] |
| 8. | Dieli F, Poccia F, Lipp M, Sireci G, Caccamo N, Di Sano C, Salerno A. Differentiation of effector/memory Vdelta2 T cells and migratory routes in lymph nodes or inflammatory sites. J Exp Med. 2003;198:391-397. [PubMed] [DOI] |
| 9. | Ferlazzo V, Sferrazza C, Caccamo N, Di Fede G, Di Lorenzo G, D'Asaro M, Meraviglia S, Dieli F, Rini G, Salerno A. In vitro effects of aminobisphosphonates on Vgamma9Vdelta2 T cell activation and differentiation. Int J Immunopathol Pharmacol. 2006;19:309-317. [PubMed] |
| 10. | Gong F, Ma Y, Ma A, Yu Q, Zhang J, Nie H, Chen X, Shen B, Li N, Zhang D. A lectin from Chinese mistletoe increases gammadelta T cell-mediated cytotoxicity through induction of caspase-dependent apoptosis. Acta Biochim Biophys Sin (Shanghai). 2007;39:445-452. [PubMed] [DOI] |
| 11. | Ma YH, Cheng WZ, Gong F, Ma AL, Yu QW, Zhang JY, Hu CY, Chen XH, Zhang DQ. Active Chinese mistletoe lectin-55 enhances colon cancer surveillance through regulating innate and adaptive immune responses. World J Gastroenterol. 2008;14:5274-5281. [PubMed] [DOI] |
| 12. | Whang MI, Guerra N, Raulet DH. Costimulation of dendritic epidermal gammadelta T cells by a new NKG2D ligand expressed specifically in the skin. J Immunol. 2009;182:4557-4564. [PubMed] [DOI] |
| 13. | Kobayashi H, Tanaka Y, Yagi J, Osaka Y, Nakazawa H, Uchiyama T, Minato N, Toma H. Safety profile and anti-tumor effects of adoptive immunotherapy using gamma-delta T cells against advanced renal cell carcinoma: a pilot study. Cancer Immunol Immunother. 2007;56:469-476. [PubMed] [DOI] |
| 14. | Watanabe N, Hizuta A, Tanaka N, Orita K. Localization of T cell receptor (TCR)-gamma delta + T cells into human colorectal cancer: flow cytometric analysis of TCR-gamma delta expression in tumour-infiltrating lymphocytes. Clin Exp Immunol. 1995;102:167-173. [PubMed] [DOI] |
| 15. | Chen J, Niu H, He W, Ba D. Antitumor activity of expanded human tumor-infiltrating gammadelta T lymphocytes. Int Arch Allergy Immunol. 2001;125:256-263. [PubMed] [DOI] |
| 16. | Bani S, Kaul A, Khan B, Ahmad SF, Suri KA, Gupta BD, Satti NK, Qazi GN. Suppression of T lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytother Res. 2006;20:279-287. [PubMed] [DOI] |
| 17. | Viey E, Fromont G, Escudier B, Morel Y, Da Rocha S, Chouaib S, Caignard A. Phosphostim-activated gamma delta T cells kill autologous metastatic renal cell carcinoma. J Immunol. 2005;174:1338-1347. [PubMed] [DOI] |
| 18. | Corvaisier M, Moreau-Aubry A, Diez E, Bennouna J, Mosnier JF, Scotet E, Bonneville M, Jotereau F. V gamma 9V delta 2 T cell response to colon carcinoma cells. J Immunol. 2005;175:5481-5488. [PubMed] [DOI] |
| 19. | 马 安伦, 葛 海良, 张 冬青, 王 树军, 周 光炎. 一种简单的γT细胞扩增培养方法及其抗肿瘤生物学功能研究. 中国肿瘤生物治疗杂志. 2000;7:181-183. |