修回日期: 2010-01-05
接受日期: 2010-01-11
在线出版日期: 2010-03-18
目的: 观察凋亡调控蛋白FLICE样抑制蛋白(FLICE-like inhibitory protein, c-FLIP)及其下游凋亡因子caspase-8在胆道损伤愈合良性狭窄形成过程中的表达和定位.
方法: 建立胆管损伤后良性狭窄犬模型, 利用采用免疫组织化学SABC法分别对15例犬胆道损伤后2、3、4、5、6 mo及其配对的15例假手术组的吻合口组织中c-FLIP及caspase-8表达和定位进行分析, 根据染色细胞的比例, 计算每张切片的平均吸光度值, 分别比较cFLIP及caspase-8在实验组及其配对的假手术组胆道吻合口组织表达的差异, 及两组内不同时相之间c-FLIP及caspase-8在吻合口组织表达的差异.
结果: c-FLIP蛋白于实验组内各时间点均呈阳性表达, 定位于间质细胞, 以成纤维细胞胞质最明显, 各时间点内实验组与对照组比较有显著性差异(22.33±3.40 vs 3.41±0.69, 21.01±5.43 vs 3.28±0.95, 18.93±2.54 vs 3.11±1.01, 18.88±3.40 vs 3.35±0.74, 17.23±3.53 vs 3.19±0.91, 均P<0.05), 而各时间点之间无显著性差异(P>0.05). caspase-8于实验组各时相均呈现弱表达, 定位以腺上皮居多, 间质组织表达相对较弱, 与配对之对照组比较均差异显著(3.20±0.86 vs 11.66±2.80, 3.42±1.17 vs 10.16±3.08, 3.65±0.90 vs 10.03±1.93, 3.91±0.71 vs10.90±4.02, 4.01±0.88 vs 11.23±2.73, P<0.05), 而各时间点之间亦无显著性差异(P>0.05). c-FLIP与caspase-8蛋白表达成负相关(r = -0.94, P<0.05).
结论: cFLIP可能通过抑制caspase-8的激活在胆道良性狭窄形成过程中发挥了其抗凋亡的作用.
引文著录: 李可洲, 骆乐, 姚豫桐, 张晓, 闫洪涛. cFLIP和caspase-8在犬胆道良性损伤修复过程中的表达. 世界华人消化杂志 2010; 18(8): 773-778
Revised: January 5, 2010
Accepted: January 11, 2010
Published online: March 18, 2010
AIM: To investigate the expression and localization of apoptosis-regulatory protein cellular FLICE-like inhibitory protein (cFLIP) and its downstream apoptotic factor caspase-8 in the formation of benign biliary strictures after bile duct injury.
METHODS: An animal model of benign biliary strictures was established in dogs by inducing bile duct injury. Tissue specimens were taken from the anastomotic sites created in 15 model dogs (experimental group) and 15 matched sham-operated dogs (control group) at 2, 3, 4, 5 and 6 months after injury induction. The expression and localization of c-FLIP and caspase-8 proteins in these specimens was detected by immunohistochemistry using the streptavidin-biotin complex (SABC) method. The average optical density for each slice was then calculated, and the differential expression of c-FLIP and caspase-8 proteins at different time points was compared between the two groups.
RESULTS: Strong positive expression of c-FLIP protein was found in anastomotic tissue in the experimental group at all time points, mainly distributed in the cytoplasm of fibroblasts. Significant differences were noted in the expression levels of c-FLIP protein between the experimental group and the control group at all time points (22.33 ± 3.40 vs 3.41 ± 0.69, 21.01 ± 5.43 vs3.28 ± 0.95, 18.93 ± 2.54 vs 3.11 ± 1.01, 18.88 ± 3.40 vs 3.35 ± 0.74, and 17.23 ± 3.53 vs 3.19 ± 0.91, respectively; all P < 0.05), but not among different time points in either of the two groups (all P > 0.05). Weak expression of caspase-8 was observed in anastomotic tissue in the experimental group at all time points, mainly concentrated in glandular epithelium and less localized in stromal tissue, Significant differences were also noted in the expression levels of caspase-8 between the experimental group and the control group at all time points (3.20 ± 0.86 vs 11.66 ± 2.80, 3.42 ± 1.17 vs 10.16 ± 3.08, 3.65 ± 0.90 vs 10.03 ± 1.93, 3.91 ± 0.71 vs 10.90 ± 4.02, and 4.01 ± 0.88 vs 11.23 ± 2.73, respectively; all P < 0.05) but not among different time points in either of the two groups (all P > 0.05). A negative correlation was noted between the expression of c-FLIP and caspase-8 (r = -0.94, P < 0.05).
CONCLUSION: cFLIP may exert anti-apoptotic effects during the formation of benign biliary stricture by down-regulating the expression of caspase-8.
- Citation: Li KZ, Luo L, Yao YT, Zhang X, Yan HT. Expression of c-FLIP and caspase-8 during the formation of canine benign biliary strictures after bile duct injury. Shijie Huaren Xiaohua Zazhi 2010; 18(8): 773-778
- URL: https://www.wjgnet.com/1009-3079/full/v18/i8/773.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i8.773
有研究表明, 胆道良性狭窄的形成类似于皮肤病理性瘢痕的发生机制, 均由成纤维细胞大量增殖分化, 细胞外基质过度合成及分泌所造成[1]. 而近年来对病理性瘢痕机制的探索日益深入, 细胞增殖与凋亡平衡观的引入[2,3]也为胆道良性狭窄形成机制的研究提供了新的思路, 但在胆道良性狭窄研究领域中, 尚未涉及对细胞凋亡的探索. 本实验旨在通过犬胆道良性狭窄模型, 对凋亡调控蛋白cFLIP及其下游凋亡因子caspase-8在胆道损伤吻合后狭窄瘢痕组织内的表达水平进行动态观察及定位情况研究, 为寻求胆道良性狭窄解决办法提供一条新思路.
本地健康杂交犬30只, 由四川大学动物实验中心提供, 雌雄不限, 平均体质量12.6 kg±2.1 kg. 40 g/L多聚甲醛溶液及PBS(pH7.0-7.6)均购于四川大学华西医学中心, 第一抗体c-FLIPs/L兔抗狗IgG(bs-0119R, 北京博奥森), caspase-8兔抗狗IgG(bs-0052R); 二抗羊抗兔IgG生物素标记(ZB2010.Lot Uo221, 北京中杉金桥), DAB显色试剂盒(DAB-0031, 福州迈新).
1.2.1 造模及分组: 分笼饲养, 并随机(数字法)分为实验组15只, 对照组15只. 术前晚禁食, 氯胺酮4 mg/kg及速眠醒0.1 mL/kg肌肉注射诱导麻醉, 上肢静脉穿刺补液, 青霉素320万U加入10%葡萄糖氯化钠注射液中, 术中静滴. 经右上腹肋缘下弧形切口入腹, 首先距十二指肠上缘2 cm处游离出胆总管(上下游离范围不超过1 cm), 实验组横向切开胆总管前壁及侧壁,保留后壁2 mm,以5-0不吸收丝线作胆总管壁全层吻合, 针距约0.4-0.5 mm, 边距约0.3-0.4 mm. 术毕探查吻合口无渗漏, 于肝肾隐窝放置引流管后关腹. 对照组游离胆总管后直接关腹. 术后于皮下注射生理盐水补液并预防感染治疗3 d, 3 d后拔除腹腔引流管.
1.2.2 标本采集及检测: 分别于术后2、3、4、5、6 mo取材, 每次取材6只, 实验组及对照组各3只. 切取吻合口连同上、下1 cm组织, 40 g/L多聚甲醛溶液, PBS(pH7.0-7.6)固定, 常规脱水、透明、浸蜡、包埋制成蜡块后行4 μm连续切片, HE染色, 光镜观察. 免疫组织化学染色采用SABC法, 切片常规脱蜡至水, H2O2灭活内源性过氧化物酶, 微波修复抗原, 正常山羊血清封闭,分别滴加一抗, 4 ℃过夜; 滴加生物素化二抗及SABC复合液, DAB-H2O2显色, 染色步骤按DAB试剂盒说明进行; 苏木素复染, 封片, 观察. 用已知c-FLIP/caspase-8的阳性切片作阳性对照, 用PBS液分别代替一抗、二抗作阴性对照. 每张切片随机选取5个互不重叠的高倍镜视野(400倍), 进行统计.
1.2.3 结果判定标准及统计指标: 阳性细胞评定标准: c-FLIP/caspase-8均以细胞质或核染成黄色为阳性细胞. 应用Image pro plus4.5图像分析软件, 对各组切片平均表达强度进行定量分析, 即测量其平均吸光度值(IA).
统计学处理 采用SPSS16.0统计软件包进行统计学分析, 各组数据以mean±SD表示; 组间及组内比较采用方差分析,P<0.05为有统计学意义. c-FLIP及caspase-8数据进行Spearman相关性分析, P<0.01有统计学意义.
实验组1只犬术后15 d死于腹腔感染, 另有1犬术后9 d死于胆漏, 为保证样本量, 于同样条件下按上述造模方法, 另外补入新样本. 其余犬只, 食欲, 反应尚可.
各组均有慢性炎症细胞浸润, 纤维组织增生并分割腺上皮, 灶性淋巴滤泡形成的现象, 为典型的慢性炎症表现. 其中2、3、4 mo组均有胆管壁, 上皮下的灶性充血及出血现象. 并有不同程度的腺体扩张. 而5、6 mo组出现腺体深陷肌层的表现, 这可能是纤维增生所造成的腺体移位. 由此可见, 胆管损伤愈合后即处于慢性持续性的炎症环境中, 管壁结构明显破坏, 纤维组织大量增生是其主要的病理改变.
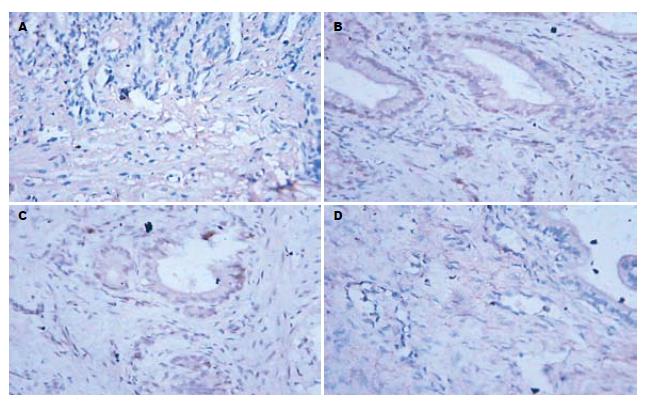
c-FLIP蛋白于实验组内各时间点均为阳性表达, 定位上来看, 主要集中于上皮下间质组织细胞质, 以成纤维细胞最为明显, 染色较深, 炎症细胞如单核巨噬细胞, 淋巴细胞及血管内皮细胞均有不同程度表达, 而腺上皮表达不明显(图1). caspase-8于实验组各时相均呈现弱表达, 定位上以腺上皮居多, 间质组织表达相对较弱(图1).
c-FLIP蛋白于实验组内各时间点均较与其配对的对照组有显著表达(P<0.05), 前者明显强于后者. 各时间点之间比较无明显差异(P>0.05), 但总体上随时间推移呈下降趋势(表1). caspase-8于实验各组均呈现弱表达, 与对照组差异显著(P<0.05), 各时间点间亦无显著性差异(P>0.05), 但总体上随时间推移呈上升趋势(表2). 相关性分析结果: 胆道损伤愈合之瘢痕形成过程中, c-FLIP与caspase-8蛋白表达成负相关(P<0.01, r = -0.94).
胆道良性损伤后的远期狭窄问题一直是临床上非常棘手的难题. 目前对其机制的探讨国内外相关报道较少, 但已有学者证实其与瘢痕发生机制相类似, 均由成纤维细胞大量增殖并过度分泌胶原等基质成分所致[1]. 而胆道环境的复杂性又使其具有异于普通瘢痕形成机制的独特性, 由此对其的研究进展远远落后于对病理性瘢痕的探究. 就前者来说, 胆道损伤后即处于胆汁成分所造就的慢性炎症环境下[1], 各种复杂的刺激因素仍于探索之中. 而就后者而言, 目前研究集中与对凋亡的探讨. Aarabi等[2]证实在增生性瘢痕形成过程中, AKT依赖的凋亡通路的抑制发挥了重要作用. Lu等[3]也发现, Fas介导的凋亡途径的阻断可能是导致病理性瘢痕的原因之一. 而Messadi等[4]则认为NF-κB及其靶基因, 尤其是抗凋亡基因可能在瘢痕疙瘩的发病机制中起重要作用. 本实验即是选取受NF-κB激活的下游抗凋亡基因cFLIP作为研究重点.
caspase-8同源结构FLICE抑制蛋白(cFLIP)是一种针对死亡受体诱导凋亡的负性调节因子. 因其碳末端含有两个类似caspase蛋白的死亡效应域(death effector domains, DEDs)可竞争性招募某些死亡域(death domain, DD), 从而造成caspase失活, 凋亡受阻. cFLIP对抑制caspase-8前体特异性较高, 与其结构上所具有的caspase-8同源性有关. 本实验中选用caspase-8作为观察cFLIP凋亡抑制作用的另一个指标也正是基于此点. 目前, 发现受cFLIP抑制的死亡受体包括: Fas, TRAIL, DR3、DR4 以及DR5等[5]. cFLIP已经被发现在胃癌[6], 胰腺癌[7], 大肠癌[8]等肿瘤细胞中处于表达上调的状态. 其突出的抗凋亡功能使肿瘤细胞无论何时都能逃脱由死亡诱导信号复合物(death-inducing signaling complex, DISC)所发起的凋亡攻势, 被众多学者称为"免疫逃逸"的始作者[9]. 目前认为, cFLIP表达受核转录因子-κB(nuclear factor kappa B, NF-κB)所调控. Kreuz等[10]发现在药物干预诱导肿瘤坏死因子激活NF-κB的SV80细胞系中, cFLIP呈现表达上调. Banno等[11]应用siRNA沉默子证明在表皮角质形成细胞中, cFLIP是主要的NF-κB依赖性抗凋亡基因. NF-κB受TNF、IL-1等外源性炎症因子所激活, 进入核内启动了包括许多炎症细胞因子, 抗凋亡蛋白, 免疫相关抗体, 黏附分子等基因表达. 因而他在炎症, 肿瘤, 免疫等众多生物学进程中被看做是最重要的枢纽性蛋白[12]. 胆道环境下的伤口愈合过程是一个慢性持续性的炎症过程[1], 大量炎症因子, 免疫因子地持续释放及缺血缺氧因素均可造成NF-κB的持续激活[13]. cFLIP作为NF-κB依赖性抗凋亡基因完全有可能处于过度表达状态. 本实验恰恰验证了这一点. cFLIP于各时间点均有较强表达, 并以纤维结缔组织为主. 这说明成纤维细胞较上皮细胞有更强的凋亡抑制趋势, 其机制可能与胆道上皮细胞的特殊结构有关. 胆管上皮细胞内的胆酸转运蛋白(apical sodium-dependent bile acid transporter, ASBT)类似于膜受体, 决定了细胞对胆酸的选择性和敏感性, 而他的表达量受胆汁成分的调节[14-16]. 有研究表明[17], 胆管上皮细胞内胆酸浓度的改变, 可通过Ca2+, P13K, PKC等信号通路影响细胞的增殖、凋亡、分泌及基因表达. 而Lilienbaum等[18]在研究神经元NF-κB信号通路时发现: Ca2+, P13K, PKC这三条信号途径均与NF-κB的激活关系密切. 因此, 有可能是胆道损伤愈合过程中的胆汁内环境的变化使ASBT表达改变, 进而影响了胆管上皮细胞对胆汁成分地摄取及反应, 通过复杂的信号网络传导, 最终导致NF-κB的激活减少或c-FLIP基因表达直接受到抑制, 但其具体机制还有待进一步探究. 总之, 胆道纤维结缔组织细胞凋亡增殖失衡可能是造成最终瘢痕形成, 胆管狭窄的原因之一. 另外, Jiang等[19]发现, 在原发性硬化性胆管炎鼠模型中, CD4+ T细胞内cFLIPL表达的上调促进了其抗凋亡能力, 并导致了肝门部炎症的恶化. 本实验中, cFLIP在炎症细胞如单核巨噬细胞, 淋巴细胞及血管内皮细胞中均有不同程度的表达, 这些炎症细胞将因为caspase-8的激活受阻而失凋亡, 从而大量增殖并分泌炎症介质, 导致炎症的持续并再次激活NF-κB, 进而又将启动下游cFLIP表达, 如此反复, 成为一个正反馈的过程, 造成炎症的不断进行且凋亡持续受阻. 这可能也是造成胆道慢性炎症环境形成, 最终成纤维细胞大量增殖并不断分泌基质成分导致胆道吻合口瘢痕形成的原因之一.
caspase即半胱氨酸特异性蛋白酶, 因含有能在天冬氨酸残基后切割其他蛋白的关键性半胱氨酸残基而具有独特性. 他们是细胞凋亡进程的启动者. caspase通常以酶原(procaspase)的形式存在, 相对分子质量为29-49 kDa. N末端具有一个原结构(prodomain), C端包含约20 kDa的大亚基和约10 kDa的小亚基, C端同源区存在半胱氨酸激活位点, 此激活位点结构域为QACR/QG. 当DISC与此结构域偶联后, N端原结构域被去除, 在大小亚基中进行切割; 大小亚基形成异源二聚体, 进而形成四聚体, caspase激活完成[20]. 因此我们可通过测定caspase的表达量来了解Procaspase被激活的程度, 即凋亡发生率的高低. caspase-8作为凋亡启动者在本实验中普遍弱阳性表达, 说明细胞凋亡程度较低, 进一步表明: (1)胆道修复细胞凋亡受阻, 尤其是成纤维细胞, 其大量增殖分化可能与此有关. (2)cFLIP可能发挥了竞争性抑制作用. 另外, caspase-8持续性的弱阳性表达, 证明其前体激活持续受阻, 这和本实验中光镜所发现的慢性炎症的持续性相吻合. 本实验中应用Spearman相关分析还发现, cFLIP和caspase-8的蛋白表达呈负相关, 这说明了cFLIP通过抑制caspase-8的激活, 充分发挥了其在胆道修复过程中的抗凋亡作用.
有文献表明[21], cFLIP的表达下调对许多不同种类的肿瘤细胞抵抗均敏感, 并已成功发现几种小分子物质能通过降低cFLIP表达以达到抗肿瘤的目的. 他们包括DNA损伤剂(顺铂和阿霉素), RNA的合成抑制剂(放线菌素D), 蛋白质合成抑制剂(放线菌酮), 拓扑异构酶Ⅰ抑制剂(喜树碱, 9-NC的, 拓扑替康)和组蛋白去乙酰化酶抑制剂(菌素A). 是否我们可以将此运用于胆道狭窄的治疗中, 提高成纤维细胞的凋亡率, 从而达到减轻瘢痕形成的作用, 这还有待于进一步的探究.
胆道良性狭窄即胆道在受到急慢性良性损伤后以瘢痕形式愈合, 从而导致后期瘢痕挛缩形成狭窄的病理转归. 常导致胆道梗阻, 结石形成以及肝硬化的发生. 病理特点以慢性炎症的持续, 成纤维及肌成纤维细胞大量增生为主.
姜慧卿, 教授, 河北医科大学第二医院消化科
胆道良性损伤后的远期狭窄问题一直是临床上非常棘手的难题. 目前对其机制的探讨国内外相关报道较少, 但已有学者证实其与瘢痕发生机制相类似, 而胆道环境的复杂性使其具有异于普通瘢痕形成机制的独特性. 胆汁成分对创面的影响使其愈合处于慢性持续性的炎症环境中. 现今热点及重点集中于对肌成纤维细胞表型转化, 胆管细胞群的生物特性, 及某些细胞因子, 信号通路的作用研究. 而胆管细胞群之间的作用与影响以及如何减少成纤维细胞增生, 基质成分沉积是目前亟待研究的问题.
Lu等发现, Fas介导的凋亡途径的阻断可能是导致病理性瘢痕的原因之一, 他们在文中引入了凋亡与增殖的平衡观. Aarabi等也证实在增生性瘢痕形成过程中, AKT通路依赖的凋亡的抑制发挥了重要作用. 而Geng等发现胆道损伤后即处于慢性炎症环境下, 成纤维及肌成纤维细胞大量增生, 胶原过度沉积造成了瘢痕的增生及塑形失败. TGF-β是此过程中最为重要的信号蛋白.
本文借鉴瘢痕研究中的凋亡增殖平衡观, 并结合胆道自身环境, 引入目前研究热点之一的炎症关键性核转录因子NF-κB, 取其下游凋亡因子, 从凋亡角度对胆道损伤愈合的独特性有了较为新颖的认识. 本文虽然没有花哨的检测手段, 但从实用角度讲, 免疫组织化学因其独到的组织定位以及节约标本量的优点而非常适合本实验. 另外, 文中所提出的ASBT对NF-κB信号通路的影响也是一大亮点. 这是作者总结大量相关文献后所提炼的一个非常值得探究的新课题.
可通过下调cFLIP表达来抑制胆道成纤维细胞增殖, 如: 局部注射, 支架载药, 手术植入等方式将cFLIP阻断剂运用于损伤胆道局部, 达到减少瘢痕形成及增生, 治疗胆道良性狭窄的目的.
本研究选题尚可, 设计合理, 结果可靠, 有一定的学术价值.
编辑:李军亮 电编:何基才
| 1. | Geng ZM, Yao YM, Liu QG, Niu XJ, Liu XG. Mechanism of benign biliary stricture: a morphological and immunohistochemical study. World J Gastroenterol. 2005;11:293-295. [PubMed] |
| 2. | Aarabi S, Bhatt KA, Shi Y, Paterno J, Chang EI, Loh SA, Holmes JW, Longaker MT, Yee H, Gurtner GC. Mechanical load initiates hypertrophic scar formation through decreased cellular apoptosis. FASEB J. 2007;21:3250-3261. [PubMed] [DOI] |
| 3. | Lu F, Gao J, Ogawa R, Hyakusoku H, Ou C. Fas-mediated apoptotic signal transduction in keloid and hypertrophic scar. Plast Reconstr Surg. 2007;119:1714-1721. [PubMed] [DOI] |
| 4. | Messadi DV, Doung HS, Zhang Q, Kelly AP, Tuan TL, Reichenberger E, Le AD. Activation of NFkappaB signal pathways in keloid fibroblasts. Arch Dermatol Res. 2004;296:125-133. [PubMed] [DOI] |
| 5. | Irmler M, Thome M, Hahne M, Schneider P, Hofmann K, Steiner V, Bodmer JL, Schröter M, Burns K, Mattmann C. Inhibition of death receptor signals by cellular FLIP. Nature. 1997;388:190-195. [PubMed] [DOI] |
| 6. | Lee SH, Kim HS, Kim SY, Lee YS, Park WS, Kim SH, Lee JY, Yoo NJ. Increased expression of FLIP, an inhibitor of Fas- mediated apoptosis, in stomach cancer. APMIS. 2003;111:309-314. [PubMed] [DOI] |
| 7. | Mori T, Doi R, Kida A, Nagai K, Kami K, Ito D, Toyoda E, Kawaguchi Y, Uemoto S. Effect of the XIAP inhibitor Embelin on TRAIL-induced apoptosis of pancreatic cancer cells. J Surg Res. 2007;142:281-286. [PubMed] [DOI] |
| 8. | 高 文超, 孙 延平, 阮 灿平, 徐 昕昀, 张 军初, 倪 灿荣, 王 强. cFLIP在大肠癌组织中的表达及意义. 中国普外基础与 临床杂志. 2009;12:218-222. |
| 9. | Pajak B, Orzechowski A. [FLIP--an enemy which might lose the battle against the specific inhibitors of translation]. Postepy Hig Med Dosw (Online). 2005;59:140-149. [PubMed] |
| 10. | Kreuz S, Siegmund D, Scheurich P, Wajant H. NF-kappaB inducers upregulate cFLIP, a cycloheximide-sensitive inhibitor of death receptor signaling. Mol Cell Biol. 2001;21:3964-3973. [PubMed] [DOI] |
| 11. | Banno T, Gazel A, Blumenberg M. Pathway-specific profiling identifies the NF-kappa B-dependent tumor necrosis factor alpha-regulated genes in epidermal keratinocytes. J Biol Chem. 2005;280:18973-18980. [PubMed] [DOI] |
| 12. | Kumar A, Takada Y, Boriek AM, Aggarwal BB. Nuclear factor-kappaB: its role in health and disease. J Mol Med. 2004;82:434-448. [PubMed] [DOI] |
| 13. | Hayden MS, Ghosh S. Shared principles in NF-kappaB signaling. Cell. 2008;132:344-362. [PubMed] [DOI] |
| 14. | Kosters A, Karpen SJ. Bile acid transporters in health and disease. Xenobiotica. 2008;38:1043-1071. [PubMed] [DOI] |
| 15. | Pellicoro A, Faber KN. Review article: The function and regulation of proteins involved in bile salt biosynthesis and transport. Aliment Pharmacol Ther. 2007;26 Suppl 2:149-160. [PubMed] |
| 16. | Alrefai WA, Gill RK. Bile acid transporters: structure, function, regulation and pathophysiological implications. Pharm Res. 2007;24:1803-1823. [PubMed] [DOI] |
| 17. | Xia X, Francis H, Glaser S, Alpini G, LeSage G. Bile acid interactions with cholangiocytes. World J Gastroenterol. 2006;12:3553-3563. [PubMed] |
| 18. | Lilienbaum A, Israël A. From calcium to NF-kappa B signaling pathways in neurons. Mol Cell Biol. 2003;23:2680-2698. [PubMed] [DOI] |
| 19. | Jiang T, Han Z, Chen S, Wu C, Tang Y, Qian C, Chen Y, Zhou Y, Zhu Y, Gu M. Resistance to activation-induced cell death and elevated FLIPL expression of CD4+ T cells in a polyI:C-induced primary biliary cirrhosis mouse model. Clin Exp Med. 2009;9:269-276. [PubMed] [DOI] |
| 20. | Nicholson DW, Thornberry NA. Caspases: killer proteases. Trends Biochem Sci. 1997;22:299-306. [PubMed] [DOI] |
| 21. | Yang JK. FLIP as an anti-cancer therapeutic target. Yonsei Med J. 2008;49:19-27. [PubMed] [DOI] |