修回日期: 2009-09-23
接受日期: 2009-10-12
在线出版日期: 2009-10-18
目的: 评价幽门螺杆菌(H. pylori)ggt同源基因的结构特征和功能.
方法: 通过生物信息学软件分析H. pylori γ谷氨酰转肽酶(ggt)同源基因产物的结构特征; 提取H. pylori DNA, 并以之为模板, 采用PCR法扩增该基因的全长及去信号肽片段; 进行序列分析后, 将全长片段与gfp片段连接, 分别克隆进杆状病毒的转移质粒pFastBac1中, 利用杆状病毒的Bac-to-Bac系统分别获得重组杆状病毒的DNA; 通过PCR方法验证这些片段克隆进杆状病毒; 将重组病毒的DNA以脂质体为媒介转染家蚕细胞, 以获得重组杆状病毒; 分别收集这些重组病毒, 并再感染家蚕细胞, 进行蛋白表达实验和活性检测, 以荧光显微镜观察融合蛋白在细胞中的分布.
结果: 通过PCR方法成功克隆了各种片段; 测序的结果表明, 未发生突变; 基因片段扩增的结果说明, 获得了3种重组的杆状病毒, 且这3种重组病毒均表达了ggt片段, 全长、去信号肽片段及去信号肽片段与gfp融合的片段的表达产物活性分别为3.61, 10.50及9.31 U/L. Western blot的结果证实了去信号肽片段与GFP的融合表达. 通过荧光显微镜观察去信号肽与gfp的融合片段的表达产物在细胞中的定位, 荧光不具有区域的特异性, 充满了整个细胞, 表明该基因产物并非作用于专一的细胞器.
结论: H. pylori ggt同源基因适合于杆状病毒表达, 表达产物具有GGT活性, 但他对细胞的作用有待进一步研究.
引文著录: 孔梅, 张尤历, 陈鑫, 陈慧娟. 幽门螺杆菌γ谷氨酰转肽酶同源基因的表达与活性检测. 世界华人消化杂志 2009; 17(29): 2996-3000
Revised: September 23, 2009
Accepted: October 12, 2009
Published online: October 18, 2009
AIM: To express the Helicobacter pylori (H. pylori) γ-glutamyltransferase (GGT) in silkworm cells using a baculovirus expression system and analyze its activity in vitro.
METHODS: The structure characteristics of the H. pylori ggt gene was analyzed using biological informatics software. The genomic DNA of H. pylori was extracted and used as template to amplify the ggt genes encoding proteins with and without signal peptide by polymerase chain reaction (PCR). After sequencing, the amplified ggt gene encoding protein without signal peptide was fused with a green fluorescent protein (GFP) sequence. Subsequently, the two amplicons and the fusion sequence were cloned into the baculovirus transfer vector pFastBac1, respectively. Bac-to-Bac baculovirus system was then used to generate recombinant virus DNA. Recombinant virus DNA was transfected into silkworm BmN cells to obtain recombinant viruses. The viruses were harvested and used to infect BmN cells again. After infection, BmN cells were harvested to detect protein expression and enzymatic activity. Fluorescence was observed in infected cells using a fluorescence microscope.
RESULTS: The ggt genes encoding proteins with and without signal peptide were successfully cloned by PCR. Sequencing results indicated that no mutations occurred. All the three recombinant viruses obtained could express GGT. The activity of GGT expressed by the recombinant viruses harboring the ggt genes encoding proteins with and without signal peptide and the fusion sequence was 3.61, 10.50 and 9.31 U/L, respectively. Western blot assay demonstrated the expression of GGT-GFP fusion protein. Fluorescent microscopy showed that the fluorescence was distributed throughout the whole cell, indicating that GGT expression is not confined to a certain organelle.
CONCLUSION: GGT with enzymatic activity can be expressed in silkworm cells using the baculovirus expression system.
- Citation: Kong M, Zhang YL, Chen X, Chen HJ. Expression of Helicobacter pylori γ-glutamyltransferase in silkworm cells using a baculovirus expression system. Shijie Huaren Xiaohua Zazhi 2009; 17(29): 2996-3000
- URL: https://www.wjgnet.com/1009-3079/full/v17/i29/2996.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i29.2996
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种螺旋形微需氧革兰氏阴性菌, 其感染是诱发人胃肠道疾病的重要因素之一, 包括慢性活动性胃炎、胃十二指肠溃疡和胃癌等[1-4]. 已有多种H. pylori的毒力因子被鉴定出来, 包括Cag A, Vac A, Ice及脲素酶等[5-10]. 最近的研究表明, H. pylori的基因组中包含一个γ谷氨酰转肽酶(gamma- glutamyltranspeptidase, GGT)同源基因, 该基因产物具有细胞凋亡的活性[11-12]. 凋亡经常发生易造成凋亡调节基因的突变, 而增加胃癌发生的风
险[13-16]. 因此, H. pylori的GGT可能与癌变有关. GGT一般存在于动植物体内, 是一种催化肽基转移作用的酶(E.C. 2.3.2.2), 具有异源多聚, 糖基化和跨膜等结构特征, 参与分泌和吸收过程, 在谷胱苷肽的新陈代谢中起重要的作用[11,17]. 但目前H. pylori GGT的功能和作用机制尚未明确. 本文比较了多株H. pylori的GGT结构, 并在杆状病毒中对ggt基因进行了表达和活性检测, 现报道如下.
感受态BmDH10Bac受体菌由浙江大学张传溪教授提供, 昆虫细胞BmN和重组杆状病毒转座载体pFastBac1由中国科学院上海生物化学与细胞研究所吴祥甫组馈赠; 限制性内切酶、Taq酶等工具酶试剂为TaKaRa公司产品; 昆虫细胞培养基Tc-100和GFP单抗购自Sigma公司; 胎牛血清FBS购自Gibco公司; 蛋白分子质量标准购自上海华舜生物工程公司; 羊抗鼠IgG和TCL发光剂购自Pierce公司; 其他常规试剂均为国产分析纯. 本实验采用的H. pylori从临床胃癌患者分离获得. 含GFP基因的pcDNA3-gfp质粒由江苏大学生命科学研究院医学组保存.
1.2.1 H. pylori的分离培养及基因组DNA的提取:H. pylori的分离培养及基因组DNA的提取参照陈劲频 et al[18]及吴莺 et al[19]的方法. 采用GES缓冲液(0.6 g/mL异硫氰酸胍, 0.1 mol/L EDTA, 0.5% Saksal)裂解H. pylori细胞, 经苯酚/氯仿除去蛋白质, 以异丙醇沉淀DNA.
1.2.2 ggt基因及gfp片段的克隆: 根据GenBank公布的H. pylori的ggt基因序列, 分析ggt基因的结构特征, 设计ggt表达的方案, 包括全长和去信号肽的表达, 并以成熟肽与gfp融合表达等. 设计扩增ggt片段的引物分别为: 全长For- cgc gaa ttc atg aga cgg agt ttt tta aaa acg(EcoRⅠ), 去信号肽Fro- cgc gaa ttc atg ccc att aaa aac act aaa gtg g(EcoRⅠ), 反向引物均为: Rev- gac ctc gag aaa ttc ttt cct tgg atc cgt t(XhoⅠ); 扩增GFP片段的引物为: Fro- gac ctc gag atg gtg agc aag ggc gag ga(XhoⅠ), Rev- cgc aag ctt tta ctt gta cag ctc gtc ca(Hind Ⅲ). 扩增ggt片段的PCR条件为: 94℃变性5 min后, 进入以下循环, 94℃ 40 s, 55℃ 40 s, 72℃, 3 min, 30个循环, 最后72℃延伸10 min. 扩增gfp片段的PCR条件为: 94℃变性5 min后, 进入以下循环, 94℃ 30 s, 58℃ 30 s, 72℃, 1 min.
1.2.3 重组Bacmid转移质粒的构建: 上述PCR获得的全长及去信号肽的ggt片段以EcoRⅠ和XhoⅠ双酶切, 与同样酶切后的重组移质粒pFastBac1 DNA进行连接, 并转化大肠杆菌, 提取质粒DNA进行酶切鉴定. GFP片段以XhoⅠ和Hind Ⅲ双酶切, 与同样酶切的重组移质粒pFastBac1 DNA连接, 再以EcoRⅠ和XhoⅠ双酶切, 与同样酶切的去信号肽的ggt连接, 构成融合表达形式.
1.2.4 重组Bacmid穿梭载体的获得: 取已构建的重组转移载体pFastBac1-ggt(全长), pFastBac1-ggt(ds)(去信号肽)及pFastBac1-ggt(ds)-gfp(融合), 分别加入到150 μL E.coli DH10Bac感受态细胞中进行转化, 其程序参照Invitrogen公司的产品说明. 取150 μL涂布于含有X-gal(1 mg/L)、IPTG(0.18 mg/L)、庆大霉素(7 mg/L)、卡那霉素(50 mg/L)、四环素(10 mg/L)的LB平板上, 37℃温箱培养36 h, 挑取白色单菌落, 用碱法提取重组病毒DNA, 以通用引物M13进行PCR, 鉴定重组杆状病毒. 扩增条件为: 95℃变性3 min 后, 进入以下循环: 94℃ 45 s, 55℃ 45 s, 72℃, 5 min, 30 个循环, 蓝色菌落作为阴性对照.
1.2.5 重组病毒的获得: 将提取的重组杆粒DNA 在脂质体的介导下转染家蚕细胞BmN, 28℃培养72 h后观察细胞病变. 细胞出现明显病变后, 再进行重复感染. 并观察荧光的产生.
1.2.6 表达产物的活性检测和蛋白鉴定: 以各种重组病毒感染家蚕细胞, 感染复数分别为10, 60 h后收集家蚕细胞. 以超声波裂解细胞, 并对细胞进行蛋白质定量及丙烯酰胺变性凝胶电泳(SDS-PAGE)和蛋白印迹(Western blot)分析. 经SDS-PAGE电泳后染色, 观察特异表达的蛋白带. 并将分离的蛋白转移至PVDF膜上, 进行Western blot分析. 一抗为GFP(1:2000)单抗, 二抗为羊抗鼠IgG(1:2500), 发光剂TCL显色, 以病毒BmPAK6为阴性对照, 并以BmNPV-GFP为阳性对照. 取200 μL的表达产物(100 g/L)在临床生化检测仪(Olympus AU2700)上检测GGT的活性, 每个处理重复3次.
通过NCBI(national center for biotechnology information)网站的公布的信息, 对各菌株的ggt基因结构进行的比较结果表明, 该基因的读码框(open reading frame, ORF)最长为1704 bp, 编码567个氨基酸. 但有些菌株的ORF较短, 其主要变化在于氨基端缺失了一定数目的氨基酸, 羧基端的氨基酸较为保守. 对567 aa长度的氨基酸序列分析, 起始28个aa为信号肽, GGT活性的结构域在羧基端. 根据全长ggt的序列设计引物, 以当地临床分离菌株DNA为模板, 扩增出了特异DNA片段. 经测序为1704 bp, 大小与公布的全长ggt一致.
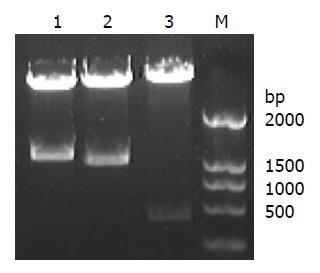
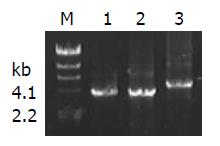
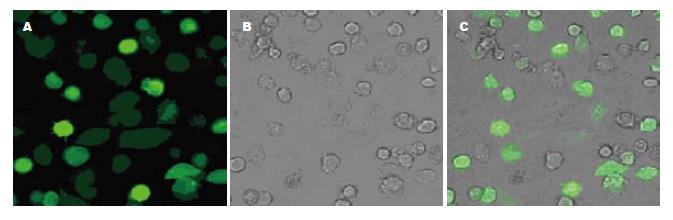
PCR扩增的目的片段经纯化后酶切, 插入到了杆状病毒转移载体pFastBac1中(图1). 提取质粒DNA, 以通用引物M13进行了PCR扩增, 进一步鉴定了基因的插入. PCR和凝胶电泳检测的结果表明, 获得了预期长度的片段, 说明基因已插入到病毒的基因组中(图2). 将提取的病毒杆粒DNA在脂质体的介导下, 转染家蚕细胞BmN, 获得了3株重组病毒, 即ggt全长(BmNPV-ggt)、去信号肽(BmNPV-ggt-ds)及去信号肽融合gfp(BmNPV-ggt-ds-gfp)等重组病毒, 并进行了复感染. 结果表明, 病毒BmNPV-ggt-ds-gfp感染后, 可以观察到荧光, 充满整个细胞(图3). 对ggt-ds-gfp融合表达的Western blot检测, 在近90 kDa的位置有特异性的杂交带, 与其蛋白理论值相近, 说明该融合蛋白得到了正确的表达(图4).
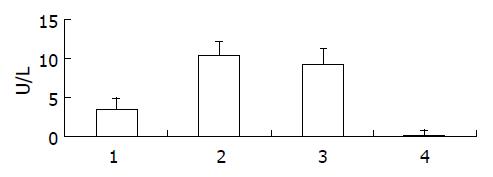
将各种病毒感染的细胞收集后, 进行超声波裂解, 裂解液经离心除去细胞碎片后, 测定其蛋白含量. 调节各处理的蛋白浓度后, 分析其GGT活性. 结果表明, 3种表达ggt的细胞液均能检测到活性, 全长GGT、去信号肽GGT及去信号肽GGT与GFP融合片段的活性分别为3.61, 10.50和9.31 U/L(图5).
随着对H. pylori研究的深入, 新的致病因子不断被证实发现. 最近发现, H. pylori的GGT与诱导细胞凋亡有关. 但其作用机制尚未明确[11]. 因此, 我们开展对ggt基因的基础研究. 在ggt基因的克隆和表达过程中, 发现一个有趣的现象. 在我们克隆的ggt基因中均存在一个HindⅢ位点, 位于956-961 bp, 而在GenBank中比较, 近一半的序列存在该位点. 由于该位点的存在, 我们改变了融合表达的策略. 因为在gfp的引物中也设计了HindⅢ位点. 先将gfp片段克隆到质粒中, 再在5'端接上去信号肽的ggt片段.
杆状病毒是一个极具潜质的表达载体[20-24]. 有报道表明, 杆状病毒还可以作为基因治疗的载体[25-29]. 在国内, 家蚕杆状病毒的应用较为广泛, 可以通过感染家蚕幼虫, 获得大量成本低廉的表达产物. 重组杆状病毒的分离采用抗生素和蓝白斑法筛选. 提取杆粒DNA后, 可通过M13引物验证. 如果扩增出的片段为2.3 kb加目的基因的长度, 即转座成功, 而未发生转座, 扩增的片段为300 bp[30-32]. 3种杆粒的PCR验证, 得到了大于4 kb的片段, 表明转座获得成功, 获得了重组病毒的DNA.
基因的信号肽可能影响基因在杆状病毒中的表达. 因此, 我们也设计了去信号肽的ggt的表达. 活性检测的结果也表明, 全长ggt的活性低于去信号肽的. 目前尚无GGT的抗体, 为蛋白的检测带来困难. 我们设计了与gfp融合的方法, Western blot的分析结果, 在大于80 kDa的位置有一特异条带, 与融合片段的理论值89 kDa(GGT蛋白为60 kDa, GFP为29 kDa)相符, 说明ggt得到了表达.
本文通过对H. pylori ggt基因的克隆及活性检测, 说明该基因确实具备GGT酶的功能. 在细胞感染过程中, 没有出现凋亡的症状, 提示该基因产物不能诱导昆虫细胞的凋亡. 可能存在2个方面的原因: 其一, 可能是昆虫细胞中缺少或诱导效应物不匹配, 造成信号不能传递下去; 其二, 在杆状病毒中存在抗细胞凋亡因子, 如iap, p35等, 这些基因在病毒感染的早期表达[23,33-34], 而ggt转录的启动子是晚期表达的多角体启动子, 晚于抗凋亡基因的表达[23-24]. 由于抗凋亡基因表达, 抑制了凋亡的信号通路, 使GGT产物的作用无法发挥. 其诱导凋亡活性的作用有待ggt表达产物纯化后, 再作肿瘤或上皮细胞的刺激凋亡分析. 相关实验正在进行.
随着对H. pylori研究的深入, 新的致病因子不断被证实发现. 最近发现, H. pylori的GGT与诱导细胞凋亡有关, 但其作用机制尚未明确. 杆状病毒是一个极具潜质的表达载体, 还可以作为基因治疗的载体. 本文比较了多株H. pylori的GGT结构, 并在杆状病毒中对ggt基因进行了表达和活性检测.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科.
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
Kim et al研究表明, H. pylori的基因组中包含一个γ谷氨酰转肽酶(GGT)同源基因, 该基因产物具有细胞凋亡的活性. 凋亡经常发生易造成凋亡调节基因的突变, 而增加胃癌发生的风险.
本文通过对H. pylori ggt基因的克隆及活性检测, 说明该基因确实具备GGT酶的功能. 在细胞感染过程中, 没有出现凋亡的症状, 提示该基因产物不能诱导昆虫细胞的凋亡. 其诱导凋亡活性的作用有待ggt表达产物纯化后, 再作肿瘤或上皮细胞的刺激凋亡分析.
本文构建幽门螺杆菌γ谷氨酰转肽酶基因的表达载体, 并将其在细胞中表达, 具有重要的临床指导意义.
编辑:李军亮 电编:吴鹏朕
| 1. | Suzuki H, Iwasaki E, Hibi T. Helicobacter pylori and gastric cancer. Gastric Cancer. 2009;12:79-87. [PubMed] [DOI] |
| 2. | Mandeville KL, Krabshuis J, Ladep NG, Mulder CJ, Quigley EM, Khan SA. Gastroenterology in developing countries: issues and advances. World J Gastroenterol. 2009;15:2839-2854. [PubMed] [DOI] |
| 3. | Cover TL, Blaser MJ. Helicobacter pylori in health and disease. Gastroenterology. 2009;136:1863-1873. [PubMed] [DOI] |
| 4. | Brenner H, Rothenbacher D, Arndt V. Epidemiology of stomach cancer. Methods Mol Biol. 2009;472:467-477. [PubMed] [DOI] |
| 5. | Hatakeyama M. Helicobacter pylori and gastric carcinogenesis. J Gastroenterol. 2009;44:239-248. [PubMed] [DOI] |
| 6. | Wen S, Moss SF. Helicobacter pylori virulence factors in gastric carcinogenesis. Cancer Lett. 2009;282:1-8. [PubMed] [DOI] |
| 7. | 张 微, 刘 纯杰. 幽门螺杆菌致胃癌发生机制. 胃肠病学和肝病学杂志. 2008;17:177-181. |
| 9. | Chomvarin C, Namwat W, Chaicumpar K, Mairiang P, Sangchan A, Sripa B, Tor-Udom S, Vilaichone RK. Prevalence of Helicobacter pylori vacA, cagA, cagE, iceA and babA2 genotypes in Thai dyspeptic patients. Int J Infect Dis. 2008;12:30-36. [PubMed] [DOI] |
| 10. | Dharne MS, Munot H, Pujari R, Kakrani AL, Patole MS, Shouche YS. Helicobacter pylori cagA, vacA and iceA genotypes in western Indian population of Maharashtra with varied gastroduodenal diseases. Indian J Pathol Microbiol. 2007;50:740-748. [PubMed] |
| 11. | Kim KM, Lee SG, Park MG, Song JY, Kang HL, Lee WK, Cho MJ, Rhee KH, Youn HS, Baik SC. Gamma- glutamyltranspeptidase of Helicobacter pylori induces mitochondria-mediated apoptosis in AGS cells. Biochem Biophys Res Commun. 2007;355:562-567. [PubMed] [DOI] |
| 12. | Ashktorab H, Frank S, Khaled AR, Durum SK, Kifle B, Smoot DT. Bax translocation and mitochondrial fragmentation induced by Helicobacter pylori. Gut. 2004;53:805-813. [PubMed] [DOI] |
| 13. | Yin HF, Li T. [Helicobacter pylori genotypes of gastrointestinal B cell lymphoma] B. eijing Daxue Xuebao. 2006;38:189-192. [PubMed] |
| 14. | Franceschi F, Cazzato A, Nista EC, Scarpellini E, Roccarina D, Gigante G, Gasbarrini G, Gasbarrini A. Role of probiotics in patients with Helicobacter pylori infection. Helicobacter. 2007;12 Suppl 2:59-63. [PubMed] [DOI] |
| 15. | Varon C, Mosnier JF, Lehours P, Matysiak-Budnik T, Mégraud F. Gastric carcinogenesis and Helicobacter pylori infection. Methods Mol Biol. 2009;511:237-265. [PubMed] [DOI] |
| 16. | Correa P. New strategies for the prevention of gastric cancer: Helicobacter pylori and genetic susceptibility. J Surg Oncol. 2005;90:134-138; discussion 138. [PubMed] [DOI] |
| 17. | Benini F, Pigozzi MG, Pozzi A, Bercich L, Reggiani A, Quattrocchi D, Distefano L, Donati P, Cesana BM, Lanzini A. Elevation of serum gamma-glutamyltranspeptidase activity is frequent in chronic hepatitis C, and is associated with insulin resistance. Dig Liver Dis. 2009;41:586-590. [PubMed] [DOI] |
| 18. | 陈 劲频, 张 尤历, 王 文兵, 陈 永昌, 印 亦萍. 幽门螺杆菌对原癌基因c-Fos和c-Jun表达的影响. 南京医科大学学报 (自然科学版). 2007;27:804-807. |
| 20. | Hitchman RB, Possee RD, King LA. Baculovirus expression systems for recombinant protein production in insect cells. Recent Pat Biotechnol. 2009;3:46-54. [PubMed] [DOI] |
| 21. | Braunagel SC, Summers MD. Molecular biology of the baculovirus occlusion-derived virus envelope. Curr Drug Targets. 2007;8:1084-1095. [PubMed] [DOI] |
| 22. | Okano K, Vanarsdall AL, Mikhailov VS, Rohrmann GF. Conserved molecular systems of the Baculoviridae. Virology. 2006;344:77-87. [PubMed] [DOI] |
| 23. | van Oers MM, Vlak JM. Baculovirus genomics. Curr Drug Targets. 2007;8:1051-1068. [PubMed] [DOI] |
| 24. | Herniou EA, Jehle JA. Baculovirus phylogeny and evolution. Curr Drug Targets. 2007;8:1043-1050. [PubMed] [DOI] |
| 25. | Kitajima M, Hamazaki H, Miyano-Kurosaki N, Takaku H. Characterization of baculovirus Autographa californica multiple nuclear polyhedrosis virus infection in mammalian cells. Biochem Biophys Res Commun. 2006;343:378-384. [PubMed] [DOI] |
| 26. | Roy P, Noad R. Virus-like particles as a vaccine delivery system: myths and facts. Hum Vaccin. 2008;4:5-12. [PubMed] |
| 27. | Hu YC. Baculoviral vectors for gene delivery: a review. Curr Gene Ther. 2008;8:54-65. [PubMed] [DOI] |
| 28. | Kost TA, Condreay JP, Jarvis DL. Baculovirus as versatile vectors for protein expression in insect and mammalian cells. Nat Biotechnol. 2005;23:567-575. [PubMed] [DOI] |
| 29. | Condreay JP, Kost TA. Baculovirus expression vectors for insect and mammalian cells. Curr Drug Targets. 2007;8:1126-1131. [PubMed] [DOI] |
| 30. | Su WJ, Shen WD, Li B, Wu Y, Gao G, Wang WB. A novel way to purify recombinant baculoviruses by using bacmid. Biosci Rep. 2009;29:71-75. [PubMed] [DOI] |
| 31. | Yao LG, Liu ZC, Zhang XM, Kan YC, Zhou JJ. A highly efficient method for the generation of a recombinant Bombyx mori nuclear-polyhedrosis-virus Bacmid and large-scale expression of foreign proteins in silkworm (B. mori) larvae. Biotechnol Appl Biochem. 2007;48:45-53. [PubMed] [DOI] |
| 32. | Motohashi T, Shimojima T, Fukagawa T, Maenaka K, Park EY. Efficient large-scale protein production of larvae and pupae of silkworm by Bombyx mori nuclear polyhedrosis virus bacmid system. Biochem Biophys Res Commun. 2005;326:564-569. [PubMed] [DOI] |
| 33. | Wen R, Ou R, Chen B. Molecular characterization and genetic organization of the inhibitor of apoptosis gene (iap-5) region of the Pieris rapae granulovirus. Virus Genes. 2007;35:443-448. [PubMed] [DOI] |