修回日期: 2009-03-14
接受日期: 2009-03-16
在线出版日期: 2009-05-28
目的: 探讨HSV-TK+GFP/GCV自杀基因系统对小鼠胰腺癌细胞系MPC体外及体内杀伤作用及其产生的旁观者效应.
方法: 通过RT-PCR从基因组文库中扩增出HSV-TK基因全长CDS序列, 并将其与GFP基因定向克隆到质粒表达载体pcDNA3.1(+), 构建重组质粒pcDNA3.1+/HSV-TK+GFP. 脂质体法将重组质粒转染小鼠胰腺癌细胞株MPC细胞, 得到带有HSV-TK和GFP基因的MPC/HSV-TK+GFP细胞, 并将其分别用于体外和体内实验.
结果: 重组质粒pcDNA3.1+/HSV-TK+GFP导入小鼠胰腺癌细胞株MPC细胞. 体外实验结果显示, 当MPC/HSV-TK+GFP细胞数占混合细胞10%时, 低浓度(20 mg/L)的GCV就可将50%左右的肿瘤细胞杀死. 体内实验结果显示GCV可明显抑制MPC /HSV-TK+GFP细胞在昆明小鼠体内的肿瘤形成.
结论: HSV-TK和GFP基因转入小鼠胰腺癌细胞株MPC细胞并获得稳定表达, HSV-TK+GFP/GCV自杀基因系统在体内外对小鼠胰腺癌均有杀伤作用, 且存在明显的旁观者效应.
引文著录: 刘为青, 杨军, 董坚. HSV-TK+GFP/GCV自杀基因系统对小鼠胰腺癌的治疗作用. 世界华人消化杂志 2009; 17(15): 1498-1503
Revised: March 14, 2009
Accepted: March 16, 2009
Published online: May 28, 2009
AIM: To study in vitro therapeutic effect on mouse pancreatic cancer, as well as the bystander effect with HSV-TK suicide gene in combination with prodrug GCV.
METHODS: HSV-TK and GFP were inserted into pcDNA3.1 (+) to construct pcDNA3.1+/HSV-TK+GFP, and pcDNA3.1+/HSV-TK+GFP was transferred into mouse pancreatic cancer cell MPC by Lipofectin. We then added GCV to these gene-modified cells and studied the sensitivity of the cells to GCV as well as the bystander effect.
RESULTS: The gene modified pancreatic cancer cells MPC/HSV-TK+GFP were successfully developed. In vitro experiments showed that when the MPC/HSV-TK+GFP cells accounted for 10% of hybrid cells, the low concentration (20 mg/L) of GCV was about 50% of tumor cell killing. In vivo results showed that the low concentration of GCV killed the cells. And tumor growth of the mouse model was inhibited.
CONCLUSION: Our data demonstrate MPC/HSV-TK+GFP cells are sensitive to the treatment of GCV compared with unmodified tumor cells, and remarkable bystander effect is seen.
- Citation: Liu WQ, Yang J, Dong J. Effects of HSV-TK+GFP/GCV suicide gene therapy system on mouse pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1498-1503
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1498.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1498
胰腺癌是一种临床表现隐匿, 发病迅速且预后不良的消化系统恶性肿瘤. 由于其早期症状不典型, 容易被忽略或被误认为胃肠道疾患, 不易早期发现. 待肿瘤侵及或压迫胆道出现黄疸、或侵及周围组织出现疼痛症状而诊断明确时, 肿瘤往往已生长很大, 多已为疾病晚期. 对胰腺癌进行深入的防治研究, 提高早诊率, 加强综合治疗, 是提高胰腺癌治疗水平的重要途径.
随着分子生物学及相关学科的进展, 肿瘤的基因疗法备受关注, 其中自杀基因疗法显示了较好的应用前景[1-2]. 自杀基因又称为前药转换酶基因[3-4], 将一些病毒或细菌基因组中的前药转换酶基因导入肿瘤细胞并表达TK, 将GCV磷酸化为二磷酸产物GCV-DP, 然后在哺乳动物细胞内激酶作用下形成三磷酸产物GCV-TP, GCV-TP具有强烈细胞毒性, 抑制DNA聚合酶, 掺入DNA合成链中, 导致链中止、染色体变性和姐妹染色单体交换, 最终导致细胞死亡[5-6], 从而达到杀死肿瘤细胞的目的. 这种独特的自杀效应能选择性的杀死肿瘤细胞, 保护正常组织细胞, 从而避免传统肿瘤治疗方法对人体带来的伤害. 此外, 研究还表明, 转导了自杀基因的肿瘤细胞在给予药物前体后被杀死, 其相邻或更远的未被转染的肿瘤细胞也可被杀死, 这种作用被称为旁观者效应[7]. 旁观者效应明显扩大了自杀基因的对细胞杀伤范围, 显示了其对于肿瘤治疗的独特优势, 并大大克服了自杀基因转染率的限制[8-9].
目前已发现和克隆的自杀基因有多种, 在肿瘤治疗中以HSV-TK最为常用. 用于HSV-TK基因疗法的前药有两类, 一是嘌呤核苷类似物, 包括ACV及其衍生物GCV、潘洛昔非(PCV)、布洛昔非(BCV), 其中GCV对转基因瘤细胞的抑制作用比ACV强10倍, 故成为目前肿瘤TK基因治疗中最常用的前药.
前期研究表明, HSV-TK/GCV系统具有极大的抗瘤效应[10]. 因此, 本实验中我们构建了含有HSV-TK及绿色荧光蛋白GFP作为筛选标记的重组质粒, 将重组质粒pcDNA3.1+/HSV-TK+GFP体外转染小鼠胰腺癌细胞株MPC细胞, 利用TK基因进行小鼠胰腺癌的治疗研究. 本研究检测HSV-TK+GFP/GCV系统对小鼠胰腺癌细胞的体外和体内杀伤性及其旁观者效应, 以期为临床治疗胰腺癌提供可用的理论基础及实验依据.
质粒pcDNA3.1(+)购自Invitrogen公司, MPC小鼠胰腺癌细胞株为本室自行建株保存. RPMI 1640培养基和脂质体(Lipofectmine2000)为Gibco公司产品, 新生小牛血清为杭州四季青公司产品, MTT和GCV为Sigma公司产品, G418为Promega公司产品. 小鼠抗TK单抗购自Novus公司, 辣根过氧化物酶标记的山羊抗小鼠IgG购自Invitrogen公司. 昆明小鼠, ♀, 4-6 wk龄, 体质量16-25 g左右, 购自昆明医学院实验动物中心.
1.2.1 重组质粒pcDNA3.1+/HSV-TK+GFP的构建: 通过RT-PCR从基因组文库中扩增出HSV-TK基因以及GFP基因全长CDS序列, 并将二者定向插入真核表达载体pcDNA3.1(+), 构建重组质粒pcDNA3.1+/HSV-TK+GFP.
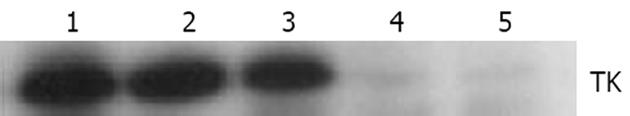
1.2.2 重组质粒转染MPC小鼠胰腺癌细胞及表达产物的检测: 接种5×104生长状态良好的MPC小鼠胰腺癌细胞于24孔板的各孔, 采用Lipofectmine2000转染试剂将重组质粒转染MPC小鼠胰腺癌细胞, 转染后48 h, 用含800 mg/L G418的培养液筛选细胞2 wk, 荧光显微镜检测GFP蛋白的表达以证实重组质粒已成功转染MPC小鼠胰腺癌细胞. 将获得稳定表达GFP的细胞株接着采用96孔板有限稀释法进行单克隆细胞的筛选, 获得表达GFP的单克隆细胞株, 选取其中GFP表达量最高的单克隆细胞株作为实验细胞株, 并将其命名为MPC/HSV-TK+GFP. 此外, 转染空载体pcDNA3.1(+)至MPC细胞以作为后续试验对照. 将MPC/HSV-TK+GFP细胞于37℃, 50 mL/L CO2培养箱常规培养、传代以及冻存, 收集培养细胞裂解后取上清用于Western blot检测, 12 000 r/min离心15 min后取上清, SDS-PAGE分离后半干法转至硝酸纤维素滤膜, 50 g/L脱脂奶粉37℃封闭1 h, 加入小鼠抗TK单抗(一抗), 37℃孵育过夜, 再加入辣根过氧化物酶标记的山羊抗小鼠IgG(二抗)孵育1 h, ECL法显色后摄影.
1.2.3 荧光显微镜下观察体外培养细胞对GCV药物作用: 将MPC/HSV-TK+GFP细胞按5×104细胞/孔接种于24孔培养板, 24 h后, 加入合适浓度的GCV, 并对MPC/HSV-TK+GFP细胞设置对照加入PBS溶液, 使用荧光显微镜观察细胞的形态及生长情况.
1.2.4 体外细胞的旁观者效应观察: 将MPC和MPC/HSV-TK+GFP细胞按常规方法制成3×108/L的细胞悬液, 将MPC和MPC/HSV-TK+GFP按以下比例接种96孔板: 0, 1∶20, 1∶10, 1∶5. 接种后完全培养基每孔补足200 μL, 每个比列设12个复孔, 于37℃, 50 mL/L CO2培养箱内静置培养, 培养48 h后将每一比例中前3孔更换含GCV 5 mg/L的RPMI 1640培养液, 另外3孔更换含GCV 20 mg/L的RPMI 1640培养液, 另外3孔更换含GCV 50 mg/L的RPMI 1640培养液, 余3孔更换普通培养液, 培养4 d后, 采用MTT法计算细胞存活率(%).
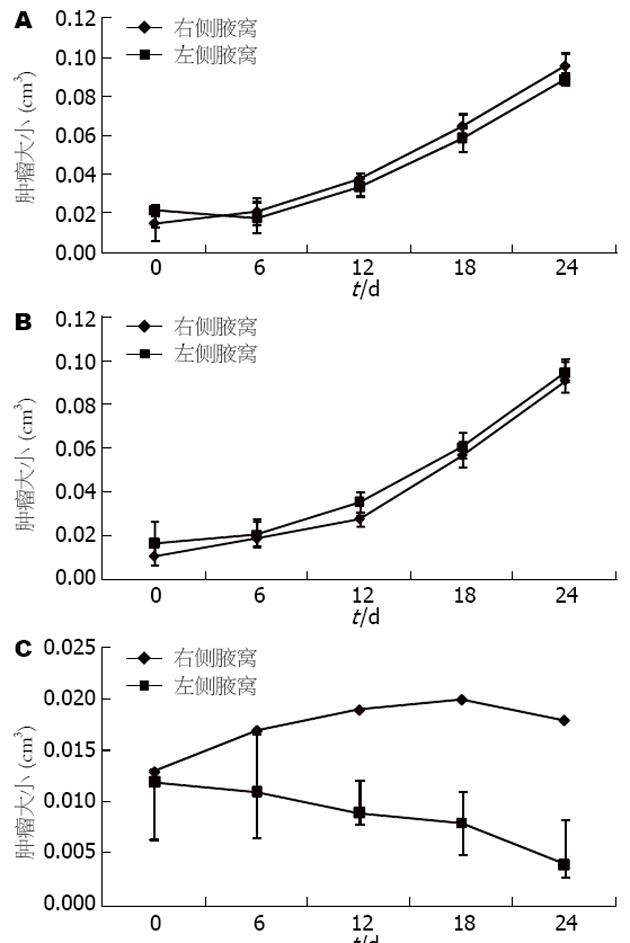
1.2.5 体内实验: (1)小鼠胰腺癌模型的建立: 昆明小鼠24只, 分为3组, 每组8只. 常规培养MPC和MPC/HSV-TK+GFP细胞, 第1组小鼠皮下接种转染空质粒载体的MPC肿瘤细胞; 第2组以及第3组小鼠皮下接种MPC/HSV-TK+GFP肿瘤细胞. 分别在各试验组小鼠左侧腋窝皮下接种1×106个相应的细胞, 对侧腋窝接种1×106个MPC细胞. (2)GCV对MPC/HSV-TK+GFP细胞在小鼠体内成瘤的影响: 第1组小鼠在肿瘤接种次日, 开始给予GCV(100 mg/kg)腹膜腔(ip)内注射治疗, 注射体积每只0.2 mL, 每日1次, 连续注射24 d; 第2组小鼠在接种肿瘤细胞后次日, 给予PBS腹膜腔(ip)内注射治疗, 注射体积每只0.2 mL, 每天1次, 连续注射24 d; 第3组小鼠在接种肿瘤细胞后次日, 给予GCV(100 mg/kg)腹膜腔(ip)内注射治疗, 注射体积每只0.2 mL, 每日1次, 连续注射24 d. 观察各组肿瘤形成情况.
统计学处理 数据用mean±SD表示, 各组数据比较用SPSS10.0软件进行完全随机的方差分析, 分析其显著性.
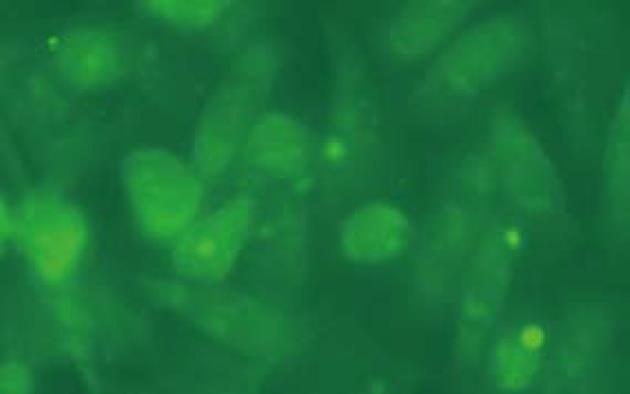
荧光显微镜下观察到实验组小鼠胰腺癌细胞内有绿色荧光信号, 实验组荧光强度强, 而两对照组细胞内未检测到荧光信号, 实验组细胞内荧光显像表明重组质粒MPC/HSV-TK+GFP已经成功转染小鼠胰腺癌细胞MPC(图1).
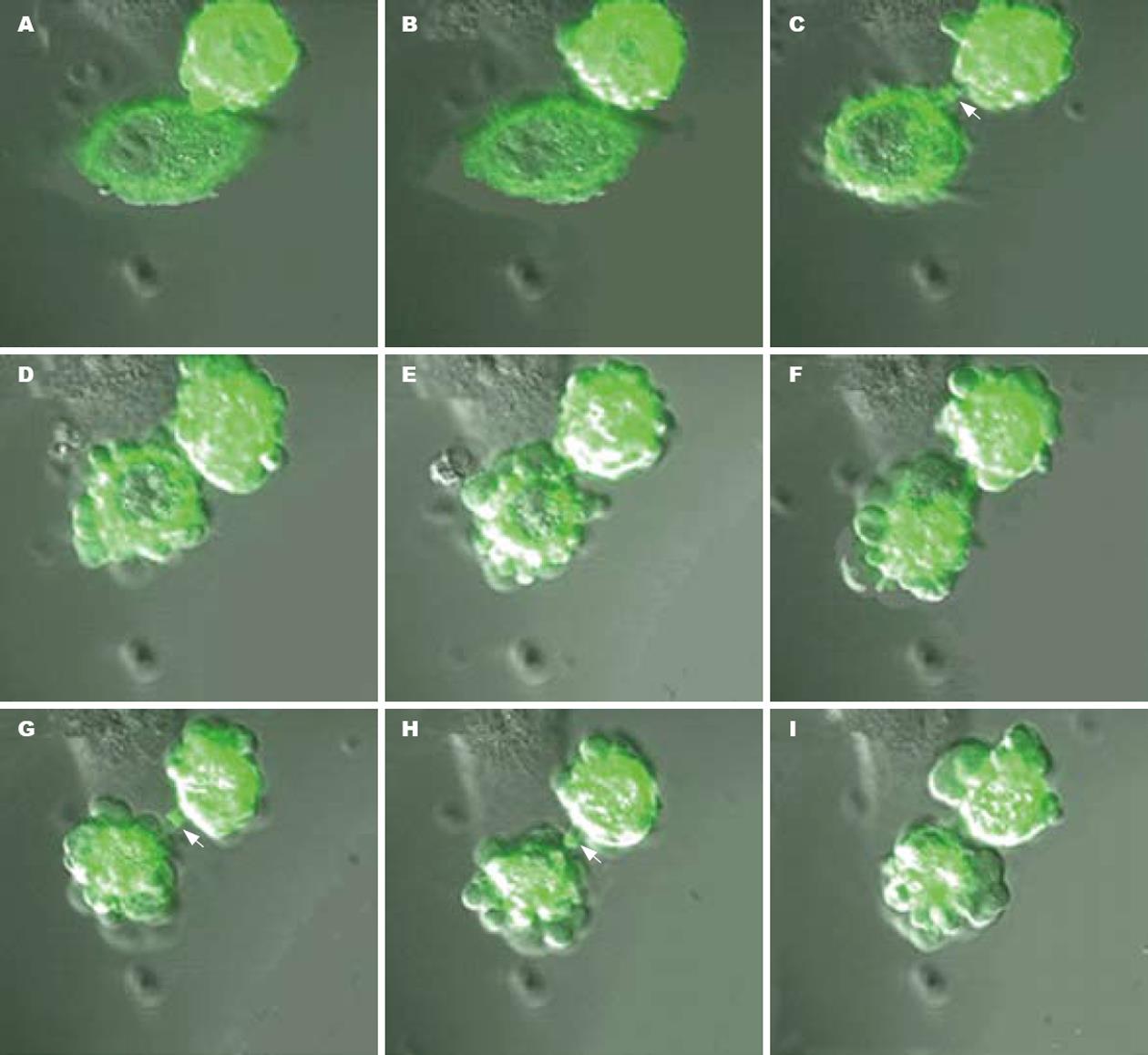
体外培养细胞置于倒置荧光显微镜下观察可见, 当加入GCV后, 转导了MPC/HSV-TK+GFP的肿瘤细胞在给予药物前体后被杀死, 随着时间的推移, 其相邻的未转染肿瘤细胞也可被杀死(图3).
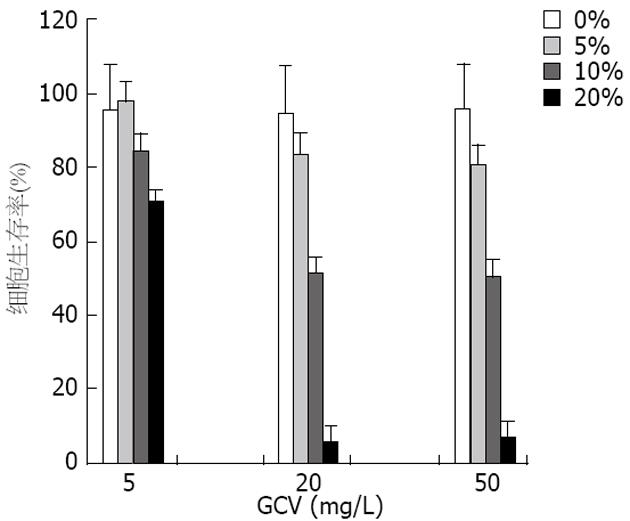
将MPC/HSV-TK+GFP细胞和MPC细胞以不同的比例混合, 加入不同浓度的GCV后观察细胞生存率的变化(图4). 当加入GCV浓度为5 mg/L, 且MPC/HSV-TK+GFP细胞占混合细胞总数的0%、5%、10%和20%时, 细胞生存率分别为96%、98%、86%和74%, 其中, MPC/HSV-TK+GFP细胞占混合细胞的20%时有36%的细胞被杀灭; 当加入GCV浓度为20 mg/L, 且MPC/HSV-TK+GFP细胞占混合细胞总数的0%、5%、10%和20%时, 细胞生存率分别为96%、92%、52%和6%, 其中, MPC/HSV-TK+GFP细胞占混合细胞的10%以及20%时分别有48%及94%的细胞被杀灭; 当加入GCV浓度为50 mg/L时, MPC/HSV-TK+GFP细胞占总数的0%、5%、10%和20%时, 细胞生存率分别为95%、93%、54%和7%, 其中, MPC/HSV-TK+GFP细胞占混合细胞的10%和20%时分别有46%及93%的细胞被杀灭. 显然, 当GCV浓度增加时, 被杀灭的肿瘤细胞数量逐渐增加, 当GCV的浓度上升到50 mg/L时, 其杀伤效果与浓度为20 mg/L GCV的杀伤效果相近; 而随着MPC/HSV-TK+GFP细胞占混合细胞比例的增大, 被杀灭的肿瘤细胞数量逐渐增加, 这些都反映出旁观者效应能增强对肿瘤的杀伤作用.
第1组小鼠给予GCV(100 mg/kg)腹膜腔(ip)内注射治疗, 连续注射24 d后观察, 每只小鼠左右腋窝肿瘤均增大, 且两侧肿瘤体积无明显差异; 第2组小鼠给予PBS腹膜腔(ip)内注射治疗, 连续注射24 d后, 每只小鼠左右腋窝肿瘤均增大, 且两侧肿瘤体积无明显差异; 第3组小鼠给予GCV(100 mg/kg)腹膜腔(ip)内注射治疗, 连续注射24 d后, 接种了MPC/HSV-TK+GFP细胞的左侧腋窝肿瘤体积、质量较对侧腋窝肿瘤明显为小, 并有显著差异(图5, 表1).
胰腺癌是我国常见的主要恶性肿瘤之一, 具有恶性程度高, 转移早等特点, 是当前消化系统肿瘤治疗中效果较差的肿瘤之一. 传统的治疗手段对于提高胰腺癌患者的生存率以及提高患者的生存质量方面无明显的改善. 因此, 探索一种新型的胰腺癌基因治疗手段是当前胰腺癌研究中的热点. 作为现代医学和生物学一个新的研究领域, 肿瘤的自杀基因治疗尤其引人瞩目. 人们已经利用TK基因进行了多种肿瘤的基因治疗研究, 并取得了较好的效果[11-15]. 当前国内外尚未见有关于HSV-TK/GCV自杀基因系统用于小鼠胰腺癌的研究, 因此, 我们选取我单位自行构建的小鼠胰腺癌细胞株MPC细胞进行HSV-TK/GCV自杀基因系统的小鼠胰腺癌体内外研究.
本实验构建了一种质粒载体进行小鼠胰腺癌细胞的体内外实验, 以观察TK/GCV对小鼠胰腺癌细胞MPC的杀伤作用. 实验中我们采用绿色荧光蛋白(GFP)作为筛选标记, 与HSV-TK基因共同插入真核表达载体pcDNA3.1(+), 构建重组质粒pcDNA3.1+/HSV-TK+GFP, 并将重组质粒转染小鼠胰腺癌MPC细胞制备MPC/HSV-TK+GFP细胞, Western blot证实TK基因能够在小鼠胰腺癌细胞中表达.
体外实验结果显示, 当MPC/HSV-TK+GFP细胞数占混合细胞10%时, 低浓度(20 mg/L)的GCV就可将50%左右的肿瘤细胞杀死, 当MPC/HSV-TK+GFP细胞数占混合细胞20%时, 几乎所有的肿瘤细胞被杀死. 实验结果提示, 当加入GCV后, 转导了MPC/HSV-TK+GFP的肿瘤细胞在给予药物前体后被杀死, 随着时间的推移, 其相邻的未转染肿瘤细胞也可被杀死, 显示出极强的旁观者效应. 旁观者效应的意义在于只需少量肿瘤细胞转染自杀基因, 就会对邻近的肿瘤细胞产生广泛的杀伤作用, 在当前体内转导基因方法不可能达到使肿瘤细胞全部转导目的基因的情况下, 无疑是一条重要的补充途径, 克服了转染率相对低下的限制问题, 明显扩大了自杀基因对肿瘤细胞的杀伤作用, 对恶性肿瘤的治疗有着十分重要意义. 转染了自杀基因的肿瘤细胞其相邻或更远的未被转染的肿瘤细胞也可被杀死的机制可能是多重的, 有研究表明磷酸化GCV核苷是通过细胞间隙从HSV-TK阳性细胞传递到周围细胞, 另外GCV治疗下的HSV-TK转导的肿瘤细胞可分泌IL-6和IL-1作为旁分泌因子介导未转导细胞的死亡[16]. 从濒死的转导了HSV-TK的细胞向临近细胞传递凋亡的信号也是旁观者效应的机制之一. HSV-TK/GCV治疗和死亡受体(CD95)聚集[17-19]以及Caspases的活化[20-21]等几者的联合可向临近细胞传递前凋亡信号.
体内实验中, 采用多疗程注射的方法对小鼠进行注射, 动物实验结果显示, 多疗程注射GCV后, 可明显抑制MPC/HSV-TK+GFP细胞在昆明小鼠体内的肿瘤形成. 本实验中, 虽然MPC /HSV-TK+GFP细胞对于GCV敏感, 但是未能被完全杀死, 实验组小鼠肿瘤体积及质量等较对照组为小, 实验中未发现肿瘤完全消退现象, 这可能与GCV注射时肿瘤体积大小有关[23]; 此外, GCV治疗肿瘤的周期较短, 实验研究过程中采用了多疗程注射的方法, 可以克服基因转导效率低, 体内短暂表达的缺点, 同时, 多疗程注射可以保持肿瘤的免疫反应, 防止肿瘤的复发.
本研究结果显示, HSV-TK+GFP/GCV自杀基因治疗系统在抑制小鼠胰腺癌细胞的生长以及杀伤肿瘤细胞的过程中发挥了良好的作用, 本研究结果为临床治疗胰腺癌提供了新的思路和实验依据. 此外, 将HSV-TK+GFP/GCV自杀基因治疗系统联合化疗以及协同其他细胞因子进行基因治疗以提高疗效, 同时, 通过调整细胞生理, 诱导肿瘤细胞凋亡, 加强肿瘤与肿瘤细胞、肿瘤细胞与正常细胞之间的GJIC功能, 提高旁观者效应而增强自杀基因疗效的研究有待进一步深入.
作为现代医学和生物学一个新的研究领域, 肿瘤的自杀基因治疗尤其引人瞩目. 人们已经利用TK基因进行了多种肿瘤的基因治疗研究, 并取得了较好的效果.
吴泰璜, 教授, 山东省立医院肝胆外科.
将HSV-TK+GFP/GCV自杀基因治疗系统联合化疗以及协同其他细胞因子进行基因治疗以提高疗效, 同时, 通过调整细胞生理, 诱导肿瘤细胞凋亡, 加强肿瘤与肿瘤细胞、肿瘤细胞与正常细胞之间的GJIC功能是当前肿瘤的自杀基因治疗领域中的研究热点.
本研究选用了小鼠胰腺癌细胞株MPC作为肿瘤细胞构建MPC/HSV-TK+GFP细胞, 同时, 将GFP作为筛选标记与HSV-TK基因一同转导进入MPC细胞中, 通过显微镜下观察可以清楚地显示出旁观者效应.
在当前体内转导基因方法不可能达到使肿瘤细胞全部转导目的基因的情况下, 自杀基因的旁观者效应无疑是一条重要的补充途径, 克服了转染率相对低下的限制问题, 明显扩大了自杀基因对肿瘤细胞的杀伤作用, 对恶性肿瘤的治疗有着十分重要意义.
自杀基因: 又称为前药转换酶基因, 将一些病毒或细菌基因组中的前药转换酶基因导入肿瘤细胞并表达TK, 将GCV磷酸化为二磷酸产物GCV-DP, 然后在哺乳动物细胞内激酶作用下形成三磷酸产物GCV-TP, GCV-TP具有强烈细胞毒性, 抑制DNA聚合酶, 掺入DNA合成链中, 导致链中止、染色体变性和姐妹染色单体交换, 最终导致细胞死亡, 从而达到杀死肿瘤细胞的目的.
本文立意新颖, 方法得当, 分析合理, 研究有一定意义.
编辑:李军亮 电编:何基才
| 1. | Denny WA. Prodrugs for Gene-Directed Enzyme-Prodrug Therapy (Suicide Gene Therapy). J Biomed Biotechnol. 2003;2003:48-70. [PubMed] |
| 2. | Ozawa K. [Hematopoietic malignancies and gene therapy]. Gan To Kagaku Ryoho. 2003;30:478-482. [PubMed] |
| 3. | Prados J, Melguizo C, Boulaiz H, Marchal JA, Aránega A. Cancer gene therapy: strategies and clinical trials. Cell Mol Biol (Noisy-le-grand). 2005;51:23-36. [PubMed] |
| 4. | Niculescu-Duvaz I, Springer CJ. Introduction to the background, principles, and state of the art in suicide gene therapy. Mol Biotechnol. 2005;30:71-88. [PubMed] [DOI] |
| 5. | Kwong KY, Zou Y, Day CP, Hung MC. The suppression of colon cancer cell growth in nude mice by targeting beta-catenin/TCF pathway. Oncogene. 2002;21:8340-8346. [PubMed] [DOI] |
| 6. | Mäkinen K, Loimas S, Wahlfors J, Alhava E, Jänne J. Evaluation of herpes simplex thymidine kinase mediated gene therapy in experimental pancreatic cancer. J Gene Med. 2000;2:361-367. [PubMed] [DOI] |
| 7. | Mullen CA. Metabolic suicide genes in gene therapy. Pharmacol Ther. 1994;63:199-207. [PubMed] [DOI] |
| 8. | Wei MX, Bougnoux P, Sacré-Salem B, Peyrat MB, Lhuillery C, Salzmann JL, Klatzmann D. Suicide gene therapy of chemically induced mammary tumor in rat: efficacy and distant bystander effect. Cancer Res. 1998;58:3529-3532. [PubMed] |
| 9. | Zhang Z, Shirakawa T, Hinata N, Matsumoto A, Fujisawa M, Okada H, Kamidono S, Matsuo M, Gotoh A. Combination with CD/5-FC gene therapy enhances killing of human bladder-cancer cells by radiation. J Gene Med. 2003;5:860-867. [PubMed] [DOI] |
| 10. | Pan X, Li ZS, Xu GM, Cui L, Tu ZX. Adenovirus-mediated gene transfer in the treatment of pancreatic cancer. Pancreas. 2003;26:274-278. [PubMed] [DOI] |
| 11. | van der Linden RR, Haagmans BL, Mongiat-Artus P, van Doornum GJ, Kraaij R, Kadmon D, Aguilar-Cordova E, Osterhaus AD, van der Kwast TH, Bangma CH. Virus specific immune responses after human neoadjuvant adenovirus-mediated suicide gene therapy for prostate cancer. Eur Urol. 2005;48:153-161. [PubMed] [DOI] |
| 12. | Kurozumi K, Tamiya T, Ono Y, Otsuka S, Kambara H, Adachi Y, Ichikawa T, Hamada H, Ohmoto T. Apoptosis induction with 5-fluorocytosine/cytosine deaminase gene therapy for human malignant glioma cells mediated by adenovirus. J Neurooncol. 2004;66:117-127. [PubMed] [DOI] |
| 13. | 谭 宇蕙, 吴 映雅, 杜 标炎, 胡 岳山, 赵 鹏, 李 杰芬. 大鼠肝癌细胞HSV-tk/GCV自杀基因系统的构建及其旁观者效应. 世界华人消化杂志. 2005;13:2069-2073. [DOI] |
| 14. | Wang Y, Xu HX, Lu MD, Tang Q. Expression of thymidine kinase mediated by a novel non-viral delivery system under the control of vascular endothelial growth factor receptor 2 promoter selectively kills human umbilical vein endothelial cells. World J Gastroenterol. 2008;14:224-230. [PubMed] [DOI] |
| 15. | Zhang JH, Wan MX, Yuan JY, Pan BR. Construction and identification of recombinant vectors carrying herpes simplex virus thymidine kinase and cytokine genes expressed in gastric carcinoma cell line SGC7901. World J Gastroenterol. 2004;10:26-30. [PubMed] |
| 16. | Freeman SM, Ramesh R, Shastri M, Munshi A, Jensen AK, Marrogi AJ. The role of cytokines in mediating the bystander effect using HSV-TK xenogeneic cells. Cancer Lett. 1995;92:167-174. [PubMed] [DOI] |
| 17. | Robe PA, Nguyen-Khac M, Jolois O, Rogister B, Merville MP, Bours V. Dexamethasone inhibits the HSV-tk/ ganciclovir bystander effect in malignant glioma cells. BMC Cancer. 2005;5:32. [PubMed] [DOI] |
| 18. | Kwon GY, Jeong J, Woo JK, Choi HY, Lee MJ, Ko JK, Shim YH, Kim CW. Co-expression of bfl-1 enhances host response in the herpes simplex virus-thymidine kinase/ganciclovir gene therapy system. Biochem Biophys Res Commun. 2003;303:756-763. [PubMed] [DOI] |
| 19. | Hall SJ, Canfield SE, Yan Y, Hassen W, Selleck WA, Chen SH. A novel bystander effect involving tumor cell-derived Fas and FasL interactions following Ad.HSV-tk and Ad.mIL-12 gene therapies in experimental prostate cancer. Gene Ther. 2002;9:511-517. [PubMed] [DOI] |
| 20. | Zhang Z, Lin J, Chu J, Ma Y, Zeng S, Luo Q. Activation of caspase-3 noninvolved in the bystander effect of the herpes simplex virus thymidine kinase gene/ganciclovir (HSV-tk/GCV) system. J Biomed Opt. 2008;13:031209. [PubMed] [DOI] |
| 21. | Chiu CC, Kang YL, Yang TH, Huang CH, Fang K. Ectopic expression of herpes simplex virus-thymidine kinase gene in human non-small cell lung cancer cells conferred caspase-activated apoptosis sensitized by ganciclovir. Int J Cancer. 2002;102:328-333. [PubMed] [DOI] |
| 22. | Vlachaki MT, Chhikara M, Aguilar L, Zhu X, Chiu KJ, Woo S, Teh BS, Thompson TC, Butler EB, Aguilar-Cordova E. Enhanced therapeutic effect of multiple injections of HSV-TK + GCV gene therapy in combination with ionizing radiation in a mouse mammary tumor model. Int J Radiat Oncol Biol Phys. 2001;51:1008-1017. [PubMed] [DOI] |