修回日期: 2007-09-13
接受日期: 2007-10-25
在线出版日期: 2008-01-08
目的: 体外研究IL-6与PC12细胞株神经递质DA, NE合成代谢之间的关系及JAK-STATs途径在其中的作用.
方法: 用不同剂量的IL-6(0.5 mg/L, 1 mg/L和1.5 mg/L)处理分化的PC12细胞, 采用磷脂酰丝氨酸外翻法检测细胞凋亡率, 应用HPLC检测上清和细胞裂解液中DA和NE的含量. 采用1 mg/L IL-6处理分化的PC12细胞, 用免疫印迹法(Western blotting)检测IL-6处理不同时间内全细胞裂解液中STAT3、TH蛋白表达水平, 浆蛋白及核蛋白裂解液内STAT3和p-STAT3表达
水平.
结果: 各组细胞凋亡率无明显差别. 加入IL-6后, 随着浓度的增加, DA和NE代谢呈近似剂量依赖性降低, 当IL-6为1 mg/L时DA和NE的变化有统计学意义. 1 mg/L IL-6可以增加STAT3蛋白的表达、p-STAT3蛋白的转核、降低酪氨酸强化酶的表达.
结论: IL-6通过JAK-STAT3信号转导途径, 影响酪氨酸羟化酶的表达, 从而降低DA和NE的合成.
引文著录: 李荣, 王杰军, 沈毅珺, 吴欣, 王妙苗, 王喜, 何晓静. IL-6体外对PC12细胞株DA和NE代谢抑制的机制. 世界华人消化杂志 2008; 16(1): 45-49
Revised: September 13, 2007
Accepted: October 25, 2007
Published online: January 8, 2008
AIM: To examine the relationship between interleukin (IL)-6 and the anabolism of DA and NE in the PC12 cell line, and to explore the related signal transduction.
METHODS: Differentiated PC12 cells were used to examine the inhibitory effect of IL-6 (0.5, 1 and 1.5 mg/L) on the anabolism of DA and NE. Apoptosis of PC12 cells was measured by fluocytometry. The concentration of DA and NE in PC12 cells and the medium was determined by HPLC. After exposure to IL-6 (1 mg/L), protein expression of p-STAT3 in the nuclei and STAT3 and tyrosine hydroxylase (TH) in the cytoplasm of PC12 cells was measured by Western blotting.
RESULTS: The apoptosis rate of PC12 cells cultured in the presence of different concentrations of IL-6 did not differ significantly. The metabolism of DA and NE in PC12 cells changed in accordance with the concentration of IL-6 added to the medium, and it obviously differed from that of the controls at a concentration of 1 mg/L. IL-6 enhanced the protein expression of STAT3 and the transcription to nuclei and decreased protein expression of TH.
CONCLUSION: IL-6 reduces the synthesis of DA and NE in vitro. The mechanism underlying the effects of IL-6 on the synthesis of DA and NE involves JAK-STATs signal transduction and decreases protein expression of TH.
- Citation: Li R, Wang JJ, Shen YJ, Wu X, Wang MM, Wang X, He XJ. In vitro inhibitory effect of interleukin-6 on the metabolism of DA and NE in PC12 cell line and the related signal transduction. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 45-49
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/45.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.45
一些以神经递质代谢障碍为基础的疾病如抑郁, 常伴随脑脊液或脑组织中IL-6的升高. 现代研究已经证明, IL-6可以影响儿茶酚胺类神经递质的代谢, 但是不同的研究组观察得到的结果不尽一致, 如Maes et al[1]发现IL-6可以降低5-HT的合成代谢, 而Zhang et al[2]发现IL-6可以促进5-HT的合成代谢. 但国内外的现有研究都局限在现象研究, 且都集中在体内研究, 而关于IL-6影响儿茶酚胺类神经递质代谢之间的信号转导通路及体外研究都鲜有报道. 为此, 我们采用国际实验研究常用的用于研究离子通道、神经递质合成和释放的体外模型[3](分化的PC12细胞)为研究对象, 通过体外实验观察IL-6对儿茶酚胺类神经递质代谢的影响以及可能的细胞信号转导途径.
HPLC检测仪器和流式细胞仪, 显微镜(CytomicsTMFC500系列), 流式细胞仪(美国Beckman Coulter公司), Western blot仪器, 孵箱. PC12细胞由第二军医大学神经生物教研室惠赠(购自ATCC), NGF(购自Sigma公司), 胎牛血清、马血清、DMEM和多聚赖氨酸(Gibico), PI和Annexin V(Sigma公司), 所有应用于细胞HPLC检测的溶剂和物质中, 除乙腈外均购自于Merck公司, 乙腈购自于上海中科院药物研究所; STAT3和p-STAT3的一抗(Santa cruz biotehcnonogy公司), 工作浓度 1∶1000, STAT3和p-STAT3的二抗(Cell signaling公司), 工作浓度 1∶3000, 酪氨酸羟化酶的一抗(Chemicon公司), 工作浓度1∶1000, 二抗(Cell Signaling公司), 工作浓度1∶3000; β-actin一抗, 二抗, 工作浓度1∶2000; 细胞核蛋白与细胞质蛋白抽提试剂盒、Western及IP细胞裂解液和PVDF膜(Beyotime Biotechnology公司).
选用第13-15代的PC12细胞, 以6×105个/孔接种在铺被有多聚赖氨酸的6孔板中, 培养液选用含100 mL/L马血清, 50 mL/L胎牛血清的DMEM, 在含有50 mL/L CO2, 37℃的孵箱中培育. 接种后第1天, 用50 μg/L的NGF诱导分化, 在含有NGF的DMEM中培养7-10 d, 隔天换液[4], 然后分为对照组, 不同剂量IL-6处理组(0.5 mg/L, 1 mg/L, 1.5 mg/L).
1.2.1 细胞凋亡的检测: 在细胞诱导分化后, 分为8组, 为空白对照组, IL-6处理组(0.01 mg/L, 0.1 mg/L, 0.25 mg/L, 0.5 mg/L, 1 mg/L, 1.5 mg/L, 2 mg/L). 在培养12, 24, 36, 48 h后收集PC12细胞做如下处理, 用Biovision公司生产的Annexin V-FITC试剂盒检测细胞凋亡率, 分别用磷酸盐缓冲液(PBS)将细胞洗2次, 取5×105个细胞, 800 r/min离心5 min, 加入结合缓冲液450 μL、Annexin V-F1TC 5 μL, PI 2 μL避光染色5 min, 应用流式细胞仪进行检测.
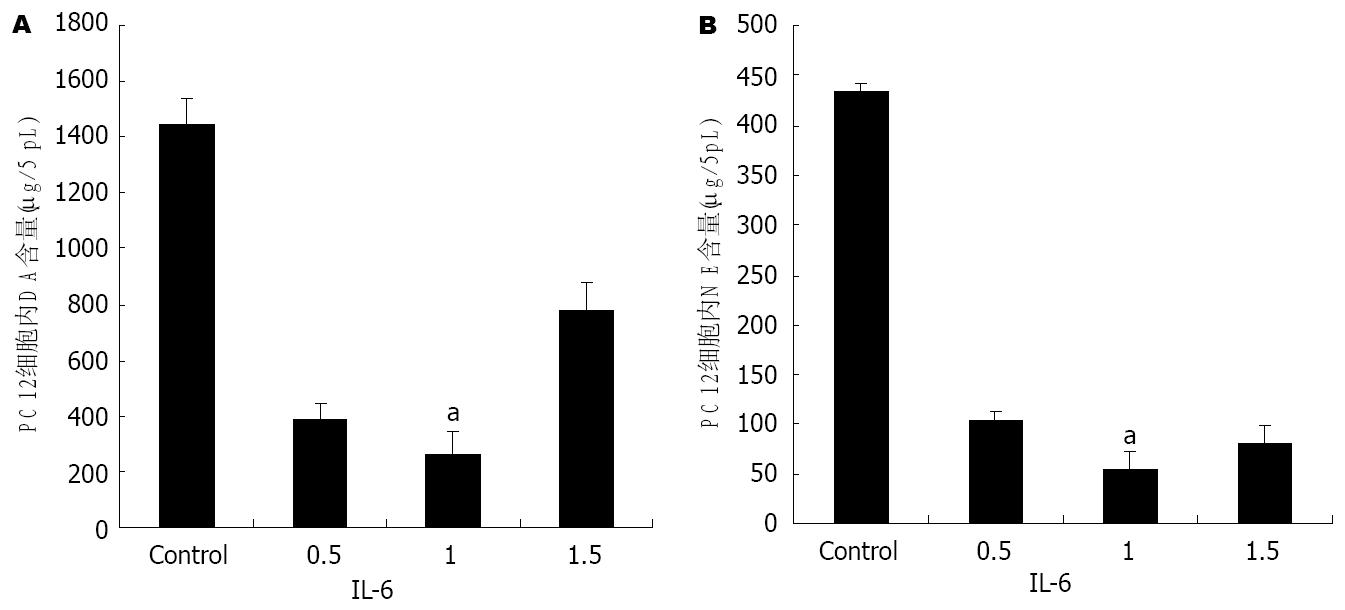
1.2.2 高效液相检测神经递质的合成和分泌: 在细胞诱导分化后, 同上分为8组, 处理24 h. 按照参考文献[5]的方法, 分别收集培养液和细胞, 培养液离心(17500 g, 10 min, 4℃)去掉蛋白及可能存在的细胞碎屑, 立即取5 μL用做HPLC检测. 收集的细胞用0.2 mol/L高氯酸处理后低温离心(17500 g, 10 min, 4℃), 然后参照文献[6], 将细胞裂解液和上清应用高效液相电化学检测器检测, 结果见图1.
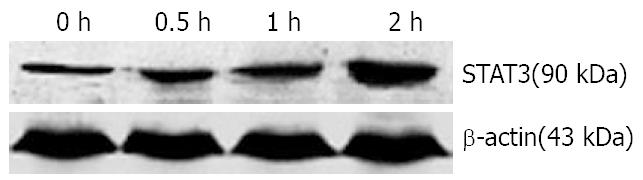
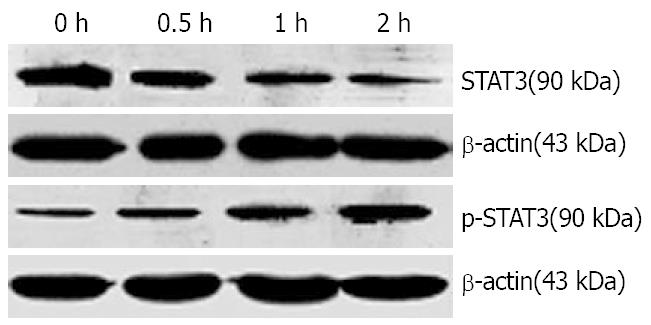
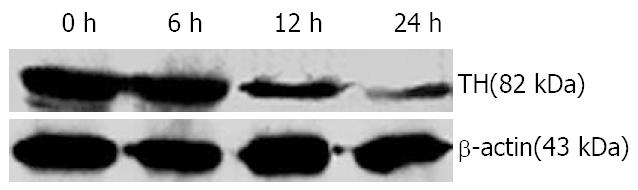
1.2.3 STAT3和酪氨酸羟化酶的检测: 将培养的PC12细胞接种于6孔细胞培养板中, 在进行Western blot检测STAT3时将细胞分为IL-6(1 mg/L)处理0, 0.5, 1, 2 h组; 在进行Western blot检测TH时将细胞分为IL-6处理0, 6, 12, 24 h组. 在垂直电泳两玻璃板(BIO-RAD, 美国)间隙中灌注分离胶及浓缩胶, 将已备好的蛋白样本煮沸5 min后, 用15 μL微量注射器按预定顺序加样, 并加入标准分子质量对照(CST公司, 美国)3 μL. 将凝胶固定于电泳装置(BIO-RAD, 美国), 并加入Tris-甘氨酸电泳缓冲液, 稳压200 V电泳40 min, 至样品到达分离胶底部. 转膜使用BIO-RAD转移仪, 在稳压100 V的电流下转移60 min, 将凝胶上的蛋白条带转移至聚偏氟乙稀(PVDF)膜上, 后将PVDF膜放入阻断缓冲液, 封闭60 min. 在阻断缓冲液中加入一抗(抗STAT3抗体, 抗酪氨酸羟化酶抗体, 抗p-STAT3抗体)4℃温度下摇过夜; 次日, 将摇过夜的PVDF膜放入阻断缓冲液, 并加入二抗, 在室温下摇1 h. 在暗室中进行显影, 室温中, 将PVDF膜置于显色混合液(Phototope-HRP Western blot detection)反应1 min, 在片夹中曝光. 底片在显影液中显影, 并在定影液中定影.
应用不同剂量IL-6处理分化的PC12细胞, 然后参照文献[6], 将细胞裂解液和上清应用高效液相电化学检测器检测, 结果如图1所示.
用1 mg/L的IL-6处理分化的PC12细胞, 不同时间点收集细胞.抽提的蛋白用于Western blot分析, 结果如图2所示.
用1 mg/L的IL-6处理分化的PC12细胞,用细胞核蛋白与细胞质蛋白抽提试剂盒处理分化的PC12细胞, 抽提的蛋白用于Western blot分析, 结果如图3所示.
IL-6是一个双重作用的细胞因子, 在神经系统的生长和存活中发挥重要作用. 在正常生理条件下处于低水平状态, 可像神经生长因子一样促进神经系统的正常发育和修复, 但在高水平表达时可造成神经系统损伤[7]. 在中枢神经系统(central nervous system, CNS), IL-6由激活的星形胶质细胞、少突胶质细胞和神经元细胞产生[8,9]. 病理情况下产生高浓度的IL-6, 可引发许多病理行为, 包括抑制食欲[10]、学习和记忆能力减退[11], 引起神经功能退化等[12]. 大量研究显示, 抑郁等以神经递质代谢障碍为基础病变的神经系统病变患者, 脑脊液及脑组织中IL-6水平明显升高[13]. 有许多学者根据抑郁患者外周血中IL-6水平升高以及应用IL-6会引发与抑郁症状极为相似的病态综合征, 因而提出细胞因子导致抑郁的假说. 当前大量研究也同样指出, IL-6可以影响儿茶酚胺类神经递质的代谢, 但研究结果不尽一致, 究其原因, 可能是体内研究涉及到的神经内分泌的调节作用, 而鲜见相关信号转导机制及体外研究的报道.
PC12细胞株是来源于大鼠肾上腺嗜铬细胞瘤, 并可以在NGF诱导后分化的细胞株, 分化的PC12细胞为类交感神经元, 具有合成和分泌Ach, DA, NE和5-HT的功能. 广泛用于神经递质代谢的研究[14]. 分化PC12细胞表面有IL-6受体, 而且低剂量的IL-6对分化的PC12细胞具有保护作用, 可以避免其免于无血清诱导的调亡[15,16]. 我们应用不同剂量IL-6处理分化的PC12细胞后, 发现细胞凋亡率无显著差别(结果未列出).
我们应用不同剂量的IL-6处理分化的PC12细胞, 发现5-HT的代谢没有明显变化, 而高浓度的IL-6可以抑制PC12细胞合成和分泌DA, NE, 以1 mg/L的作用最明显(图1). 在DA代谢方面, Goodwill et al[17]发现IL-6升高的实验对象中DA浓度下降, 结果与此一致, Zalcman et al也研究发现注射人IL-6(200 ng)可以升高大脑前皮质二羟苯乙酸(dihydroxy-phenyl acetic acid, DOPAC)的浓度[18,19], 即增加IL-6的分解代谢. 但是, 在NE及5-HT代谢方面与研究结果不一致[1,2,20]. 由于体外研究条件易于标准化, 测试精确, 因此对于IL-6对儿茶酚胺类神经递质代谢的结果更为客观, 而体内研究的结果可能是众多细胞因子调控所得到的结果, 并不能精确反应作用结果.
目前认为, IL-6的信号主要通过JAK-STAT途径转导至核内, 在JAK-STAT途径中, IL-6主要激活STAT3[21]. 而JAK-STAT途径中的各主要蛋白在脑区的各个阶段和部位都有存在, 并且参与中枢神经系统的发育及神经细胞的增殖、分化过程[22], 也与脑肿瘤、缺血等病理过程密切相关[23]. 通过Western blot方法, 我们发现1 mg/L IL-6可以增加全细胞裂解液中STAT3蛋白的表达, 以IL-6作用2 h最为明显. 进一步研究表明细胞质中STAT3蛋白的表达没有明显变化, 而细胞核内p-STAT3的含量明显升高, 提示该细胞因子的作用主要是增加STAT3的活化和转核. 而PC12细胞内的酪氨酸羟化酶的表达也随着下降, 以IL-6作用24 h后最为明显, 提示IL-6可能通过激活JAK-STAT3途径影响儿茶酚胺类神经递质酪氨酸羟化酶的表达, 进而影响儿茶酚胺类神经递质的合成代谢. Goodwill et al[17]的研究结果中也认为IL-6可以影响儿茶酚胺类神经递质合成的限速酶的表达进而影响DA的合成代谢.
我们的实验从体外研究的角度在一次证实IL-6确实可以影响DA、NE的代谢, 而这两种神经递质与抑郁的发生密切相关, 支持Maes et al[1]的免疫功能与神经递质代谢之间的联系. 但是, 由于低浓度IL-6通过JAK-STATS途径对分化的PC12细胞发挥保护作用, 那么高浓度的IL-6是单独通过JAK-STATS途径还是其他信号转导途径的共同作用, 仍有待进一步探讨.
中枢单胺类神经元传导缺陷是抑郁症较为公认的假说之一, 即脑内NE、5-HT和DA神经递质含量下降为抑郁症主要病因的假说. 到目前为止, 神经生化学理论是迄今被临床药理充分利用以阐述抑郁症发病的神经生物学机制.
现代研究证明, IL-6影响儿茶酚胺类神经递质的代谢, 但是不同的研究组观察得到的结果不尽一致, 国内外的现有研究都局限在现象研究, 且都集中在体内研究, 而关于IL-6影响儿茶酚胺类神经递质代谢之间的信号转导通路及体外研究都鲜有报道.
本研究率先采用体外研究模式了解IL-6与DA、NE代谢之间的关系及可能信号转导途径, 对进一步进行该方面的研究具有启发意义.
本实验从体外研究的角度再一次证实IL-6确实可以影响DA、NE的代谢, 而这两种神经递质与抑郁的发生密切相关, 支持Maes et al有关免疫功能与神经递质代谢之间联系的研究.
本文图片清晰, 内容较新, 对基础研究有一定的参考价值.
编辑:程剑侠 电编:何基才
| 1. | Maes M, Scharpe S, Meltzer HY, Bosmans E, Suy E, Calabrese J, Cosyns P. Relationships between interleukin-6 activity, acute phase proteins, and function of the hypothalamic-pituitary-adrenal axis in severe depression. Psychiatry Res. 1993;49:11-27. [PubMed] |
| 2. | Zhang J, Terreni L, De Simoni MG, Dunn AJ. Peripheral interleukin-6 administration increases extracellular concentrations of serotonin and the evoked release of serotonin in the rat striatum. Neurochem Int. 2001;38:303-308. [PubMed] |
| 3. | Greene LA, Tischler AS. Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor. Proc Natl Acad Sci USA. 1976;73:2424-2428. [PubMed] |
| 4. | Ireland LM, Yan CH, Nelson LM, Atchison WD. Differential effects of 2,4-dithiobiuret on the synthesis and release of acetylcholine and dopamine from rat pheochromocytoma (PC12) cells. J Pharmacol Exp Ther. 1995;275:1453-1462. [PubMed] |
| 5. | Liu HQ, Zhu XZ, Weng EQ. Intracellular dopamine oxidation mediates rotenone-induced apoptosis in PC12 cells. Acta Pharmacol Sin. 2005;26:17-26. [PubMed] |
| 6. | Liang YQ, Tang XC. Comparative studies of huperzine A, donepezil, and rivastigmine on brain acetylcholine, dopamine, norepinephrine, and 5-hydroxytryptamine levels in freely-moving rats. Acta Pharmacol Sin. 2006;27:1127-1136. [PubMed] |
| 7. | Zhao B, Schwartz JP. Involvement of cytokines in normal CNS development and neurological diseases: recent progress and perspectives. J Neurosci Res. 1998;52:7-16. [PubMed] |
| 8. | Fernandes A, Falcao AS, Silva RF, Brito MA, Brites D. MAPKs are key players in mediating cytokine release and cell death induced by unconjugated bilirubin in cultured rat cortical astrocytes. Eur J Neurosci. 2007;25:1058-1068. [PubMed] |
| 9. | Ghorbel MT, Sharman G, Leroux M, Barrett T, Donovan DM, Becker KG, Murphy D. Microarray analysis reveals interleukin-6 as a novel secretory product of the hypothalamo-neurohypophyseal system. J Biol Chem. 2003;278:19280-19285. [PubMed] |
| 10. | Elwan O, Madkour O, Elwan F, Mostafa M, Abbas Helmy A, Abdel-Naseer M, Abdel Shafy S, El Faiuomy N. Brain aging in normal Egyptians: cognition, education, personality, genetic and immunological study. J Neurol Sci. 2003;211:15-22. [PubMed] |
| 11. | Nishiyama N. Thymectomy-induced deterioration of learning and memory. Cell Mol Biol (Noisy-le-grand). 2001;47:161-165. [PubMed] |
| 12. | Tha KK, Okuma Y, Miyazaki H, Murayama T, Uehara T, Hatakeyama R, Hayashi Y, Nomura Y. Changes in expressions of proinflammatory cytokines IL-1beta, TNF-alpha and IL-6 in the brain of senescence accelerated mouse (SAM) P8. Brain Res. 2000;885:25-31. [PubMed] |
| 13. | Muller N, Ackenheil M. Psychoneuroimmunology and the cytokine action in the CNS: implications for psychiatric disorders. Prog Neuropsychopharmacol Biol Psychiatry. 1998;22:1-33. [PubMed] |
| 14. | Kim CH, Koo BS, Kim KO, Kim JK, Chang YC, Lee IS. Salviae miltiorrhizae radix increases dopamine release of rat and pheochromocytoma PC12 cells. Phytother Res. 2006;20:191-199. [PubMed] |
| 15. | Kunioku H, Inoue K, Tomida M. Interleukin-6 protects rat PC12 cells from serum deprivation or chemotherapeutic agents through the phosphatidy-linositol 3-kinase and STAT3 pathways. Neurosci Lett. 2001;309:13-16. [PubMed] |
| 16. | Umegaki H, Yamada K, Naito M, Kameyama T, Iguchi A, Nabeshima T. Protective effect of interleukin-6 against the death of PC12 cells caused by serum deprivation or by the addition of a calcium ionophore. Biochem Pharmacol. 1996;52:911-916. [PubMed] |
| 17. | Goodwill MH, Lawrence DA, Seegal RF. Polychlorinated biphenyls induce proinflammatory cytokine release and dopaminergic dysfunction: protection in interleukin-6 knockout mice. J Neuroimmunol. 2007;183:125-132. [PubMed] |
| 18. | Dunn AJ. Systemic interleukin-1 administration stimulates hypothalamic norepinephrine metabolism parallelling the increased plasma corticosterone. Life Sci. 1988;43:429-435. [PubMed] |
| 19. | Zalcman S, Green-Johnson JM, Murray L, Nance DM, Dyck D, Anisman H, Greenberg AH. Cytokine-specific central monoamine alterations induced by interleukin-1, -2 and -6. Brain Res. 1994;643:40-49. [PubMed] |
| 20. | Terao A, Oikawa M, Saito M. Cytokine-induced change in hypothalamic norepinephrine turnover: involvement of corticotropin-releasing hormone and prostaglandins. Brain Res. 1993;622:257-261. [PubMed] |
| 21. | Murray PJ. The JAK-STAT signaling pathway: input and output integration. J Immunol. 2007;178:2623-2629. [PubMed] |
| 22. | Cattaneo E, Conti L, De-Fraja C. Signalling through the JAK-STAT pathway in the developing brain. Trends Neurosci. 1999;22:365-369. [PubMed] |
| 23. | Cattaneo E, Magrassi L, De-Fraja C, Conti L, Di Gennaro I, Butti G, Govoni S. Variations in the levels of the JAK/STAT and ShcA proteins in human brain tumors. Anticancer Res. 1998;18:2381-2387. [PubMed] |