修回日期: 2005-10-09
接受日期: 2005-10-13
在线出版日期: 2006-01-08
目的: 探讨经肝动脉灌注GRGDSP(Gly-Arg-Gly-Asp-Ser-Pro)联合肝动脉化疗栓塞术治疗大鼠肝肿瘤生长与转移的机制.
方法: 成年♀Wistar大鼠30只制作为肝癌模型, 随机分为: A组(n = 10), 即TACE+GRGDSP组; B组(n = 10), 即TACE组及C组(n = 10), 即生理盐水组. 介入术前及术后12 d分别MRI检查计算肿瘤体积生长率V2/V1. 术后行病理学检查计算肝肿瘤坏死率及转移情况, 并采取免疫组化检测、吸光度分析von-Willebrand factor (Ⅷ因子)和Ki67在肿瘤组织中的表达.
结果: 存活26只大鼠, V2/V1值及Ki67阳性表达吸光度值(A, B, C组分别为4.4±0.7, 7.0±1.1, 13.0±1.7; 0.21±0.05, 0.30±0.06, 0.38±0.04)比较: 总体均存在显著性差异(F = 112.97, P<0.01; F = 25.81, P<0.01), A组低于B, C二组(P<0.05), B组亦低于C组(P<0.05); 肝内转移灶数及Ⅷ因子阳性表达吸光度值(A, B, C组分别为4.89±1.25, 6.63±1.60, 7.22±1.92; 0.18±0.02, 0.22±0.02, 0.23±0.02)比较, 总体均存在显著性差异(F = 5.04, P<0.05; F = 15.62,P<0.01), 均为A组低于B, C组(P<0.05), 而B, C两组无显著性差异; 肿瘤坏死率(A, B, C组分别为60.33±4.68%, 55.80±5.23%, 32.56±4.84%)比较, 总体存在显著性差异(F = 76.15, P<0.01), A, B组间无显著性差异, 但均高于C组(P<0.05).
结论: 经肝动脉灌注GRGDSP联合肝动脉化疗栓塞术治疗大鼠肝肿瘤具有显著抑制移植性肝肿瘤生长和肝内转移的作用, 其机制可能有GRGDSP抑制了肿瘤血管生成和肿瘤细胞的增生.
引文著录: 尹君, 梁惠民, 钱骏, 夏风, 王勇, 邓宪波, 王伟, 冯敢生. 经肝动脉灌注 GRGDSP 联合化疗栓塞治疗大鼠肝肿瘤的机制. 世界华人消化杂志 2006; 14(1): 57-62
Revised: October 9, 2005
Accepted: October 13, 2005
Published online: January 8, 2006
AIM: To explore the initial mechanisms of trans-arterial administration of GRGDSP (Gly-Arg-Gly-Asp-Ser-Pro) combined with transarterial chemoembolization (TACE) in the treatment of hepatic carcinoma in Wistar rats.
METHODS: The subcapsular implantation of a solid Walker-256 in the livers was carried out in 30 Wistar rats. The tumor volume V1 was measured using magnetic resonance tomography (MRT) 12 d after the implantation. Then rats were designed into 3 groups. The rats in group A (n = 10) were treated with GRGDSP (250 μg) plus TACE. The rats in group B (n = 10) were only treated with TACE, and the ones in group C were treated with normal saline, serving as the controls. Another 12 d later, MRT were performed again to determine the tumor volume V2 and the value of V2/V1 was calculated. Pathological examination was performed to detect the necrosis and metastasis of carcinoma. The expression of von-Willebrand factor and Ki67 were evaluated in the tumor tissues by immunohistochemistry and optical density analysis.
RESULTS: In the survived 26 rats, the values of V2/V1 and Ki67 optical density in group A (n = 9), B (n = 8) and C (n = 9) were 4.4 ± 0.7, 7.0 ± 1.1, 13.0 ± 1.7 and 0.21 ± 0.04, 0.30 ± 0.06, 0.38 ± 0.05 respectively, and there were significant differences among 3 groups (F = 112.97, P < 0.01; F = 25.81, P < 0.01) and between either two groups (P < 0.05). The numbers of metastatic foci and the optical density of von-Willebrand factor in group A, B, and C were 4.89 ± 1.25, 6.63 ± 1.60, 7.22 ± 1.92 and 0.18 ± 0.02, 0.22 ± 0.02, 0.23 ± 0.02, respectively, and there were significant differences among 3 groups (F = 5.04, P < 0.05; F = 15.62, P < 0.01), and between A and B (P < 0.05) as well as between A and C (P < 0.05). The rates of necrosis in group A, B, and C were 0.33 ± 4.68%, 55.80 ± 5.23%, and 32.56 ± 4.84%, respectively, and significant differences were found among 3 groups (F = 76.15, P < 0.01), and between group A and C as well as between B and C (P < 0.05).
CONCLUSION: Growth and intrahepatic metastasis can be significantly inhibited in implanted hepatic carcinoma of rat by transarterial administration of GRGDSP combined with TACE, and the mechanism may be related to GRGDSP's in-hibition on the tumor angiogenesis and prolieration of tumor cells.
- Citation: Yin J, Liang HM, Qian J, Xia F, Wang Y, Deng XB, Wang W, Feng GS. Mechanism of transarterial administration of GRGDSP combined with chemoembolization for treating hepatic carcinoma in rats. Shijie Huaren Xiaohua Zazhi 2006; 14(1): 57-62
- URL: https://www.wjgnet.com/1009-3079/full/v14/i1/57.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i1.57
目前经肝动脉化疗栓塞术(transarterial chemo-embolization, TACE)被公认为治疗不可切除性肝癌的一种重要手段[1], 但肝癌患者的5 a生存率并未因此得到明显的增加[2,3], 其主要原因之一是TACE术后残癌的复发和转移. 众所周知, 肿瘤转移是一个多步骤的复杂进展过程, 而肿瘤细胞在整合素的介导下黏附于正常组织基底膜是其浸润和转移的关键步骤. 近年来, 针对整合素的治疗正逐渐成为抑制肿瘤复发和转移的研究热点. 我们建立大鼠肝癌模型, 评价经肝动脉灌注抑制整合素功能的生物肽--GRGDSP(Gly-Arg-Gly-Asp-Ser-Pro), 并联合TACE治疗大鼠肝恶性肿瘤的疗效.
受试动物为♀Wistar大鼠, 体质量200±20 g(华中科技大学同济医学院动物学部提供). Walker-256瘤株购于上海医药工业研究院. 磁共振仪为Magnetom Vision, 1.5 T, 德国Simens公司生产. 聚乙烯微导管(内径0.28 mm, 外径0.61 mm)为德国Heidelberg Wenzel公司生产. GRGDSP由美国Anaspec Inc公司生产, 购自深圳晶美生物工程公司. 兔抗大鼠Ⅷ因子购自美国Santa Cruz公司, 北京中山生物技术有限公司国内分装. 兔抗人Ki67mAb由美国Zymed公司生产, 购自北京中山生物技术有限公司. 光密度分析采用全自动彩色图像分析系统HMIAS-2000型(武汉千屏影像技术有限责任公司生产).
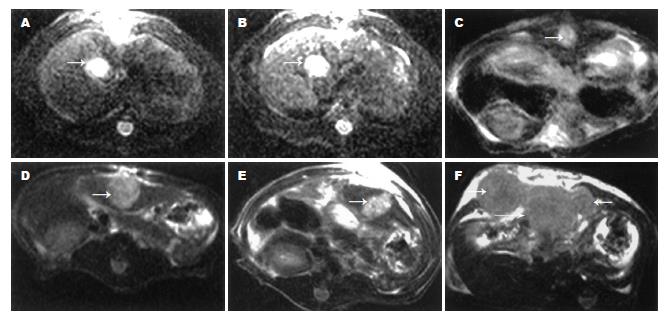
只于1只大鼠胁部sc含107/L肿瘤细胞腹水0.5 mL, 1 wk后长出直径约2.0 cm左右的肿瘤结节. 肝癌移植术参照文献[4]进行: 将携带母瘤动物处死后取出瘤结节, 选择新鲜活组织部分切取约1.5 mm3的小瘤块, 植入另外30只大鼠肝左叶包膜下. 移植术后12 d时, 行MRI测量肿瘤术前体积V1. 选择腕部小线圈, T1WI: SE序列, TR 450 ms, TE 12 ms; T2WI: TSE序列, TR 2 800 ms, TE 96 ms; 层厚2.0 mm, 矩阵192×256, 无间距横断面扫描. 利用公式V = 0.5×d1×d22计算肿瘤体积(d1: 肿瘤最大径, d2: 与之呈垂直方向的最小径)[5]V1. 将载瘤大鼠随机分为3组, 于解剖显微镜下经大鼠胃十二指肠动脉逆行插管至肝动脉并进行以下介入治疗方案:A组(GRGDSP+TACE, n = 10), 灌注GRGDSP 250 mg/100 mL+MMC 50 mg/50 mL+UFLP 50 mL+GF 25 mg/25 mL; B组(单纯TACE, n = 10), 灌注MMC 50 mg/50 mL+UFLP 50 mL+GF 25 mg/25 mL; C组(生理盐水组, n = 10), 灌注生理盐水0.2 mL. 介入治疗12 d后, 再次行MRI检查, 测得肝肿瘤体积V2, 并计算肿瘤治疗前后的体积变化V2/V1.
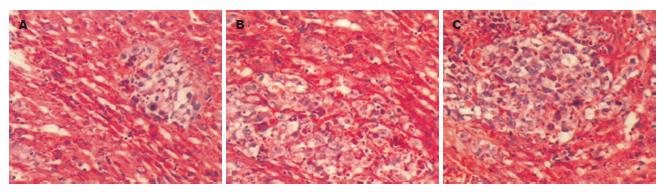
1.2.1 病理学检查: MRI复查后处死大鼠, 取出肿瘤组织及其后上方5 mm范围肝组织. 先行大体观察计算肿瘤组织的坏死率(坏死最大切面经线乘积占肿瘤最大切面经线乘积的比例), 再用40 g/L甲醛固定, 石蜡包埋, 于各标本中央切片一张行HE染色. 光学显微镜(以下简称光镜)下寻找肝组织切片中所有转移灶, 并根据肿瘤细胞数目进行分级、计数(200倍光镜下). 分级标准参照文献[6], 即根据肿瘤细胞数进行:Ⅰ级<25; 25<Ⅱ级<50; 50<Ⅲ级<100; Ⅳ级>100, 巨大转移灶Ⅳ级的倍数计算, 总转移灶数 =Ⅰ级(结节数)×1+Ⅱ级×2+Ⅲ级×3+Ⅳ级×4.
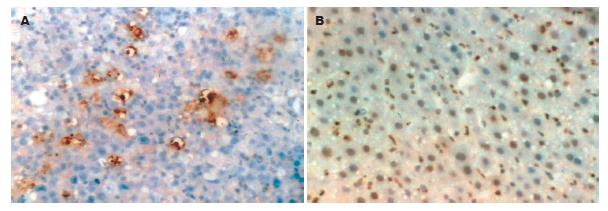
1.2.2 免疫组织化学检查: 采用链霉亲合素-生物素-酶复合物法(strept avidin-biotin comples, SABC)行Ⅷ因子免疫组化染色, 按试剂盒说明书步骤进行. Ⅷ因子阳性表达为内皮细胞质呈棕黄色着色. 选取切片中阳性颗粒清晰、无非特异性背景着色、并能反映该切片染色强度的部位为代表性部位, 在200倍视野下测量阳性表达细胞的平均吸光度(A), 取其均值代表微血管密度(microvessel density, MVD)值. 采用S-P免疫组织化学方法(具体方法参照试剂的说明进行), 用PBS液代替一抗作阴性对照. Ki67阳性主要在细胞核着棕黄色或棕褐色, 其吸光度测量方法同MVD.
统计学处理 采用SPSS 12.0版本统计软件(Chicago, USA)对各组数据及其差异的显著性进行分析, P<0.05为有显著性差异.
除麻醉意外(n = 4), 所有动物均存活, 肝癌移植率为100%, MRI检查均发现肿瘤, 病灶在T1WI上呈均匀稍低信号, 在T2WI上呈均匀中-高信号, 边界较清晰. 存活大鼠肿瘤体积V1与V2分别为A组(n = 9): 89.2±4.6 mm3和394.8±54.1 mm3; B组(n = 8): 87.4±7.3 mm3和 609.4±106.9 mm3; C组(n = 9): 86.1±5.5 mm3和1 114.5±119.0 mm3. 介入治疗后与治疗前肿瘤体积之比V2/V1分别为A组4.4±0.7, B组7.0±1.1, C组13.0±1.7, V2/V1有显著性差异(F = 112.97, P<0.01), 各组间均有显著性差异(P<0.05) (图1).
3组标本大体表现主要是不同程度的坏死和出血. A, B二组标本表面观呈均质鱼肉状, 切面观肿瘤中央区呈较大范围的坏死, 表现为灰黄色豆腐渣样改变, 伴有少量出血; C组标本出血较多, 坏死较轻, 表现为小片坏死区与存活肿瘤组织间隔存在, 直至肿瘤边缘. 光镜下A, B组肿瘤坏死呈凝固性, 表现为一片细颗粒状无结构样物质, 与存活肿瘤组织界限较为清楚, 坏死组织彻底崩解, 不见组织轮廓, 坏死率见表1; 但C组可见到部分轮廓可以识别的细胞结构. 介入治疗后各组瘤旁5 mm肝组织内转移灶数分别为A组4.89±1.25, B组6.63±1.60, C组7.22±1.92; 总体存在显著性差异(F = 5.04, P<0.05), A组与B, C组间均存在显著性差异(P<0.05), 而B, C两组间无显著性差异(图2).
| 分组 | n | 肿瘤坏死率 (%) | Ⅷ因子 (MVD) | Ki67 |
| A组 | 9 | 60.33±4.68 | 0.18±0.02 | 0.21±0.04 |
| B组 | 8 | 55.80±5.23a | 0.22±0.02a | 0.30±0.06a |
| C组 | 8 | 32.56±4.84a | 0.23±0.02a | 0.38±0.05ab |
| F值 | 76.15 | 15.68 | 25.81 | |
| P值 | <0.01 | <0.01 | <0.01 |
迄今为止, TACE是目前治疗不可切除性肝癌的首选方案, 但术后肝肿瘤的转移和复发始终影响着介入治疗的疗效和患者的远期生存率. 而肿瘤的浸润和转移是一个多步骤的复杂过程, 包括: (1)肿瘤细胞表面的上皮黏连素(E-cadherin)表达减少或异常, 引起细胞间黏附力降低而脱黏附[7]; (2)肿瘤细胞在其表面整合素介导下黏附于细胞外基质(extracellular matrix, ECM)[8-10]; (3)细胞外基质在蛋白溶解酶(如基质金属蛋白酶, matrix metalloproteinase, MMPs)的作用下发生降解[11]; (4)肿瘤细胞在趋化因子的作用下于基底膜缺损处移出. 针对上述不同的环节进行阻断, 都有可能预防肿瘤的浸润和转移. 整合素为细胞表面的一类受体分子, 基本功能是介导细胞间或细胞与ECM间的黏附, 肿瘤细胞表面常有异常表达. 在生理和病理过程中, 他们调节细胞的生长、分化、迁移、增殖和凋亡、炎症反应、淋巴细胞归巢、血管生成及血栓形成等过程[12], 发挥着重要生物学功能; 而在肿瘤生长和转移中又发挥着如下作用[8-10,13,14]: (1)介导肝癌细胞黏附于细胞外基质成分, 如纤维黏连蛋白、层黏连蛋白、玻璃黏连蛋白及胶原蛋白等; (2)介导趋化、迁移活性; (3)通过介导细胞-底物间的黏附抑制钙黏蛋白介导的肿瘤细胞间的黏附; (4)参与肿瘤血管生成(主要是通过αvβ3). 其黏附功能是通过识别配体ECM中特异的RGD序列(Gly-Arg-Gly, 精氨酸-甘氨酸-天冬氨酸)并与之结合完成的, 而RGD是广泛存在于ECM中并能够为整合素分子识别的最主要氨基酸序列. 针对不同的整合素使用相应的单克隆抗体亦可起到抗肿瘤细胞黏附的作用, 但因易于在体内产生抗抗体, 不容易穿过血管壁到达作用部位[15], 且整合素种类较多等因素, 某一单克隆抗体作用有限. RGD肽是含RGD序列的一类外源性生物肽, 能够与ECM中RGD序列竞争性结合整合素, 从而相应地抑制整合素介导的一系列功能[16,17]. 因此, RGD肽可以看作是一种广谱的整合素拮抗剂.
但RGD也有不足之处: 在体内迅速经肾脏清除, 需要注射毫克剂量才能抑制动物实验中的肿瘤转移[18,19]. 正因为如此, 此类药物多年来一直停留在实验阶段而未应用于临床, 针对这一问题, 国内外学者尝试了RGD肽的各种结合物如与聚乙二醇及脂质体结合, 以延长其在体内作用时间及增加稳定性[19-21]. 我们利用介入化疗栓塞途径给药的优势(即提高局部药物浓度并延长作用时间), 采取经肝动脉灌注GRGDSP联合TACE, 既是在介入治疗肝癌肝内转移方面的一个尝试, 又是对RGD肽给药新途径的积极探索. GRGDSP作为一种人工合成的线性RGD肽, 具有抑制肿瘤细胞黏附、肿瘤血管内皮细胞的黏附和迁移的作用[16,17,22-24], 研究[25]表明, RGD肽在体外能够抑制Walker-256细胞对纤维母细胞周围ECM的黏附和迁移. 针对临床上TACE术后肿瘤易于复发转移的问题, 我们利用GRGDSP能抑制肿瘤转移的特点, 经肝动脉局部灌注GRGDSP, 使GRGDSP在肝肿瘤内局部药物浓度增高以增强其疗效, 同时结合临床上所常用的TACE介入治疗肝癌的方案, 以期产生协同作用而增强介入治疗大鼠肝恶性肿瘤的总体疗效. 实验结果显示: 经多种方案的介入治疗后, V2/V1值为A组4.4±0.7, B组7.0±1.1, C组13.0±1.7, 各组间V2/V1均有显著性差异(P<0.05); 瘤周5 mm肝组织内转移灶数分别为A组4.89±1.25, B组6.63±1.60, C组7.22±1.92; A组与B, C组均存在显著性差异(P<0.05), 而B, C两组无显著性差异. 以上结果表明, 经肝动脉灌注GRGDSP联合TACE, 与单纯TACE和普通对照组相比, 能够显著减少肝内转移, 并能明显抑制大鼠移植性肝肿瘤的生长速度. 同时实验结果还表明, 单纯TACE与普通对照组相比, 可明显抑制肝肿瘤的生长, 并不能有效抑制肝肿瘤肝内转移.
肿瘤的生长和转移很大程度上取决于自身的增殖与坏死和凋亡的比例, 这些又与新生血管生成密切相关[26]. TACE治疗原理是通过栓塞血管使肿瘤坏死及化疗药诱导的增生抑制和凋亡增加. MVD是目前用以衡量肿瘤新生血管生成程度的常用指标, 在一定程度上间接预测残存肿瘤细胞的生存、生长、侵袭及转移能力; Ki67是细胞增生相关的细胞核抗原, 出现在细胞周期各活性阶段中, 如G1, S, G2, M期, 而不出现在G0期, 是反映被检测组织的生长分数的良好指标[27], 在一定程度上间接预测残存肿瘤细胞的增殖活性. 实验结果显示, GRGDSP联合TACE组Ⅷ因子(MVD)和Ki67吸光度较另两组显著减少(P<0.05), 而单纯TACE组较普通对照组显著减少了Ki67表达(P<0.05), Ⅷ因子(MVD)吸光度无显著性差异, 即GRGDSP联合TACE组显著抑制了肿瘤组织血管生成和肿瘤细胞增殖, 而TACE组与普通对照组相比有显著抑制肿瘤细胞增殖的作用; 在肿瘤坏死方面, 联合治疗组与TACE组无明显差异, 但均高于普通对照组(P<0.05). 以上结果表明GRGDSP联合TACE抑制肿瘤转移, 原因可能有RGD肽抑制了肿瘤血管生成; 而抑制肿瘤生长的部分原因是抑制了肿瘤血管生成和残存肿瘤细胞的增殖活性. 说明经肝动脉灌注GRGDSP联合TACE方案是有效的RGD肽给药途径. 该方案抑制肿瘤血管生成和肿瘤细胞增殖可能是GRGDSP抑制了整合素的相关功能, 因为后者具有介导肿瘤血管生成、调节肿瘤细胞增生和抑制其凋亡的作用[28-30]. 本实验证实经肝动脉灌注GRGDSP联合TACE治疗大鼠移植性肝肿瘤疗法的有效性和安全性, 同时具有抑制肿瘤转移和生长的作用, 其可能机制有抑制肿瘤血管生成和抑制肿瘤细胞增殖. 针对临床上接受介入治疗的肝癌患者后期肝内外转移的普遍现象, 该方案将有着深远的意义. 本实验方法具有广阔的临床应用前景, 有望成为肝癌综合介入治疗的一个新内容.
经肝动脉化疗栓塞术(TACE)是目前被公认为治疗不可切除性肝癌的一种重要手段, 但肝癌患者的生存期并未因此得到明显的延长, 其主要原因之一是TACE术后残癌的复发和转移; 另一方面, 肿瘤转移是肿瘤治疗学中的一个重要课题, 有许多研究试图从肿瘤转移的各个步骤中阻断这一过程, 其中RGD肽阻断肿瘤细胞黏附基底膜过程是目前研究一个热点.
本文研究领域中的研究热点、重点是尝试解决TACE治疗肝癌中的转移问题, 这一问题是肝癌介入治疗中常见并且难以解决又似乎被忽视的问题, 长期地制约着TACE这一治疗手段对肝癌治疗的远期疗效, 也影响着肿瘤介入放射学的发展.
1 孙婧, 周信达, 刘银坤, 汤钊猷, 施建英, 鲍为华,薛琼. 抗黏附药物对裸鼠人肝癌转移复发防治的实验研究. 中华消化杂志 2000; 20: 53-54
2 高进, 刘玉琴. 肿瘤侵袭转移研究百年回顾与思考. 中华肿瘤杂志2004; 26: 444-446
1 本文首次在介入放射学领域探讨肿瘤转移预防性治疗问题.
2 对抑制肿瘤转移疗效确切但在生物体内代谢较快而不稳定的RGD肽类药物, 采取经肝动脉途径给药, 是利用介入放射学的优势探讨该药恰当的给药途径.
3 比较了RGD肽对肿瘤生长的抑制作用, 从新的理论角度探讨了对肿瘤介入治疗的机制.
本文是介入放射学学科对治疗介入治疗肝癌肝内转移问题的初步探讨, 也是对抗肿瘤转移药RGD肽的最佳给药途径的一次有意义的尝试, 在理论上均具有开拓性价值. 如在临床实践中具有类似的作用, 则将大大提高肝癌患者的远期生存率, 也是对学科理论研究和临床发展的一大贡献.
TACE, 即transarterial chemoembolization, TACE, 经肝动脉化疗栓塞术.
GRGDSP, 即Gly-Arg-Gly-Asp-Ser-Pro, 甘氨酸-精氨酸-甘氨酸-天冬氨酸-丝氨酸-脯氨酸.
肝癌是严重威胁人民生命健康的疾病之一, TACE是治疗失去手术机会肝癌患者的最主要介入治疗手段, 但是转移问题是其难以提高远期生存率的主要因素之一. 本文采取TACE途径并联合灌注抗肿瘤转移药物GRGDSP, 通过病理检查证实了该法对大鼠肝肿瘤肝内转移的抑制作用, 同时发现了GRGDSP对肿瘤生长的抑制作用, 并从血管生成和肿瘤细胞增生方面探讨了TACE联合GRGDSP治疗肿瘤的机制.
电编:张敏 编辑:潘伯荣 审读:张海宁
| 1. | Qian J, Feng GS, Vogl T. Combined interventional therapies of hepatocellular carcinoma. World J Gastroenterol. 2003;9:1885-1891. [PubMed] |
| 2. | Ferrari FS, Stella A, Gambacorta D, Magnolfi F, Fantozzi F, Pasquinucci P, Civeli L, Pieraccini M. Treatment of large hepatocellular carcinoma: com-parison between techniques and long term results. Radiol Med (Torino). 2004;108:356-371. [PubMed] |
| 3. | Chen XM, Luo PF, Lin HH, Zhou ZJ, Shao PJ, Fu L, Li WK. Long-term result of combination of tran-scatheter arterial chemoembolization and percu-taneous ethanol injection for treatment of hepato-cellular carcinoma. Ai Zheng. 2004;23:829-832. [PubMed] |
| 4. | 钱 骏, 冯 敢生, Jochen T, Philippe P, Peter H, Claus C. 同种移植大鼠肝细胞癌模型的建立及其磁共振表现. 中华放射学杂志. 2002;36:455-458. |
| 5. | Carlsson G, Gullberg B, Hafstrom L. Estimation of liver tumor volume using different formulas - an experimental study in rats. J Cancer Res Clin Oncol. 1983;105:20-23. [PubMed] |
| 7. | Shimoyama Y, Hirohashi S. Cadherin intercellular adhesion molecule in hepatocellular carcinomas: loss of E-cadherin expression in an undifferentiated carcinoma. Cancer Lett. 1991;57:131-135. [PubMed] |
| 8. | Torimura T, Ueno T, Kin M, Ogata R, Inuzuka S, Su-gawara H, Kurotatsu R, Shimada M, Yano H, Kojiro M. Integrin alpha6beta1 plays a significant role in the attachment of hepatoma cells to laminin. J Hepatol. 1999;31:734-740. [PubMed] |
| 9. | Masumoto A, Arao S, Otsuki M. Role of beta1 inte-grins in adhesion and invasion of hepatocellular carcinoma cells. Hepatology. 1999;29:68-74. [PubMed] |
| 10. | Torimura T, Ueno T, Kin M, Harad R, Nakamura T, Sakamoto M, Kumashiro R, Yano H, Kojiro M, Sata M. Laminin deposition to type IV collagen enhances haptotaxis, chemokinesis, and adhesion of hepatoma cells through beta1-integrins. J Hepatol. 2001;35:245-253. [PubMed] |
| 11. | Chenard MP, Lutz Y, Mechine-Neuville A, Stoll I, Bellocq JP, Rio MC, Basset P. Presence of high levels of MT1-MMP protein in fibroblastic cells of human invasive carcinomas. Int J Cancer. 1999;82:208-212. [PubMed] |
| 13. | Genda T, Sakamoto M, Ichida T, Asakura H, Hiro-hashi S. Loss of cell-cell contact is induced by integrin-mediated cell-substratum adhesion in highly-motile and highly-metastatic hepatocellular carcinoma cells. Lab Invest. 2000;80:387-394. [PubMed] |
| 15. | Molema G, de Leij LF, Meijer DK. Tumor vascular en-dothelium: barrier or target in tumor directed drug delivery and immunotherapy. Pharm Res. 1997;14:2-10. [PubMed] |
| 16. | Tsuchiya Y, Sawada S, Tsukada K, Saiki I. A new pseudo-peptide of Arg-Gly-Asp (RGD) inhibits intra-hepatic metastasis of orthotopically implanted murine hepatocellular carcinoma. Int J Oncol. 2002;20:319-324. [PubMed] |
| 17. | Wu ZZ, Li P, Huang QP, Qin J, Xiao GH, Cai SX. Inhibition of adhesion of hepatocellular carcinoma cells to basement membrane components by receptor competition with RGD - or YIGSR-containing synth-etic peptides. Biorheology. 2003;40:489-502. [PubMed] |
| 20. | Saiki I, Yoneda J, Igarashi Y, Aoki M, Kusunose N, Ono K, Azuma I. Antimetastatic activity of polymeric RGDT peptides conjugated with poly(ethylene glycol). Jpn J Cancer Res. 1993;84:558-565. [PubMed] |
| 21. | Oku N, Tokudome Y, Koike C, Nishikawa N, Mori H, Saiki I, Okada S. Liposomal Arg-Gly-Asp analogs effectively inhibit metastatic B16 melanoma coloni-zation in murine lungs. Life Sci. 1996;58:2263-2270. [PubMed] |
| 22. | Sheu JR, Lin CH, Peng HC, Huang TF. Triflavin, an Arg-Gly-Asp-containing peptide, inhibits the adhesion of tumor cells to matrix proteins via binding to multiple integrin receptors expressed on human hepatoma cells. Proc Soc Exp Biol Med. 1996;213:71-79. [PubMed] |
| 23. | Takayama T, Suzuki N, Narukawa M, Goldberg HA, Otsuka K, Ito K. Enamel matrix derivative is a potent inhibitor of breast cancer cell attachment to bone. Life Sci. 2005;76:1211-1221. [PubMed] |
| 24. | Joshi P, Chung CY, Aukhil I, Erickson HP. Endothe-lial cells adhere to the RGD domain and the fibrinogen-like terminal knob of tenascin. J Cell Sci. 1993;106:389-400. [PubMed] |
| 25. | Madeja Z, Sroka J. Contact guidance of Walker carcinosarcoma cells by the underlying normal fibroblasts is inhibited by RGD-containing synthetic peptides. Folia Histochem Cytobiol. 2002;40:251-260. [PubMed] |
| 26. | Weidner N. Tumor angiogenesis: review of current applications in tumor prognostication. Semin Diagn Pathol. 1993;10:302-313. [PubMed] |
| 27. | Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown. J Cell Physiol. 2000;182:311-322. [PubMed] |
| 28. | Zhang H, Ozaki I, Mizuta T, Yoshimura T, Matsuha-shi S, Hisatomi A, Tadano J, Sakai T, Yamamoto K. Mechanism of beta 1-integrin-mediated hepatoma cell growth involves p27 and S-phase kinase-associ-ated protein 2. Hepatology. 2003;38:305-313. [PubMed] |
| 29. | Zhang H, Ozaki I, Mizuta T, Yoshimura T, Matsu-hashi S, Eguchi Y, Yasutake T, Hisatomi A, Sakai T, Yamamoto K. Transforming growth factor-beta 1-induced apoptosis is blocked by beta 1-integrin-mediated mitogen-activated protein kinase activa-tion in human hepatoma cells. Cancer Sci. 2004;95:878-886. [PubMed] |
| 30. | Buerkle MA, Pahernik SA, Sutter A, Jonczyk A, Messmer K, Dellian M. Inhibition of the alpha-nu integrins with a cyclic RGD peptide impairs angiogenesis, growth and metastasis of solid tumo-urs in vivo. Br J Cancer. 2002;86:788-795. [PubMed] |