修回日期: 2004-10-06
接受日期: 2004-10-11
在线出版日期: 2005-02-15
目的: 探讨脱嘌呤/脱嘧啶核酸内切酶(apurinic/apyrimidinic endonuclease, Ape1), 又称氧化还原因子(redox factor-1, Ref-1)在肝细胞性肝癌(HCC)的表达特点及其与临床病理因素的关系.
方法: 应用免疫组化S-P法分别检测正常肝组织10例、结节性肝硬化组织40例和HCC103例组织中Ape1表达情况.
结果: 在HCC组织中Ape1在细胞核、细胞质均可表达, 其中细胞核/细胞质联合表达(49.5%)显著高于结节性肝硬化组(20%)和正常对照组(0%)(P<0.01).Ape1细胞核和细胞质阳性分度在正常组、肝硬化组、HCC组之间依次增高, 并与HCC组织学分级有密切关系(P<0.01或0.05).
结论: 癌细胞过度表达Ape1蛋白可作为判断肝癌组织学分级的有用指标之一. Ape1基因在HCC的发生、发展中可能具有重要作用.
引文著录: 张沁宏, 肖华亮, 李增鹏, 仲召阳, 何怡, 卿毅, 王东. 肝细胞癌组织中DNA损伤修复基因APE1表达意义. 世界华人消化杂志 2005; 13(4): 508-511
Revised: October 6, 2004
Accepted: October 11, 2004
Published online: February 15, 2005
AIM: To explore the expression and clinicopathological relevance of apurinic/apyrimidinic endonuclease (Ape1) in hepatocellular carcinoma (HCC).
METHODS: Ape1 expression was detected by immunohistochemical S-P method in tissues of normal liver (n = 10), hepatocirrhosis (n = 40) and HCC (n = 103).
RESULTS: Three types of Ape1 positive staining were noticed in HCC: nuclear, cytoplasmic and mixed. There were significant more mixed type of Ape1 expression in HCC than in hepatocirrhosis and normal liver (49.5% vs 20%, 0%, P<0.01). The positive degree of Ape1 expression in both nucleus and cytoplasm was significantly higher in HCC than that in hepatocirrhosis and normal liver, and higher in hepatocirrhosis than that in normal liver (P<0.01). The positive expression of Ape1 was correlated with the histological grade of HCC (P<0.05).
CONCLUSION: Overexperssion of Ape1 in neoplastic cells might be a useful marker in evaluating histological grade of HCC. Ape1 gene may play an important role in tumorigenesis and progression of HCC.
- Citation: Zhang QH, Xiao HL, Li ZP, Zhong ZY, He Y, Qing Y, Wang D. Expression of apurinic/apyrimidinic endonuclease 1 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 508-511
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/508.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.508
肝细胞性肝癌(hepatocellular carcinoma, HCC)是我国最常见的恶性肿瘤之一, 研究表明, DNA损伤修复机制与多种肿瘤的发生、发展以及预后有关[1], 而且其中某些重要的因子很可能成为未来治疗肿瘤的靶向分子. 脱嘌呤/脱嘧啶核酸内切酶(apurinic/apyrimidinic endonuclease, Ape1), 又称氧化还原因子(redox factor-1, Ref-1)是一个多功能的DNA碱基切除修复途径(base excision repair, BER)的限速酶, 是细胞DNA放射性损伤和烷化剂致伤重要的修复因子[2]. 通过碱基切除修复机制, Ape1可以修复细胞内大量存在的嘌呤嘧啶缺失位点. 这种位点具有细胞毒性及基因毒性, 如不能修复, 将导致基因突变、染色体微卫星不稳定或细胞凋亡. 此外, Ape1还具有氧化还原功能(reduction-oxidation, redox), 通过维持细胞内多种转录因子的激活还原态, 而参与多种关键的细胞反应, 如氧化应激, 转录因子调节, 细胞周期控制与凋亡. 已报道受Ape1调控的转录因子包括p53, HIF-1α, NF-κB, Fos/Jun(AP-1), ATF/CREB家族, PAX-8等[3-4].Ape1在多种肿瘤中均可见高表达[5-7], 但在HCC组织中表达情况以及其在HCC发生、发展过程中的作用国内外尚未见报道. 为此, 我们采用免疫组化技术检测了Ape1在103例HCC的表达情况, 旨在探讨其与HCC临床病理特征的关系.
我院病理科1991-2004年存档, 经病理学诊断为HCC的手术切除标本103例. 年龄25-77(平均45.5)岁; 男93例, 女10例, 伴肝硬化30例, 占29.1%; 血清HBsAg阳性81例, 占78.6%.术前均无化、放疗. 根据国际抗癌联盟(UICC)TNM分类: Ⅰ期0例, Ⅱ期38例(36.9%), ⅢA期16例(15.5%), ⅢB期2例(1.9%), ⅣA期36例(34.9%), ⅣB期11例(10.8%).Edmondson及Steiner组织学分级标准: Ⅰ级5例(4.8%), Ⅱ级27例(26.2%), Ⅲ级56例(54.4%), Ⅳ级15例(14.6%). 另选取结节性肝硬化10例及尸检正常肝组织10例做对照. 标本均经40 g/L甲醛固定, 石蜡包埋, 4 mm厚切片. 兔抗人Ape1 mAb购自Novus Biologicals公司(Litlleton, CO), 工作浓度为1:500; S-P免疫组化试剂盒购自北京中山公司.
采用S-P二步法: 石蜡切片经二甲苯脱蜡, 乙醇梯度水化, 30 mL/L H2O2-甲醇室温10 min, 行微波抗原修复, 800W微波5 min, 200W微波10 min; 滴加一抗, 4 ℃过夜, 二抗50 mL 37 ℃孵育30 min, DAB-H2O2显色, 苏木素复染. 以PBS代替一抗作阴性对照. Ape1免疫组化阳性信号为棕黄色细小颗粒状, 定位于细胞核和/或细胞质. 染色结果参照Mark Kelley实验室的标准[5]进行肿瘤细胞阳性计分. 首先在高倍镜下计数1 000个肿瘤细胞, 避开肿瘤边缘及坏死区域, 根据阳性瘤细胞数目所占百分比得出细胞核或细胞质标记指数(labeling index, LI), 即细胞核或细胞质 LI = 阳性瘤细胞数/1 000个瘤细胞100%.分为以下四级计分: Ⅰ: 0分, <10%; Ⅱ: 1分, 11-25%; Ⅲ: 2分, 26-50%; Ⅳ: 3分, 51%以上. 染色强度按瘤细胞着色的深浅计分: 0分, 阴性; 1分, 弱阳性; 2分, 中等阳性; 3分, 强阳性. 将2个分值相加即得出该例标本的免疫组化阳性分度: 0-1分为阴性, 记为(-); 2-4分为弱阳性, 记为(+); 5分以上为阳性, 记为(++).
统计学处理 采用SPSS10.0统计软件进行χ2检验.
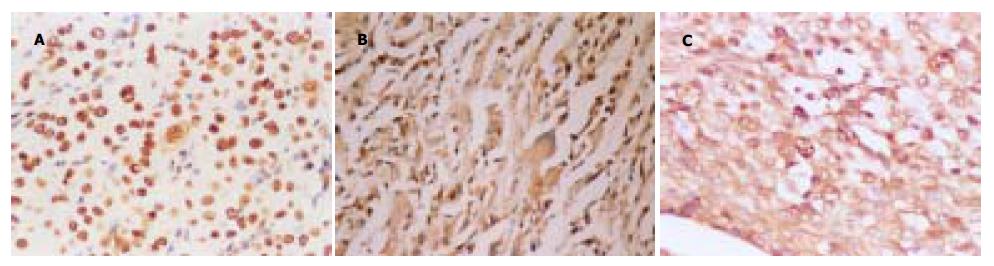
Ape1在HCC组织中, 细胞核和/或细胞质均可见表达, 其中单纯性细胞核表达48例(占46.6%, 图1A), 细胞核/细胞质联合表达51例(占49.5%, 图1C), 单纯性细胞质表达4例(占3.9%, 图1B).HCC周围肝硬化组织及单纯性肝硬化组织40例, 单纯性细胞核表达25例(62.5%), 细胞核/细胞质联合表达8例(20%).Ape1在正常肝脏组织仅在细胞核可见表达, 共计4例阳性(40%).Ape1细胞核表达共计77例, 占50.3%, 这一表达方式在HCC组、肝硬化组及正常对照组相互间两两比较均无显著差异. Ape1细胞核/细胞质联合表达共计59例(占38.6%), 在HCC组与肝硬化组中Ape1细胞核/细胞质表达明显高于正常对照组, 且HCC组与肝硬化组比较也具有显著差异(P = 0.000<0.01).Ape1细胞质表达仅有4例(占2.6%), 样本资料太小, 未行c 检验, 但这一表达方式却只出现于HCC组中, 具有提示意义(表1).
| 组织类型 | n | 细胞核 | 细胞质 | 细胞核/细胞质 |
| 正常肝 | 10 | 4(40) | 0 | 0 |
| 肝硬化 | 40 | 25(62.5) | 0 | 8(20) |
| HCC | 103 | 48(46.6) | 4(3.9) | 51(49.5) |
| 合计 | 153 | 77(50.3) | 4(2.6) | 59(38.6) |
Ape1细胞核阳性分度在正常组、肝硬化组、HCC组中呈依次递增趋势, 经χ2检验有显著差异(P = 0.000<0.01).Ape1细胞质阳性分度在正常组、肝硬化组、HCC组中同样呈依次递增趋势, 经χ2检验也具有显著差异(P = 0.000<0.01, 表2, 图2).Ape1表达与年龄、性别、肿瘤大小、TNM分级无关. HCC中血清学检查HBsAg阳性患者Ape1表达与HBsAg阴性患者比较无显著差异. 组织学分级中, Ⅲ-Ⅳ级Ape1细胞核和细胞质阳性分度较Ⅰ-Ⅱ级均有显著增高(核P = 0.026<0.05; 质P = 0.001<0.01, 表3).
| 组织类型 | n | 细胞核 | P值 | 细胞质 | P值 | ||||
| - | + | ++ | - | + | ++ | ||||
| 正常肝 | 10 | 6 | 4 | 0 | 10 | 0 | 0 | ||
| 肝硬化 | 40 | 7 | 15 | 18 | 32 | 8 | 0 | ||
| HCC | 103 | 4 | 19 | 80 | <0.01 | 48 | 36 | 19 | <0.01 |
人体细胞, 乃至所有生物细胞都存在着DNA损伤修复系统, 这是细胞维持自身基因组稳定性最重要的防御和保护机制. 内源和环境的诸多因素, 包括电离辐射、UV射线、氧自由基、水解以及烷化类化疗药物都可直接损伤DNA[8]. 脱嘌呤/脱嘧啶位点(AP位点)是DNA损伤的最主要的形式[9], 在正常生理情况下, 每天每个细胞科产生10-20 000个脱嘌呤位点和500个脱嘧啶位点. AP位点可阻断DNA复制, 引起基因突变或遗传不稳定性, 具有细胞毒和基因毒作用. 已知直接转录、错配修复、核酸切除修复以及碱基切除修复等多种修复途径参与基因损伤的修复. Ape1是DNA碱基切除修复途径的一个起关键作用的限速酶, 能与AP位点结合, 通过Mg2+依赖的核酸内切酶作用, 水解AP位点5'端, 形成3'-OH端和5'-脱氧核苷[10], 为下一步碱基切除修复创造了必要条件. 此外, Ape1还具有氧化还原功能, 他能通过调节转录因子来激活多种肿瘤基因产物的活性, 如c-Jun, c-Fos, c-Myb以及Pax蛋白[11-12]. 在人体骨肉瘤[5]、卵巢癌[13]等多种肿瘤中都发现Ape1过高表达. 多数研究表明, Ape1表达定位的改变以及表达强度的变化很可能是细胞表型异常的决定因素.
在正常肝细胞中, Ape1蛋白可呈弱表达[2], 但在肝癌细胞中尚未见报道. 本结果显示, Ape1蛋白在HCC组织中可呈现3种表达方式: 细胞核表达、细胞核/细胞质联合表达、细胞质表达. 这种表达方式的多样性与绝大多数蛋白表达的单一性明显不同. 为明确这种表达多样性的意义, 我们将HCC组织与肝硬化组织及正常肝组织的Ape1表达做了对比, 发现3种表达方式中, 单纯性细胞核表达在全部研究对象中最多见(共占52.3%), 且在各自组内也是主要的表达方式(正常组40%, 肝硬化组62.5%, HCC组46.6%), 但这一表达方式在3组间比较并无差异. 而Ape1细胞核/细胞质联合表达虽然只占38.6%, 但这种方式在HCC组中明显增高, 肝硬化组与正常对照组比较也有显著差异(P<0.01). 由于Ape1细胞质表达方式例数太少(仅4例), 样本资料过小而无法进行统计分析, 但这4例全部发生于HCC组中, 与其他两组的零发生率形成鲜明对比, 也具有提示意义. 因此, 我们认为Ape1蛋白在细胞质内出现表达时具有重要意义.
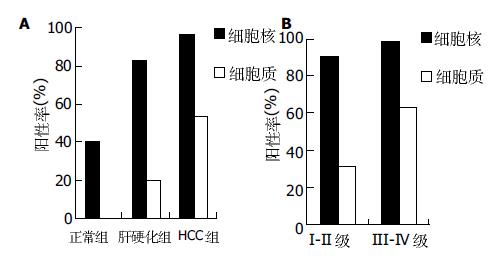
进一步将Ape1细胞核表达和细胞质表达分别进行统计分析. 从Ape1免疫组化阳性分度结果上看, 细胞核阳性分度与细胞质的一致, 二者均随着病程进展(组间比较)或肿瘤恶性程度(组织学分级比较)的增高而增强. 再进一步验证, 对免疫组化阳性分度的四项指标, 即细胞核LI、细胞质LI、细胞核染色强度、细胞质染色强度分别进行统计分析, 发现除细胞核LI外, 其余三项指标在组间比较及肿瘤组织学分级比较中均有显著差异(P<0.01或0.05), 而细胞核LI在仅在HCC组vs正常组、肝硬化组vs正常组比较中有差异, 而在HCC组vs肝硬化组及HCC组织学分级中无统计学意义. 此外, 我们也根据传统的阳性率统计方法进行了分析, 发现细胞核阳性率和细胞质阳性率在正常对照组、肝硬化组、HCC组中均呈递增趋势, 且均存在显著差异(图2A). 但细胞核阳性率在HCC组织学分级之间无统计学意义, 而细胞质阳性率在HCC组织学分级比较中, 随着肿瘤恶性程度的增高而增高(P<0.01, 图2B). 这一结果与免疫组化阳性分度结果略有不同. 因此我们认为, 在Ape1表达分析中, 免疫组化阳性分度统计方法优于阳性率统计方法, 而定位分析比定量分析则更具有病理学意义, 细胞质过度表达Ape1蛋白可能作为肝细胞早期癌变的指标之一.
本研究结果提示, 在HCC发生、发展过程中Ape1蛋白在肝细胞中的表达随着病程进展而增强, 其主要表达方式逐渐由胞核表达向胞质表达过渡, 当细胞质内出现Ape1的强表达时可作为恶性生物学行为的标志.
编辑:潘伯荣 审读:张海宁
| 1. | Loeb KR, Loeb LA. Significance of multiple mutations in cancer. Carcinogenesis. 2000;21:379-385. [PubMed] [DOI] |
| 2. | Evans AR, Limp-Foster M, Kelley MR. Going APE over ref-1. Mutat Res. 2000;461:83-108. [PubMed] [DOI] |
| 3. | Gaiddon C, Moorthy NC, Prives C. Ref-1 regulates the transactivation and pro-apoptotic functions of p53 in vivo. EMBO J. 1999;18:5609-5621. [PubMed] [DOI] |
| 4. | Huang LE, Arany Z, Livingston DM, Bunn HF. Activation of hypoxia-inducible transcription factor depends primarily upon redox-sensitive stabilization of its alpha subunit. J Biol Chem. 1996;271:32253-32259. [PubMed] [DOI] |
| 5. | Wang D, Luo M, Kelley MR. Human apurinic endonuclease 1 (APE1) expression and prognostic significance in osteosarcoma: enhanced sensitivity of osteosarcoma to DNA damaging agents using silencing RNA APE1 expression inhibition. Mol Cancer Ther. 2004;3:679-686. [PubMed] |
| 6. | Puglisi F, Barbone F, Tell G, Aprile G, Pertoldi B, Raiti C, Kelley MR, Damante G, Sobrero A, Beltrami CA. Prognostic role of Ape/Ref-1 subcellular expression in stage I-III breast carcinomas. Oncol Rep. 2002;9:11-17. [PubMed] |
| 7. | Kakolyris S, Giatromanolaki A, Koukourakis M, Kaklamanis L, Kanavaros P, Hickson ID, Barzilay G, Georgoulias V, Gatter KC, Harris AL. Nuclear localization of human AP endonuclease 1 (HAP1/Ref-1) associates with prognosis in early operable non-small cell lung cancer (NSCLC). J Pathol. 1999;189:351-357. [PubMed] [DOI] |
| 8. | Kakolyris S, Kaklamanis L, Engels K, Fox SB, Taylor M, Hickson ID, Gatter KC, Harris AL. Human AP endonuclease 1 (HAP1) protein expression in breast cancer correlates with lymph node status and angiogenesis. Br J Cancer. 1998;77:1169-1173. [PubMed] [DOI] |
| 9. | Mol CD, Hosfield DJ, Tainer JA. Abasic site recognition by two apurinic/apyrimidinic endonuclease families in DNA base excision repair: the 3' ends justify the means. Mutat Res. 2000;460:211-229. [PubMed] [DOI] |
| 10. | Demple B, Harrison L. Repair of oxidative damage to DNA: enzymology and biology. Annu Rev Biochem. 1994;63:915-948. [PubMed] [DOI] |
| 11. | Fritz G. Human APE/Ref-1 protein. Int J Biochem Cell Biol. 2000;32:925-929. [PubMed] [DOI] |
| 12. | Tell G, Scaloni A, Pellizzari L, Formisano S, Pucillo C, Damante G. Redox potential controls the structure and DNA binding activity of the paired domain. J Biol Chem. 1998;273:25062-25072. [PubMed] [DOI] |
| 13. | Tanner B, Grimme S, Schiffer I, Heimerdinger C, Schmidt M, Dutkowski P, Neubert S, Oesch F, Franzen A, Kölbl H. Nuclear expression of apurinic/apyrimidinic endonuclease increases with progression of ovarian carcinomas. Gynecol Oncol. 2004;92:568-577. [PubMed] [DOI] |