修回日期: 2004-12-02
接受日期: 2004-12-08
在线出版日期: 2005-02-15
目的: 对人胎肝干细胞进行体外分离、培养与鉴定, 为其在生物人工肝及肝细胞移植方面的应用奠定基础.
方法: 取16-29周龄死产人胚胎肝脏, 参照本室建立的方法对胎肝干细胞进行分离. 所获细胞悬液用50 g反复离心, 沉淀物用F12培养液悬浮细胞; 将细胞悬液加入Percoll液进行梯度离心, 吸取50%与70% Percoll层之间的细胞层, 用Hanks液洗涤两次后离心. 将细胞团悬浮于DMEM/F12(2:1)培养液中, 接种于塑料培养瓶或六孔培养板中; 在37 ℃ 50 mL/L CO2孵箱中培养. 采用免疫组织化学法鉴定细胞表型.
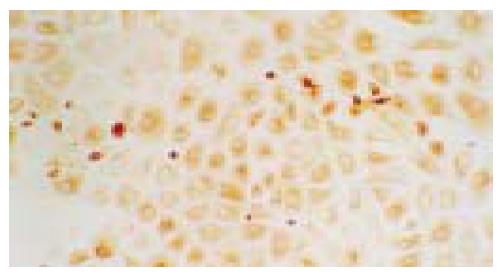
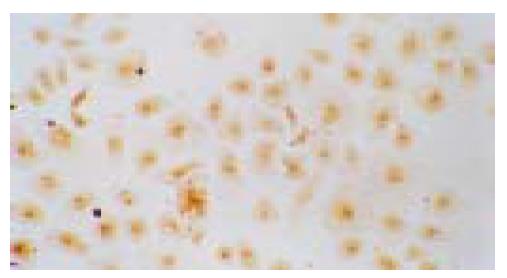
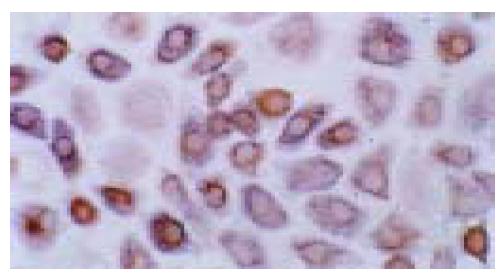
结果: 原代细胞呈圆形或卵圆形, 体积明显小于肝细胞, 胞核大而胞质少, 核浆比较小, 培养中细胞生长旺盛. 培养的细胞胞质CK19, OV6及白蛋白染色均呈阳性; 部分细胞胞质同时表达白蛋白和CK19.
结论: 人胚胎肝脏中存在在肝干细胞, 这些细胞表现出不同的分化状态.
引文著录: 毛海洲, 陈耀凯, 王宇明, 张磊, 刘国栋. 人胎肝干细胞的体外分离培养与鉴定. 世界华人消化杂志 2005; 13(4): 452-455
Revised: December 2, 2004
Accepted: December 8, 2004
Published online: February 15, 2005
AIM: To isolate, culture and identify human fetal liver stem cells in vitro to lay a foundation for the application of these cells in bioartificial liver support system and hepatocyte transplantation.
METHODS: The fetal liver stem cells were isolated from the liver of dead human fetus. The cell suspension was centrifuged at 50 g. The sediment was resuspended with F12 solution, followed by Percoll gradient centrifugation. The cell layer between 50% and 70% of Percoll was collected, washed, centrifuged, resuspended in DMEM (2:1), and incubated. Immunohistochemistry was used to identify the phenotypes of the cultured cells.
RESULTS: The primary cells were round or oval, much smaller than hepatocytes with larger nucleus and less plasma. These cells grew prosperously in culture medium. The plasma of the cultured cells was positive for CK19, OV6 and albumin staining. Double staining showed that some cells were positive for both albumin and CK19.
CONCLUSION: The liver stem cells exist in the human fetal liver and display various differentiation status.
- Citation: Mao HZ, Chen YK, Wang YM, Zhang L, Liu GD. Isolation, culture and identification of human fetal liver stem cells in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(4): 452-455
- URL: https://www.wjgnet.com/1009-3079/full/v13/i4/452.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i4.452
理论上, 哺乳动物肝脏应由多分化潜能的肝干细胞演变、分化而来, 对大鼠、小鼠等哺乳动物胎肝的研究已证实这一推断[1-16]. 然而有关人胚胎肝脏内可能存在的肝干细胞研究甚少, 新近Malhi et al[17]从人胎肝中分离出一种上皮祖/干细胞(epithelial progenitor/stem cells), 具有很强的集落形成能力, 在培养条件下可增生数月, 且细胞分裂达40次以上后仍保持正常核型, 在联合免疫缺陷小鼠体内可分化为成熟肝细胞, 可见人胚胎肝脏发育过程中必然存在肝干细胞的参与. 鉴于对人胎肝干细胞的研究将为其在生物人工肝及细胞移植方面的应用奠定基础, 我们对人胎肝干细胞进行了体外分离、培养与鉴定.
人胚胎肝脏取自16-29周龄死产人胚胎, 胚胎母亲知情并签署知情同意书. 参照本室建立的方法对胎肝干细胞进行分离[18]. 用前灌液(无钙镁磷酸缓冲液)灌注人胎肝至灰褐色; 在无菌托盘中用37 ℃ 0.5 g/L Ⅳ型胶原酶继续灌注, 直至肝组织完全软化, 肝包膜下组织液化后行钝性撕碎; 37 ℃下震荡、消化15 min后, 三层纱布过滤; 所获细胞悬液先用50 r/min反复离心3次, 上清液再用500 r/min进行反复离心3次, 最后将沉淀物用F12培养液悬浮细胞; 将Percoll(Pharmacia)配成50%, 70%, 90%的梯度离心液, 从离心管底部开始逐层铺加, 细胞悬液置于最上层, 4 ℃ 12 000 g离心30 min; 小心吸取50%与70% Percoll层之间的细胞层, 用Hanks液洗涤2次后离心.
将细胞团悬浮于培养液中, 接种于塑料培养瓶或六孔培养板中, 内置细胞爬片; 在37 ℃ 50 mL/L CO2孵箱中培养, 第2 d换液, 以后隔天换液, 从第2次换液开始加入10 g/L二甲亚砜; 用倒置相差显微镜连续观察并显微摄影记录细胞生长状况. 培养液为DMEM/F12(2:1)和100 mL/L小牛血清或胎牛血清, 含10 mmol/L尼克酰胺(Sigma)、2 mmol/L L-谷胺酰胺(Gibco BRL,Gaithersburg, MD)、20 mmol/L HEPES(Wako, Tokyo)、20 mg/L表皮生长因子(Sigma)、0.2 mmol/L酸式二磷酸维生素C(Sigma)、1 mg/L胰岛素、1×10-7 mmol/L地塞米松、100 kU/L青霉素钠及100 kU/L链毒素.
采用免疫组织化学法鉴定细胞表型. (1)单染色: 细胞爬片漂洗后以40 g/L多聚甲醛溶液固定15 min, 漂洗后移入含0.2 g/L吐温-20的磷酸盐缓冲液中浸泡2 min; 用200 mL/L正常山羊血清37 ℃封闭15 min, 然后加第一抗体工作液4 ℃过夜; 漂洗后移入含0.2 g/L吐温-20的磷酸盐缓冲液中浸泡2 min, 再加生物素标记的第二抗体37 ℃ 45 min; 加结合过氧化物酶链霉亲和素37 ℃ 45 min; 加新鲜配制的DAB, 显微镜下观察5-10 min, 棕黄色染色为阳性信号; 以PBS化替第一抗体作为阴性对照. 单克隆抗体: OV6抗体由美国Brown大学Hixson教授惠赠, 白蛋白抗体为丹麦DAKO公司产品, CK19抗体购自北京中山生物技术有限公司. (2)双染色: HistostainTM-DS双染色试剂盒为北京中山生物技术有限公司产品, 按说明书进行操作. 将细胞爬片浸入过氧化氢溶液中10 min灭活内源性过氧化物酶; 加200 mL/L正常山羊血清37 ℃封闭15 min; 加白蛋白抗体(1:100)孵育; 加通用型生物素化第二抗体孵育10 min; 加链霉卵白素-碱磷酸酶, 孵育10 min; 加酶底物色素混合液, 镜下观察结果, 出现暗紫色后终止反应; 加双染色增强试剂, 孵育30 min; 加正常血清封闭30 min; 加CK19(1:100)孵育; 加通用型生物素化第二抗体孵育10 min; 加过氧化物酶标记的链霉卵白素孵育10 min; 加酶底物色素混合液, 镜下观察显猩红色后中终止反应; 加封片剂覆盖细胞60 ℃ 15 min后封片.
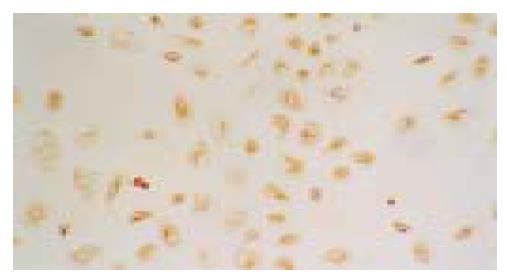
获得的原代细胞呈圆形或卵圆形, 体积明显小于肝细胞, 胞核大而胞质少, 核浆比较小, 细胞存活率大于95%.以2×105/L的终密度接种于培养瓶或六孔培养板.
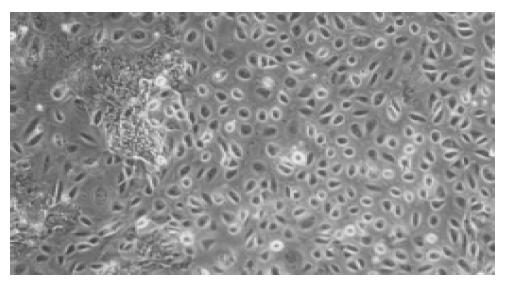
培养中细胞生长旺盛, 1-2 h后细胞开始贴壁并伸展, 12 h后细胞增生明显活跃, 细胞体积有所增大, 细胞形态呈不规则多边或多角形, 细胞间隙逐渐缩小. 3-4 d后出现数个边缘清晰、折光率较高的细胞集落, 随着培养天数的增加, 细胞集落逐渐增大. 5-10 d细胞大部分已融合成片, 细胞间隙缩小, 呈铺路石样改变(图1). 培养瓶中的细胞长满后进行传代培养, 一般可传2-4代. 此后内皮样细胞逐渐占据优势, 培养液中漂浮细胞逐渐增多, 培养液中可见黑色颗粒状物质, 最后大部分细胞开始崩解, 与瓶壁脱离.
有关人胎肝干细胞研究的资料较少, 可供借鉴的经验多来源于动物实验[19-20].Suzuki et al[21]采用荧光激活细胞分类法从小鼠胎肝中分离到一种增生能力很强的细胞, 体外培养时可形成较大集落, 体外存活时间亦大为延长, 提示小鼠胎肝中存在高增生潜能的肝干细胞. Dabeva et al[22]从胚胎14 d(ED14) Fischer344大鼠分离出胎肝上皮细胞(fetal liver epithelial cells, FLECs), 经双标记免疫组化/原位杂交法鉴定, 分离出的细胞存在3个亚群: (1)表达AFP及白蛋白, 但不表达CK19; (2)表达CK19但不表达AFP及白蛋白; (3)同时表达AFP、白蛋白及CK19. 作者将FLEC移植到2/3肝切除的正常F344大鼠及惹卓碱(retrosine)处理的同基因二肽肽酶IV(dipeptidyl peptidase Ⅳ)变异F344大鼠(DPPⅣ(-)), 两种模型中前者肝细胞增生能力正常, 而后者肝细胞增生能力受损. 结果发现, 不同亚群的FLEC在两种模型中的增生、分化及分布存在极大的差异; 在第1种模型中, 移植后1-2 wk仅肝细胞表型FLEC(表达AFP及白蛋白)及胆管表型FLEC(表达CK19)增生, 而在第2种模型中, 发生增生的细胞主要是双表型FLEC(表达AFP、白蛋白及CK19); 移植1 mo后, 侵入肝实质的DPPⅣ(+)双表型FLEC表现为肝细胞表型并形成新的肝索结构, 而靠近胆管的双表型FLEC则表现为胆管上皮细胞表型并形成新的胆管结构或融入原有胆管; 在未行2/3肝切除的对照组中, FLEC不发生增生或分化. 上述结果清楚地显示ED14大鼠胎肝中存在单向分化和双向分化的祖细胞, 他们具有不同的分化增生能力, 其增生、分化与受体肝再生的需求及植入细胞所在的位置有关. Haruna et al[23]研究了人类肝脏发育过程中CK19(胆管细胞表型)及HepPar1(肝细胞表型)的表达及变化. 结果: CK19和HepPar1是肝原基(primordium)中未成熟肝祖细胞最先出现的标志, 在胎龄4 wk时即已出现; 在胎龄8-14 wk期间, 祖细胞持续表达HepPar1及CK19, 但随着肝祖细胞进一步向肝细胞分化, HepPar1表达增加, 而CK19则在胎龄14-16 wk的肝细胞中消失; 随着肝祖细胞进一步向胆管细胞演变, CK19表达增加而HepPar1表达逐渐消失. 以上结果显示人胎肝内存在双向分化的肝祖细胞, 随着其向肝细胞或胆管细胞的分化, 特异性细胞表型亦会发生相应变化.
我们先前在分离大鼠肝卵圆细胞过程中, 根据肝干细胞体积小、质量轻、从本质上属于非实质细胞这一原理, 采用两步法分离大鼠肝卵圆细胞获得较满意的效果[24]. 我们再将以上方法应用于人胎肝干细胞的分离, 首先采用50 g离心力将肝实质细胞分离出去, 然后再采用500 g离心力将非实质细胞沉淀, 最后将肝非实质细胞置于Percoll梯度离心分离液中离心, 位于50%与70%的Percoll层之间的细胞层即为胎肝干细胞层. 肝干细胞同时具有肝细胞与胆管细胞的表型, 我们的结果显示, 部分细胞同时表达白蛋白和CK19的细胞, 结合细胞的形态学特征, 该类细胞属于肝干细胞当无异议. 本结果还显示, 胎肝干细胞的分化状态与分化方向也不尽相同, 表达白蛋白为主的细胞可能属分化接近于成熟肝细胞或具有肝细胞分化倾向者, 而表达CK19为主的细胞可能属分化接近于胆管细胞或具有胆管细胞分化倾向者.
编辑:潘伯荣 审读:张海宁
| 1. | Lavon N, Yanuka O, Benvenisty N. Differentiation and isolation of hepatic-like cells from human embryonic stem cells. Differentiation. 2004;72:230-238. [PubMed] [DOI] |
| 2. | Lee SW, Wang X, Chowdhury NR, Roy-Chowdhury J. Hepatocyte transplantation: state of the art and strategies for overcoming existing hurdles. Ann Hepatol. 2004;3:48-53. [PubMed] |
| 3. | Kim JW, Kim SY, Park SY, Kim YM, Kim JM, Lee MH, Ryu HM. Mesenchymal progenitor cells in the human umbilical cord. Ann Hematol. 2004;83:733-738. [PubMed] [DOI] |
| 4. | Chen AC, Berhow MA, Tappenden KA, Donovan SM. Genistein inhibits intestinal cell proliferation in piglets. Pediatr Res. 2005;57:192-200. [PubMed] [DOI] |
| 5. | Kim JY, Sawada A, Tokimasa S, Endo H, Ozono K, Hara J, Takihara Y. Defective long-term repopulating ability in hematopoietic stem cells lacking the Polycomb-group gene rae28. Eur J Haematol. 2004;73:75-84. [PubMed] [DOI] |
| 6. | Suzuki A, Zheng YW, Fukao K, Nakauchi H, Taniguchi H. Liver repopulation by c-Met-positive stem/progenitor cells isolated from the developing rat liver. Hepatogastroenterology. 2004;51:423-426. [PubMed] |
| 7. | Christensen JL, Wright DE, Wagers AJ, Weissman IL. Circulation and chemotaxis of fetal hematopoietic stem cells. PLoS Biol. 2004;2:E75. [PubMed] [DOI] |
| 8. | Jochheim A, Hillemann T, Kania G, Scharf J, Attaran M, Manns MP, Wobus AM, Ott M. Quantitative gene expressionprofiling reveals a fetal hepatic phenotype of murine ES-derived hepatocytes. Int J Dev Biol. 2004;48:23-29. [PubMed] [DOI] |
| 9. | Suskind DL, Muench MO. Searching for common stem cells of the hepatic and hematopoietic systems in the human fetal liver: CD34+ cytokeratin 7/8+ cells express markers for stellate cells. J Hepatol. 2004;40:261-268. [PubMed] [DOI] |
| 10. | Khosrotehrani K, Johnson KL, Cha DH, Salomon RN, Bianchi DW. Transfer of fetal cells with multilineage potential to maternal tissue. JAMA. 2004;292:75-80. [PubMed] [DOI] |
| 11. | Shirahashi H, Wu J, Yamamoto N, Catana A, Wege H, Wager B, Okita K, Zern MA. Differentiation of human andmouse embryonic stem cells along a hepatocyte lineage. Cell Transplant. 2004;13:197-211. [PubMed] [DOI] |
| 12. | Sembeil R, Sanhadji K, Vivier G, Chargui J, Touraine JL. Prolonged survival of mouse skin allografts after transplantation of fetal liver cells transduced with hIL-10 gene. Transpl Immunol. 2004;13:1-8. [PubMed] [DOI] |
| 13. | Tarasov AI, Petrenko AY, Jones DR. The osmotic characteristics of human fetal liver-derived hematopoietic stem cell candidates. Cryobiology. 2004;48:333-340. [PubMed] [DOI] |
| 14. | Fox IJ, Chowdhury JR. Hepatocyte transplantation. Am J Transplant. 2004;4 Suppl 6:7-13. [PubMed] [DOI] |
| 15. | Honig GR, Li F, Lu SJ, Vida L. Hematopoietic differentiation of rhesus monkey embryonic stem cells. Blood Cells Mol Dis. 2004;32:5-10. [PubMed] [DOI] |
| 16. | Götherström C, Ringdén O, Tammik C, Zetterberg E, Westgren M, Le Blanc K. Immunologic properties of human fetal mesenchymal stem cells. Am J Obstet Gynecol. 2004;190:239-245. [PubMed] [DOI] |
| 17. | Malhi H, Irani AN, Gagandeep S, Gupta S. Isolation of human progenitor liver epithelial cells with extensive replication capacity and differentiation into mature hepatocytes. J Cell Sci. 2002;115:2679-2688. [PubMed] |
| 19. | Miller CL, Lai B. Human and mouse hematopoietic colony-forming cell assays. Methods Mol Biol. 2004;290:71-90. [PubMed] [DOI] |
| 20. | Airey JA, Almeida-Porada G, Colletti EJ, Porada CD, Chamberlain J, Movsesian M, Sutko JL, Zanjani ED. Human mesenchymal stem cells form Purkinje fibers in fetal sheep heart. Circulation. 2004;109:1401-1407. [PubMed] [DOI] |
| 21. | Suzuki A, Zheng YW, Fukao K, Nakauchi H, Taniguchi H. Clonal expansion of hepatic stem/progenitor cells following flow cytometric cell sorting. Cell Transplant. 2001;10:393-396. [PubMed] |
| 22. | Dabeva MD, Petkov PM, Sandhu J, Oren R, Laconi E, Hurston E, Shafritz DA. Proliferation and differentiation of fetalliver epithelial progenitor cells after transplantation into adult rat liver. Am J Pathol. 2000;156:2017-2031. [PubMed] [DOI] |
| 23. | Haruna Y, Saito K, Spaulding S, Nalesnik MA, Gerber MA. Identification of bipotential progenitor cells in human liver development. Hepatology. 1996;23:476-481. [PubMed] [DOI] |