修回日期: 2004-09-01
接受日期: 2004-09-09
在线出版日期: 2004-11-15
目的: 探讨肝细胞、胰岛细胞和储脂细胞共培养对肝细胞功能的影响.
方法: 采用改良胶原酶消化法分离获得大鼠肝细胞和储脂细胞, 同时利用梯度离心分离胰岛细胞. 分两组实验, 肝细胞培养组(对照组), 肝细胞用RPMI1640、胰岛素10-7 mol/L、100 mL/L FBS及地塞米松10-8 mol/L配成细胞悬液, 2 mL放入9 cm2培养瓶中连续培养15 d(37 ℃ 50 mL/L CO2). 肝细胞、胰岛细胞和储脂细胞共培养组(实验组): 将1×107 /L的储脂细胞2 mL先加入培养瓶中, 培养条件及培养液同肝细胞培养组, 培养48 h后弃上清后将肝细胞2×108 /L 2 mL和胰岛细胞(100个)分别加入并观察肝细胞存活情况; 全自动生化分析仪测定培养上清液中总蛋白及尿素氮的含量; 两组细胞均在培养10 d行细胞组织学及组织化学检测, 包括肝细胞HE染色、肝细胞内糖原PAS染色及葡萄糖-6-磷酸酶染色检测.
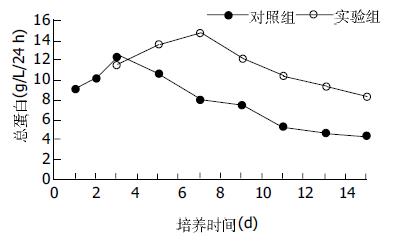
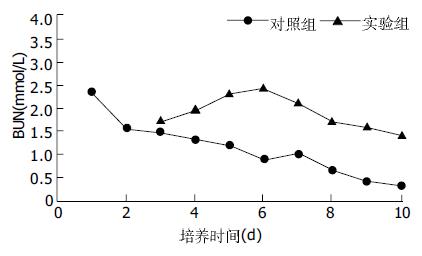
结果: 培养第7 d对照组部分肝细胞脱落, 核固缩, 胞质破碎分解. 而实验组肝细胞粘壁生长好, 肝细胞、储脂细胞和胰岛细胞相间形成团状和索形. 培养10 d对照组肝细胞核完全固缩, 胞质破碎分解, 糖原、葡萄糖-6-磷酸酶的表达消失; 实验组肝细胞呈片状, 胞质饱满, 糖原、葡萄糖-6磷酸酶的表达良好. 培养5 d后实验组白蛋白及尿素氮的合成明显高于对照组(P<0.05).
结论: 肝细胞、胰岛细胞和储脂细胞共培养明显延长肝细胞存活期.
引文著录: 于聪慧, 林梅, 梅建民, 余昌中, 杨荣华, 姚军波. 肝细胞、胰岛细胞与储脂细胞共培养对肝细胞功能的影响. 世界华人消化杂志 2004; 12(11): 2731-2733
Revised: September 1, 2004
Accepted: September 9, 2004
Published online: November 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2731-2733
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2731.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2731
肝细胞和胰岛细胞混合培养能促进肝细胞功能已有许多报道[1-2], 但肝细胞、胰岛细胞和储脂细胞三种细胞混合培养是否能增强肝细胞存活时间研究较少. 我们将肝细胞、胰岛细胞和储脂细胞三种细胞共培养, 观察肝细胞的生长和功能表达情况.
SD大鼠, ♂, 质量250-300 g, 北京大学医学部医用动物中心提供, 普通饲料喂养, 随意饮水, 室温22-28 ℃. 胶原酶Ⅳ型, DNA酶Ⅰ型, Nycodenz和Ficoll-400均购自Sigma公司, RPMI 1640培养基、胎牛血清(56 ℃, 30 min灭活)购自华美化学试剂公司, 全自动生化分析仪(TOSHIBA-7170, 日本). 二氧化碳孵育箱CI-46(BAXTER公司, 美国), 兰格衡流泵-YZ1515(保定兰格衡流泵有限公司).
采用胶原酶消化法分离大鼠肝细胞、储脂细胞和胰岛细胞. 主要步骤: 首先分离出胆总管和十二指肠, 在胆管开口的上下端结扎十二指肠, 16 G穿刺针行胆总管穿刺将0.5 g/L的胶原酶溶液约5 mL缓慢注入, 使胰腺充分膨胀后将穿刺远端的胆总管结扎; 然后将18 G的穿刺导针置入门静脉并固定, 同时将肾静脉远端的下腔静脉剪开并剪开膈肌夹闭肝上下腔静脉, 启动循环灌流装置. 先灌流0.2 g/L的EDTA(乙二胺四乙酸 Ethylenediamine tetraacetic acid)溶液, 以15 mL/min的灌流速度灌注肝脏, 灌流温度37 ℃, 不时地轻揉肝表面, 10 min左右将灌流液变换为0.5 g/L的胶原酶溶液, 与此同时将胰腺解剖剪下放入一含0.5 g/L胶原酶溶液的无菌盘内由另一组人员进一步消化分离(方法见下). 肉眼观察肝脏出现小的裂纹后停止灌流, 将肝脏剪下, 移入装有HANK'S液无菌平皿中.
1.2.1 分离肝细胞和储脂细胞组: 将平皿放入超净台, 用无菌镊剥去肝表面的包膜, 用肝梳轻轻梳刮肝表面, 将肝脏的管道系统及纤维弃去, 细胞悬液经80目网过滤, 将细胞悬液等份置入两个50 mL离心管中并用RPMI1640+100 mL/L FBS培养液充分稀释至50 mL吹打均匀放低速离心机离心5 min, 离心速度300 r/min(20 ℃), 将上清液移入另外一个50 mL的离心管(以下称B管)中, 此上清液中富含储脂细胞; 有沉淀的管(以下称A管)富含肝细胞. A管细胞悬液经0.2 g/L胶原酶孵育液(含DNAⅠ酶)孵育10 min(37 ℃ 50 mL/L CO2), 100目网过滤, 将细胞悬液用RPMI1640+100 mL/L FBS培养液离心清洗3次, 三次的时间分别是2, 1.5和1 min, 离心速度为500 r/min(20 ℃)即获得肝细胞. B管细胞悬液经2 000 r/min 5 min, 弃上清, 加入0.5 g/L的胶原酶溶液放入恒温震荡器中消化30 min(200 r/min, 37 ℃), 所得细胞悬液经200目钢网过滤, 用RPMI1640+100 mL/L FBS培养液离心清洗, 反复3次. 三次的时间分别是5, 3 min和2 min, 离心速度为2 000 r/min. 在所得的沉淀中加入RPMLl640液至12 mL, 再加入Nycodenz液6 mL, 充分吹打混匀. 将细胞悬液分别装入两个10 mL的锥型离心管中, 在细胞悬液上小心地滴加一层RPMLl640液. 3 000 r/min离心15 min(20 ℃), 将RPMLl640液与细胞悬液交界面间的细胞吸出, 用RPMLl640液2 000 r/min离心冲洗2次, 每次7 min(20 ℃)即得储脂细胞.
1.2.2 分离胰岛细胞组: 将无菌盘放在冰浴上, 用小镊子撕去胰腺被膜同时用小剪刀剪碎胰腺组织, 将悬液倒入锥形瓶置恒温震荡器中消化12-16 min(200 r/min, 38 ℃), 每5 min取样30 μL用双硫腙染色观察发现胰岛消化良好时立即用含有200 mL/L FBS的培养液离心清洗2次. 用200目网过滤后将沉淀和250 mL/L Ficoll 4 mL均匀混合, 在其上小心加入230 mL/L、200 mL/L、110 mL/L和RPMIl640液各2 mL, 高速离心20 min(3 000 r/min, 20 ℃), 吸出上两层界面的细胞, 用RPMIl640液洗涤2次即得胰岛细胞.
1.2.3 细胞计数及存活率的判定: 采用4 g/L台盼蓝溶液鉴定细胞存活率, 并将染有台盼蓝的细胞单独计数. 按公式计算细胞总数和细胞存活率.
1.2.4 三种细胞混合培养方法: 肝细胞培养组(对照组): 肝细胞用RPMI 1640+胰岛素10-7 mol/L+100 mL/L FBS+地塞米松10-8 mol/L配成2×108 /L的肝细胞悬液, 将2 mL细胞悬液放入9 cm2的培养皿中, 二氧化碳孵箱连续培养(37 ℃ 50 mL/L CO2). 三种细胞共培养组(下称实验组), 先将1×107 /L的储脂细胞2 mL加入培养瓶中, 培养条件及培养液同肝细胞培养组, 培养48 h后将培养液弃去, 再加入肝细胞2 mL(2×108/L)和胰岛细胞100个/瓶, 实验组三种细胞的培养比例为4 000:200:1, 对照组和实验组分别培养10瓶, 培养15 d. 培养期间倒置显微镜观察细胞生长情况, 隔日收集培养上清液1 mL放入试管封存, -20 ℃冰箱冻存待测, 全自动生化检测仪检测培养液中总蛋白、尿素氮含量.两组在培养第10 d时分别做爬片组织学及组织化学检测, 包括肝细胞HE染色、肝细胞内糖原PAS染色及葡萄糖-6-磷酸酶染色检测.
统计学处理 实验数据采用mean±SD, 结果进行t检验.
肝细胞分别为(93.5±3.5%)和(2.5±0.2)×1011 /L, 储脂细胞分别为(90.5±3.5%)和(1.0±0.2)×107/鼠, 胰岛细胞分别为(89.3±25%)和462±125个/鼠(纯化后).
在两组细胞培养的过程中通过倒置显微镜观察, 实验组在培养3 d后肝细胞生长活跃, 细胞逐渐形成呈团状和索条状, 同时储脂细胞有明显的网状伪足长出, 和肝细胞胰岛细胞共同生长, 到培养第10 d时细胞长成大片状, 肝细胞胞质丰满, 胞核完整. 而对照组肝细胞在培养第7 d, 部分细胞有脱落, 肝细胞质变稀疏, 细胞核固缩, 第10 d大部分细胞脱落.培养第10 d肝细胞经HE染色, 对照组肝细胞胞质分解, 细胞核固缩.实验组中90%的肝细胞圆形, 胞质丰满, 胞膜完整, 细胞内糖原、葡萄糖-6-磷酸酶的表达正常.
肝细胞生长需要良好的内环境, 胰岛素是肝细胞生长过程中的重要因素之一, 能促进肝细胞糖原和蛋白质的合成, 同时肝细胞和其共生细胞之间的连接也是肝细胞生长、分裂、细胞间信号传导的重要条件[3-8], 大量的研究表明, 肝细胞在生长过程中需要良好的立体结构才能使细胞的功能良好的发挥[9-12]. 储脂细胞呈伪足样生长, 良好的纤维臂呈网络样, 是肝细胞生存的良好框架[13-15]. 我们的结果表明, 三种细胞培养能够提高肝细胞存活时间和功能表达, 但影响因素有多种, 其中培养顺序和三种细胞的培养比例是影响细胞生长的重要因素, 三种细胞中储脂细胞贴壁时间最长大约48 h, 肝细胞和胰岛细胞贴壁时间相近. 我们采取先培养储脂细胞48 h后, 待观察到储脂细胞已有部分纤维丝伸展出来后再将肝细胞和胰岛细胞接种于上, 结果较满意, 肝细胞有良好的功能表达, 细胞贴壁好, 生存时间明显延长. 另外, 肝细胞、储脂细胞和胰岛细胞的培养比例仍需要进一步摸索. 在实验中, 我们对三种细胞培养比例进行了大量摸索实验(实验结果待发表), 结果发现肝细胞、储脂细胞和胰岛细胞以4 000:200:1配比培养较为合适. 我们认为肝细胞生长虽然需要良好的框架, 但是在整体的培养体系中, 储脂细胞需要适当的数量才有利于肝细胞的生长, 过多的储脂细胞将会限制肝细胞的生长.
编辑:N/A
| 1. | Kaufmann PM, Fiegel HC, Kneser U, Pollok JM, Kluth D, Rogiers X. Influence of pancreatic islets on growth and differentiation of hepatocytes in co-culture. Tissue Eng. 1999;5:583-596. [PubMed] [DOI] |
| 2. | Kneser U, Kaufmann PM, Fiegel HC, Pollok JM, Kluth D, Herbst H, Rogiers X. Heterotopic hepatocyte transplantation utilizing pancreatic islet cotransplantation for hepatotrophic stimulation: morphologic and morphometric evaluation. Pediatr Surg Int. 1999;15:168-174. [PubMed] [DOI] |
| 3. | Murakami S, Ijima H, Ono T, Kawakami K. Development of co-culture system of hepatocytes with bone marrow cells for expression and maintenance of hepatic functions. Int J Artif Organs. 2004;27:118-126. [PubMed] |
| 4. | Agius L. Metabolic interactions of parenchymal hepatocytes and dividing epithelial cells in co-culture. Biochem J. 1998;252:23-28. [DOI] |
| 5. | Miura K, Nagai H, Ueno Y, Goto T, Mikami K, Nakane K, Yoneyama K, Watanabe D, Terada K, Sugiyama T. Epimorphin is involved in differentiation of rat hepatic stem-like cells through cell-cell contact. Biochem Biophys Res Commun. 2003;311:415-423. [PubMed] [DOI] |
| 6. | Arnaud A, Fontana L, Sáez-Lara MJ, Gil A, López-Pedrosa JM. Exogenous nucleosides modulate the expression of rat liver extracellular matrix genes in single cultures of primary hepatocytes and a liver stellate cell line and in their co-culture. Clin Nutr. 2004;23:43-51. [PubMed] [DOI] |
| 7. | Bhatia SN, Balis UJ, Yarmush ML, Toner M. Effect of cell-cell interactions in preservation of cellular phenotype: cocultivation of hepatocytes and nonparenchymal cells. FASEB J. 1999;13:1883-1900. [PubMed] |
| 8. | Bhatia SN, Balis UJ, Yarmush ML, Toner M. Probing heterotypic cell interactions: hepatocyte function in microfabricated co-cultures. J Biomater Sci Polym Ed. 1998;9:1137-1160. [PubMed] [DOI] |
| 9. | Griffith LG, Wu B, Cima MJ, Powers MJ, Chaignaud B, Vacanti JP. In vitro organogenesis of liver tissue. Ann N Y Acad Sci. 1997;831:382-397. [PubMed] [DOI] |
| 10. | Kudryavtseva EI, Engelhardt NV. Requirement of 3D extracellular network for maintenance of mature hepatocyte morphology and suppression of alpha-fetoprotein synthesis in vitro. Immunol Lett. 2003;90:25-31. [DOI] |
| 11. | De Bartolo L, Bader A. Review of a flat membrane bioreactor as a bioartificial liver. Ann Transplant. 2001;6:40-46. [PubMed] |
| 12. | Bhandari RN, Riccalton LA, Lewis AL, Fry JR, Hammond AH, Tendler SJ, Shakesheff KM. Liver tissue engineering: a role for co-culture systems in modifying hepatocyte function and viability. Tissue Eng. 2001;7:345-357. [PubMed] [DOI] |
| 13. | Rojkind M, Novikoff PM, Greenwel P, Rubin J, Rojas-Valencia L, de Carvalho AC, Stockert R, Spray D, Hertzberg EL, Wolkoff AW. Characterization and functional studies on rat liver fat-storing cell line and freshly isolated hepatocyte coculture system. Am J Pathol. 1995;146:1508-1520. [PubMed] |
| 14. | Schirmacher P, Geerts A, Pietrangelo A, Dienes HP, Rogler CE. Hepatocyte growth factor/hepatopoietin A is expressed in fat-storing cells from rat liver but not myofibroblast-like cells derived from fat-storing cells. Hepatology. 1992;15:5-11. [PubMed] [DOI] |