修回日期: 2024-02-13
接受日期: 2024-03-22
在线出版日期: 2024-04-28
乙型肝炎病毒(hepatitis B virus, HBV)相关慢性肝病患者外周血T细胞及细胞因子水平与患者免疫功能状态密切相关, 不同疾病程度的HBV相关肝病患者的T细胞、细胞因子水平及与肝病阶段的相关性值得进一步探究.
探究不同阶段HBV相关慢性肝病患者外周血T细胞亚群计数、细胞因子变化特点及关联性.
本研究为一项观察性研究, 共纳入慢性乙型肝炎(chronic hepatitis B, CHB)患者65例, 肝硬化失代偿期(decompensated cirrhosis, DCC)患者122例, 肝细胞癌(hepatocellular carcinoma, HCC)患者109例, 收集患者一般信息、病史、治疗情况及实验室检查结果、Child-Paugh分级及HCC患者肿瘤巴塞罗那分期, 分析各项指标, 尤其是T细胞亚群计数及细胞因子的组间差异及特征.
HBV相关肝硬化、HCC患者外周血CD8+T细胞水平与Child分级A到C呈负相关. HCC患者CD8+T细胞绝对计数显著低于DCC[240(150-379) cells/μL vs 277(154-435) cells/μL, P<0.05]及CHB[240(150-379) cells/μL vs 452(269-706) cells/μL, P<0.001]患者. 白细胞介素(interleukin, IL)-6、IL-8、肿瘤坏死因子(tumor necrosis factor, TNF)-α在HCC组均最高. DCC、HCC患者Child-Paugh分级越差, CD3+、CD8+T细胞水平越低, IL-6水平越高. HCC患者CD3+、CD8+T细胞水平随着肿瘤巴塞罗那分期由A到D呈下降趋势, IL-6呈上升趋势. 且肝硬化、HCC患者CD3+(r = -0.340, P<0.001)、CD8+(r = -0.353, P<0.001)T细胞水平与IL-6升高水平呈显著负相关.
HBV相关肝硬化、HCC患者外周血CD8+T细胞计数与Child分级(由A到C)呈负相关, 且IL-6水平与CD8+T细胞计数存在负相关关系.
核心提要: 乙型肝炎病毒相关慢性肝病中T细胞及细胞因子变化情况与疾病严重程度密切相关. 随着Child分期由A到C, 患者的CD8+T细胞呈下降趋势, 而白细胞介素6呈上升趋势, 关注患者外周血T细胞及细胞因子水平有助于评估患者的免疫功能状态, 用以指导临床治疗.
引文著录: 刘晨瑞, 李亚萍, 王怡恺, 张雯, 郝苗, 王文俊, 李婷, 党双锁. HBV相关肝病患者外周血T细胞及细胞因子水平研究. 世界华人消化杂志 2024; 32(4): 293-301
Revised: February 13, 2024
Accepted: March 22, 2024
Published online: April 28, 2024
The peripheral blood T cell and cytokine levels in patients with hepatitis B virus (HBV)-related chronic liver disease are closely related to their immune function status. The T cell and cytokine levels in patients with different severities of HBV-related liver disease and their correlation with the stage of liver disease deserve further exploration.
To investigate the characteristics and correlations of peripheral blood T cell subsets and cytokine changes in patients with HBV-related chronic liver diseases at different stages.
This is an observational study that included 65 patients with chronic hepatitis B (CHB), 122 with decompensated cirrhosis (DCC), and 109 with hepatocellular carcinoma (HCC). General patient information, medical history, treatment details, laboratory test results, Child-Pugh classification, and Barcelona Clinic Liver Cancer (BCLC) stage for HCC patients were collected. Various parameters, especially T cell subset counts and cytokine profiles, were analyzed to assess their intergroup differences and features.
Peripheral blood CD8+ T cell levels in HBV-related cirrhosis and HCC patients were negatively correlated with Child-Pugh classification from A to C. The absolute count of CD8+ T cells in HCC patients was significantly lower than that in decompensated cirrhosis [240 (150-379) cells/μL vs 277 (154-435) cells/μL, P < 0.05] and CHB patients [240 (150-379) cells/μL vs 452 (269-706) cells/μL, P < 0.001]. Interleukin-6 (IL-6), interleukin-8 (IL-8), and tumor necrosis factor α (TNF-α) levels were highest in the HCC group. In patients with decompensated cirrhosis and HCC, as Child-Pugh classification worsened, CD3+ and CD8+ T cell levels decreased, and IL-6 levels increased. In HCC patients, CD3+ and CD8+ T cell levels decreased from BCLC stage A to D, while IL-6 levels increased. Moreover, in patients with cirrhosis and HCC, CD3+ (r = -0.340, P < 0.001) and CD8+ (r = -0.353, P < 0.001) T cell levels were significantly negatively correlated with elevated IL-6 levels.
Peripheral blood CD8+ T cell counts in patients with HBV-related cirrhosis and HCC are negatively correlated with Child-Pugh classification (from A to C), and there is a negative correlation between IL-6 levels and CD8+ T cell counts.
- Citation: Liu CR, Li YP, Wang YK, Zhang W, Hao M, Wang WJ, Li T, Dang SS. Peripheral blood T cell and cytokine levels in HBV-related liver disease patients. Shijie Huaren Xiaohua Zazhi 2024; 32(4): 293-301
- URL: https://www.wjgnet.com/1009-3079/full/v32/i4/293.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i4.293
目前乙型肝炎病毒(hepatitis B virus, HBV)仍然是全球高发病率和死亡率的主要原因, 每年因慢性感染、肝硬化和肝癌导致超85万人死亡[1]. 我国2013-2017年普通人群乙型肝炎病毒感染率约为6.89%[2], 现存HBV感染者约8600万, 病例数仍局全球首位. HBV感染者发生肝癌的风险是乙肝表面抗原(hepatitis B surface antigen, HBsAg)阴性人群的10-30倍[3], 且在我国肝细胞癌(hepatocellular carcinoma, HCC)的病因中, HBV感染超过84%[4], 据预测2020-2044年我国每年HCC发病和死亡人数仍将超过10万[5], 因此, HBV感染仍然是一个重要的全球健康问题, 在全球范围内造成了高死亡率和较重的疾病负担.
研究表明慢性乙型肝炎细胞损伤和炎症反应是由宿主免疫反应和病毒共同作用的结果, 其中引起肝细胞损伤起主要作用的是细胞免疫反应, 前期在黑猩猩中的研究表明T细胞在其中发挥了关键作用, 其中CD8+T细胞是发挥清除HBV的主要效应细胞, CD4+T细胞起到重要的辅助作用[6], 而HBV特异性CD8+T细胞耗竭是导致HBV感染慢性化的重要原因, 耗竭的CD8+T细胞表现为数量减少、分泌效应细胞因子能力减弱, 以及抗原识别能力下降等. 为明确处于HBV感染不同疾病阶段患者的T细胞免疫亚群及细胞因子水平, 本研究观察了296例HBV相关慢性肝病患者的外周血T细胞亚群及细胞因子水平与肝功能、HCC巴塞罗那分期等的关系, 并报道如下.
收集2020-01/2022-12于西安交通大学第二附属医院感染科住院部就诊的HBV相关慢性肝病[肝硬化失代偿期(decompensated cirrhosis, DCC)、HCC]患者及同期门诊就诊的慢性乙型病毒性肝炎(chronic hepatitis b, CHB)患者的临床资料, 展开观察性分析. 所有患者常规收集血常规、肝功能、外周血T细胞亚群计数、细胞因子系列、HBsAg载量及HBV DNA载量; 对DCC、HCC患者还需收集肾功能、凝血功能、甘油三酯、胆固醇、甲胎蛋白、C反应蛋白、降钙素原等, 并依据患者上腹部CT、MRI、B超结果评估肝硬化及肝癌患者腹水程度及肝癌患者肿瘤直径、数目、转移情况. 本研究已通过西安交通大学第二附属医院伦理委员会审批, 伦理批号2022-750.
纳入标准: (1)年龄>18岁, 符合CHB、失代偿肝硬化或HCC的诊断标准; (2)病例资料完整; (3)正在接受核苷(酸)类似物治疗. 排除标准: (1)合并妊娠; (2)合并其他血液系统疾病; (3)合并其他严重影响免疫功能或肝功能的疾病如HIV、HCV及其他明确的感染等; (4)合并自身免疫性疾病, 或免疫抑制剂使用者; (5)合并其他恶性肿瘤.
本研究中的实验室检查项目均来自西安交通大学第二附属医院检验科, 其中细胞因子采用化学发光免疫分析仪(Siemens, Immulite1000)进行检测, 外周血T细胞亚群计数采用流式细胞仪(Beckmancoulter, Navios)进行检测.
统计学处理 采用IBM SPSS® Statistics 23.0统计软件进行分析. 计数资料以率/比/构成比表示, 对计量资料行正态性检验, 符合正态分布的数据以mean±SD差表示, 不符合正态分布的数据以M(P25-P75)表示. 组间计数资料比较采用χ2检验; 符合正态分布的计量资料的多组间比较采用方差分析, 两组间比较采用t检验, 相关性分析采用Pearson相关; 不符正态分布的的计量资料的多组间比较采用Kruskal-Wallis检验, 两组间比较采用Mann-Whithey U检验, 相关性分析采用Spearman秩相关. 采用双侧检验, P<0.05为差异有统计学意义.
共收集HBV相关慢性肝病患者296例, 其中CHB组65例, 男性32例, 女性33例, 平均年龄41.5岁±9.0岁; 肝硬化组122例, 其中男性72例, 女性50例, 平均年龄56.0岁±11.1岁; HCC组109例, 其中男性96例, 女性13例, 平均年龄56.3岁±9.3岁. 患者人口资料、Child分级及巴塞罗那分期情况见表1.
| 项目 | CHB组(n = 65) | DCC组(n = 122) | HCC组(n = 109) | P |
| 年龄(岁) | 41.5±9.0 | 56.0±11.1 | 56.3±9.3 | <0.001 |
| 性别, n(%) | <0.001 | |||
| 男 | 32(49.2) | 72 (59.0) | 96 (88.1) | |
| 女 | 33 (50.8) | 50 (41.0) | 13 (11.0) | |
| Child分级, n(%) | 0.003 | |||
| A级 | / | 65(53.3) | 35(32.1) | |
| B级 | / | 41(33.6) | 56(51.4) | |
| C级 | / | 16(13.1) | 18(16.5) | |
| 巴塞罗那分期, n(%) | ||||
| 0期 | / | / | 5(4.6) | |
| A期 | / | / | 27(24.8) | |
| B期 | / | / | 14(12.8) | |
| C期 | / | / | 47(43.1) | |
| D期 | / | / | 16(14.7) |
CHB患者白细胞计数、血小板、白蛋白水平高于肝硬化组及HCC组患者, 粒细胞淋巴细胞比值(neutrophil lymphocyte ratio, NLR)、总胆红素、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)水平低于肝硬化组及HCC组患者. 其中NLR、总胆红素、AST、AFP随着疾病严重性加重呈逐渐上升趋势. HCC患者血肌酐、CRP、PCT水平高于肝硬化患者, 血钠水平低于肝硬化患者. HCC、DCC患者HBsAg水平高于CHB组. 三组患者实验室检查结果及各组间差异见表2.
| 项目 | CHB组(n = 65) | DCC组(n = 122) | HCC组(n = 109) | P |
| 白细胞(×109/L) | 5.2(3.3-6.0) | 3.9(2.9-4.8)a | 4.1(3.4.8)c | 0.002 |
| 血小板(×109/L) | 169(103-222) | 90(67-135)a | 103(76-154)a | <0.001 |
| NLR | 1.7(1.3-2.3) | 1.9(1.1.8)a | 2.4(1.6-4.1)a | <0.001 |
| 总胆红素(μmol/L) | 13.7(9.3-15.1) | 20.3(13.7-29.7)a | 24.5(16.6-37.3)bd | <0.001 |
| ALT(U/L) | 25(14-41) | 27(16-44) | 27.5(20-45) | 0.187 |
| AST(U/L) | 25(21-33) | 38(24-60)b | 49(32-83)d | <0.001 |
| 白蛋白(g/L) | 45.9(42.7-47.2) | 35.8(30.6-40.5)b | 35.2(31.1-38.0)b | <0.001 |
| AFP(pg/mL) | 4.2(2.3-6.2) | 3.5(2.3-6.5) | 12.4(4.1-28.0)bc | <0.001 |
| HBsAg(IU/mL) | 2370(84-4954) | 531(86-1164)a | 595(91-1431)b | 0.006 |
| HBV DNA(log10IU/mL) | 1.00(1.00-2.18) | 1.00(1.00-3.08) | 1.00(1.00-2.84) | 0.259 |
| HBeAg阳性(%) | 12(18.5) | 23(18.6) | 27(24.5) | 0.466 |
| 血肌酐(μmol/L) | / | 49.8(40.5-59.2) | 52.4(45.0-65.1) | 0.021 |
| 血钠(mmol/L) | / | 139.4(137.9-141.0) | 138.6(136.2-139.9) | 0.003 |
| 总胆固醇(mmol/L) | / | 3.5(2.7-4.1) | 3.4(3.0-4.1) | 0.859 |
| 甘油三酯(mmol/L) | / | 0.96(0.77-1.39) | 0.97(0.73-1.26) | 0.313 |
| INR | / | 1.1(1.0-1.3) | 1.1(1.0-1.3) | 0.441 |
| PTA(%) | / | 77.0(65.6-87.2) | 75.6(66.9-92.5) | 0.536 |
| CRP(mg/L) | / | 1.6(1.6-3.3) | 4.1(1.6-23.7) | <0.001 |
| PCT(ng/mL) | / | 0.05(0.05-0.10) | 0.11(0.05-0.31) | <0.001 |
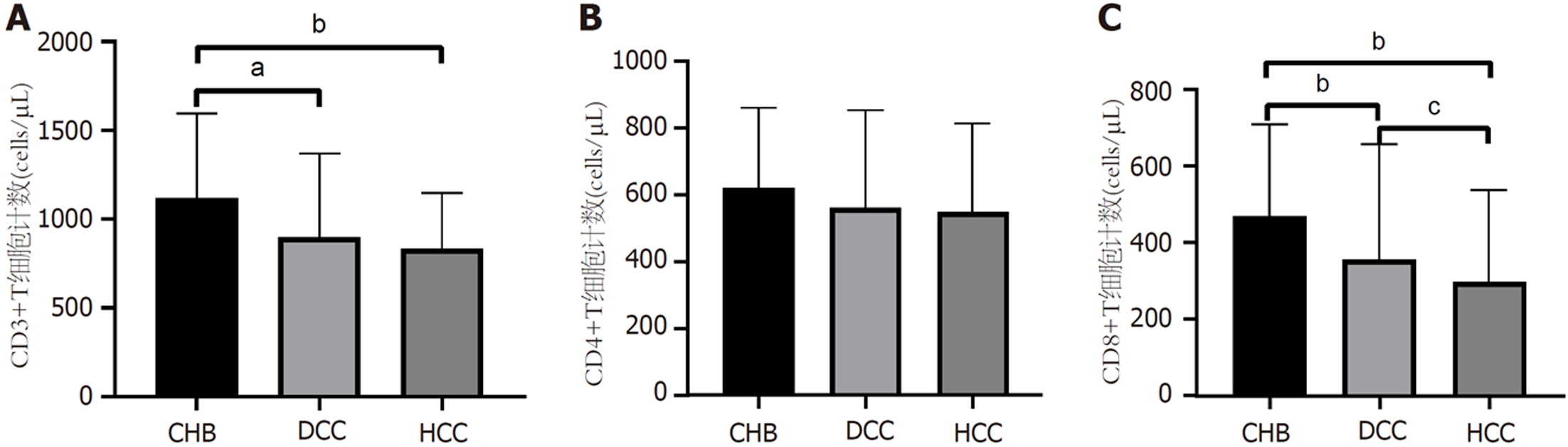
2.3.1 外周血T细胞亚群计数水平: CHB组CD3+T细胞计数显著高于肝硬化组[1120(805-1595) cells/μL vs 892(587-1362) cells/μL, P<0.01]和HCC组[1120(805-1595) cells/μL vs 836(540-1139) cells/μL, P<0.001], 见图1A. CHB组CD8+T细胞计数显著高于肝硬化组[452(279-706) cells/μL vs 277(156-428) cells/μL, P<0.001]及HCC组[452(279-706) cells/μL vs 240(153-376) cells/μL, P<0.001], 肝硬化组CD8+T细胞计数亦显著高于HCC组[277(156-428) cells/μL vs 240(153-376) cells/μL, P<0.05], 见图1C. 三组患者CD4+T细胞计数无统计学差异(P = 0.064), 见图1B.
2.3.2 细胞因子水平: HCC组白细胞介素(interleukin, IL)-6水平显著高于肝硬化组, 肝硬化组IL-6显著高于CHB组; HCC组IL-8水平显著高于肝硬化组, 肝硬化组IL-8显著高于CHB组; CHB组肿瘤坏死因子(tumor necrosis factor, TNF)-α水平显著低于肝硬化组和HCC组. 三组患者细胞因子水平见表3.
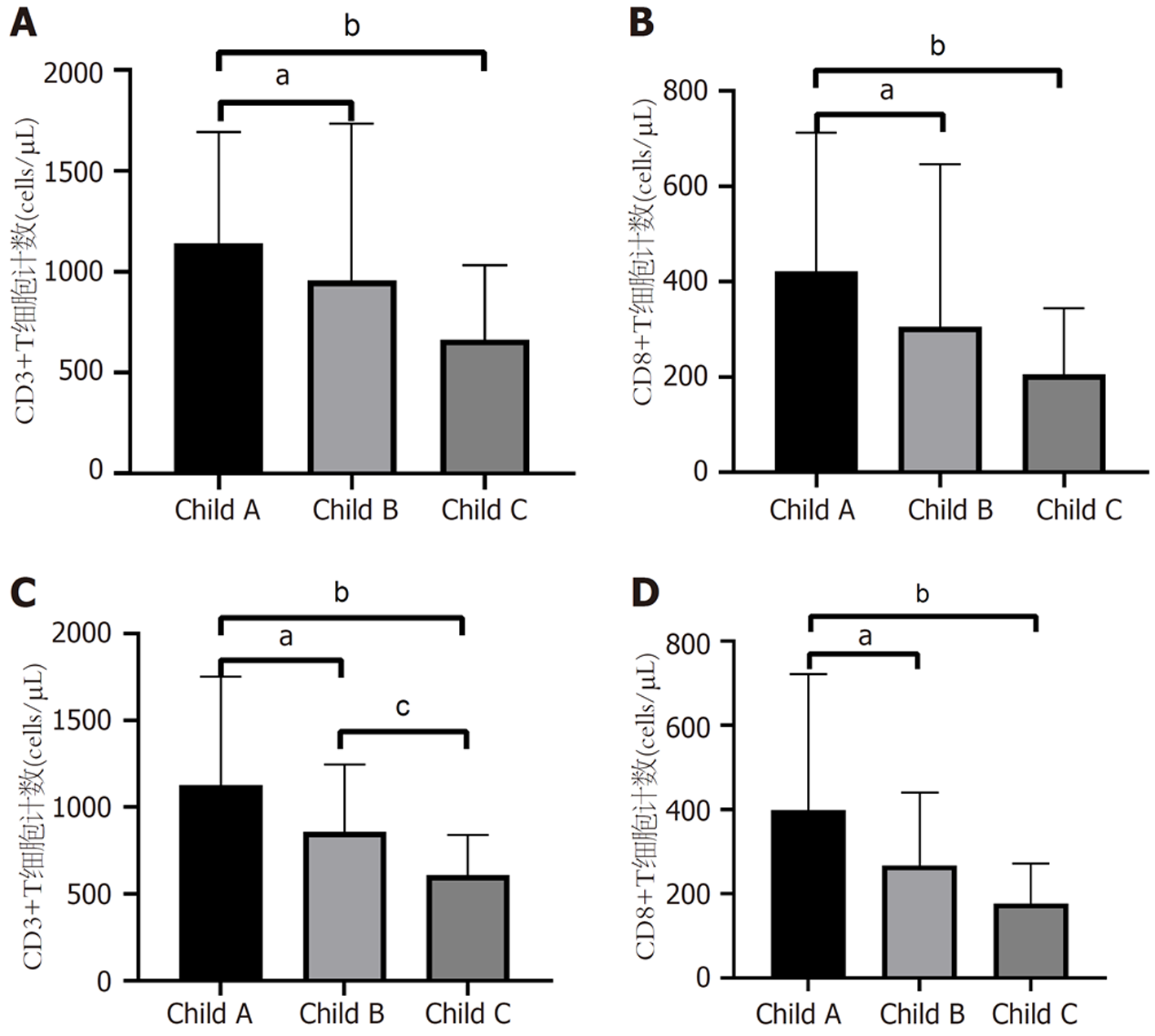
2.3.3 肝硬化、HCC患者肝功能分级与T细胞亚群计数的特征分析: 将肝硬化、HCC组患者分别按照Child-Paugh分级划分为A到C三组, 分别分析肝硬化、HCC组患者不同肝功能分级组外周血CD3+、CD8+T细胞计数差异.
肝硬化组: Child A级CD3+T细胞计数高于Child B级[1069(836-1524) cells/μL vs 757(405-1144) cells/μL, P<0.05]与Child C级[1069(836-1524) cells/μL vs 592(503-747) cells/μL, P<0.01]见图2A; Child A级CD8+T细胞计数高于Child B级[382(262.5-569) cells/μL vs 199(86-361) cells/μL, P<0.05]与Child C级[382(263-569) cells/μL vs 157(120-264) cells/μL, P<0.01]见图2B.
HCC组: Child A级CD3+T细胞计数高于Child B级[1097(652-1374) cells/μL vs 790(535-1073) cells/μL, P<0.05]与Child C级[1097(652-1374) cells/μL vs 540(423-768) cells/μL, P<0.01], Child B级CD3+T细胞计数高于Child C级[790(535-1072.5) cells/μL vs 540(423-768) cells/μL, P<0.05], 见图2C; Child A级CD8+T细胞计数高于Child B级[346(201-433) cells/μL vs 208(135-314) cells/μL, P<0.05]与Child C级[346(201-433) cells/μL vs 172(69-232) cells/μL, P<0.01]见图2D.
肝硬化、HCC患者均可见CD3+、CD8+T细胞计数随着肝功能分级A到C级而呈下降趋势.
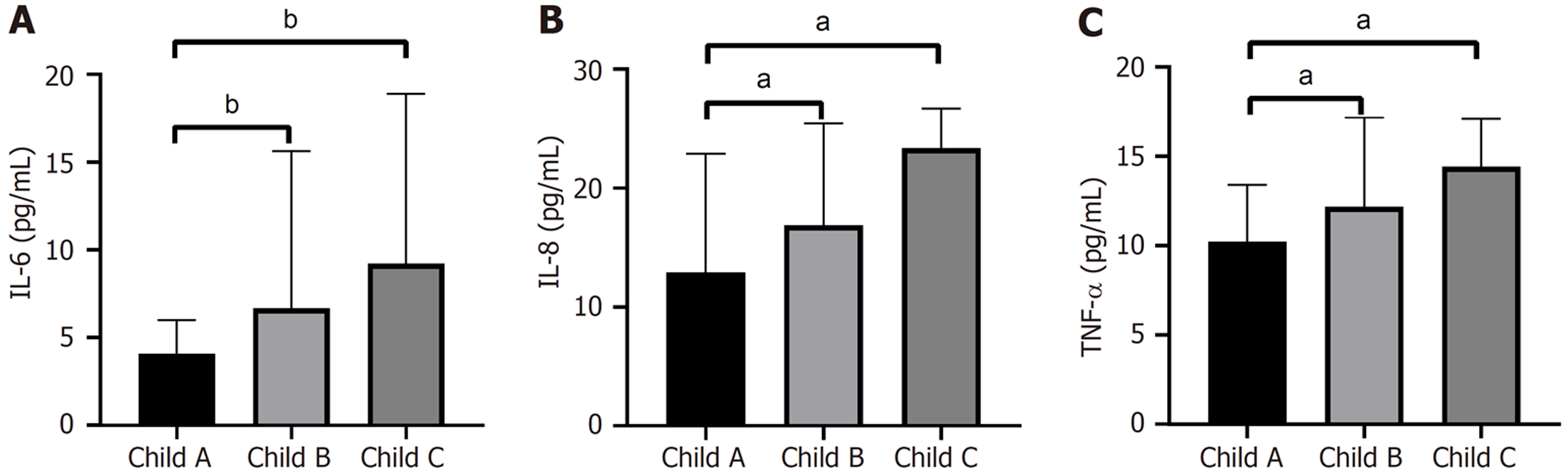
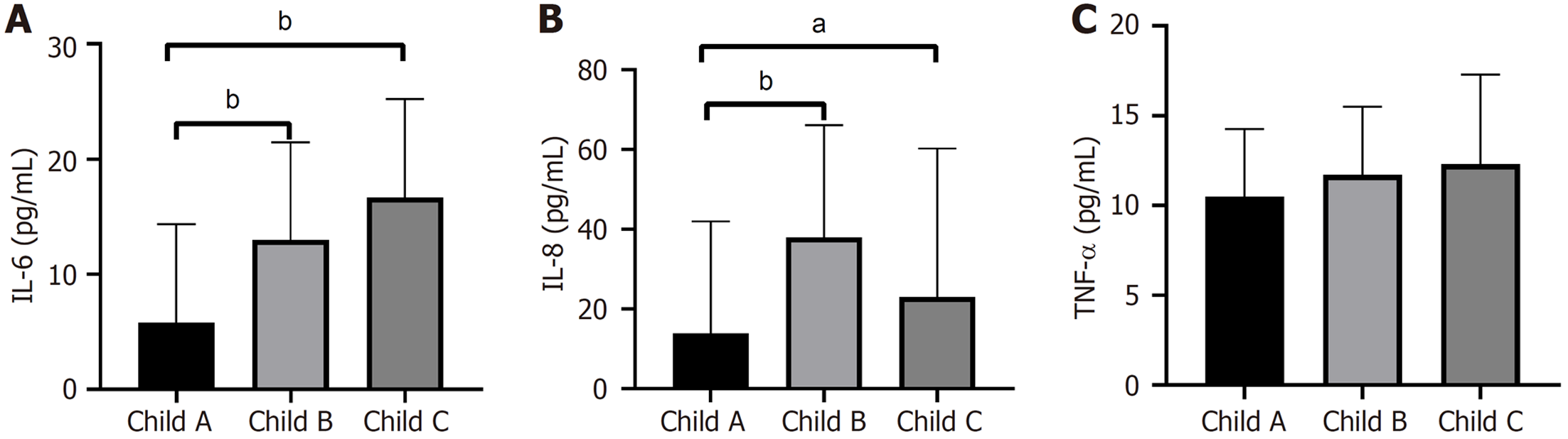
2.3.4 细胞因子与肝功能分级特征分析: 按同样方法分析肝硬化、HCC患者不同Child分级细胞因子水平.
肝硬化组Child A级IL-6水平显著低于Child B级[3.90(2.00-5.90) pg/mL vs 6.9(3.9-17.0) pg/mL, P<0.01]与Child C级[3.90(2.00-5.90) pg/mL vs 6.7(6.6-14.4) pg/mL, P<0.001], 见图3A; Child A级IL-8显著低于Child B级[12.9(7.8-22.9) pg/mL vs 17.1(13.4-26.1) pg/mL, P<0.05]与Child C级[12.9(7.8-22.9) pg/mL vs 23.2(11.2-24.60) pg/mL, P<0.05], 见图3B; Child A级TNF-α显著低于Child B级[10.2(7.9-13.4) pg/mL vs 12.3(10.1-17.6) pg/mL, P<0.05]与Child C级[10.20(7.9-13.4) pg/mL vs 13.20(10.0-17.1) pg/mL, P<0.05], Child B级与Child C级TNF-α无统计学差异(P = 0.873), 见图3C.
HCC组Child A级IL-6显著低于Child B级[5.0(1.6-12.9) pg/mL vs 12.6(4.3-21.8) pg/mL, P<0.01]与Child C级[5.0(1.6-12.9) pg/mL vs 16.6(11.2-44.2) pg/mL, P<0.01], 见图4A; Child A级IL-8显著低于Child B级[13.8(9.1-42.0) pg/mL vs 37.9(21.2-66.1) pg/mL, P<0.01]与Child C级[13.8(9.1-42.0) pg/mL vs 23.0(16.8-60.2) pg/mL, P<0.05], 见图4B; TNF-α在三组间无统计学差异(P = 0.517), 见图4C.
肝硬化、HCC患者中均可见IL-6随肝功能分级变差而上升的趋势.
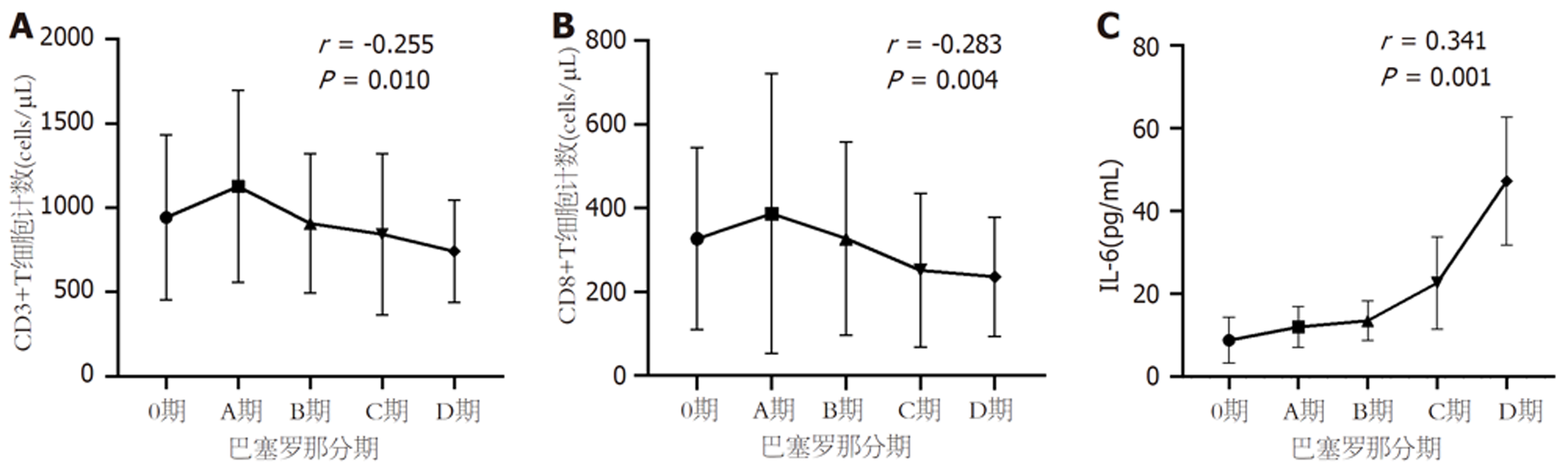
2.3.5 T细胞计数、IL-6与HCC肿瘤分期的相关性分析: 将HCC患者按照巴塞罗那分期由0期到D期分为5组后, 分析外周血CD3+、CD8+T细胞计数、IL-6水平与肿瘤分期的相关性. CD3+T、CD8+T细胞计数随着肿瘤分期A期到D期而呈现逐渐下降趋势, CD3+(r = -0.255, P = 0.010)、CD8+T细胞计数(r = -0.283, P = 0.004)与肿瘤分期呈负相关, 见图5A和B. 中位IL-6表达水平与巴塞罗那分期呈正相关(r = 0.341, P = 0.001), 见图5C.
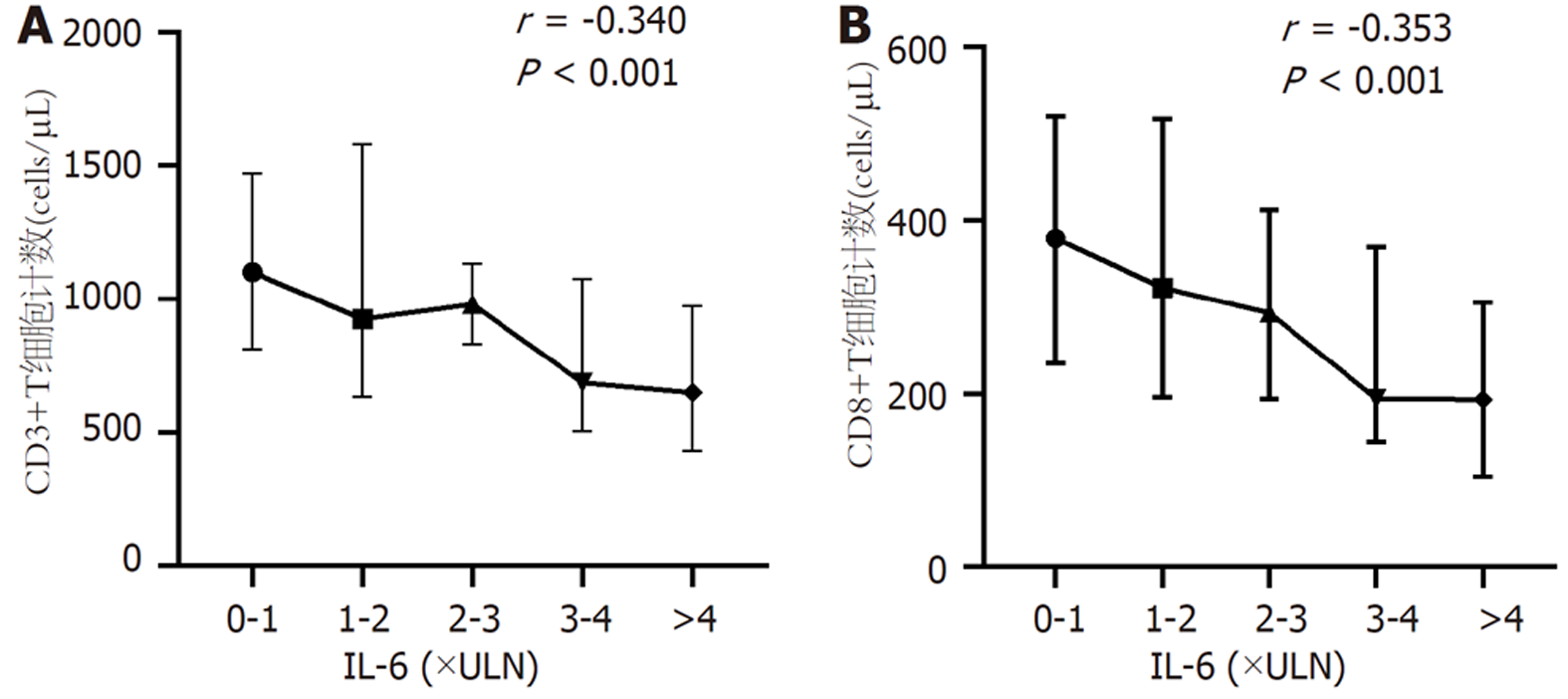
2.3.6 CD8+T细胞与IL-6相关性分析: 将肝硬化、HCC两组患者合并后按照IL-6水平0-1×ULN、1-2×ULN、2-3×ULN、3-4×ULN、>4×ULN(按照西安交通大学第二附属医院检验科制定的参考标准IL-6 ULN = 3.4 pg/mL)将所有患者分五个等级, 分析CD3+、CD8+T细胞计数与IL-6升高程度的关联性. 患者IL-6升高程度与CD3+(r = -0.340, P<0.001)、CD8+T细胞计数(r = -0.353, P<0.001)均呈负相关, 见图6A和B, 肝硬化、HCC患者IL-6水平越高, 其CD3+、CD8+T细胞计数越低.
本研究通过对HBV相关慢性肝病患者的临床资料进行分析比较, 重点关注患者外周血T细胞及细胞因子水平, 从而反映其免疫功能状态. 本研究发现不同程度的HBV相关慢性肝病患者其免疫状态存在诸多差异. 肝功能分级差、肿瘤分期靠后的患者具有更高水平的血清IL-6和更低的外周血CD8+T细胞计数, 肝硬化、HCC患者表现出外周血CD8+T细胞耗竭和促炎因子升高, 推测这些改变与肝硬化及HCC的发生、发展有关.
T细胞耗竭是在慢性病毒感染或肿瘤发展过程中由长期抗原刺激引起的功能失调状态, CD8+ T细胞耗竭是CD8+ T细胞数量减少和功能障碍. 本研究发现CD3+T、CD8+T细胞计数由肝炎到DCC再到HCC呈现出显著下降的趋势, 可能与CD8+T细胞耗竭有关. 陈锡莲、陈慧等学者的研究同样发现慢性HBV感染者CD3+T细胞水平从CHB组到HCC组逐渐降低, CD8+T细胞水平在HCC患者中显著下降[7,8], 且在AHB中最低. 分析原因可能是急性HBV感染过程中CD8+T细胞是起到免疫清除的主要细胞, 大量效应T细胞发挥作用后死亡, 导致CD8+T细胞减少, 且肿瘤特异性T细胞大多为CD8+T细胞, 在受到抗原的持续刺激后可能会出现CD8+T细胞增殖能力、数量下降, 从而导致HCC患者外周血CD8+T细胞计数下降. 我们研究纳入的均是CHB患者, 虽未对AHB患者进行分析, 但得到的结论与上述研究结果类似. 可见HCC患者出现外周CD8+T细胞计数下降并不少见. 此外, 本研究发现无论在DCC患者还是HCC患者中, 肝功能Child分级越差的患者其CD3+、CD8+T细胞计数越低. 有学者也曾在肝硬化患者中进行肝功能Child分级与T细胞亚群水平的研究, 发现外周血CD3+、CD8+T细胞随着肝功能分级变差而逐渐下降[9-11], 其中在酒精性肝硬化中, CD8+T细胞下降幅度最大, 与本研究得出的结论基本一致.
细胞因子作为炎症反应的重要载体与肝脏疾病的进展或演变密切相关, 我们发现由CHB到DCC到HCC, 肝功能Child分级由A到C, 患者外周血细胞因子IL-6、IL8、TNF-α均呈现逐渐升高趋势, 其中以IL-6的变化尤为显著. 相关研究表明IL-6与肝硬化的严重程度有关, IL-6水平越高, 肝硬化肝功能受损及肝性脑病程度越重[12,13]. IL-6的上调和随后的STAT3级联调节可促进肝星状细胞激活, 导致肝纤维化和肝硬化进展[14]; IL-6还可导致过度炎症激活, 诱导氧化应激反应, 导致组织损伤和肝病进展[15]. 在HBV感染中, kuffer细胞通过释放IL-6活化肝星状细胞, 导致肝纤维化进展[16], 活化的肝星状细胞在肝纤维化过程中可形成恶性循环, 这种情况被称为炎症-纤维化轴, 因此IL-6与肝硬化的严重程度有关[13]. 此外, IL-6是TNF-α的下游分子[17], 因此TNF-α可能出现与IL-6同样的变化趋势. IL-6不仅是机体重要的炎症因子, 还是肥胖相关HCC发生的重要促进因子[18]. 多项研究表明循环高IL-6水平与HCC发生风险有密切关系[19-21]. 肿瘤微环境中的慢性炎症是导致肿瘤进展的重要直接驱动因素. IL-6可激活多条信号通路, 其中最显著的便是STAT3通路, 在多种肿瘤的进展过程中都可观察到IL-6/STAT3信号通路的异常过度激活, 这种过度激活与HCC不良预后密切相关[22,23].
IL-6在肝脏疾病发生和进展中发挥重要的作用. 我们发现肝硬化、HCC患者IL-6水平升高, 且在HCC患者中, 肿瘤分期越晚, 其IL-6水平越高. 一方面可能与这些患者中部分合并感染有关, 另一方面可能也预示着这些患者的免疫功能状态处于持续的慢性炎症激活状态, 而这种状态可能与HCC的发生或进展有关. 有趣的是本研究发现患者的IL-6水平大多与其外周血CD8+T细胞计数水平呈负相关. 有研究表明IL-6水平高的HCC患者表现出CD8+T细胞分泌的IFN-γ减少, 且过量的IL-6可抑制CD8+T细胞的增殖, IL-6水平升高与T细胞功能受损有关[24]. 还有研究表明IL-6通路的过度激活可能减弱Th1细胞反应, 抑制淋巴结和肿瘤微环境中T细胞的募集, 从而抑制抗肿瘤T细胞免疫[25-27]. 此外, 脾功能亢进可能导致三系细胞减少, 但有研究表明脾功能亢进患者进行脾切除或脾动脉栓塞术后, 其CD8+T细胞比例及计数反而出现下降[28], 因此可能是脾功能亢进之外的其他因素导致DCC、HCC患者外周血CD8+T细胞计数下降, 本研究中这些患者炎症因子水平升高, 且与CD8+T细胞计数呈负相关, 因此考虑是慢性炎症反应导致其外周血CD8+T细胞的耗竭.
综上, HCC患者表现出外周CD8+T细胞耗竭和IL-6升高为特点的慢性炎症状态, 这种慢性炎症可能对肿瘤的发生发展及CD8+T细胞耗竭起到促进作用. 但本研究为回顾性观察性研究, 今后进行前瞻性研究能进一步明确IL-6变化与CD8+T细胞计数、肿瘤进展的因果关系.
乙型肝炎病毒(hepatitis B virus, HBV)相关慢性肝病患者的免疫功能状态是临床中需要密切关注的问题. 收集我院就诊的HBV相关慢性肝病患者, 包括慢性乙型肝炎(chronic hepatitis B, CHB)、肝硬化失代偿期(decompensated cirrhosis, DCC)、肝细胞癌(hepatocellular carcinoma, HCC)患者的外周血T细胞亚群绝对计数及常用细胞因子水平, 探讨其与疾病严重程度及肝功能状态的关系.
HBV相关慢性肝病患者的外周血T细胞免疫状态与患者细胞因子水平可能为评估患者整体疾病状态及临床用药提供一定的指导作用.
探究HBV慢性肝病患者外周血CD3+、CD4+、CD8+T细胞水平及细胞因子水平与疾病程度、肝功能分级之间的关系.
收集CHB患者65例, DCC患者122例, HCC患者109例, 结合患者病史资料及实验室检查结果, 分析T细胞亚群绝对计数及细胞因子的组间差异及特征.
HBV相关DCC、HCC患者外周血CD8+T细胞水平与Child分级A到C呈负相关. HCC患者CD8+T细胞绝对计数显著低于肝硬化失代偿及CHB患者. 白细胞介素(interleukin, IL)-6、IL-8、肿瘤坏死因子(tumor necrosis factor, TNF)-α在HCC组均最高. DCC、HCC患者Child-Paugh分级越差, CD3+、CD8+T细胞水平越低, IL-6水平越高. HCC患者CD3+、CD8+T细胞水平随着肿瘤巴塞罗那分期由A到D呈下降趋势, IL-6呈上升趋势. 且DCC、HCC患者CD3+、CD8+T细胞水平与IL-6水平呈显著负相关.
CD8+T细胞计数及IL-6水平在不同肝病程度分组的患者中存在显著差异, 且在DCC及HCC患者中CD8+T细胞计数与IL-6存在负相关关系.
HBV相关肝病患者外周血T细胞水平与IL-6水平在不同疾病程度及肝功能分级之间存在的差异可能与疾病发展和患者预后有关, 但后续仍需要开展前瞻性观察研究证实.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Cao G, Jing W, Liu J, Liu M. Countdown on hepatitis B elimination by 2030: the global burden of liver disease related to hepatitis B and association with socioeconomic status. Hepatol Int. 2022;16:1282-1296. [PubMed] [DOI] |
| 2. | Wang H, Men P, Xiao Y, Gao P, Lv M, Yuan Q, Chen W, Bai S, Wu J. Hepatitis B infection in the general population of China: a systematic review and meta-analysis. BMC Infect Dis. 2019;19:811. [PubMed] [DOI] |
| 3. | Franceschi S, Montella M, Polesel J, La Vecchia C, Crispo A, Dal Maso L, Casarin P, Izzo F, Tommasi LG, Chemin I, Trépo C, Crovatto M, Talamini R. Hepatitis viruses, alcohol, and tobacco in the etiology of hepatocellular carcinoma in Italy. Cancer Epidemiol Biomarkers Prev. 2006;15:683-689. [PubMed] [DOI] |
| 5. | 杨 帆, 曹 毛毛, 李 贺, 严 鑫鑫, 孙 殿钦, 何 思怡, 张 绍丽, 雷 林, 陈 万青. 1990-2019年中国人群肝癌流行病学趋势分析及预测. 中华消化外科杂志. 2022;21:106-113. |
| 6. | Guidotti LG, Chisari FV. Immunobiology and pathogenesis of viral hepatitis. Annu Rev Pathol. 2006;1:23-61. [PubMed] [DOI] |
| 7. | 陈 慧, 顾 兴华, 吴 敏娟, 徐 俊驰, 李 明, 胥 萍. HBV感染不同病程中病毒载量与肝功能相关指标及免疫功能的变化分析. 国际免疫学杂志. 2015;38:138-142. [DOI] |
| 8. | 陈 锡莲, 杨 勇卫, 林 静, 李 彩东, 刘 友德, 邹 志强. HBV相关原发性肝癌患者T淋巴细胞亚群和细胞因子表达水平差异研究. 国际医药卫生导报. 2021;27:2980-2984. [DOI] |
| 9. | Matos LC, Batista P, Monteiro N, Ribeiro J, Cipriano MA, Henriques P, Girão F, Carvalho A. Lymphocyte subsets in alcoholic liver disease. World J Hepatol. 2013;5:46-55. [PubMed] [DOI] |
| 10. | 李 欣, 赵 培培, 王 富兵, 丁 江涛, 范 辉, 魏 怡然. 乙肝后肝硬化患者Child-Pugh分级与细胞免疫功能相关性分析. 标记免疫分析与临床. 2022;29:932-934, 957. [DOI] |
| 12. | Rey I, Effendi-Ys R. Association Between Serum IL-6, IL-10, IL-12, and IL-23 Levels and Severity of Liver Cirrhosis. Med Arch. 2021;75:199-203. [PubMed] [DOI] |
| 13. | Xiang DM, Sun W, Ning BF, Zhou TF, Li XF, Zhong W, Cheng Z, Xia MY, Wang X, Deng X, Wang W, Li HY, Cui XL, Li SC, Wu B, Xie WF, Wang HY, Ding J. The HLF/IL-6/STAT3 feedforward circuit drives hepatic stellate cell activation to promote liver fibrosis. Gut. 2018;67:1704-1715. [PubMed] [DOI] |
| 14. | Dirchwolf M, Podhorzer A, Marino M, Shulman C, Cartier M, Zunino M, Paz S, Muñoz A, Bocassi A, Gimenez J, Di Pietro L, Romero G, Fainboim H, Fainboim L. Immune dysfunction in cirrhosis: Distinct cytokines phenotypes according to cirrhosis severity. Cytokine. 2016;77:14-25. [PubMed] [DOI] |
| 15. | Li S, Hong M, Tan HY, Wang N, Feng Y. Insights into the Role and Interdependence of Oxidative Stress and Inflammation in Liver Diseases. Oxid Med Cell Longev. 2016;2016:4234061. [PubMed] [DOI] |
| 16. | Khan S, Bhargava A, Pathak N, Maudar KK, Varshney S, Mishra PK. Circulating Biomarkers and their Possible Role in Pathogenesis of Chronic Hepatitis B and C Viral Infections. Indian J Clin Biochem. 2011;26:161-168. [PubMed] [DOI] |
| 17. | Kamimura D, Ishihara K, Hirano T. IL-6 signal transduction and its physiological roles: the signal orchestration model. Rev Physiol Biochem Pharmacol. 2003;149:1-38. [PubMed] [DOI] |
| 18. | Park EJ, Lee JH, Yu GY, He G, Ali SR, Holzer RG, Osterreicher CH, Takahashi H, Karin M. Dietary and genetic obesity promote liver inflammation and tumorigenesis by enhancing IL-6 and TNF expression. Cell. 2010;140:197-208. [PubMed] [DOI] |
| 19. | Giannitrapani L, Cervello M, Soresi M, Notarbartolo M, La Rosa M, Virruso L, D'Alessandro N, Montalto G. Circulating IL-6 and sIL-6R in patients with hepatocellular carcinoma. Ann N Y Acad Sci. 2002;963:46-52. [PubMed] [DOI] |
| 20. | Porta C, De Amici M, Quaglini S, Paglino C, Tagliani F, Boncimino A, Moratti R, Corazza GR. Circulating interleukin-6 as a tumor marker for hepatocellular carcinoma. Ann Oncol. 2008;19:353-358. [PubMed] [DOI] |
| 21. | Giannitrapani L, Soresi M, Giacalone A, Campagna ME, Marasà M, Cervello M, Marasà S, Montalto G. IL-6 -174G/C polymorphism and IL-6 serum levels in patients with liver cirrhosis and hepatocellular carcinoma. OMICS. 2011;15:183-186. [PubMed] [DOI] |
| 22. | Middleton K, Jones J, Lwin Z, Coward JI. Interleukin-6: an angiogenic target in solid tumours. Crit Rev Oncol Hematol. 2014;89:129-139. [PubMed] [DOI] |
| 23. | Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3. Nat Rev Cancer. 2009;9:798-809. [PubMed] [DOI] |
| 24. | Yang H, Kang B, Ha Y, Lee SH, Kim I, Kim H, Lee WS, Kim G, Jung S, Rha SY, Gaillard VE, Cheon J, Kim C, Chon HJ. High serum IL-6 correlates with reduced clinical benefit of atezolizumab and bevacizumab in unresectable hepatocellular carcinoma. JHEP Rep. 2023;5:100672. [PubMed] [DOI] |
| 25. | Nakanishi Y, Lu B, Gerard C, Iwasaki A. CD8(+) T lymphocyte mobilization to virus-infected tissue requires CD4(+) T-cell help. Nature. 2009;462:510-513. [PubMed] [DOI] |
| 26. | Tsukamoto H, Senju S, Matsumura K, Swain SL, Nishimura Y. IL-6-mediated environmental conditioning of defective Th1 differentiation dampens antitumour immune responses in old age. Nat Commun. 2015;6:6702. [PubMed] [DOI] |
| 27. | Tsukamoto H, Fujieda K, Senju S, Ikeda T, Oshiumi H, Nishimura Y. Immune-suppressive effects of interleukin-6 on T-cell-mediated anti-tumor immunity. Cancer Sci. 2018;109:523-530. [PubMed] [DOI] |
| 28. | 王 永军, 罗 大勇, 李 恒, 张 伟, 秦 一雨, 罗 志梅. 全脾切除术与部分脾切除术对门静脉高压症脾功能亢进患者免疫功能影响的比较. 中华肝脏外科手术学电子杂志. 2017;6:216-221. [DOI] |