修回日期: 2023-10-09
接受日期: 2023-10-23
在线出版日期: 2023-10-28
筛选胃溃疡继发癌变的敏感性标志物对胃癌的预防和治疗具有重要意义. 先前的研究提示胃蛋白酶原和胃泌素-17(gastrin-17, G-17)可能在早期胃癌的预测方面有一定的参考价值, 但尚无确切统一的观点.
探讨血清胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PGⅠ)/胃蛋白酶原Ⅱ(pepsinogen Ⅱ, PGⅡ)联合G-17预测胃溃疡继发癌变的临床价值, 为胃癌的早期诊断提供敏感性生化标志物.
回顾性总结2020-07/2023-04我院初诊为胃溃疡患者215例, 根据胃镜下组织病理学诊断分为单纯溃疡组184例和胃癌组31例. 入院检测血清PGⅠ、PGⅡ、G-17和肿瘤标志物[包括癌抗原(cancer antigen, CA)724、CA199、癌胚抗原(carcinoembryonic antigen, CEA)和铁蛋白], 13C呼气试验测定幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染超基准(delta over baseline, DOB)值.
两组性别、年龄、DOB值和病程比较无明显差异(P>0.05). 与单纯溃疡组相比, 胃癌组血清PGⅡ、G-17、CA724、CA199和CEA水平升高, 而PGⅠ、铁蛋白和PGI/PGII下降(P<0.05). Spearman检验显示, PGⅠ/PGⅡ与G-17、CA724、CA199和CEA呈负相关, 与铁蛋白呈正相关(P<0.05). G-17与CA724、CA199和CEA呈正相关, 与铁蛋白呈负相关(P<0.05). 受试者工作曲线(receiver operating curve, ROC)显示, PGⅠ/PGⅡ和G-17诊断胃溃疡继发癌变的曲线下面积(area under curve, AUC)分别为0.804和0.742, PGⅠ/PGⅡ和G-17联合诊断的AUC为0.899, 显著高于单一指标(P<0.05).
血清PGⅠ/PGⅡ下降和G-17升高与胃溃疡继发癌变紧密相关, PGⅠ/PGⅡ联合G-17对胃溃疡继发癌变的预测性能较好, PGⅠ/PGⅡ和G-17可作为早期诊断胃癌的敏感性标志物.
核心提要: 血清胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ、胃泌素-17可作为早期诊断胃癌的敏感性标志物, 二者联用可为胃溃疡继发癌变的高危患者的早癌筛查提供检测手段.
引文著录: 俞巧燕, 张洪成, 金好. 血清胃蛋白酶原PGI/PGII联合胃泌素-17预测胃溃疡继发癌变. 世界华人消化杂志 2023; 31(20): 846-851
Revised: October 9, 2023
Accepted: October 23, 2023
Published online: October 28, 2023
Screening sensitivity markers for canceration of gastric ulcer is of great significance for the prevention and treatment of gastric cancer. Previous studies have suggested that pepsinogen and gastrin-17 (G-17) may have appreciated value in the prediction of early gastric cancer, but there is still no definitive consensus on this.
To assess the clinical value of serum pepsinogen I (PGⅠ)/pepsinogen Ⅱ (PGⅡ) ratio combined with G-17 in predicting canceration of gastric ulcer to provide sensitive biochemical markers for early diagnosis of gastric cancer.
A retrospective analysis was conducted on 215 patients with gastric ulcer at our hospital from July 2020 to April 2023. According to the histopathological diagnosis by gastroscopy, the patients were divided into either a simple ulcer group (184 cases) or a gastric cancer group (31 cases). Serum PGⅠ, PGⅡ, G-17, and tumor markers [including carbohydrate antigen (CA)724, CA199, carcinoembryonic antigen (CEA), and ferritin] were detected on admission. The delta over baseline (DOB) value of Helicobacter pylori (H. pylori) infection was measured by the 13C breath test.
There were no differences in gender, age, DOB value, or disease course between the two groups (P > 0.05). Compared with the simple ulcer group, serum levels of PGⅡ, G-17, CA724, CA199, and CEA in the gastric cancer group were increased, while PGⅠ, ferritin, and PGⅠ/PGⅡ ratio were decreased (P < 0.05). Spearman test showed that PGⅠ/PGⅡ ratio was negatively correlated with G-17, CA724, CA199, and CEA, and positively correlated with ferritin (P < 0.05). G-17 was positively correlated with CA724, CA199, and CEA, and negatively correlated with ferritin (P < 0.05). Receiver operating curve (ROC) analysis showed that the area under the ROC curve (AUC) of PGⅠ/PGⅡ ratio and G-17 for diagnosing canceration of gastric ulcer was 0.804 and 0.742, respectively. The AUC of PGⅠ/PGⅡ ratio combined with G-17 was 0.899, significantly higher than that of either indicator alone (P < 0.05).
The decrease of serum PGⅠ/PGⅡ ratio and increase of G-17 are closely related to the canceration of gastric ulcer. The combination of PGⅠ/PGⅡ ratio and G-17 has good predictive performance for canceration of gastric ulcer. PGⅠ/PGⅡ ratio and G-17 can serve as sensitive biomarkers for the early diagnosis of gastric cancer.
- Citation: Yu QY, Zhang HC, Jin H. Prediction of canceration of gastric ulcer with serum pepsinogen Ⅰ/Ⅱ ratio and gastrin-17. Shijie Huaren Xiaohua Zazhi 2023; 31(20): 846-851
- URL: https://www.wjgnet.com/1009-3079/full/v31/i20/846.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i20.846
幽门螺旋杆菌(Helicobacter pylori, H. pylori)感染已经被证实与消化道相关疾病尤其是溃疡的发生密切相关, 是胃溃疡的强效预测因子[1]. 胃溃疡有一定的癌变率, 尤其是老年患者、长期难治性溃疡、继发穿孔或者出血, 癌变的几率显著升高[2,3]. 早期识别溃疡继发癌变的高危患者对降低胃癌的发生率, 提高胃癌手术根治率具有十分重要的临床意义. 通过筛选血清敏感性标志物是早期诊断肿瘤的重要途径. 早期研究认为[4], 肿瘤标志物如癌抗原(cancer antigen, CA)199、癌胚抗原(carcinoembryonic antigen, CEA)于消化道肿瘤的发生密切相关, 但是缺乏组织特异性. 胃蛋白酶原和胃泌素-17(gastrin-17, G-17)是胃腺体细胞分泌的特异性组织蛋白, 不仅发挥消化酶的特性, 同时也能反映腺体细胞的生物学功能. 在溃疡和癌变的情况下对腺体细胞的损伤程度可能不一致, 从而导致胃蛋白酶原和G-17的分泌异常[5,6]. 我们推测, 胃蛋白酶原和G-17在预测胃溃疡继发癌变方面可能有一定参考价值. 搜索国内外文献尚无确切且统一的观点阐述胃蛋白酶原和G-17预测胃溃疡继发癌变的临床价值. 基于此, 本研究重点分析血清胃蛋白酶原Ⅰ(pepsinogen Ⅰ, PGⅠ)/胃蛋白酶原Ⅱ(pepsinogen Ⅱ, PGⅡ)联合G-17预测胃溃疡继发癌变的临床价值, 以期为胃癌的早期诊断提供敏感性生化标志物.
回顾性总结2020-07/2023-04我院初诊断胃溃疡患者215例. 纳入标准: (1)年龄大于18岁; (2)符合胃溃疡的诊断标准, 有完整的胃镜下组织病理学诊断结果; (3)临床资料完整. 排除标准: (1)既往进行手术或者放化疗; (2)已经确诊胃癌或者消化道其他部位肿瘤; (3)同时参与其他研究.
根据胃镜下组织病理学诊断分为单纯溃疡组184例和胃癌组31例. 由我院经验丰富的胃镜室医师根据病变情况至少获取三个不同区域组织标本, 体积至少大于1 cm3. 由经验丰富的2名病理科医师对组织标本的病理图像分别判读, 再对疑虑的组织标本讨论以及综合判断确定, 仍有疑虑的咨询额外1名病理科医师共同讨论确定, 有完整的病理报告.
入院24 h内检测血清PGⅠ、PGⅡ、G-17和肿瘤标志物, 包括CA724、CA199、CEA和铁蛋白, ELISA法检测对应指标, 试剂盒购自武汉明德生物科技股份有限公司, 根据说明书步骤进行. 13C呼气试验测定H. pylori感染超基准(delta over baseline, DOB)值, 试剂盒购自深圳市中核海得威生物科技有限公司, 国药准字H20000021.
统计学处理 以SPSS 20.0统计软件对计量资料(均数±标准差)比较采用t检验, 计数资料[例(%)]比较用χ2检验; Spearman检验做相关分析, 受试者工作曲线(receiver operating curve, ROC)计算曲线下面积(area under curve, AUC)、敏感度和特异度, 获取最佳临界值, AUC比较采用Z检验. 取双侧检验水准α = 0.05.
两组性别、年龄、DOB值、病程、溃疡出血、质子泵抑制剂(proton pump inhibitor, PPI)使用率以及溃疡的严重程度比较无明显差异. 见表1.
| 组别 | 例数 | 男/女 | 年龄(岁) | DOB值 | 病程(mo) | 溃疡出血[例(%)] | PPI抑制剂[例(%)] | 严重程度(轻/中/重度) |
| 溃疡组 | 184 | 112/42 | 58.9±9.3 | 92.3±13.3 | 15.6±5.3 | 15(8.2) | 89(48.4) | 45/77/62 |
| 胃癌组 | 31 | 19/12 | 57.6±8.8 | 102.5±16.5 | 17.8±6.9 | 5(16.1) | 15(48.4) | 5/15/11 |
| t/χ2 | 1.633 | 0.659 | 1.124 | 0.432 | 2.001 | 0.000 | 1.081 | |
| P | 0.201 | 0.452 | 0.102 | 0.724 | 0.157 | 0.999 | 0.582 |
与单纯溃疡组相比, 胃癌组血清PGⅡ、G-17、CA724、CA199和CEA水平升高, 而PGⅠ、铁蛋白和PGⅠ/PGⅡ下降(P<0.05). 见表2.
| 组别 | 例数 | PGⅠ(μg/L) | PGⅡ(μg/L) | PGⅠ/PGⅡ | G-17(pmol/L) | CA724(U/mL) | CA199(U/mL) | CEA(ng/mL) | 铁蛋白(ng/mL) |
| 溃疡组 | 184 | 112.3±25.6 | 9.8±3.2 | 11.5±2.3 | 21.2±4.5 | 4.6±1.3 | 10.2±3.4 | 1.8±0.4 | 65.8±13.5 |
| 胃癌组 | 31 | 65.3±14.7 | 15.8±4.6 | 4.1±0.9 | 30.3±6.9 | 7.7±2.2 | 16.5±4.7 | 4.6±1.3 | 36.5±9.1 |
| t | 15.326 | 10.203 | 17.758 | 9.635 | 4.526 | 5.002 | 4.032 | 6.032 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
Spearman检验显示, PGⅠ/PGⅡ与G-17、CA724、CA199和CEA呈负相关, 与铁蛋白呈正相关(P<0.05). G-17与CA724、CA199和CEA呈正相关, 与铁蛋白呈负相关(P<0.05). 见表3.
| 指标 | PGⅠ/PGⅡ | G-17 | ||
| rs值 | P | rs值 | P | |
| G-17 | -0.756 | <0.001 | - | - |
| CA724 | -0.452 | 0.002 | 0.423 | 0.005 |
| CA199 | -0.469 | 0.001 | 0.467 | 0.001 |
| CEA | -0.521 | <0.001 | 0.498 | <0.001 |
| 铁蛋白 | 0.369 | 0.012 | -0.389 | 0.009 |
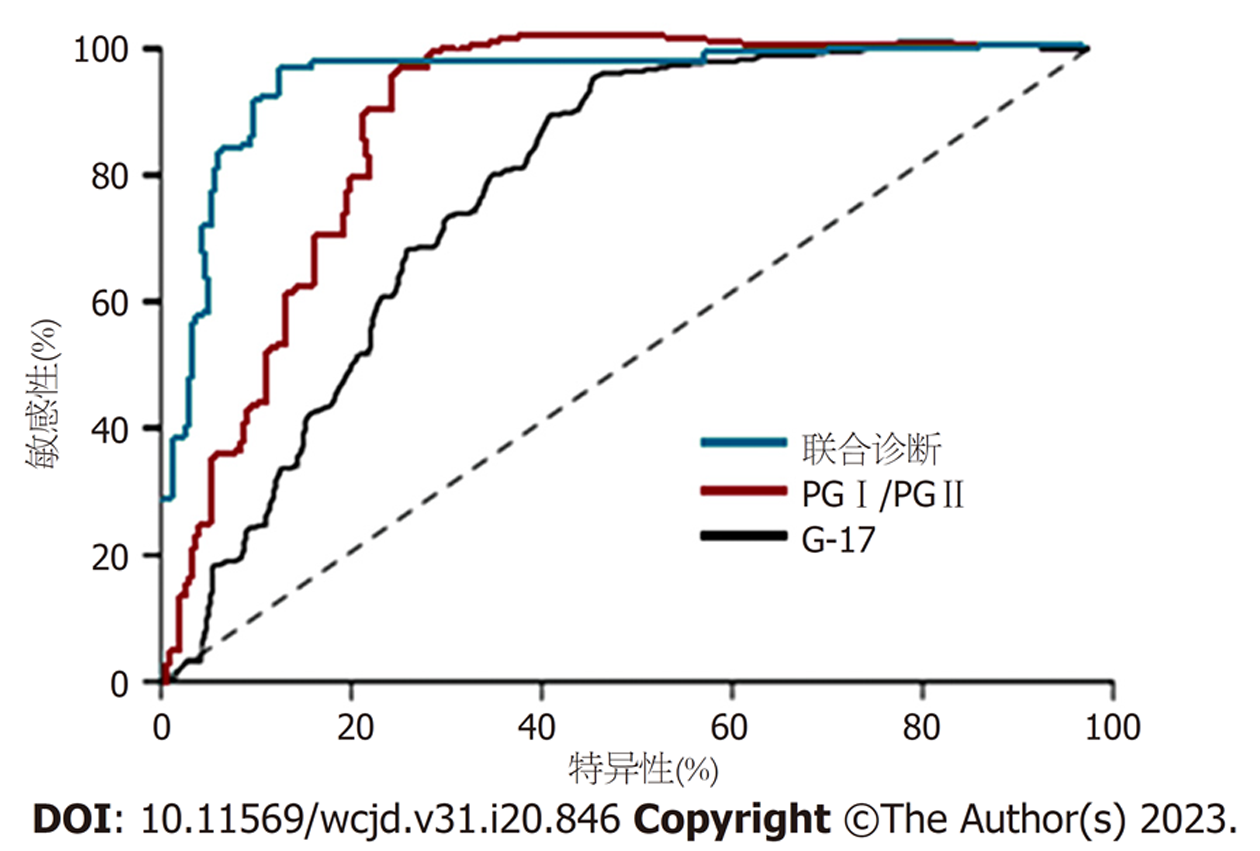
ROC显示, PGⅠ/PGⅡ和G-17诊断胃溃疡继发癌变的AUC分别为0.804和0.742, PGⅠ/PGⅡ和G-17联合诊断的AUC为0.899, 显著高于单一指标(Z = 4.021和4.998, P<0.05). 见表4和图1.
| 指标 | AUC | 95%CI | P | 敏感度(%) | 特异度(%) | 临界值 |
| PGⅠ/PGⅡ | 0.804 | 0.745-0.866 | <0.001 | 72.5 | 84.5 | 6.9 |
| G-17 | 0.742 | 0.711-0.802 | 0.003 | 71.1 | 77.9 | 25.6 pmol/L |
| 联合诊断 | 0.899 | 0.823-0.945 | <0.001 | 83.3 | 95.8 | - |
已经证实[7], 胃溃疡是胃癌的独立危险因素. H. pylori引起的慢性炎症与胃癌发生有关, 胃癌的风险与胃炎的炎症程度密切相关[8]. 虽然胃癌和胃溃疡都与H. pylori感染有关, 但它们的确切病因机制不同. 胃癌是由上皮细胞不受控制的增殖引起, 并伴有低酸分泌(或低氯血症); 而胃溃疡是由胃上皮层伤口愈合中断引起, 并与高氯血症有关[9]. 虽有研究探讨了胃溃疡继发癌变的临床特征和主要危险因素[10], 但尚未寻找到特异性用于胃溃疡继发癌变的确切的早期诊断生物标记物.本研究则探讨了血清PGⅠ/PGⅡ联合G-17预测胃溃疡继发癌变的临床价值, 具有一定的实践价值.
本研究显示, 两组性别、年龄、DOB值和病程比较无明显差异, 提示单纯根据H. pylori感染的定量DOB值不能作为评估癌变风险的主要依据. 尽管理论上H. pylori感染越严重, 溃疡的疾病程度可能也越严重, 溃疡相关并发症如出血和穿孔的几率越高, 癌变的风险也相应升高[11], 但DOB值尚不能作为鉴别溃疡与胃癌的客观依据. 胃癌组血清PGⅡ、G-17、CA724、CA199和CEA水平升高, 而PGⅠ、铁蛋白和PGⅠ/PGⅡ下降. CA724、CA199、CEA和铁蛋白是评估消化道恶性肿瘤的常用指标. 如张志伟[12]指出, 联合血清趋化因子(C-C基元)配体20、CEA和CA724可用于诊断H. pylori感染的慢性萎缩性胃炎患者发生癌前病变的风险. 陈丽丽等[13]研究显示, 联合血清胃蛋白酶原、CA724和CA199诊断早期胃癌的敏感度和特异度较好. 强金虎[14]发现, 血浆纤维蛋白原、前清蛋白和铁蛋白检测对老年胃癌具有较高的诊断性能. 但不同的研究往往选取不同的肿瘤标志物, 目前尚无敏感度和特异度满意的标志物用于胃癌的早期鉴别诊断.
胃蛋白酶原(pepsinogen, PG)是胃黏膜细胞分泌的一种天冬氨酸蛋白酶, 是胃液中胃蛋白酶的非活性前体. 它由375个氨基酸组成, 分子量约42 kDa, PGⅠ和PGⅡ的基因表达位点不同, 分别位于11号和6号染色体上. PG合成后主要释放到胃里, 一小部分通过胃粘膜的毛细血管进入血液循环. PG可以反映胃黏膜的功能和状态, 与胃病变密切相关. 胃癌患者内镜治疗后PG含量高于手术前[15]. 胃溃疡患者血清PG含量较高[16]. PG血清学检测具有无创性、价格低廉、便于动态监测等优点, 还具有与萎缩性胃炎和胃癌高发地区的大规模筛查相兼容的成本效益[17]. Han等[18]指出, PGⅠ、PGⅡ和PGⅠ/PGⅡ联合检测对胃癌的筛查、预防和诊断具有重要的临床价值. 陈少华[19]指出, PGⅠ/PGⅡ可作为青年胃癌的早期筛查指标. 赵茜等[20]研究显示, 胃癌前病变H. pylori感染与血清G-17、PGⅠ/PGⅡ和CA724的异常表达高度相关. 段才华等[21]也认为, 联合血清G-17、PGⅠ、PGⅡ和CA724检测可提高胃癌的筛查率, 反应胃癌组织的病理严重程度.
胃泌素由胃的内分泌G细胞合成, 并刺激顶叶细胞分泌胃酸. 胃酸可将无活性的胃蛋白酶原转化为活性胃蛋白酶. G-17和G-34是经典的胃泌素, G-17在胃窦粘膜中更普遍, G-34在十二指肠中占主导地位. 胃泌素病理条件下可促进胃上皮细胞增殖、抑制细胞凋亡并支持其迁移[22]. 基于这些生理学, 萎缩中胃腺体的损失会降低PG和G-17水平[23]. 健康人群中, 高水平的血清G-17(>15 pmol/L)与萎缩性胃炎的患病风险增加显著相关. 但随着胃病的进展, 血清G-17对萎缩性胃炎的诊断强度逐渐下降, 尤其是进展为胃癌时[24]. 建议将G-17纳入胃癌前病变的筛查和预测模型中, 以实现对胃癌的准确风险分层. Cai等[25]对中国人群进行了一项全国性的多中心横断面研究, 共筛选出7个胃癌的风险预测变量(年龄、性别、PG Ⅰ/Ⅱ、G-17、H. pylori感染、腌制食品和油炸食品), 构建的量化模型对预测胃癌的发生具有较好的准确性.
本研究显示, PGⅠ/PGⅡ与G-17、CA724、CA199和CEA呈负相关, 与铁蛋白呈正相关. G-17与CA724、CA199和CEA呈正相关, 与铁蛋白呈负相关. 提示, PGⅠ/PGⅡ和G-17异常表达与肿瘤标志物可能存在内在联系. 进一步采用ROC显示, PGⅠ/PGⅡ和G-17联合诊断胃溃疡继发癌变的AUC最高, 提示PGⅠ/PGⅡ联合G-17对筛查胃溃疡继发癌变的高危患者具有一定的应用潜力.
综上所述, 血清PGⅠ/PGⅡ下降和G-17升高与胃溃疡继发癌变紧密相关, PGⅠ/PGⅡ联合G-17对胃溃疡继发癌变的预测性能较好, PGⅠ/PGⅡ和G-17可作为诊断胃癌早期的敏感性标志物.
筛选胃溃疡继发癌变的生物标志物对胃癌的及早预防、诊断和治疗具有重要的临床应用价值.
胃蛋白酶原和胃泌素-17(gastrin-17, G-17)可能是鉴别胃癌高危人群的标志物.
探讨血清(pepsinogen Ⅰ, PGⅠ)/胃蛋白酶原II(pepsinogen Ⅱ, PGⅡ)联合G-17在胃溃疡继发癌变的高危患者用于胃癌风险筛查的临床应用价值.
纳入184例胃溃疡患者和31例胃癌患者, 比较两组患者的血清PGⅠ/PGⅡ及G-17和肿瘤标志物的含量差异. Spearman检验分析PGⅠ/PGⅡ及G-17与肿瘤标志物的相关性, 受试者工作曲线分析PGⅠ/PGⅡ和G-17诊断胃溃疡继发癌变临床价值.
胃癌组血清PGⅡ、G-17水平升高, 而PGⅠ和PGⅠ/PGⅡ降低. PGⅠ/PGⅡ与癌抗原724、199和癌胚抗原呈负相关, 与铁蛋白呈正相关; 而G-17反之. PGⅠ/PGⅡ、G-17及二者联用诊断胃溃疡继发癌变的曲线下面积分别为0.804、0.742和0.899, 其中PGⅠ/PGⅡ、G-17的最佳临界值分别为6.9 pmol/L和25.6 pmol/L.
血清PGⅠ/PGⅡ降低和G-17升高与胃溃疡继发癌变有关, 其区分癌变可能性的PGⅠ/PGⅡ、G-17的最佳临界值分别为6.9 pmol/L和25.6 pmol/L.
PGⅠ/PGⅡ联合G-17可用于胃溃疡继发癌变的高危患者的早癌风险筛查.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): E
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Yu C, Qiu J, Xiong M, Ou C, Zeng M, Song H. Trends in Helicobacter pylori-related gastric ulcer research from 2012 to 2022: A bibliometric and visual analysis. Front Med (Lausanne). 2022;9:1027534. [PubMed] [DOI] |
| 3. | 陈 绪阳, 吉 茂礼, 刘 雪花, 魏 铁军, 张 恒, 郭 艺静, 张 永利, 姜 萌. 外周血MPV, PDW与血清CEA联合检测对胃癌和胃溃疡的鉴别诊断作用. 现代检验医学杂志. 2019;34:107-110+141. [DOI] |
| 4. | Abd Temur A, Aqeel Rashid F. Irisin and Carcinoembryonic Antigen (CEA) as Potential Diagnostic Biomarkers in Gastric and Colorectal Cancers. Rep Biochem Mol Biol. 2021;10:488-494. [PubMed] [DOI] |
| 5. | Dong Z, Zhang X, Chen X, Zhang J. Significance of Serological Gastric Biopsy in Different Gastric Mucosal Lesions: an Observational Study. Clin Lab. 2019;65. [PubMed] [DOI] |
| 6. | Lin Z, Bian H, Chen C, Chen W, Li Q. Application of serum pepsinogen and carbohydrate antigen 72-4 (CA72-4) combined with gastrin-17 (G-17) detection in the screening, diagnosis, and evaluation of early gastric cancer. J Gastrointest Oncol. 2021;12:1042-1048. [PubMed] [DOI] |
| 7. | Zhang R, Li H, Li N, Shi JF, Li J, Chen HD, Yu YW, Qin C, Ren JS, Chen WQ, He J. Risk factors for gastric cancer: a large-scale, population-based case-control study. Chin Med J (Engl). 2021;134:1952-1958. [PubMed] [DOI] |
| 8. | Li B, Cheung KS, Wong IY, Leung WK, Law S. Nonaspirin nonsteroidal anti-inflammatory drugs and gastric cancer risk after Helicobacter pylori eradication: A territory-wide study. Cancer. 2021;127:1805-1815. [PubMed] [DOI] |
| 9. | Wang J, Yao Y, Zhang Q, Li S, Tang L. Inflammatory responses induced by Helicobacter pylori on the carcinogenesis of gastric epithelial GES1 cells. Int J Oncol. 2019;54:2200-2210. [PubMed] [DOI] |
| 11. | Liatsos C, Papaefthymiou A, Kyriakos N, Galanopoulos M, Doulberis M, Giakoumis M, Petridou E, Mavrogiannis C, Rokkas T, Kountouras J. Helicobacter pylori, gastric microbiota and gastric cancer relationship: Unrolling the tangle. World J Gastrointest Oncol. 2022;14:959-972. [PubMed] [DOI] |
| 15. | Trivanovic D, Plestina S, Honovic L, Dobrila-Dintinjana R, Vlasic Tanaskovic J, Vrbanec D. Gastric cancer detection using the serum pepsinogen test method. Tumori. 2022;108:386-391. [PubMed] [DOI] |
| 17. | 石 振旺, 方 东, 鲍 德明, 王 黎明, 许 勤, 赵 敏, 陈 正. 胃癌高发地区慢性萎缩性胃炎血清幽门螺杆菌抗体分型情况以及癌变风险的差异. 安徽医药. 2023;27:332-336. [DOI] |
| 18. | Han XL, Yi CL, Ma JD, He Y, Wu LM, Wang YF, Yang HJ, Liang DY, Shi JF. Clinical Value of Pepsinogen in the Screening, Prevention, and Diagnosis of Gastric Cancer. Lab Med. 2022;53:71-77. [PubMed] [DOI] |
| 19. | 陈 少华, 张 倩, 孙 永梅, 李 明. PGI/PGII比值在青年胃癌患者诊断价值研究. 安徽理工大学学报(自然科学版). 2022;42:103-108. |
| 21. | 段 才华, 刘 九思, 王 全根, 丁 萍, 王 延庆. 血清G-17、PGI、PGII及CA724联合外周血RDW、PDW检测在胃癌筛查中的意义分析. 现代诊断与治疗. 2021;32:3959-3960. |
| 22. | Shen H, Xiong K, Wu X, Cheng S, Lou Q, Jin H, Zhang X. The Diagnostic Value of Serum Gastrin-17 and Pepsinogen for Gastric Cancer Screening in Eastern China. Gastroenterol Res Pract. 2021;2021:6894248. [PubMed] [DOI] |
| 23. | Li X, Feng M, Yuan G. Clinical efficacy of Weisu granule combined with Weifuchun tablet in the treatment of chronic atrophic gastritis and its effect on serum G-17, PG I and PG II levels. Am J Transl Res. 2022;14:275-284. [PubMed] |
| 24. | Wang R, Chen XZ. Prevalence of atrophic gastritis in southwest China and predictive strength of serum gastrin-17: A cross-sectional study (SIGES). Sci Rep. 2020;10:4523. [PubMed] [DOI] |
| 25. | Cai Q, Zhu C, Yuan Y, Feng Q, Feng Y, Hao Y, Li J, Zhang K, Ye G, Ye L, Lv N, Zhang S, Liu C, Li M, Liu Q, Li R, Pan J, Yang X, Zhu X, Li Y, Lao B, Ling A, Chen H, Li X, Xu P, Zhou J, Liu B, Du Z, Du Y, Li Z; Gastrointestinal Early Cancer Prevention & Treatment Alliance of China (GECA). Development and validation of a prediction rule for estimating gastric cancer risk in the Chinese high-risk population: a nationwide multicentre study. Gut. 2019;68:1576-1587. [PubMed] [DOI] |