修回日期: 2013-07-11
接受日期: 2013-07-31
在线出版日期: 2013-09-08
目的: 探讨大鼠白介素-10(rat interleukin-10, rIL-10)基因干预对猪血清诱导的大鼠肝纤维化的拮抗作用及其对肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、血小板衍生生长因子-β(platelet derivative growth factor-β, PDGF-β)和环氧合酶-2(cyclooxygenase-2, COX-2)表达的影响.
方法: 30只清洁级SD大鼠被随机分为正常对照组(N组)和纤维化模型组, N组每周腹腔注射2次生理盐水, 每次0.5 mL, 共8 wk; 纤维化模型组每周腹腔注射2次猪血清, 每次0.5 mL, 共8 wk. 至造模第5周开始纤维化模型组随机分为纤维化组(M组), rIL-10质粒治疗组(I组), 空质粒对照组(P组). N组和M组大鼠尾静脉注射林格氏液作为试剂对照, I组大鼠尾静脉注射pcDNA3-rIL-10质粒, P组大鼠尾静脉注射pcDNA3.0空质粒, 1次/wk. 所有大鼠在第8周末处死, 通过HE染色检测各组大鼠肝组织病理改变; SP免疫组织化学检测各组大鼠肝脏TNF-α、PDGF-β和COX-2表达的情况.
结果: 肝组织学病理显示猪血清诱导肝纤维化模型造模成功, rIL-10基因干预能明显降低大鼠肝纤维化的程度, 与M组和P组相比, I组纤维化程度明显下降. 免疫组织化学结果显示: M组、P组TNF-α、PDGF-β和COX-2较N组表达明显增加(0.2206±0.0434, 0.2217±0.0518 vs 0.1860±0.0104; 0.2891±0.0417, 0.2818±0.0272 vs 0.2514±0.0228; 0.2174±0.0429, 0.2117±0.0221 vs 0.1987±0.0106, 均P<0.01); I组TNF-α、PDGF-β和COX-2较M组、P组表达显著减低(0.2048±0.0124 vs 0.2206±0.0434, 0.2217±0.0518; 0.2513±0.0165 vs 0.2891±0.0417, 0.2818±0.0272; 0.1961±0.0142 vs 0.2174±0.0429, 0.2117±0.0221, 均P<0.01).
结论: rIL-10基因干预能有效拮抗猪血清诱导的大鼠肝纤维化形成, 其机制可能与其抑制肝组织中TNF-α、PDGF-β和COX-2的表达相关.
核心提示: 肝组织学病理显示猪血清诱导肝纤维化模型造模成功, 大鼠白介素-10(rat interleukin-10, rIL-10)基因干预能明显降低大鼠肝纤维化的程度, 免疫组织化学结果显示通过大鼠尾静脉高压注射rIL-10质粒显著降低肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、血小板衍生生长因子-β(platelet derivative growth factor-β, PDGF-β)和环氧合酶-2(cyclooxygenase-2, COX-2)的表达, 其机制可能为rIL-10基因在肝组织中高表达, 高表达的IL-10可能通过直接或间接抑制或下调肝组织内TNF-α、PDGF-β和COX-2的表达从而发挥抗纤维化作用.
引文著录: 林颖, 黄月红, 陈治新, 王小众, 张莉娟. 白介素-10基因干预对纤维化大鼠TNF-α、PDGF-β和COX-2表达的影响. 世界华人消化杂志 2013; 21(25): 2571-2577
Revised: July 11, 2013
Accepted: July 31, 2013
Published online: September 8, 2013
AIM: To study the effect of intravenous injection of recombinant IL-10 (rIL-10) gene vector on the expression of tumor necrosis factor-α (TNF-α), platelet derivative growth factor-β (PDGF-β) and cyclooxygenase-2 (COX-2) in pig serum-induced experimental liver fibrosis in rats.
METHODS: Thirty SD rats were divided into a normal control and a fibrosis model group. The normal control group was intraperitoneally injected with 0.5 mL of normal sodium twice a week for 8 wk, while the fibrosis model group was injected with equal volume of pig serum for the same duration. At the beginning of the 5th week, the fibrosis model group was further randomly divided into a fibrosis model subgroup, a rIL-10 gene therapy subgroup and an empty vector control subgroup. Rats in the normal control group and fibrosis model subgroup were injected with Ringer's solution (as a reagent control) via the tail vein weekly, the rIL-10 gene therapy subgroup was injected with rIL-10 plasmid pcDNA3-rIL-10, and the empty vector control subgroup was injected with empty vector pcDNA3. All rats were sacrificed at the end of the 8th week, and liver tissue samples were collected to observe pathological changes in liver tissue by HE staining and to detect the expression of TNF-α, PDGF-β and COX-2 in liver tissue by immunohistochemistry.
RESULTS: Histopathology analysis proved that experimental liver fibrosis was induced successfully with pig serum. Compared with the fibrosis model subgroup and empty vector control subgroup, the rIL-10 gene therapy subgroup showed mild liver cell degeneration, decreased inflammatory cell infiltration and collagen deposition. Compared with the normal control group, the expression of TNF-α, PDGF-β and COX-2 was significantly increased in the fibrosis model subgroup and empty vector control subgroup (0.2206 ± 0.0434, 0.2217 ± 0.0518 vs 0.1860 ± 0.0104; 0.2891 ± 0.0417, 0.2818 ± 0.0272 vs 0.2514 ± 0.0228; 0.2174 ± 0.0429, 0.2117 ± 0.0221 vs 0.1987 ± 0.0106, all P < 0.01). Compared with the fibrosis model subgroup and empty vector control subgroup, the expression of TNF-α, PDGF-β and COX-2 was significantly reduced in the rIL-10 gene therapy subgroup (0.2048 ± 0.0124 vs 0.2206 ± 0.0434, 0.2217 ± 0.0518; 0.2513 ± 0.0165 vs 0.2891 ± 0.0417, 0.2818 ± 0.0272; 0.1961 ± 0.0142 vs 0.2174 ± 0.0429, 0.2117 ± 0.0221, all P < 0.01).
CONCLUSION: rIL-10 gene treatment attenuates pig serum-induced liver fibrosis in rats possibly by reducing the expression of TNF-α, PDGF-β and COX-2 in liver tissue.
- Citation: Lin Y, Huang YH, Chen ZX, Wang XZ, Zhang LJ. Effect of intravenous injection of recombinant IL-10 gene vector on expression of TNF-α, PDGF-β and COX-2 in experimental fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(25): 2571-2577
- URL: https://www.wjgnet.com/1009-3079/full/v21/i25/2571.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i25.2571
肝纤维化是由于肝脏细胞外基质(extracellular matrix, ECM)合成与降解失衡所致, 肝星形细胞(hepatic stellate cell, HSC)是肝脏合成ECM的主要细胞, 其活化与增殖是肝纤维化形成的中心环节[1], 细胞因子在此环节中起着重要作用. 白介素-10(interleukin-10, IL-10)是一种免疫抑制细胞因子, 具有免疫调节作用及抗炎作用[2], 但其拮抗肝纤维化的作用机制仍不清楚. 本研究室先期研究证实外源性IL-10具有抑制肝脏的炎症反应、抑制HSC的活化与增殖和抑制ECM的合成等抗纤维化的特性, 为IL-10基因治疗肝纤维化提供了一定的理论依据[3]. 本实验采用猪血清诱导肝纤维化模型, 行大鼠白介素-10(rat interleukin-10, rIL-10)基因干预, 通过观察肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、血小板衍生生长因子-β(platelet derivative growth factor-β, PDGF-β)和环氧合酶-2(cyclooxygenase-2, COX-2)在肝组织中的表达情况, 进而探讨rIL-10基因干预对肝纤维化形成的拮抗作用及其机制.
♂清洁级SD大鼠30只, 体质量200-300 g, 中国科学院上海实验动物中心[许可证号SCXK(沪)2003-0003], 清洁级条件喂养, 自由进食进水; pcDNA-rIL-10真核表达质粒由本实验室构建; rIL-10单克隆抗体由美国Biosourse公司生产; rIL-10 ELISA试剂盒由美国Biosourse公司生产; Qiagen Maxi-Prep试剂盒由美国Qiagen公司生产; Porcine serum由芬兰PAA细胞培养公司生产; 抗体及SP试剂盒由北京中山生物技术有限公司生产; 台式高速离心机(型号: 5417C)为德国Eppendorf公司产品; 相差显微镜(型号: CK2)为日本奥林巴斯公司产品; 显微数码成像系统(型号: BX-41)为日本奥林巴斯公司产品; 酶标仪(型号: ELX-800)为美国宝特BIO-TEK公司产品; 干燥箱(型号: UH-686-101A)为上海实验仪器有限公司产品; 电热恒温水温箱(型号: HW1)为上海实验仪器有限公司产品.
1.2.1 分组: 30只♂清洁级SD大鼠被随机分为正常对照组(N组, 6只)和纤维化模型组(24只). N组每周腹腔注射2次生理盐水, 每次0.5 mL, 共8 wk; 纤维化模型组每周腹腔注射2次猪血清, 每次0.5 mL, 共8 wk; 至造模第5周开始, 模型组被随机分为肝纤维化模型组(M组, 8只), pcDNA3-rIL-10质粒治疗组(I组, 8只), pcDNA3.0空质粒对照组(P组, 8只). N组和M组大鼠尾静脉注射林格氏液作为试剂对照, I组大鼠尾静脉注射pcDNA3-rIL-10质粒, P组大鼠尾静脉注射pcDNA3.0空质粒, 每周1次. 所有大鼠在实验第8周末处死, 收集各组大鼠肝组织.
1.2.2 肝组织病理学检查: 分别将各实验组大鼠肝组织用40g/L甲醛固定后石蜡包埋、切片后行HE染色.
1.2.3 免疫组织化学法检测大鼠肝组织TNF-α、PDGF-β和COX-2的表达: 采用SP免疫组织化学染色, 具体操作按北京中山生物技术有限公司SP试剂盒说明进行. 省略一抗和二抗作为空白对照; 以PBS替换一抗, 作为阴性对照. 阳性染色者在细胞质或/和细胞核或/和细胞膜有棕黄色颗粒沉着. 染色结果根据染色细胞多少及染色深浅判断各指标表达情况, 使用Image-pro plus 5.0软件检测各组目的蛋白平均光密度.
统计学处理 计量资料以mean±SD表示, 组间差异用SPSS17.0统计分析软件包处理, 采用方差分析, P<0.01为差异有统计学意义.
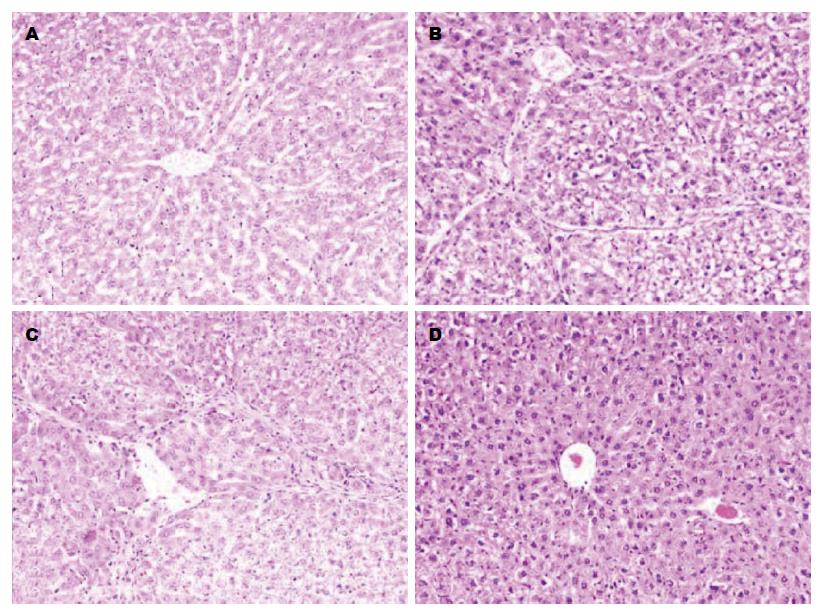
本实验组织病理学结果见文献[4], 如图1所示N组大鼠肝内可见肝小叶结构正常, 肝细胞索排列正常, 仅少量胶原纤维在汇管区中央静脉分布. M组大鼠肝组织发生严重的病理改变: 肝细胞脂肪变性, 中性粒细胞和单核细胞浸润, 大量胶原从汇管区沿肝细胞界板向内延伸形成粗细不等的纤维隔, 小叶结构紊乱, 部分假小叶形成. I组肝细胞变性及坏死程度显著减轻, 汇管区及其周围炎性细胞浸润很少, 小叶结构虽有部分紊乱, 但肝纤维化程度较M组明显减轻. P组大鼠肝组织炎症程度与纤维化程度没有明显的改变, 与M组相似.
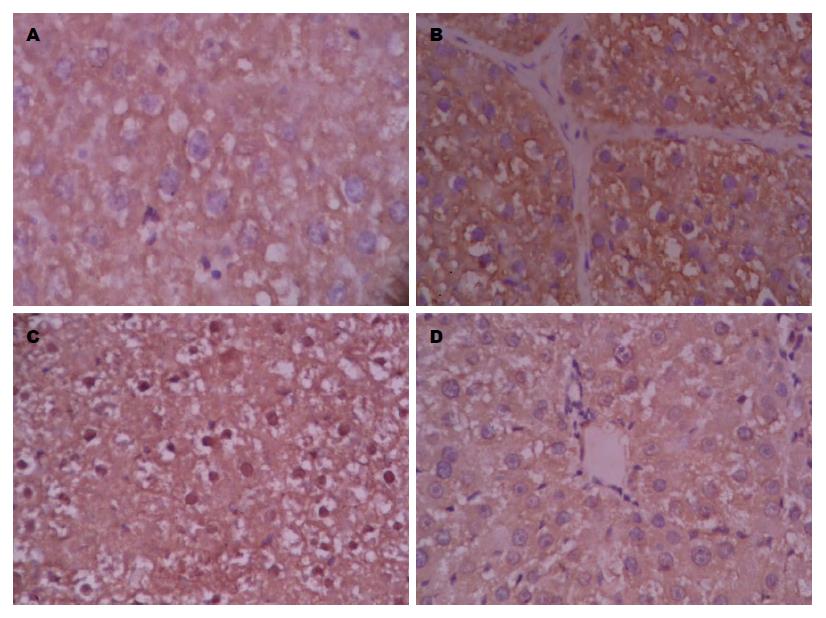
2.2.1 rIL-10基因干预后各组大鼠肝组织中TNF-α的表达情况: 大鼠肝组织免疫组织化学染色结果镜下如图2: TNF-α棕黄色阳性着色部位主要见于肝细胞等细胞的胞质和胞膜. 与N组比较, M组、P组TNF-α阳性表达明显增强, 差别具有统计学意义(P<0.01)(表1); 与M组、P组比较, I组TNF-α阳性着色范围及程度均显著降低, 差别具有统计学意义(P<0.01)(表1).
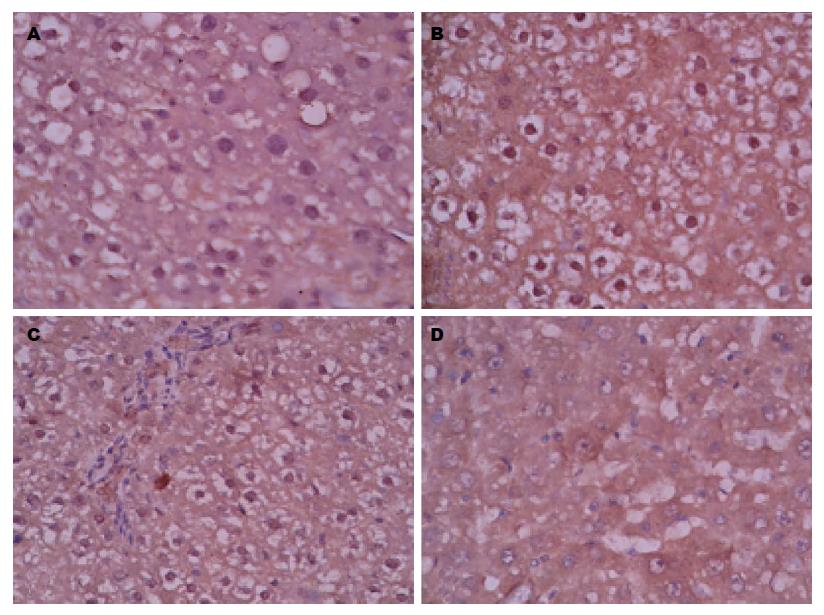
2.2.2 rIL-10基因干预后各组大鼠肝组织中PDGF-β表达情况: 大鼠肝组织免疫组织化学染色结果如图3: PDGF-β棕黄色阳性着色部位主要见于肝细胞等细胞的胞质和胞膜. 与N组比较, M组、P组PDGF-β阳性表达增强, 差别具有统计学意义(P<0.01)(表1); 与M组、P组比较, I组PDGF-β阳性着色范围及程度均显著降低(P<0.01)(表1).
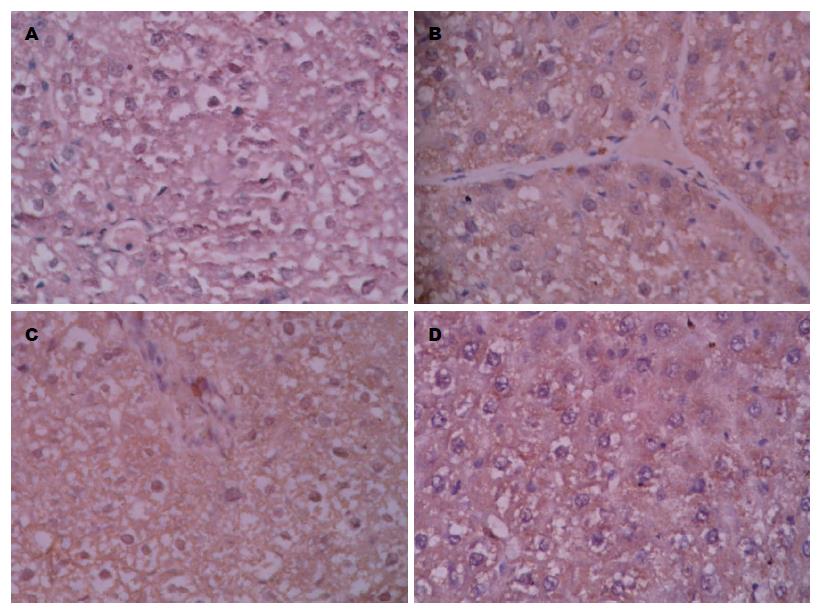
2.2.3 rIL-10基因干预后各组大鼠肝组织中COX-2表达情况: 大鼠肝组织免疫组织化学染色结果镜下如图4: COX-2棕黄色阳性着色位于肝细胞等细胞的胞质. 与N组比较, M组、P组COX-2阳性表达增强, 差别具有统计学意义(P<0.01)(表1); 与M组、P组比较, I组COX-2阳性着色范围及程度均显著降低, 差别具有统计学意义(P<0.01)(表1).
建立合适的动物模型对研究肝纤维化形成的分子机制有着极其重要的作用. 本实验采用猪血清腹腔注射构建肝纤维化动物模型[5]. 猪血清则是免疫性肝纤维化常用的异种抗原, 其中的白蛋白诱导机体产生相应的抗体, 形成抗原-抗体复合物, 沉积于汇管区和间质组织, 通过免疫复合物介导的细胞毒反应活化枯否氏细胞(Kupffer cell, KC)而导致肝血管和间质组织结构的改变, 最终导致肝纤维化[6]. 免疫法造模与临床上慢性肝炎所致肝纤维化和肝硬化在发病机制上较为相似. 本实验肝脏组织病理学结果显示肝细胞有不同程度变性甚至坏死, 中性粒细胞和单核细胞浸润, 增生的纤维组织从汇管区沿肝细胞界板向内延伸形成粗细不等的纤维隔, 小叶结构紊乱, 假小叶形成, 表明构建猪血清诱导的大鼠肝纤维化模型成功. 与以往经典CCl4诱导的肝纤维化模型相比, 猪血清诱导免疫性肝纤维化模型造模操作简单, 大鼠的死亡率低, 所致肝纤维化持久[7].
IL-10由辅助T细胞亚群Th2细胞、B细胞、单核细胞、巨噬细胞、角质细胞和基质细胞等在免疫激活状态下产生. 肝脏KC和活化的HSC也可产生IL-10. IL-10是一种具有多种生物学活性的抗炎性细胞因子, 近来研究显示其与肝纤维化的发生发展密切相关, Roulot等[8]研究显示肝脏IL-10的表达缺失与肝纤维化的进展密切相关. 本研究生前期实验通过尾静脉高压注射法将rIL-10基因转移至肝纤维化大鼠体内, 结果显示rIL-10基因干预的肝纤维化肝脏组织炎症程度及纤维化程度较肝纤维化对照组明显减轻, 具有良好的拮抗肝纤维化形成的作用, 可能与尾静脉高压注射法可使rIL-10基因在肝组织中高表达IL-10相关[9], 其具体的作用机制仍需进一步探讨.
肝脏炎症或损伤等因素除直接对肝细胞造成损害外, 损伤的肝细胞、KC、内皮细胞释放细胞因子, 如TNF-α、转化生长因子β1、PDGF-β、肝细胞生长因子、白细胞介素(IL-1、IL-6)等, 上述因子均能直接或间接地促进HSC的激活[10]. TNF-α是一种致纤维化细胞因子, 他可通过多种途径参与纤维化的调控: 一方面TNF-α可直接促进HSC增殖、合成胶原和蛋白多糖; 另一方面TNF-α作为炎性细胞因子, 可刺激KC等活化、释放更多的细胞因子如PDGF等, 后者活化HSC, 使其产生过量的ECM, 加重肝纤维化的进展[11,12]. 本实验结果证实, 在肝纤维化时TNF-α显著增高, rIL-10基因干预肝纤维化大鼠后, 肝脏组织中TNF-α的表达明显降低. 其机制可能是肝组织高表达IL-10通过抑制炎性细胞因子TNF-α的表达, 使后者致炎作用减轻的同时又能减轻对HSC的直接作用, 从而拮抗肝纤维化的进程.
PDGF是重要的促有丝分裂因子, 有α、β、γ等3种异构体, 其中以β作用最强, 且肝脏中表达以β为主. 在肝纤维化早期, 受到慢性炎症刺激, KC产生并持续释放PDGF-β, 刺激HSC的活化和增殖, 转化为成纤维细胞, 并促使HSC迁移, 聚集于炎症受损区, 而活化的HSC又能分泌PDGF-β并过量表达相应的受体, 从而导致ECM过量产生和沉积[13]. 同时PDGF可上调组织金属蛋白酶抑制物抑制胶原酶的作用, 以减少ECM的降解[14]. ECM合成和降解失衡的结果促进肝纤维化发生. 本实验结果证实, 在肝纤维化时PDGF-β表达显著增高, rIL-10基因干预肝纤维化大鼠后, 肝组织中PDGF-β的表达明显降低. 表明IL-10使肝纤维化的程度明显减轻可能与其显著抑制PDGF-β的表达有着密切的联系. 其机制可能是IL-10通过抑制促有丝分裂因子PDGF-β的表达, 从而使HSC的增殖和活化成成纤维细胞受到一定程度的抑制, 减少ECM的产生, 同时减轻对成纤维细胞的趋化作用, 使之无法到达损伤部位.
目前普遍认为COX-1在大多数组织中(胃、肾、血小板和内皮细胞)表达, 参与合成正常细胞活动所需的前列腺素; 而COX-2是经刺激迅速产生的诱导酶,其催化合成的前列腺素参与炎症反应, 表达在单核、巨噬细胞、滑膜细胞、软骨细胞、成纤维细胞和内皮细胞等. 近来研究表明COX-2可能参与肝损伤的炎性反应, 调节HSC的增殖, 从而促进肝纤维化的形成和发展. Nanji等[15]通过RT-PCR检测组织中COX的表达情况得出COX-2 mRNA在正常大鼠肝脏不表达, 而在小鼠正常肝组织中有低表达, 在急慢性肝损伤、酒精性脂肪肝中, 肝脏COX-2表达明显增高, 表达的细胞主要有KC、肝细胞、贮脂细胞等, 而KC为肝脏COX-2高表达的主要细胞来源. Guéchot等[16]研究显示慢性肝炎肝纤维化患者肝组织中COX-2表达明显上调, 血清透明质酸水平升高, 使用选择性 COX-2抑制剂后二者水平均明显下降. Nieto等[17]研究表明TNF-α可通过COX-2的表达上调单核细胞趋化蛋白1, 促进肝脏损伤后炎性反应, 导致肝纤维化的发生. 本实验结果证实, 在肝纤维化时COX-2显著增高, rIL-10基因干预肝纤维化大鼠后, 肝脏组织中COX-2的表达明显降低. 机制可能是IL-10通过抑制COX-2的表达, 一方面使HSC的增殖和活化受到一定程度的抑制; 另一方面抑制前列腺素E-2生成, 使基质金属蛋白酶组织抑制物合成减少, 进而基质金属蛋白酶能够降解胶原、蛋白多糖等.
总之, 重组rIL-10基因真核表达质粒尾静脉高压注射法能有效地抑制肝纤维化的发展, 对肝纤维化形成具有一定的拮抗作用, 此作用可能与rIL-10基因在肝组织中高表达有关及肝组织内高表达的IL-10可能通过直接或间接抑制或下调肝组织内TNF-α、PDGF-β和COX-2的表达从而抑制HSC的活化, 促进Ⅰ、Ⅲ型胶原的降解, 从而减少ECM堆积.
肝纤维化是以细胞外基质(extracellular matrix, ECM)沉积为特征的创伤愈合过程, 肝星形细胞(hepatic stellate cell, HSC)是肝纤维化发生发展中的关键细胞, HSC活化受细胞因子和细胞内信号转导途径所调控, 其活化过程中的相关调控因子是抗纤维化治疗的重要靶向目标. 肝纤维化分子机制的不断阐明, 将为攻克肝纤维化治疗带来希望.
刘占举, 教授, 同济大学附属上海市第十人民医院
通过抑制肝组织内促纤维化因子的表达从而抑制HSC的活化, 促进Ⅰ、Ⅲ型胶原的降解, 从而减少ECM沉积, 对肝纤维化形成具有一定的拮抗作用. 因此如何抑制促肝纤维化因子的表达成为当前研究热点.
近年来Brito等通过研究发现, 在肝纤维化的进展中TNF-α、PDGF-β和COX-2扮演重要角色, 是抗纤维化治疗重要靶标.
通过向大鼠尾静脉高压注射白介素-10(rat interleukin-10, rIL-10)质粒使rIL-10基因在肝组织中高表达, 而高表达的IL-10可能通过直接或间接抑制或下调肝组织内TNF-α、PDGF-β和COX-2的表达从而抑制HSC的活化, 进而起到抗纤维化作用.
rIL-10基因干预能有效拮抗猪血清诱导的大鼠肝纤维化形成, 其机制可能与其抑制肝组织中TNF-α、PDGF-β和COX-2的表达相关, 为外源性IL-10基因干预治疗肝纤维化提供了一定的理论基础.
本文选题新颖, 具有一定指导意义.
编辑: 田滢 电编: 鲁亚静
| 2. | Jiang J, Yamato E, Miyazaki J. Intravenous delivery of naked plasmid DNA for in vivo cytokine expression. Biochem Biophys Res Commun. 2001;289:1088-1092. [PubMed] [DOI] |
| 3. | 陈 运新, 黄 月红, 郑 伟达, 陈 治新, 王 小众. 大鼠肝细胞对肝星状细胞增殖与 活化的影响及其机制探讨. 胃肠病学和肝病学杂志. 2008;17:933-936. |
| 4. | 黄 月红, 陈 运新, 郑 伟达, 张 莉娟, 陈 治新, 王 小众. 肝脏靶向表达大鼠白介素-10基因对猪血清诱导的大鼠肝纤维化的抑制. 第三军医大学学报. 2011;33:1353-1357. |
| 5. | Bhunchet E, Eishi Y, Wake K. Contribution of immune response to the hepatic fibrosis induced by porcine serum. Hepatology. 1996;23:811-817. [PubMed] [DOI] |
| 6. | Paronetto F, Popper H. Chronic liver injury induced by immunologic reactions. Cirrhosis following immunization with heterologous sera. Am J Pathol. 1966;49:1087-1101. [PubMed] |
| 8. | Roulot D, Sevcsik AM, Coste T, Strosberg AD, Marullo S. Role of transforming growth factor beta type II receptor in hepatic fibrosis: studies of human chronic hepatitis C and experimental fibrosis in rats. Hepatology. 1999;29:1730-1738. [PubMed] [DOI] |
| 10. | Brito JM, Mermelstein CS, Tempone AJ, Borojevic R. Mast cells can revert dexamethasone-mediated down-regulation of stem cell factor. Eur J Pharmacol. 2001;414:105-112. [PubMed] [DOI] |
| 11. | Faouzi S, Lepreux S, Bedin C, Dubuisson L, Balabaud C, Bioulac-Sage P, Desmoulière A, Rosenbaum J. Activation of cultured rat hepatic stellate cells by tumoral hepatocytes. Lab Invest. 1999;79:485-493. [PubMed] |
| 12. | Dooley S, Delvoux B, Lahme B, Mangasser-Stephan K, Gressner AM. Modulation of transforming growth factor beta response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts. Hepatology. 2000;31:1094-1106. [PubMed] [DOI] |
| 13. | Marra F, Gentilini A, Pinzani M, Choudhury GG, Parola M, Herbst H, Dianzani MU, Laffi G, Abboud HE, Gentilini P. Phosphatidylinositol 3-kinase is required for platelet-derived growth factor's actions on hepatic stellate cells. Gastroenterology. 1997;112:1297-1306. [PubMed] [DOI] |
| 14. | Herbst H, Schuppan D, Milani S. [Fibrogenesis and fibrolysis in the liver]. Verh Dtsch Ges Pathol. 1995;79:15-27. [PubMed] |
| 15. | Nanji AA, Miao L, Thomas P, Rahemtulla A, Khwaja S, Zhao S, Peters D, Tahan SR, Dannenberg AJ. Enhanced cyclooxygenase-2 gene expression in alcoholic liver disease in the rat. Gastroenterology. 1997;112:943-951. [PubMed] [DOI] |
| 16. | Guéchot J, Serfaty L, Bonnand AM, Chazouillères O, Poupon RE, Poupon R. Prognostic value of serum hyaluronan in patients with compensated HCV cirrhosis. J Hepatol. 2000;32:447-452. [PubMed] [DOI] |
| 17. | Nieto N, Greenwel P, Friedman SL, Zhang F, Dannenberg AJ, Cederbaum AI. Ethanol and arachidonic acid increase alpha 2(I) collagen expression in rat hepatic stellate cells overexpressing cytochrome P450 2E1. Role of H2O2 and cyclooxygenase-2. J Biol Chem. 2000;275:20136-20145. [PubMed] [DOI] |