修回日期: 2009-09-05
接受日期: 2009-09-15
在线出版日期: 2009-09-28
目的: 探讨益肝康抗肝纤维化作用机制、配伍意义, 并采用对比血清药理学方法探讨更为科学的中药研究方法.
方法: 分别制备益肝康及其拆方-丹参小复方正常大鼠(A组, A1组: 正常大鼠血清对照组; A2组: 正常大鼠丹参小复方血清组; A3组: 正常大鼠益肝康血清组)与肝纤维化大鼠(B组, B1组: 肝纤维化大鼠血清对照组; B2组: 肝纤维化大鼠丹参小复方血清组; B3组: 肝纤维化大鼠益肝康血清组)药物血清, 温育体外培养的HSC, 3H-脯氨酸掺入法检测胶原合成, Western blot技术检测TGF-β1蛋白表达, RT-PCR技术检测TGF-β1 mRNA表达.
结果: 益肝康及丹参小复方正常大鼠与肝纤维化大鼠药物血清均可以抑制HSC胶原合成(100 mL/L时A组: 2275.00±114.30 cpm, 2401.87±108.50 cpm vs 2963.62±128.01 cpm; B组: 2205.31±108.97 cpm, 2462.70±177.02 cpm vs 3179.12±223.34 cpm; 200 mL时A组: 2372.96±123.3 cpm vs 2515.37±98.25 cpm vs 3209.38±110.75 cpm; B组: 2394.29±150.50 cpm vs2611.25±126.05 cpm vs 3490.46±183.16 cpm, P<0.05或0.01), 100 mL时降低TGF-β1基因及蛋白表达(均P<0.01). 2组在胶原合成、TGF-β1基因及蛋白表达益肝康组作用优于丹参小复方(均P<0.01), 而益肝康组与丹参小复方组比较则B组血清作用优于A组(益肝康组: TGF-β1基因: 0.356±0.032 vs 0.568±0.028; TGF-β1蛋白: 0.458±0.009 vs 0.639±0.102; 丹参小复方组: 0.601±0.047 vs 0.810±0.051; 0.612±0.126 vs 0.860±0.138, P<0.05或P<0.01).
结论: 益肝康及丹参小复方均可抑制HSC胶原合成, 其主要机制之一是抑制TGF-β1基因和蛋白表达, 益肝康更具配伍意义, 肝纤维化大鼠药物血清药效优于正常大鼠血清药效.
引文著录: 房澍名, 姚冬梅, 张晓岚, 姚希贤. 拆方益肝康不同药物血清对肝星状细胞胶原代谢及TGF-β1的影响. 世界华人消化杂志 2009; 17(27): 2773-2777
Revised: September 5, 2009
Accepted: September 15, 2009
Published online: September 28, 2009
AIM: To investigate the seropharmacological effects of Yigankang Decoction and its separated recipe on collagen metabolism and transforming growth factor-beta 1 (TGF-β1) expression in hepatic stellate cells (HSCs) and explore the antifibrotic mechanism of Yigankang Decoction.
METHODS: Normal rats and rats with carbon tetrachloride (CCl4)-induced liver fibrosis were administered Yigankang Decoction and its separated recipe (containing radix salvia militiorrhizae, astragalus and angelica sinensis), respectively, to prepare medicated sera. After medicated rat sera were incubated with subcultured HSCs, the synthesis of collagen was evaluated by 3H-proline incorporation assay, and the expression of TGF-β1 mRNA and protein was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: All kinds of medicated rat sera prepared in the study could inhibit 3H-proline incorporation at a concentration of 100 or 200 mL/L (normal rat sera at 100 mL/L: 2275.00 ± 114.30 cpm vs 2401.87 ± 108.50 cpm vs 2963.62 ± 128.01 cpm; fibrotic rat sera at 100 mL/L: 2205.31 ± 108.97 cpm vs 2462.70 ± 177.02 cpm vs 3179.12 ± 223.34 cpm; normal rat sera at 200 mL/L: 372.96 ± 123.3 cpm vs 2515.37 ± 98.25 cpm vs 3209.38 ± 110.75 cpm; fibrotic rat sera at 200 mL/L: 2394.29 ± 150.50 cpm vs 2611.25 ± 126.05 cpm vs 3490.46 ± 183.16 cpm; all P < 0.05 or 0.01), and decrease the expression of TGF-β1 mRNA and protein at a concentration of 100 mL/L (all P < 0.01). The sera from rats medicated with Yigankang Decoction had more significant inhibitory effects on 3H-proline incorporation and TGF-β1 expression than those from rats medicated with the separated recipe (all P < 0.01). The sera from medicated fibrotic rats were superior to those from medicated normal rats in the downregulation of TGF-β1 expression (Yigankang Decoction: TGF-β1 mRNA, 0.356 ± 0.032 vs 0.568 ± 0.028; TGF-β1 protein, 0.458 ± 0.009 vs 0.639 ± 0.102; the separated recipe: TGF-β1 mRNA, 0.601 ± 0.047 vs 0.810 ± 0.051; TGF-β1 protein, 0.612 ± 0.126 vs 0.860 ± 0.138; all P <0.05 or P < 0.01).
CONCLUSION: Both Yigankang Decoction and its separated recipe can inhibit collagen synthesis in HSCs perhaps through inhibiton of TGF-β1 expression. Sera from rats medicated with Yigankang Decoction and from fibrotic rats were superior to those from rats medicated with the separated recipe and from normal rats in inhibiting collagen synthesis and decreasing TGF-β1 expression, respectively.
- Citation: Fang SM, Yao DM, Zhang XL, Yao XX. Seropharmacological effects of Yigankang Decoction and its separated recipe on collagen metabolism and transforming growth factor-beta 1 expression in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2773-2777
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2773.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2773
系列研究表明, 以丹参等活血化瘀药为主组方的益肝康有较好的抗肝纤维化作用[1-5]. 为深入了解该方的抗肝纤维化作用机制、配伍意义以及探讨更为科学的中药研究方法, 我们采用对比血清药理学方法, 即分别提取正常大鼠和CCl4造模肝纤维化大鼠益肝康及其拆方-丹参小复方(丹参、黄芪、归尾)的药物血清, 作用于体外培养的肝星状细胞(hepatic stellate cell, HSC), 探讨该方对HSC胶原代谢及转化生长因子β1 (transforming growth factor-β1, TGF-β1)基因与蛋白表达的影响, 以探讨新的药物作用靶点及配伍意义, 并采用对比血清药物学方法观察在体药物与正常及病态机体相互作用的差异.
益肝康由丹参、黄芪、归尾、赤芍等9味药组成, 丹参小复方由丹参、黄芪、归尾3味药组成, 丹参小复方组中药物用量与益肝康组单味药用量一致, 由河北省消化病研究所制备成浓缩水煎剂灌胃液, 生药浓度0.72 kg/L. 健康♂SD大鼠96只, 清洁级, 体质量280-330 g, 购自河北医科大学实验动物中心. 3H-脯氨酸(3H-Pro)购自中国原子能科学研究院. 小鼠抗TGF-β1 mAb购自美国Santa Cruz公司. 兔抗鼠Actin多克隆抗体购自武汉博士德生物工程有限公司. HRP标记的山羊抗小鼠IgG、ECL发光试剂盒、浓缩型DAB试剂盒均购自北京中山生物技术有限公司. 蛋白Marker购自北京鼎国生物技术发展中心. 硝酸纤维素膜与DNA marker购自华美生物工程公司. RT-PCR扩增系统购自美国Promega公司. 总RNA提取试剂盒购自北京博大泰克生物技术有限公司. TGF-β1引物由上海生工生物工程公司合成. 其余试剂均为进口或国产分析纯.
1.2.1 药物血清制备: 将大鼠随机分为甲组(正常大鼠药物血清组)和乙组(肝纤维化大鼠药物血清组), 每小组48只, 乙组大鼠给予400 mL/L CCl4纯制花生油溶液sc, 首剂4 mL/kg, 以后改为2 mL/kg, 每周2次, 共9 wk; 甲组大鼠给予纯制花生油sc, 剂量及时间同乙组[6]. 9 wk后各组随即抽取3只大鼠, 取肝组织进行HE染色, 鉴定造模成功后将2组大鼠各随机分为3小组, 每组15只, 甲1/乙1: 对照组, 甲2/乙2: 丹参小复方组, 甲3/乙3: 益肝康组, 药物组按成人每千克体质量10倍用量每日分2次给予益肝康/丹参小复方水煎剂ig, 连续5 d, 对照组以生理盐水ig. 第6天按常规量再ig 1次, 1 h后, 下腔静脉取血, 静置3 h, 3000 r/min低温离心20 min, 分离血清, 56℃灭活30 min, 过滤除菌, 加入RPMI 1640培养液, 分别配制成含50、100、200 mL/L药物/对照血清的培养基.
1.2.2 实验分组: A组: 正常大鼠药物血清组, B组: 肝纤维化大鼠药物血清组, 每组各再分为3小组, A1组: 正常大鼠血清对照组, A2组: 正常大鼠丹参小复方血清组, A3组: 正常大鼠益肝康血清组; B1组: 肝纤维化大鼠血清对照组, B2组: 肝纤维化大鼠丹参小复方血清组, B3组: 肝纤维化大鼠益肝康血清组, 每小组6复孔或6培养瓶.
1.2.3 对HSC胶原合成的影响: 采用3H-Pro掺入法. 将HSC以每孔6.0×103的密度接种于96孔培养板, 培养箱中孵育长至亚单层, 换无血清的RPMI 1640继续培养24 h, 使细胞基本同步化于G0期; 分别添加50、100及200 mL/L的正常及肝纤维化大鼠益肝康/丹参小复方药物血清, 200 µL/孔, 温育6 h后, 每孔加入0.3 µCi的3H-Pro, 继续温育18 h; 2.5 g/L胰蛋白酶消化, 将细胞抽滤到玻璃纤维纸上, 蒸馏水洗涤抽滤数次, 60℃烘干, 置于闪烁杯中, 加入5 mL闪烁液, 于液体闪烁记数仪上测定样品放射性(cpm).
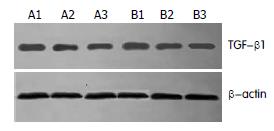
1.2.4 对HSC TGF-β1蛋白表达的影响: 采用Western blot方法. 接种2.0×105-3.0×105个细胞于25 cm2培养瓶, 孵育至细胞近100%融合时, 换不含胎牛血清的培养液继续培养24 h, 使细胞基本同步化于G0期后, 分别添加100 mL/L的正常及肝纤维化大鼠益肝康/丹参小复方药物血清, 5 mL/瓶, 温育HSC 24 h后, 提取HSC胞质蛋白, 进行100 g/L聚丙烯酰胺凝胶电泳; 冷却状态下转膜, 170 mA, 恒流, 1 h; 1:100小鼠抗TGF-β1 mAb 4℃密封过夜; 1:1000辣根过氧化物酶标记的山羊抗小鼠IgG室温密封摇动孵育2 h; ECL发光剂显色1 min, X光片暗室曝光30 s至数分钟, 显影、定影, 密度扫描分析, 灰度值以TGF-β1与Actin的积分吸光度(A)的比值表示.
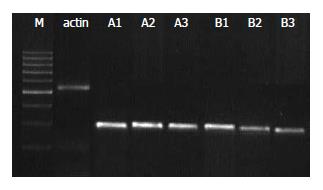
1.2.5 对HSC TGF-β1 mRNA表达的影响: 采用RT-PCR方法. 接种2.0×105-3.0×105个细胞于25 cm2培养瓶, 孵育至细胞近100%融合时, 换不含胎牛血清的培养液继续培养24 h, 使细胞基本同步化于G0期后, 分别添加100 mL/L的正常及肝纤维化大鼠益肝康/丹参小复方药物血清, 5 mL/瓶, 温育HSC 24 h后, 提取HSC总RNA, 进行完整性鉴定及纯度和定量检测, 取2 μg总RNA进行RT-PCR, 使用50 μL反应体系分别扩增TGF-β1和β-actin. TGF-β1引物序列: 上游5'-CTTCAGCTCCACAGAGAAGAACTGC-3', 下游5'-CACGATCATGTTGGACAACTGCTCC-3'(扩增产物大小为298 bp), β-actin: 上游5'-GTCACCCACACTGTGCCCATCT-3', 下游5'-ACAGAGTACTTGCGCTCAGGAG-3'(扩增产物大小为542 bp), 具体循环参数如下, RT: 48℃, 45 min; PCR: 94℃预变性2 min进入循环, 94℃变性30 s, 60℃退火1 min, 68℃延伸1.5 min, 经40个循环扩增后68℃延伸7 min. 取10 μL RT-PCR产物及10 μL DNA Marker进行15 g/L琼脂糖凝胶电泳, 采用MULIT IMAGE凝胶图像分析仪进行吸光度扫描, 结果以TGF-β1与β-actin的积分吸光度的比值表示.
统计学处理 实验数据以mean±SD表示, 采用SPSS13.0软件进行分析, 组间比较采用单因素方差分析, 应用最小显著差法(LSD)进行两两比较, P<0.05为有统计学差异.
2种方法制备的益肝康及丹参小复方药物血清对HSC的3H-Pro掺入均有抑制作用. A组(正常大鼠药物血清)中, 益肝康及丹参小复方药物血清50 mL/L浓度组对3H-Pro掺入抑制作用与对照组相比无显著性差异(P>0.05), 而100、200 mL/L浓度组均具有显著性差异(P<0.01); B组(肝纤维化大鼠药物血清)中: 各浓度益肝康及丹参小复方药物血清组与对照组相比均具有显著性差异(P<0.05, 0.01). 相应浓度的益肝康药物血清对3H-Pro掺入抑制作用优于丹参小复方药物血清, 具有显著性差异(P<0.05, 0.01). 肝纤维化大鼠药物血清对3H-Pro掺入抑制作用优于正常大鼠药物血清(P<0.05, 表1).
| 分组 | 放射性(cpm) | 抑制率(%) | 分组 | 放射性(cpm) | 抑制率(%) |
| A1组 | 2604.11±86.40 | B1组 | 2866.56±188.19 | ||
| A2组 | 2574.51±125.25 | 1.14 | B2组 | 2657.16±149.36a | 7.30 |
| A3组 | 2555.63±105.79 | 1.86 | B3组 | 2453.82±201.63bc | 14.48 |
| A1组 | 2963.62±128.01 | B1组 | 3179.12±223.34 | ||
| A2组 | 2401.87±108.50b | 18.95 | B2组 | 2462.70±177.02b | 22.53 |
| A3组 | 2275.00±114.30bc | 23.20 | B3组 | 2205.31±108.97bd | 30.68 |
| A1组 | 3209.38±110.75 | B1组 | 3490.46±183.16 | ||
| A2组 | 2515.37±98.25b | 21.62 | B2组 | 2611.25±126.05b | 25.19 |
| A3组 | 2372.96±123.30bc | 26.00 | B3组 | 2394.29±150.50bc | 31.47 |
肝纤维化是所有慢性肝病进展成肝硬化的共同病理基础与必经阶段, 是影响慢性肝病预后的重要环节[7-8]. 肝纤维化的病理学基础为细胞外基质(extracellular matrix, ECM)合成增加, 降解减少, 导致胶原过度沉积[9]. HSC是肝脏ECM的主要来源, 是肝纤维化形成的细胞学基础[10-11]. 细胞因子是细胞间信号转导、联系的重要物质基础, HSC活化的启动及延续过程中始终贯穿着细胞因子的网络调节[12]. 由于细胞因子在肝纤维化形成过程中的重要作用, 提示通过控制某些关键细胞因子的活性治疗肝纤维化的可能性. TGF-β1是目前所知最强大的促胶原生成因子, 与细胞膜上的相应受体结合后可激活HSC, 促进HSC分泌Ⅰ、Ⅲ、Ⅳ型胶原、纤维连接蛋白和整合素等, 使ECM合成增加, 并通过抑制基质金属蛋白酶及促进基质金属蛋白酶抑制剂和纤溶酶原激活物抑制因子的活性使ECM降解减少, 还可诱导肝细胞凋亡, 促进血小板衍生生长因子受体的表达, 是肝纤维化形成与发展过程中最为关键的细胞因子之一[13-14]. HSC株是从CCl4诱发的肝硬化大鼠中分离并通过培养使细胞自发获得永久性, 表型为活化的HSC, 是较为理想的肝纤维化研究模型.
肝纤维化属中医"胁痛"、"癥积"、"血瘀"范畴, 病变部位主要关乎肝脾两脏, 肝郁脾虚是本病形成的主要病理基础, 血瘀是本病主要病机特点, 治疗应以活血化瘀为主, 益气健脾为辅. 中药复方益肝康系重用丹参, 辅以当归、赤芍等活血化瘀, 并用黄芪等益气健脾药而成. 为明确益肝康抗肝纤维化的作用机制、配伍意义及进一步简化组方, 本研究所长期以来对该复方有关单味药、丹参小复方及益肝康进行了大量临床与实验研究, 结果表明该方具有减轻症状, 改善肝功能, 抑制HSC活化、增殖, 促进HSC凋亡, 抗脂质过氧化, 保护受损肝细胞及线粒体等细胞器功能等作用, 而且目前尚未发现明显不良反应[1-5]. 本研究表明益肝康、丹参小复方药物血清均可显著抑制HSC胶原合成及TGF-β1基因和蛋白表达, 说明该复方作用机制之一是从mRNA和蛋白水平抑制TGF-β1表达, 从而抑制HSC ECM的合成, 发挥抗肝纤维化作用. 而药物配伍后的益肝康组(A3, B3)较丹参小复方组(A2, B2)具有更为显著的作用, 可能与药物科学配伍后的相辅相乘作用使抗肝纤维化有效成分增加有关, 充分体现了中医君臣佐使配方的整体优势.
血清药理学方法在中药研究中被广泛采用, 但实际临床中服药者大多为病患, 且肝脏作为体内最重要的药物代谢转化器官, 其不同的生理及病理状态对药物代谢转化过程必有不同影响, 而传统血清药理学方法未能解决此类问题. 本部分实验采用"改良血清药理学方法"与传统血清药理学方法进行对比研究, 结果表明肝纤维化大鼠药物血清对HSC胶原合成及TGF-β1基因与蛋白表达的抑制作用均优于正常大鼠药物血清, 分析原因, 是否系中医辨证论治的特点使得该方对肝纤维化病态机体更具针对性, 疗效更明显? 抑或与肝纤维化大鼠肝功能受损, 对药物的转化、代谢能力降低, 从而导致病态机体内药物有效成分浓度提高, 作用时间延长, 使抗肝纤维化作用增强有关? 中药作用机制及有效物质的研究一直是中药新药开发的热点和难点, 已成为中药发展的瓶颈, 血清药理学为科学阐明中药复方的有效成分及作用机制提供了一种有力的工具, 但在实验技术上还需要进一步探讨、规范和完善[15-16].
肝纤维化目前尚无满意的治疗方法, 中医中药显示出良好的前景. 中药复方益肝康经多年的临床与实验研究被证实具有抗肝纤维化作用. 本研究旨在观察该方及其拆方对HSC胶原代谢及TGF-β1的影响, 并对血清药理学方法进行探讨.
李勇, 副教授, 上海中医药大学附属市中医医院消化科.
中药复方益肝康具有多层次、多靶点的抗肝纤维化作用, 但尚无益肝康与拆方对比、正常大鼠药物血清与肝纤维化大鼠药物血清对比, 来观察其对HSC胶原代谢及TGF-β1影响和机制的研究, 这也是中药开发的难点和热点.
本研究将益肝康进行拆方, 以HSC胶原代谢及TGF-β1为靶点探讨该方抗肝纤维化机制及配伍意义, 并将正常大鼠药物血清与肝纤维化大鼠药物血清进行药效学对比, 观察不同状态机体对药物代谢的差异.
本研究探讨了中药复方益肝康新的作用靶点及配伍意义, 为进一步重组、精简组方及抗肝纤维化中药新药开发提供理论依据. 并建立"对比血清药理学方法", 提供了一种具有普遍性的中药研究方法学基础.
本文思路较清晰, 实验设计合理, 统计学处理恰当, 具有一定的科学性及先进性, 为抗纤维化中药研究提供了一种新的思路.
编辑:李军亮 电编:吴鹏朕
| 3. | Zhang YP, Yao XX, Zhao X. Interleukin-1 beta up-regulates tissue inhibitor of matrix metalloproteinase-1 mRNA and phosphorylation of c-jun N-terminal kinase and p38 in hepatic stellate cells. World J Gastroenterol. 2006;12:1392-1396. [PubMed] |
| 5. | Yao XX, Jiang SL, Tang YW, Yao DM, Yao X. Efficacy of Chinese medicine Yi-gan-kang granule in prophylaxis and treatment of liver fibrosis in rats. World J Gastroenterol. 2005;11:2583-2590. [PubMed] |
| 6. | Wei H, Lu H, Li D, Zhan Y, Wang Z, Huang X. The expression of AT1 receptor on hepatic stellate cells in rat fibrosis induced by CCl4. Chin Med J (Engl). 2001;114:583-587. [PubMed] |
| 8. | Rockey DC. Antifibrotic therapy in chronic liver disease. Clin Gastroenterol Hepatol. 2005;3:95-107. [PubMed] [DOI] |
| 9. | Prosser CC, Yen RD, Wu J. Molecular therapy for hepatic injury and fibrosis: where are we? World J Gastroenterol. 2006;12:509-515. [PubMed] |
| 10. | Sarem M, Znaidak R, Macias M, Rey R. [Hepatic stellate cells: it's role in normal and pathological conditions]. Gastroenterol Hepatol. 2006;29:93-101. [PubMed] [DOI] |
| 11. | Urtasun R, Nieto N. [Hepatic stellate cells and oxidative stress]. Rev Esp Enferm Dig. 2007;99:223-230. [PubMed] |
| 12. | Friedman SL. Cytokines and fibrogenesis. Semin Liver Dis. 1999;19:129-140. [PubMed] [DOI] |
| 13. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 14. | Ma HH, Yao JL, Li G, Yao CL, Chen XJ, Yang SJ. Effects of c-myb antisense RNA on TGF-beta1 and beta1-I collagen expression in cultured hepatic stellate cells. World J Gastroenterol. 2004;10:3662-3665. [PubMed] |
| 15. | 李 静, 殷 飞, 姚 树坤. 血清药理学研究进展. 中国中医基础医学杂志. 2009;15:234-236. |