修回日期: 2008-09-29
接受日期: 2008-10-01
在线出版日期: 2008-10-18
目的: 探讨模拟失重条件下健康大鼠肠道黏膜组织中核因子-κB(NF-κB)的表达变化及其意义.
方法: 成年Wistar大鼠80只, 随机分为10组, 按模拟失重时相分别为0.5、1、2、7、21 d和相应的对照组. 采用尾悬吊法建立模拟失重动物模型. 免疫组织化学法检测肠道黏膜组织中NF-κB的表达水平.
结果: 0.5、1、2、7、21 d模拟失重组大鼠肠道组织NF-κB表达水平均显著高于相应对照组(10.11%±3.29% vs 5.50%±1.92%, 22.00%±5.31% vs 6.50%±2.32%, 25.50%±4.11% vs 8.75%±6.36%, 21.50%±3.02% vs 6.75%±2.12%, 10.87%±2.64% vs 5.62%±2.13%, 均P<0.01), 模拟失重0.5 d组肠道组织NF-κB表达开始升高, 2 d组达高峰, 随模拟失重时间的延长, NF-κB表达水平依次下降, 21 d组仍然高于相应对照组.
结论: 尾悬吊模拟失重大鼠肠道组织NF-κB表达水平明显上调, 提示肠道组织NF-κB表达变化与失重应激反应和失重耐受有密切关系.
引文著录: 李成林, 张铭, 周金莲, 崔彦, 余佩武. 模拟失重对大鼠肠黏膜NF-κB表达的影响. 世界华人消化杂志 2008; 16(29): 3328-3331
Revised: September 29, 2008
Accepted: October 1, 2008
Published online: October 18, 2008
AIM: To investigate the effects of simulated gravity loss on NF-κB expression in rat intestinal tissues, and its significance.
METHODS: Tail-suspension (TS) was used to simulate the physiological effects of gravity loss. Eighty male Wistar rats were randomly assigned to 10 experimental groups suspended for 0.5, 1, 2, 7, 21 d respectively and their corresponding control groups. The dynamic expressions of NF-κB in intestinal tissues were seperately measured using the immunohistochemistry.
RESULTS: Compared with control groups, the expression levels of NF-κB in the intestinal tissue of tail-suspension 0.5, 1, 2, 7, 21 d groups were elevated significantly (10.11% ± 3.29% vs 5.50% ± 1.92%, 22.00% ± 5.31% vs 6.50% ± 2.32%, 25.50% ± 4.11% vs 8.75% ± 6.36%, 21.50% ± 3.02% vs 6.75% ± 2.12%, 10.87% ± 2.64% vs 5.62% ± 2.13%, all P < 0.01). NF-κB expression level began to rise in 0.5 tail-suspension group, and reached the maxium level in in 2 d group, then went down gradually.
CONCLUSION: The results suggest that simulated gravity loss acts as a kind of stress to elevate NF-κB expression and indicate a close link between altered intestinal NF-κB expression and tolerance of gravity loss.
- Citation: Li CL, Zhang M, Zhou JL, Cui Y, Yu PW. Effects of simulated gravity loss on nuclear factor kappa-B expression in rat intestinal tissues. Shijie Huaren Xiaohua Zazhi 2008; 16(29): 3328-3331
- URL: https://www.wjgnet.com/1009-3079/full/v16/i29/3328.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i29.3328
几十年来的载人航天实践及相关科学研究, 已经证明了失重对人体的各个生理系统都有明显的影响, 其中包括体液转移、心血管功能障碍、骨质丢失、肌肉萎缩、免疫功能下降、内分泌功能紊乱及空间运动病等多种生理和病理变化. 但针对失重对胃肠道影响的研究甚少. 有研究发现由失重而引起的体液变化可影响肠道的吸收和动力[1], 同时, 失重作为一种应激可以引起多种细胞因子的增高. 近年来研究发现NF-κB是具有多向性调节作用的诱导型核转录因子, 广泛调控着自昆虫至人类的一系列基因的表达, 尤其是在与免疫反应、应激反应和炎症反应相关的基因表达上[2]. 本文观察了尾悬吊模拟失重大鼠肠黏膜组织NF-κB的表达水平, 以期能进一步从分子水平认识模拟失重时肠道功能改变的发生机制.
清洁级成年♂Wistar大鼠80只, 体质量300±20 g, 由中国农业大学实验动物研究所提供. NF-κB兔多克隆抗体购自博士德公司, 工作浓度1:150. PV-6001试剂盒购自中山公司. 用PBS代替第一抗体作为空白对照实验.
1.2.1 分组: ♂Wistar大鼠80只按不同时相随机分为10组: 模拟失重0.5 d组、模拟失重1 d组、模拟失重2 d组、模拟失重7 d组、模拟失重21 d组和相应的地面对照组. 每组8只.
1.2.2 动物模型与取材: 参照王承珉 et al的方法采用尾悬吊法建立模拟失重大鼠模型[3-4]. 大鼠单笼饲养, 实验组大鼠尾部悬于笼顶, 前肢踏于笼底. 对照组大鼠置于相同鼠笼中, 自由活动. 所有大鼠可自由进食、饮水. 动物室温度保持在23℃±2℃, 每天灯光照明12 h与黑暗交替循环, 保持适当湿度及通风条件. 在解除模拟失重的不同时相点即时宰杀, ip戊巴比妥钠(45 mg/kg)将动物麻醉, 无菌操作, 经腹正中线剖腹, 打开腹腔取出距离盲肠5 cm的回肠组织, 40 g/L甲醛缓冲液固定.
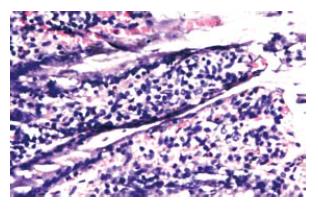
1.2.3 常规病理检查: 固定的回肠组织常规脱水, 石蜡包埋, 切片(厚3 μm)贴在载玻片上, 常规HE染色行光镜病理.
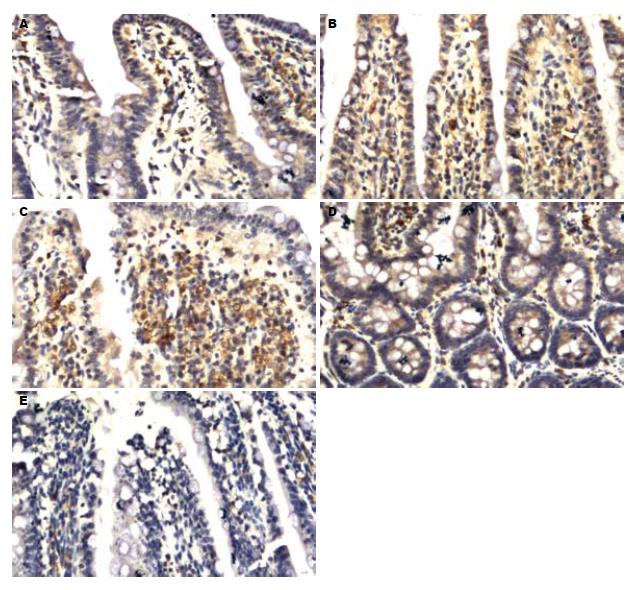
1.2.4 免疫组织化学法检测NF-κB表达: 常规切片, 脱蜡至水; 30 mL/L H2O2室温10 min以阻断内源性过氧化物酶; PBS冲洗3 min×3次, 枸橼酸钠高压锅热修复2 min后自然冷却, PBS洗3 min×3次; 加入一抗NF-κB于湿盒中4℃过夜; PBS洗3 min×3次, 加入辣根酶羊抗兔多聚体, 室温30 min; PBS洗3 min×3次; DAB溶液显色; 蒸馏水冲洗、苏木素复染、脱水、封片. 阳性反应产物呈棕黄色颗粒状, 位于细胞核和胞质中. 计数5个高倍视野(×400)下的阳性细胞数, 分别计算阳性率, 阳性率 = 阳性细胞数/总细胞数×100%.
统计学处理 采用STATA 7.0软件进行统计分析, 以t检验比较两组间差异.
本研究各组动物在实验期间无死亡, 没有意外退出实验情况. 在尾悬吊开始至悬吊24 h期间, 大鼠焦躁不安, 转而精神较差, 饮食量减少, 活动减弱, 24-48 h后逐渐适应而恢复稳定状态.
在失重条件下, 胃肠道血流增加, 动力减慢. 消化道发生运动减少, 分泌活动和黏膜形态功能改变, 肠蠕动减弱, 结肠通过时间延长[1,6-7]. 白树民 et al[5]发现悬吊3 wk后, SD大鼠肠道出现了肿胀细胞, 上皮细胞绒毛排列紊乱、稀疏. Rivera et al[8]的研究发现, 模拟失重情况下, 大鼠门静脉血内毒素的水平增高. 说明在失重条件下, 肠道黏膜的通透性发生了改变. 他们还发现, 失重时, 大鼠血液的TNF-α增高, 提示体内存在着炎性因子的失衡. 在非失重时, 某些病理因素可引起局部细胞因子网络失衡及某些细胞因子、黏附分子的过度表达, 从而引起白细胞介导的组织损伤. 现已发现, 功能性NF-κB结合序列广泛存在于细胞因子、黏附分子如白细胞介素-8, TNF-α, iNOS, 细胞间黏附分子-1等的启动子和增强子中, NF-κB活化导致了上述基因的表达. 在肠道的缺血再灌注、炎性疾病及多器官功能障碍的肠道功能损伤中, NF-κB通过激活细胞因子级联反应、生成促炎介质及抑制炎性细胞凋亡起重要作用[9-13]. Banan et al[14]证明NF-κB的激活在由酒精引起的肠道黏膜屏障完整性损害方面发挥作用. Gadjeva et al[15]发现NF-κB在急性炎症时的肠道稳定性方面起重要作用. Sharma et al[16]的实验表明模拟失重可引起NF-κB在睾丸的高表达.
本实验采用免疫组织化学方法检测发现, 尾悬吊0.5、1、2、7、21 d后大鼠回肠黏膜组织中NF-κB蛋白表达水平较对照组明显增强, 说明模拟失重条件下, 因肠道血液分布改变, 体液转移, 肠道血液的潴留, 这一系列变化可能引起了大鼠肠道血管充血和水肿, 静脉和毛细血管充盈度增加, 伴有炎症细胞浸润, 导致细胞因子过度表达. 故本实验可证实尾悬吊模拟失重可造成大鼠肠道黏膜的急性变化, 且以模拟失重初期(7 d内)为甚, 而随着尾悬吊时间延长到21 d, 肠道组织中NF-κB的蛋白表达有所减弱, 推测尾悬吊模拟失重大鼠肠道黏膜的改变可能为可逆性的, 或是机体通过自身调节逐渐适应了模拟失重环境. 如果悬吊时间继续延长, 肠道组织中NF-κB蛋白表达水平能否降至正常或是进一步加剧肠道损伤尚有待深入研究.
本实验的光镜结果显示: 大鼠回肠只表现为血管的充血. 无明显的其他病理变化. 说明失重对肠道的影响较之对心脏、肺及肌肉等的影响小.
本研究表明尾悬吊模拟失重大鼠存在肠道急性变化并同时伴有NF-κB表达增强, 为进一步深入研究细胞因子在失重条件下引起胃肠道改变的可能机制提供了实验基础.
随着几十年来的载人航天实践的发展带来了相关科学研究的深入, 现已经发现失重对人体的各个生理系统都有明显的影响, 相关的研究集中在体液转移、心血管功能障碍、骨质丢失、肌肉萎缩、免疫功能下降、内分泌功能紊乱及空间运动病等多种生理和病理变化. 而针对失重对胃肠道影响的研究甚少.
田晓峰, 教授, 大连医科大学附属第二医院; 王正康, 教授, 北京中日友好医院普外科
Rivera et al的研究发现, 模拟失重情况下, 大鼠门静脉内毒素的水平增高. 说明在失重条件下, 肠道黏膜的通透性发生了改变. 同时他们发现血清中的TNF-a升高, 说明存在着炎性因子的过度表达, 本文测定肠道黏膜的NF-kB表达, 试图揭示可能的关联.
Gandia et al发现失重时胃肠道血流增加, 动力减慢. 消化道发生运动减少, 分泌活动和黏膜形态功能改变, 失重时肠蠕动减弱, 结肠通过时间延长. 白树民 et al发现悬吊3 wk后, SD大鼠肠道出现了肿胀细胞, 上皮细胞绒毛排列紊乱、稀疏. 并且发现肠道菌群发生了变化. 李天志 et al的实验发现, 模拟失重大鼠肺组织NF-κB和ICAM-1的表达水平明显上调, 考虑与肺组织损伤有关.
NF-kB的检测为今后的失重时白细胞介素-8, iNOS, 细胞间黏附分子-1等损伤方面的检测提供参考, 通过一系列的研究以期了解炎性因素在模拟失重时的肠道损伤的相关性.
本研究结果可信, 结论可靠, 学术价值尚可, 建议作进一步深入探讨.
编辑:李军亮 电编:何基才
| 1. | Amidon GL, DeBrincat GA, Najib N. Effects of gravity on gastric emptying, intestinal transit, and drug absorption. J Clin Pharmacol. 1991;31:968-973. [PubMed] |
| 2. | Li C, Browder W, Kao RL. Early activation of transcription factor NF-kappaB during ischemia in perfused rat heart. Am J Physiol. 1999;276:H543-H552. [PubMed] |
| 6. | Gandia P, Saivin S, Lavit M, Houin G. Influence of simulated weightlessness on the pharmacokinetics of acetaminophen administered by the oral route: a study in the rat. Fundam Clin Pharmacol. 2004;18:57-64. [PubMed] [DOI] |
| 7. | Gandia P, Bareille MP, Saivin S, Le-Traon AP, Lavit M, Guell A, Houin G. Influence of simulated weightlessness on the oral pharmacokinetics of acetaminophen as a gastric emptying probe in man: a plasma and a saliva study. J Clin Pharmacol. 2003;43:1235-1243. [PubMed] [DOI] |
| 8. | Rivera CA, Tcharmtchi MH, Mendoza L, Smith CW. Endotoxemia and hepatic injury in a rodent model of hindlimb unloading. J Appl Physiol. 2003;95:1656-1663. [PubMed] |
| 9. | Nichols TC. NF-kappaB and reperfusion injury. Drug News Perspect. 2004;17:99-104. [PubMed] [DOI] |
| 10. | Mallick IH, Yang WX, Winslet MC, Seifalian AM. Pyrrolidine dithiocarbamate reduces ischemia-reperfusion injury of the small intestine. World J Gastroenterol. 2005;11:7308-7313. [PubMed] |
| 11. | Zhang XP, Zhang L, Chen LJ, Cheng QH, Wang JM, Cai W, Shen HP, Cai J. Influence of dexamethasone on inflammatory mediators and NF-kappaB expression in multiple organs of rats with severe acute pancreatitis. World J Gastroenterol. 2007;13:548-556. [PubMed] [DOI] |
| 12. | Suzuki T, Yamashita K, Jomen W, Ueki S, Aoyagi T, Fukai M, Furukawa H, Umezawa K, Ozaki M, Todo S. The novel NF-kappaB inhibitor, dehydroxymethylepoxyquinomicin, prevents local and remote organ injury following intestinal ischemia/reperfusion in rats. J Surg Res. 2008;149:69-75. [PubMed] [DOI] |
| 13. | Schmidt C, Höcherl K, Kurt B, Bucher M. Role of nuclear factor-kappaB-dependent induction of cytokines in the regulation of vasopressin V1A-receptors during cecal ligation and puncture-induced circulatory failure. Crit Care Med. 2008;36:2363-2372. [PubMed] [DOI] |
| 14. | Banan A, Keshavarzian A, Zhang L, Shaikh M, Forsyth CB, Tang Y, Fields JZ. NF-kappaB activation as a key mechanism in ethanol-induced disruption of the F-actin cytoskeleton and monolayer barrier integrity in intestinal epithelium. Alcohol. 2007;41:447-460. [PubMed] [DOI] |
| 15. | Gadjeva M, Wang Y, Horwitz BH. NF-kappaB p50 and p65 subunits control intestinal homeostasis. Eur J Immunol. 2007;37:2509-2517. [PubMed] [DOI] |
| 16. | Sharma CS, Sarkar S, Periyakaruppan A, Ravichandran P, Sadanandan B, Ramesh V, Thomas R, Hall JC, Wilson BL, Ramesh GT. Simulated microgravity activates apoptosis and NF-kappaB in mice testis. Mol Cell Biochem. 2008;313:71-78. [PubMed] [DOI] |