Введение
Меланома – это злокачественная опухоль, которая развивается из меланоцитов и поражает преимущественно кожу. Заболеваемость меланомой растет во всем мире среди белого населения, особенно там, где светлокожие люди подвергаются чрезмерному пребыванию на солнце [1]. Спровоцировать развитие меланомы может сочетание факторов, включая таковые окружающей среды и генетические.
Меланома составляет всего 4% от всех форм рака, но даже небольшие опухоли имеют тенденцию к метастазированию и, следовательно, относительно неблагоприятный прогноз. Так, 5-летняя общая выживаемость (ОВ) в случаях регионарного метастазирования составляет 61,7%, а при отдаленном метастазировании – 15,2% [2]. Также стоит отметить, что с меланомой связано 90% смертей, приходящихся на группу злокачественных опухолей кожи. Поэтому важнейшее значение для больных меланомой имеют быстрое выявление заболевания, его качественная диагностика и эффективное лечение.
До недавнего времени у пациентов с запущенной меланомой было мало эффективных вариантов лечения; исторически ответ на обычную химио- и иммуномодулирующую терапию (интерлейкин-2 или интерферон-γ) составлял ~5–19%.
С 2011 г. начался новый этап в иммунотерапии меланомы благодаря внедрению в клиническую практику нового класса препаратов моноклональных антител, блокирующих цитотоксический Т-лимфоцит-ассоциированный антиген 4 (CTLA4) на лимфоцитах. Исследования показали более значимые на лечение со средней ОВ 10,1 месяца среди ранее леченных пациентов и 11,2 месяца среди ранее не леченных больных [3, 4]. Эта терапия впервые за несколько десятилетий не только продемонстрировала способность увеличивать продолжительность жизни пациентов, но и обозначила вопрос о возможности излечения части больных даже на IV стадии заболевания, тем самым подтвердив высокий потенциал иммунотерапевтических подходов. Однако большинство пациентов не отвечают на терапию антителами против CTLA4 и по-прежнему нуждаются в эффективных терапевтических вариантах.
За последние годы удалось расшифровать сложный генетический профиль меланомы. Предметом интенсивного исследования стал сигнальный путь: RAS/RAF/MEK/MAPK (ERK) [5]. Его активация происходит как за счет активации рецепторов на поверхности опухоли, так и вследствие мутации в генах семейства RAS/RAF, регулирующих этот каскад. Имеющиеся нарушения приводят к постоянной активации RAS/RAF/MEK/MAPK (ERK) сигнального каскада, что в последующем приводит к злокачественной трансформации клеток.
BRAF-мутации при меланоме
В 2002 г. исследователи из Института Сэнгера обнаружили, что мутации в гене, кодирующем серин-треониновую протеинкиназу B-RAF (BRAF), встречаются более чем в 60% первоначально протестированных меланом [6]. Открытие генетических основ меланомы и их характеристики выявили потенциальные мишени для терапии, среди которых мутации BRAF считаются основными.
Распространенность мутаций кодона 600 BRAF у пациентов с меланомой колеблется от 40 до 60%. Наиболее распространенными мутациями при меланоме являются BRAF V600E (около 80%) и BRAF V600K (5–30%); другие мутации редки [7].
При меланоме мутации BRAF наиболее часто встречаются у пациентов, опухоли которых возникают на коже без хронических повреждений, вызванных солнцем, и они редко встречаются в меланомах, возникающих из слизистых оболочек и акральных участков [8].
В зависимости от наличия BRAF-мутации выделяются две группы пациентов:
«BRAF-позитивные»:
- BRAF-мутация встречается приблизительно у 40–60% пациентов с меланомой;
- мутации BRAF ассоциируются с неблагоприятным прогнозом при меланоме и характеризуются более агрессивным течением заболевания по сравнению с BRAF wt меланомой;
- BRAF-позитивные пациенты чаще моложе, чаще имеют опухоли с поверхностным распространением и поражением лимфоузлов, без длительного воздействия ультрафиолета в анамнезе;
- также BRAF-позитивные пациенты имеют большую вероятность развития метастазов в ЦНС.
«BRAF-негативные» (дикий тип – wild type):
- BRAF-негативными являются приблизительно 40–60% пациентов с меланомой;
- нет различий во времени перехода заболевания в метастатическую фазу у BRAF-позитивных и BRAF-негативных больных;
- характерно менее агрессивное течение заболевания [8].
Онкогенные мутации в гене BRAF коррелируют с повышенной тяжестью и снижением ответа на химиотерапию при широком спектре опухолей человека. Следовательно, прямое терапевтическое ингибирование онкогенной активности киназы BRAF открывает путь к лечению этих опухолей [9].
В настоящее время статус мутации BRAF – единственный биомаркер, предсказывающий терапевтический ответ при запущенной меланоме. Молекулярное тестирование мутаций BRAF у пациентов с запущенной меланомой стало стандартом для определения курса лечения, и оно рекомендовано действующими клиническими рекомендациями Министерства здравоохранения РФ и Российского общества клинической онкологии (RUSSCO) [10,11].
В связи с открытием BRAF и других мутаций лечение меланомы сместилось в сторону адресной, персонализированной, терапии, адаптированной в соответствии с обнаруженными мутациями.
Говоря об индивидуализации лекарственного лечения меланомы кожи, мы более подробно остановимся на выборе терапии первой линии для больных метастатической или неоперабельной меланомой кожи с мутацией в гене BRAF.
Комбинированная терапия метастатической или неоперабельной меланомы кожи
Молекулярно-генетическое исследование опухоли на наличие мутации в 15-м экзоне гена BRAF обязательно при определении тактики лечения в случаях метастатической или неоперабельной формы меланомы кожи. Ингибиторы пути MAPK служат вариантом выбора первой линии терапии для пациентов с мутацией в гене BRAF V600 [12–15].
Безусловно, появление терапии ингибиторами сигнального пути митогенактивированной протеинкиназы стало важным шагом в качестве монотерапии пациентов с ранее нелеченной метастатической меланомой с мутациями BRAF V600E или V600K и изменило неблагоприятный прогноз, связанный с этими молекулярными изменениями. Такие пациенты теперь имеют более длительную медианную выживаемость, чем больные меланомой BRAF дикого типа [16]. Тем не менее до половины пациентов с наличием мутации в гене BRAF не отвечают на лечение, а у тех, кто действительно ответил, приобретенная резистентность обычно развивалась в среднем через 6–7 месяцев при применении монотерапии таргетными препаратами [17, 18].
Понятно, что причиной возникновения меланомы служит нарушение различных сигнальных путей из-за мутаций онкогенов или опухолевых супрессоров. Существует множество возможных механизмов резистентности, и большинство из них включают реактивацию пути MAPK [19, 20]. Мутации NRAS и варианты сплайсинга мРНК BRAF V600E являются общим механизмом, идентифицированным на сегодняшний день [19]. Было также показано, что активация пути PI3K-PTEN-AKT участвует в приобретении устойчивости к ингибиторам BRAF [20].
Последовательная терапия ингибитором MEK после прогрессирования на фоне применения ингибитора BRAF не принесла положительных результатов, поскольку в исследовании с участием 40 пациентов не наблюдалось никакого ответа, а выживаемость без прогрессирования (ВБП) составляла только 1,8 месяца. Это позволяет предположить, что устойчивость к ингибиторам BRAF также обеспечивает устойчивость к ингибиторам MEK [21].
Недавние исследования подтвердили, что для достижения положительных результатов пациентами с меланомой и мутацией в гене необходимо воздействовать на несколько точек с нарушенной регуляцией сигнального пути не менее чем двумя таргетными препаратами, что свидетельствует о важности концепции комбинированной терапии. Таким образом, глубокое понимание молекулярных механизмов патогенеза меланомы при персонализированном подходе к лечению помогает рационально выбирать правильную комбинацию лекарств [22]. Кроме того, комбинированная терапия необходима для отсрочки приобретенной резистентности, что ведет к увеличению продолжительности ответа на лекарственную терапию [23].
Поскольку по большей части устойчивость к ингибитору BRAF возникает в результате реактивации MAPK, разработано несколько мощных, не конкурентных с АТФ ингибиторов MEK, которые не воздействуют на другие киназы. Было показано, что комбинированное лечение ингибиторами BRAF и MEK значительно увеличивает долю пациентов с объективным ответом, а также существенно задерживает развитие приобретенной резистентности и блокирует парадоксальную активацию пути MAPK. Как показано в исследованиях BRIM7 и coBRIM, двойное ингибирование MEK+BRAF увеличивает частоту ответа, ОВ и ВБП у пациентов с меланомой без предшествовавшего использования ингибитора BRAF при меньшем количестве побочных эффектов, связанных с парадоксальной активацией пути MAPK [24–27].
Результаты комбинированной терапии ингибиторами MEK и ингибиторами BRAF обнадеживают. Новые клинические исследования подтверждают повышение ВБП при одновременном ингибировании BRAF и MEK. В рандомизированном исследовании III фазы (coBRIM) сравнивались пациенты с меланомой и мутацией BRAF, получавшие вемурафениб 960 мг 2 раза в день или вемурафениб+кобиметиниб 60 мг в день. В исследование были включены 495 ранее не получавших лечения пациентов с BRAF V600E/K – неоперабельной местнораспространенной или метастатической меланомой. Демографические данные пациентов были хорошо сбалансированы в двух группах, включая стадию заболевания, статус эффективности ECOG, возраст и географический регион. Более половины пациентов имели меланому IV стадии, M1c.
Исследование показало, что применение комбинированной терапии пациентов с распространенной меланомой с мутацией BRAF V600, ранее не получавших лечения, повышало ОВ и ВБП примерно на 5 месяцев по сравнению с одним вемурафенибом. Медиана ОВ составила 22,5 месяца (95% доверительный интервал [ДИ]: 20,3–28,8) при использовании комбинации по сравнению с 17,4 месяца (95% ДИ: 14,5–19,8) при монотерапии. Показатели 5-летней общей выживаемости составили 30,8 против 26,3% соответственно (рис. 1).
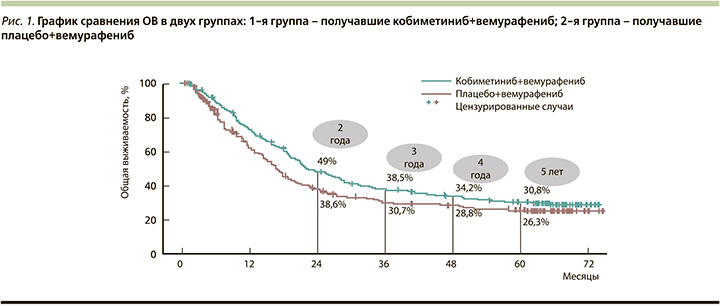
Медиана ВБП составила 12,6 месяца (95% ДИ: 9,5–14,8) при применении кобиметиниба и вемурафениба по сравнению с 7,2 месяца (95% ДИ: 5,6–7,5) при использовании одного вемурафениба. Показатели 5-летней выживаемости больных составили 14 и 10% соответственно. В целом безопасность применения комбинации вемурафениба и кобиметиниба была сопоставимой с профилем безопасности в группе монотерапии [26, 27, 29]. Также авторы обнаружили, что уровни ЛДГ коррелируют с результатами в группе комбинированной терапии (рис. 2).
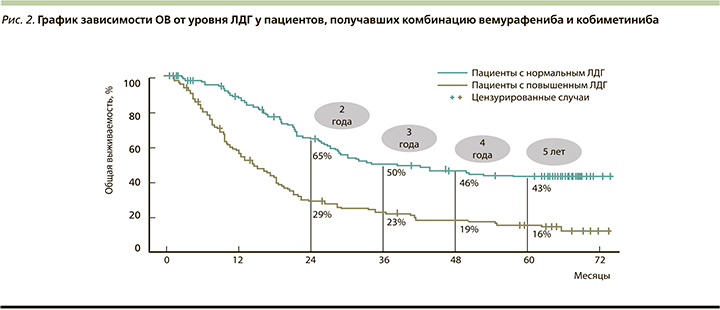
Медиана ОВ для пациентов с нормальным уровнем ЛДГ составила 38,5 месяцев (95% ДИ 28,0 не подлежит оценке). Напротив, у пациентов с повышенным уровнем ЛДГ медиана ОВ составила всего 14,8 месяца (95% ДИ: 11,3–18,6). Комбинация также обеспечила лучшую медианную ВБП (15,0 против 8,6 месяца) и 5-летнюю ВБП (18 против 7%) у пациентов с нормальным исходным уровнем ЛДГ по сравнению с пациентами с повышенным уровнем ЛДГ [30].
Таким образом, исследование coBRIM подтвердило увеличение эффективности комбинированной терапии ингибиторами BRAF и MEK по сравнению с монотерапией ингибитором BRAF больных меланомой кожи с мутацией BRAF V600.
Дополнительным преимуществом комбинированной терапии является снижение частоты кожных побочных явлений по сравнению с монотерапией MEK или ингибитором BRAF. В частности, плоскоклеточный рак кожи и кератоакантома развились только у 3,5% пациентов, получавших комбинированную терапию, по сравнению с 19,7% пациентов, получавших вемурафениб в монорежиме. Следовательно, переход от моно- к комбинированной терапии позволяет снижать опасения по поводу нежелательных кожных побочных эффектов [26].
Комбинация ингибиторов BRAF и MEK стала стандартом лечения пациентов с метастатической или нерезектабильной BRAF-положительной меланомой кожи и рекомендована действующими руководящими принципами клинических рекомендаций Министерства здравоохранения РФ и Российского общества клинической онкологии (RUSSCO) в качестве терапии первой линии [10, 11].
Таким образом, комбинированная терапия вемурафениб+кобиметиниб позволяет:
1. Добиваться быстрого ответа на лечение пациентов с высокой скоростью прогрессирования заболевания и обеспечивать контроль болезни у 98% больных;
2. Повышать ВБП и ОВ у пациентов с запущенными стадиями меланомы (по данным исследования BRIM7);
3. Обеспечивать выраженную противоопухолевую эффективность у пациентов c мутацией BRAF V600 без предшествовавшего использования ингибиторов BRAF;
4. Обеспечивать максимальную эффективность терапии у пациентов с драйверной мутацией;
5. Добиваться длительного контроля за заболеванием (40% пациентов переживают 4–5-летний порог – по данным исследования BRIM7);
6. Предлагать хорошо изученный профиль безопасности комбинации и успешно корректировать нежелательные явления.
В 2020 г. компания «Roche» первая в мире зарегистрировала тройную комбинацию атезолизумаб+коби-метиниб+вемурафениб для лечения неоперабельной местно-распространенной или метастатической меланомы кожи на основании исследования «TRILOGY». Исследование IMspire150 (TRILOGY) представляет собой международное многоцентровое двойное слепое рандомизированное исследование III фазы у пациентов, ранее не получавших терапию по поводу меланомы с мутацией в гене BRAFV600 (NCT02908672) [31].
Пациентов, которые рассматривались как удовлетворяющие критериям включения в исследование, рандомизированно распределяли в соотношении 1:1 в одну из двух групп для получения одного из следующих 28-дневных циклов терапии: атезолизумаб+кобиметиниб+вемурафениб (группа атезолизумаба) и плацебо+кобиметиниб+вемурафениб (контрольная группа). Терапию продолжали до момента прогрессирования заболевания по оценке исследователя, развития неприемлемой токсичности, смерти, досрочного прекращения исследования по решению пациента или врача, в зависимости от того, что произойдет раньше. В исследовании была достигнута первичная конечная точка ВБП. Добавление атезолизумаба к комбинации кобиметиниба и вемурафениба приводило к значительно более продолжительной медиане выживаемости без прогрессирования по оценке исследователя с 10,6 месяца (95% ДИ: 9,3–12,7) в контрольной группе до 15,1 месяца (95% ДИ: 11,4–18,4) в группе атезолизумаба.
На дату окончания сбора данных (11 октября 2019 г.) медианная продолжительность наблюдения в общей исследуемой популяции составляла 18,9 месяца. Благоприятная тенденция в изменении выживаемости без прогрессирования заболевания в группе атезолизумаба наблюдалась во всех предварительно выделенных подгруппах пациентов.
Медианная длительность ответа была больше в группе атезолизумаба (21,0 месяц, 95% ДИ 15,1 не поддается оценке) по сравнению контрольной группой (12,6 месяца; 95% ДИ: 10,5–16,6). Улучшение выживаемости без прогрессирования было обусловлено, прежде всего, увеличением длительности ответа в группе атезолизумаба по сравнению с контрольной группой. Профиль безопасности соответство-вал известным профилям безопасности отдельных лекарственных препаратов.
Добавление атезолизумаба лишь незначительно повышает частоту развития нежелательных явлений степени 3/4 (79,1%) по сравнению с контрольной группой (73,0%). Оно не обостряет нежелательные явления, типичные для ингибиторов BRAF и MEK.
Частота развития некоторых нежелательных явлений, связанных с применением ингибиторов PD-L1 (например, нарушения функции щитовидной железы, пневмонит и рост результатов функциональных проб печени), возрастала, однако в большинстве случаев эти нежелательные явления относились к степени 1–2. Частота отмены всей исследуемой терапии вследствие развития нежелательных явлений не возросла в группе атезолизумаба (12,6%) по сравнению с контрольными группами (15,7%). Она соответствовала данным, полученным для комбинации вемурафениба и кобиметиниба в исследовании coBRIM (11%). Профиль безопасности соответствовал известным профилям безопасности отдельных лекарственных препаратов.
Заключение
Открытие мутации в гене BRAF значительно ускорило разработку новых таргетных терапевтических средств в последние несколько лет. Эти препараты обладают большим потенциалом в отношении улучшения прогноза меланомы, продемонстрировали хороший опухолевый ответ, увеличили среднюю ВБП при распространенных формах заболевания, однако их эффективность ограничена многочисленными, сложными и часто перекрывающимися путями резистентности. Использование ингибиторов MEK в сочетании с таковыми BRAF предлагает способ борьбы с этой проблемой. Комбинация вемурафениба и кобиметиниба оказалась безопасной и хорошо переносимой при применении в эффективных дозах. Поскольку использование комбинации BRAF и МЕК-ингибиторов сопровождается формированием иммунного ответа, создаются предпосылки к добавлению к этой комбинации иммуноонкологической терапии. Так добавление атезолизумаба к комбинации вемурафениба и кобиметиниба в исследовании «TRILOGY» приводило к клинически значимому увеличению выживаемости без прогрессирования по сравнению с вемурафенибом или кобиметинибом.
В качестве клинической рекомендации необходимо обратить внимание практикующих онкологов на необходимость одномоментного назначения вемурафениба и кобиметиниба с последующим добавлением атезолизумаба.


