Введение
Заболеваемость раком ободочной кишки (РОК) как в мире, так и в нашей стране с каждым годом растет. За последние 20 лет в структуре онкологической заболеваемости РФ РОК переместился с шестого на второе место [1]. Радикальному лечению при I–III стадиях РОК в 2016 г. подлежали 63,6% пациентов: из них 68,7% – только хирургическому лечению и 31,3% – комплексному, включившему операцию и адъювантную химиотерапию (АХТ) [1]. Однако, как показывает практика, показатели выживаемости зависят не только от характера проводимого лечения, но и от биологических особенностей опухоли. В настоящий момент к известным прогностическим факторам, определяющим ранее метастазирование у больных после радикального лечения, относятся глубина опухолевой инвазии (параметр Т), статус регионарных лимфоузлов (параметр N), морфологическая дифференцировка опухоли, лимфоваскулярная или периневральная инвазия, края резекции, перфорация опухоли, уровень ракового эмбрионального антигена (РЭА) [2]. Отдельную когорту составляют пациенты с микросателлитной нестабильностью (MSI-H). Так, по результатам 17 исследований, пациенты с MSI-H при II стадии РОК имеют 5-летнюю выживаемость 90% только после хирургического лечения без проведения АХТ [3]. При этом, несмотря на соблюдение стандартов лечения, пациенты с благоприятными факторами прогноза (ранняя стадия, высокая дифференцировка опухоли) могут через 6–12 месяцев иметь отдаленные метастазы (ОМ) и, наоборот, пациенты с неблагоприятными факторами прогноза (повышенный уровень РЭА после хирургического лечения, глубокая инвазия – T4) могут длительное время находиться в ремиссии. С чем это связано? Вероятнее всего, с процессами метастазирования опухолевых клеток, которые до настоящего времени изучены недостаточно хорошо. Например, научный интерес представляет участие в процессе метастазирования цитокинов (хемокинов). Первым из их семейства был исследован хемокиновый рецептор 4 (CXCR4), и выявлена его связь с появлением метастазов в легких при раке молочной железы [4].
Хемокины были впервые идентифицированы в 1977 г. Так, первым из них стал CXC – хемокин 4. В настоящее время изучено 50 хемокинов, относящихся к 4 подсемействам, выявлено 20 хемокиновых рецепторов [5].
Основным механизмом действия хемокинов является индукция хемотаксиса многих типов клеток, кроме того, они являются необходимым компонентом для оптимальных межклеточных взаимодействий в иммунологическом ответе. В данный момент хемокины представлены в основном четырьмя большими семействами: СХС(а), СС(в), С(у) и СХ3С(8). Хемокины каждого из них взаимодействуют со своими поверхностными рецепторами: соответственно CXCR, CCR, CR, CX3CR [6].
Известно, что некоторые опухолевые клетки способны экспрессировать хемокиновые рецепторы, и это во многих случаях способствует усилению роста опухоли. Наибольшее количество работ посвящено изучению хемокинов семейства СХС, к которому относятся интерлейкин-8 (IL-8) и индуцирующий интерферон-γ-протеин-10 (IP-10), Mig, SDF-lcс, CXCL10, CXCL12 и др. [6, 7].
Рецептор CXCR4 экспрессируется многими опухолями и, как показывают исследования, ассоциируется с резким усилением ангиогенеза, развитием метастазов и более агрессивным течением опухолевого процесса, часто указанный рецептор обнаруживается в метастатических клетках [8, 9].
Таким образом, изучение зависимости метастазирования РОК от уровня экспрессии хемокиновых рецепторов в опухолевой ткани актуально.
Цель исследования: изучение влияния экспрессии хемокинового рецептора CXCR4 в опухолевой ткани на показатель безрецидивной выживаемости (БРВ) пациентов с РОК II (рT4N0M0) и III стадий (pT4N1-2M0).
Методы
Нами проведено открытое проспективное нерандомизированное исследование в параллельных группах, включившее больных РОК, находившихся под наблюдением в СПбГБУЗ «Городской клинический онкологический диспансер» с период с 2010 по 2016 г.
В исследовании участвовали 113 пациентов, у которых после проведенного радикального хирургического лечения верифицирована аденокарцинома ободочной кишки II (рT4N0M0) и III стадий (pT4N1-2M0).
В зависимости от стадии заболевания все пациенты были разделены на две группы: группа А (n=53) – пациенты, у которых верифицирована II стадия заболевания (Dukes B), и группа Б (n=60) – пациенты, у которых верифицирована III стадия заболевания (Dukes C).
Все больные находились под динамическим контролем, и им выполнялись диагностические процедуры согласно стандартам наблюдения пациентов с РОК в течение 5 лет после хирургического вмешательства.
Стандарты наблюдения пациентов с II–III стадиями РОК после радикального хирургического лечения включают:
- • физикальный осмотр каждые 3–6 месяцев в течение 2 лет, далее каждые 6 месяцев до 5 лет;
- • исследование крови на РЭА каждые 3–6 месяцев в течение 2 лет, далее каждые 6 месяцев до 5 лет;
- • компьютерную томографию органов грудной клетки, брюшной полости и малого таза каждые 6–12 месяцев до 5 лет;
- • фиброколоноскопию 1 раз в год.
Данный режим наблюдения был соблюден в отношении 100% пациентов, включенных в исследование.
Медиана наблюдения за пациентами составила 60 месяцев. С момента начала наблюдения в различные сроки у части больных были диагностированы ОМ, в связи с чем все пациенты в группах А и Б были разделены на подгруппы. Дизайн нашего исследования представлен на рис. 1.
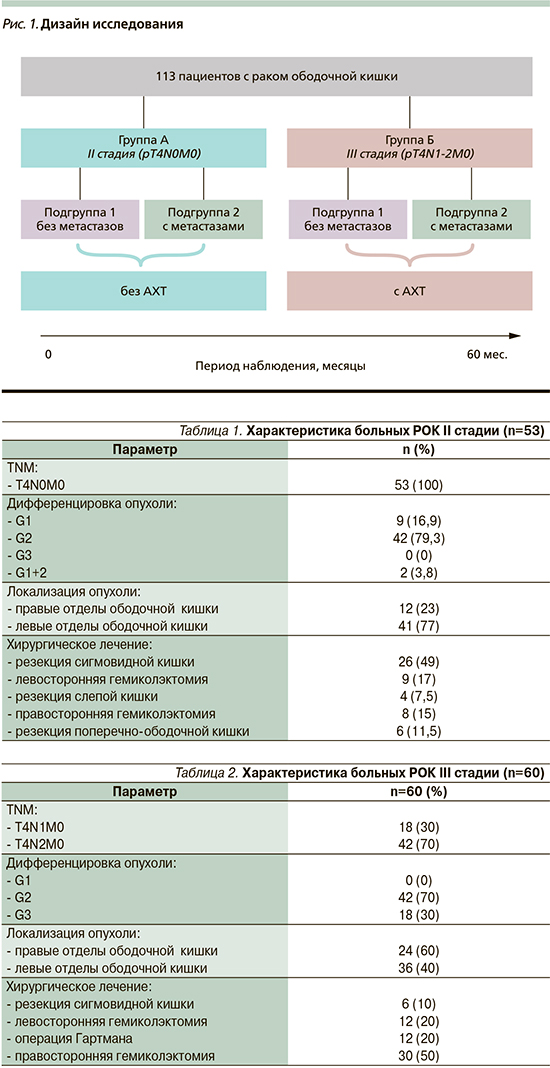
У пациентов подгруппы 1 каждой из групп в течение 60 месяцев не было зарегистрировано появления отдаленных метастазов при использовании стандартных методик наблюдения; у пациентов подгруппы 2 зарегистрировано прогрессирование процесса в виде появления ОМ при использовании стандартных методик наблюдения.
В группе А пациентам не проводилась АХТ, т.к. данная группа набиралась в 2010–2011 гг., когда в стандарты лечения данная опция не входила. В группе Б пациенты получали АХТ по схеме FOLFOX6 в течение 6 месяцев после хирургического лечения.
Характеристика пациентов группы А
Распределение по гендерному и возрастному признакам: 26 мужчин и 27 женщин в возрасте от 28 до 76 лет, средний возраст составил 59,41±8,62 года, медиана возраста – 61 год.
Как следует из табл. 1, первичные опухоли локализовались в различных отделах ободочной кишки и имели разную степень дифференцировки (G1, G2), послеоперационная стадия у всех была равнозначной – pT4N0M0; микроскопическая сосудистая или периневральная инвазия отсутствовала, перфорация опухоли отсутствовала, выполнялась R0-резекция, уровень РЭА в послеоперационном периоде находился в пределах нормальных значений.
Пациенты, у которых в течение 5 лет после проведенной операции не было выявлено прогрессирования опухолевого процесса, составили 1-ю подгруппу (n=22), в 2-ю подгруппу вошли пациенты, у которых было зарегистрировано появление ОМ (n=31).
Характеристика пациентов группы Б
Распределение по гендерному и возрастному признакам: 30 мужчин и 30 женщин в возрасте от 31 года до 70 лет, средний возраст составил 59,60 ±3,48 года, медиана возраста – 61.
Основные параметры пациентов представлены в табл. 2: микроскопическая сосудистая, или периневральная, инвазия, как и в группе А, отсутствовала, перфорация опухоли отсутствовала, выполнялась R0=резекция, уровень РЭА в послеоперационном периоде находился в пределах нормальных значений.
Пациенты, у которых в течение 5 лет после комплексного лечения не было выявлено прогрессирования опухолевого процесса, составили 1-ю подгруппу (n=30), во 2-ю подгруппу вошли больные, у которых было зарегистрировано появление ОМ (n=30).
Гистологические блоки всех пациентов были исследованы на экспрессию CXCR4 иммуногистохимическим методом. Первым этапом выполнен пересмотр гистологических препаратов. При микроскопическом исследовании выбирался блок с опухолью и нормальной слизистой оболочкой.
С данного блока нарезались срезы толщиной 4 мк, которые размещали на стекла с поли-L-лизиновым покрытием. Срезы подсушивались, депарафинировались и подвергались демаскировке антигенов при помощи цитратного буфера в условиях водяной бани (t=95°C, 30 минут). Затем их оставляли остывать при комнатной температуре, далее они промывались трис-буфером с твином. Каждый срез обводился парафиновым карандашом, после чего осуществлялось ингибирование эндогенной пероксидазы 3%-ной перекисью водорода в течение 20 минут. Далее на каждый срез наносилось антитело к CXCR4, которое инкубировалось в течение ночи при температуре +2–8°С (в условиях холодильной камеры), экспозиция длилась 30 минут на термостолике в условиях «водяной бани» при температуре 300C. Визуализация реакции антиген–антитело осуществлялось при помощи системы визуализации EnVisionReal (DAKO) с диаминобензидином в качестве хромогена. Оценивались ядерная и цитоплазматическая реакции.
Учитывая отсутствие в настоящее время стандартов градации окраски для хемокиновых рецепторов в опухолевой ткани, нами была самостоятельно сформирована шкала определения уровня экспрессии хемокиновых рецепторов: низкий, средний, высокий (Раскин Г.А., 2012). Уровень экспрессии определялся процентом выявления рецепторов хемокинов в аденокарциноме толстой кишки: низкий (0–30%), средний (30–70%), высокий (70–100%).
Для выявления корреляционных взаимосвязей использовался критерий корреляции Спирмена, для сравнительных характеристик – критерий Манна–Уитни, для оценки общей выживаемости – метод Каплана–Майера, для оценки влияния прогностических факторов на показатели выживаемости применялась регрессионная модель Кокса. Все подсчеты производились с помощью программы Statistica (версия 10.0), MedCalc (версия 18.10.2).
Результаты исследования
Группа А
В 1-й подгруппе группы А медиана безрецидивного периода не была достигнута: все пациенты пережили 60 месяцев наблюдения без рецидива заболевания.
При исследовании CXCR4 были получены следующие результаты: среднее значение уровня его экспресcии составило 27,73±7,58% (95% доверительный интервал [ДИ] – 11,97–43,49%), значения варьировались в диапазоне от 0,00 до 95,00%. Медиана данного показателя составила 15,00% (95% ДИ – 0,00–30,47%).
Во 2-й подгруппе при динамическом наблюдении выявлено прогрессирование опухолевого процесса в интервале от 1 до 44 месяцев в виде появления ОМ, в основном все пациенты имели множественные метастазы в различные органы, у 70% больных наблюдалось поражение печени. Медиана безрецидивного периода во 2-й подгруппе составила 9,5±0,47 месяца.
При исследовании CXCR4 были получены следующие результаты: среднее значение уровня его экспресcии составило 50,00±29,01% (95% ДИ от 39,36 до 60,64%), значения варьировались в диапазоне от 0,00 до 95,00%. Медиана данного показателя составила 50,00% (95% ДИ – 35,86–62,07%).
При сравнении двух подгрупп по экспрессии CXCR4 с использованием критерия Манна–Уитни в 2-й подгруппе ее уровень оказался достоверно выше, чем в 1-й (U=201,50; Z=2,535; р=0,0113).
С целью оценки влияния уровня экспрессии CXCR4 на БРВ нами была построена регрессионная модель Кокса, показавшая наличие достоверной зависимости (р=0,0157, 95% ДИ – 1,0024–1,0226). Зависимость БРВ от уровня экспрессии CXCR4 в группе А представлена на рис. 2.

Группа Б
В 1-й подгруппе группы А медиана безрецидивного периода, так же как и в группе А, не была достигнута: все пациенты пережили 60 месяцев наблюдения без рецидива заболевания.
При исследовании CXCR4 получены следующие результаты: среднее значение уровня его экспрессии составило 14,50±5,29% ( 95% ДИ – 2,52–26,48%), значения варьировались в диапазоне от 0,00 до 40,00%. Медиана данного показателя составила 7,50% (95% ДИ – 0,00–35,25%).
Во 2-й подгруппе при динамическом наблюдении было выявлено прогрессирование опухолевого процесса в интервале от 2 до 60 месяцев, 50% пациентов имели множественные метастазы в различные органы, а 50% – солитарные. Медиана безрецидивного периода составила 18 месяцев (95% ДИ – 7–18 месяцев).
При исследовании CXCR4 были получены следующие результаты: среднее значение уровня его экспрессии составило 67,00±8,95% (95% ДИ – 46,75–87,25%), значения варьировались в диапазоне от 0,00 до 90,00%. Медиана данного показателя составила 70,00% (95% ДИ – 50,00–90,00%).
При сравнении двух подгрупп по экспрессии CXCR4 с использованием критерия Манна–Уитни в 2-й подгруппе ее уровень оказался достоверно выше, чем в 1-й (U=8,00; Z= 3,193; р=0,0014).
Поскольку в результате построения регрессионной модели Кокса выявлена зависимость БРВ от уровня экспрессии CXCR4, мы построили однофакторную модель регрессионного анализа зависимости БРВ от уровня экспрессии CXCR4:
Y=24,3566–0,2419×Х,
где Y – время до прогрессирования, Х – уровень экспрессии CXCR4.
Общая значимость регрессионной модели зависимости БРВ от уровня экспрессии CXCR4 была достоверной: р=0,0002. Зависимость БРВ от уровня экспрессии CXCR4 в группе Б представлена на рис. 3.
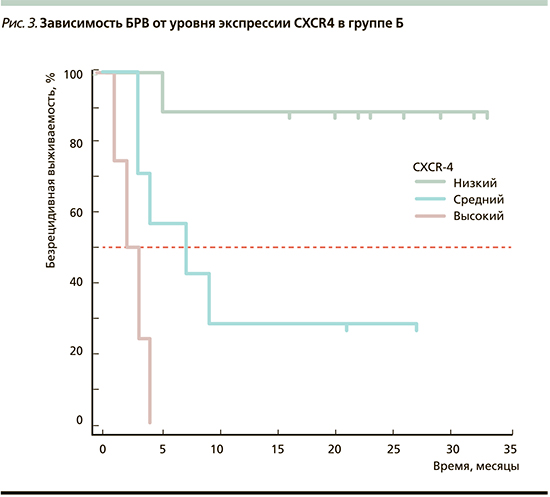
Таким образом, медиана безрецидивного периода оказалась достоверно более низкой в подгруппах пациентов с ОМ, где выявлена высокая экспрессия хемокиновых рецепторов в опухолевой ткани, что позволяет сделать вывод, согласно которому чем выше экспрессия хемокиновых рецепторов, тем агрессивнее опухоль и ниже показатель БРВ.
Обсуждение
Основываясь на результатах проведенного исследования можно сделать вывод о том, что высокая экспрессия хемокинового рецептора CXCR4 в опухолевой ткани является неблагоприятным прогностическим фактором у больных РОК II (рT4N0M0) и III стадии (pT4N1-2M0) и может использоваться как дополнительный фактор прогноза при назначении комплексного лечения. Например, в спорных ситуациях – при II стадии (pT4N0M0) и тяжелой сопутствующей патологии, а также может помочь решить вопрос в отношении категории пациентов, прооперированных в экстренных ситуациях и имеют послеоперационную стадию рT3NхM0.Так, X. Yu et al. в своей работе ассоциируют активацию пары CXCL12/CXCR4 с инвазией и появлением ОМ у больных колоректальным раком [10]. J. Kim et al. путем анализа общей выживаемости пациентов, болеющих раком толстой кишки, доказали, что высокая экспрессия рецептора CXCR4 значительно уменьшает медиану выживаемости больных (10 против 27 месяцев, р=0,036). [11].Однако для более точного определения значимости экспрессии хемокинового рецептора CXCR4 в опухолевой ткани у больных ПОК необходимо проведение крупных проспективных рандомизированных исследований.
Заключение
Определение экспрессии хемокинового рецептора CXCR4 в опухолевой ткани может использоваться в качестве дополнительного прогностического фактора при планировании АХТ у больных РОК.


