Введение
Рак молочной железы (РМЖ) занимает первое место по заболеваемости и смертности от злокачественных новообразований у женщин в России [1]. Это гетерогенное заболевание по своим биологическим подвидам, которому свойственнны агрессивный рост и способность к активному метастазированию. Важной прогностической характеристикой РМЖ являются его две морфологические формы – дольковая (лобулярная) и протоковая. Встречаемость второй формы гораздо реже, чем первой. При этом дольковый рак, с одной стороны, характеризуется сохранной экспрессией рецепторов к гормонам, низким индексом Ki-67, отсутствием HER2, но, с другой стороны, склонен к диссеминации и поздним рецидивам. Это обусловливает лучшие показатели 10-летней выживаемости без отдаленных метастазов и общей выживаемости (ОВ) при лобулярном раке (выигрыш 3 и 6% соответственно) [2].
Также в ряде исследований показано, что дольковый рак малочувствителен к адъювантной и неоадъювантной полихимиотерапии, зато хорошо отзывается на гормональную терапию и анти-CDK4/6-ингибиторы [3].
Одним из немаловажных факторов, отличающих дольковый РМЖ от протокового, является метастазирование. Наиболее часто дольковый рак метастазирует лимфогенным путем в регионарные подмышечные, подключичные и парастернальные лимфоузлы [4]. Отдаленными гематогенными метастазами чаще поражены кости, легкие, плевра, печень, костный мозг [4–6]. Вторичное поражение головного мозга расценивается как карциноматозный менингит в виде диффузной лептоменингиальной инфильтрации [4, 7]. Встречаются метастазы в позвоночнике со сдавлением структур спинного мозга, развитием нижней параплегии и нарушением функции тазовых органов. Кроме того, интраабдоминальные метастазы имеют склонность к вовлечению серозных оболочек, забрюшинного пространства и яичников [8]. Диффузный рост опухоли в матке и яичниках клинически и морфологически напоминает метастазы рака желудка и в ряде случаев не отличим от опухоли Крукенберга [7, 9, 10]. Крайне редко при лобулярном РМЖ встречается изолированное метастатическое поражение желудочно-кишечного тракта. В литературе описано 31 подобное наблюдение, в т.ч. случай метастатического поражения желудка через 30 лет после радикальной мастэктомии [4, 11]. Для дифференциальной диагностики между метастатической и первичной опухолями пораженного органа зачастую требуется проведение иммуногистохимического исследования [12].
Примерно у 41% женщин, больных гормонпозитивным (HR+) HER2-РМЖ в постменопаузе, первые метастазы развиваются в висцеральных органах, что закономерно ассоциируется с неблагоприятным прогнозом заболевания [5, 12]. До недавнего времени выбора лечебных опций для лечения HR+-метастатического РМЖ (мРМЖ) было немного. Стандартом лечения таких пациенток была эндокринотерапия. Однако со временем у пациенток развивается резистентность к гормонотерапии, что в итоге приводит к прогрессированию. Сейчас в руках врача-онколога имеется больше инструментов, позволяющих контролировать болезнь, добиваясь большего количества объективных ответов. Такая ситуация стала возможной благодаря открытию сигнального пути циклинзависимых киназ [13].
Появление ингибиторов CDK4/6 в клинической практике кардинально изменило возможности и стандарты терапии больных гормонзависимым подтипом мРМЖ и позволило достичь значительного прогресса в продлении жизни пациентов с HR+-HER2-мРМЖ с медианой ОВ, приближающейся к 4 годам [14, 15].
Основанием для регистрации ингибитора CDK4/6 – рибоциклиба, стали данные международных исследований MonaLEEsa-2, -3, -7 [16–18]. В данных исследованиях группа пациентов с висцеральными метастазами составляла около 60% [6]. Медиана времени без прогрессирования в группе пациентов с висцеральными метастазами была сопоставимой с группой пациентов без висцеральных метастазов и значительно превосходила монорежимы эндокринотерапии [6]. Для пациентов, получающих комбинацию рибоциклиба в сочетании с фулвестрантом в 1-й линии терапии, медиана ОВ на момент среза данных не была достигнута, а в группе фулвестранта с плацебо составила 45,1 месяца [15].
Частота объективных ответов на комбинацию CDK4/6-ингибитора рибоциклиба с эндокринотерапией в исследованиях также оказалась значительно выше по сравнению с монорежимами эндокринотерапии. Так, частота объективных ответов от пациентов с висцеральными метастазами в исследовании MonaLEEsa-2 составила 78 против 71% в группе без метастазов, в MonaLEEsa-3 (пациенты в постменопаузе в 1-й и 2-й линиях терапии) 74 против 59% и в MonaLEEsa-7 (пациенты в пременопаузе) 79% против 57% [6].
В отечественной литературе представлено крайне мало описаний редких локализаций метастазов РМЖ и тем более опыта применения ингибиторов CDK4/6 при таком виде метастазирования. В связи с этим хотим поделиться собственным наблюдением подобного случая.
Клинический случай
В 2009 г. в возрасте 50 лет (менопауза в течение 5 лет) больной М. установлен диагноз «злокачественное новообразование левой молочной железы IIIA-cт. (T2N2M0)». Комплексное лечение: радикальная мастэктомия по Маддену слева, 6 курсов адъювантной химиотерапии по схеме FAC (фторурацил, адриамицин, циклофосфамид), курс дистанционной лучевой терапии на мягкие ткани передней грудной стенки и зоны лимфооттока в СОД 48 Гр.
Гистологическое заключение: инфильтрирующая дольковая карцинома низкой степени дифференцировки-G3. Результаты иммуногистохимического (ИГХ) исследования: РЭ – 8 баллов, РП – 2 балла, Her2 – 0, Ki-67 – 10%.
После окончания лечения до 2015 г. пациентка находилась на диспансерном наблюдении у онколога, признаков прогрессирования или рецидива заболевания не отмечалось.
В феврале 2015 г. диагностирован рецидив в послеоперационный рубец, выполнено иссечение рубца. Гистологическое заключение: метастаз РМЖ низкой степени дифференцировки. ИГХ: РЭ – 8 баллов, РП – 8 баллов, Her2 – 0, Ki-67 – 30%. В послеоперационном периоде пациентке назначена гормональная терапия препаратом тамоксифен 20 мг/сут. Продолжено динамическое наблюдение.
В октябре 2018 г. во время планового обследования при ультразвуковом исследовании (УЗИ) органов брюшной полости впервые были выявлены крупные очаги в печени, подозрительные на метастазы. Выполнена компьютерная томография (КТ) органов брюшной полости с контрастным усилением: подтверждено метастатическое поражение печени (4 очага размером 2,1×1,0 см, 7,0×1,2; 0,8×0,6×1,1; 1,0×0,9×1,7; 6,7×5,6×5,2 см).
Для дальнейшего обследования пациентка обратилась в клинику Израиля. ПЭТ-КТ (позитронная эмиссионная-компьютерная томография) от октября 2018 г.: множественное метастатическое поражение печени (наиболее крупное образование до 7 см, SUV max – 12,0). Биохимический анализ крови – аланинаминотрансфераза (АЛТ) – 25 U/l, аспартатаминотрансфераза (АСТ) – 40 U/l, общий биллирубин – 12,7 мкмоль/л. Выполнена биопсия печени под контролем УЗИ от 10.10.2018. Гистологическое заключение: метастаз инфильтрирующей дольковой карциномы молочной железы низкой степени дифференцировки. ИГХ: РЭ – 8 баллов, РП – 6 баллов, Her2 – 0, Ki-67 – 40%.
В клинике проведено тестирование опухолевой ткани на чувствительность к лекарственным препаратам методом культивирования опухолевых сфероидов. Выборка состояла из комбинаций и монорежимов: палбоциклиб+летрозол, палбоциклиб+фулвестрант, летрозол, анастрозол, фулвестрант, эверолимус, эрибулин+эксеместан, химиотерапия, паклитаксел, гемцитабин+цисплатин. Тестирование показало высокую чувствительность к комбинации гемцитабин+цисплатин и полное отсутствие чувствительности к остальным препаратам.
С данными результатами обследования и рекомендациями по лечению пациентка в ноябре 2018 г. обратилась за медицинской помощью в медицинский центр Дальневосточного федерального университета с жалобами на боль в правом подреберье и тошноту. В биохимическом анализе крови выявлено повышение уровня трансаминаз: АЛТ – 100 U/l, АСТ – 80 U/l, общий биллирубин – 13,9 мкмоль/л. Состояние расценено как висцеральный криз, начата полихимиотерапия по схеме гемцитабин (1600 мг) 1-й, 8-й дни +цисплатин (300 мг) 1 день.
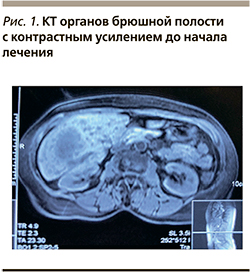 После первого цикла GP у больной появились кровянистые выделения из половых путей; 21.11.2018 осмотрена гинекологом: выявлено объемное образование шейки матки до 2 см в диаметре. УЗИ органов малого таза (рис. 1): эндометрий М-Эхо 8,6, шейка матки 30 мм, форма правильная, строение изменено за счет единичного полипоидного образования на «ножке» 20 мм; жидкость в позадиматочном пространстве не определяется; яичники в типичном месте, размеры не увеличены (заключение: объемное образование шейки матки). 12.12.2018 выполнена гистероскопия, диагностическое выскабливание цервикального канала, биопсия шейки матки. Гистологическое заключение: недифференцированная злокачественная опухоль (нельзя исключить метастатическое поражение). Рекомендовано выполнение ИГХ исследования. Пациентке продолжена химиотерапия. Лечение переносила с гематологической токсичностью: нейтропенией II–III степеней (с поддерживающей терапией филграстимом). В декабре 2018 г. завершен 2-й курс химиотерапии по схеме GP. Больной проведено контрольное обследование. В биохимическом анализе крови: АСТ – 20 U/l, АЛТ – 21 U/l, общий билирубин – 12,8 мкмоль/л. По результатам КТ органов брюшной полости от 09.01.2019 отмечено уменьшение суммы наибольших размеров метастатических очагов в печени на 25% (с 70 до 52 мм) по критериям RECIST 1.1, что соответствовало стабилизации процесса.
После первого цикла GP у больной появились кровянистые выделения из половых путей; 21.11.2018 осмотрена гинекологом: выявлено объемное образование шейки матки до 2 см в диаметре. УЗИ органов малого таза (рис. 1): эндометрий М-Эхо 8,6, шейка матки 30 мм, форма правильная, строение изменено за счет единичного полипоидного образования на «ножке» 20 мм; жидкость в позадиматочном пространстве не определяется; яичники в типичном месте, размеры не увеличены (заключение: объемное образование шейки матки). 12.12.2018 выполнена гистероскопия, диагностическое выскабливание цервикального канала, биопсия шейки матки. Гистологическое заключение: недифференцированная злокачественная опухоль (нельзя исключить метастатическое поражение). Рекомендовано выполнение ИГХ исследования. Пациентке продолжена химиотерапия. Лечение переносила с гематологической токсичностью: нейтропенией II–III степеней (с поддерживающей терапией филграстимом). В декабре 2018 г. завершен 2-й курс химиотерапии по схеме GP. Больной проведено контрольное обследование. В биохимическом анализе крови: АСТ – 20 U/l, АЛТ – 21 U/l, общий билирубин – 12,8 мкмоль/л. По результатам КТ органов брюшной полости от 09.01.2019 отмечено уменьшение суммы наибольших размеров метастатических очагов в печени на 25% (с 70 до 52 мм) по критериям RECIST 1.1, что соответствовало стабилизации процесса.
Результаты ИГХ от 14.01.2019: эндометриоидная карцинома солидного типа строения, G3 (первичная карцинома шейки матки из очага эндометриоза или вторичное поражение полости матки, нельзя исключить метастаз РМЖ). CD-10, CK-17 негативные; р53, EMA, BCL2, ER положительные, Ki-67 – 25%. Кроме того, в январе 2019 г. у пациентки появились боли в костях таза при ходьбе. Выполнена магнитно-резонансная томография тазобедренных суставов: многочисленные метастазы в кости таза и бедренные кости с обеих сторон. Начата терапия деносумабом 120 мг 1 раз в 28 дней, а также гормональная терапия препаратом летрозол 2,5 мг/сут.
Ранее исследованный гистологический материал в связи с неоднозначностью заключения был направлен на пересмотр в НМИЦ онкологии им. Н.Н. Петрова (Санкт-Петербург). Заключение по результатам пересмотра от 15.02.2019: метастаз инвазивного РМЖ в шейку матки, МСК, GATA3, PR – положительные, PAX8, Her2 – негативные.
Назначенную терапию пациентка получала до марта 2019 г., когда по результатам контрольного КТ органов брюшной полости от 20.03.2019 установлено увеличение суммы наибольших размеров метастатических очагов в печени на 16% (стабилизации процесса).
С марта 2019 г. к гормонотерапии ингибитором ароматазы подключен CDK4/6-ингибитор – рибоциклиб, в дозировке 600 мг/сут в течение 21 дня в условиях дневного стационара.
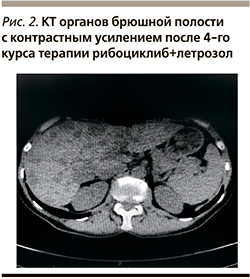 Оценка динамики на фоне терапии рибоциклибом с летрозолом проведена 22.05.2019. По результатам физикального осмотра и УЗИ (рис. 2): полный регресс новообразования шейки матки. По данным КТ органов брюшной полости отмечено уменьшение суммы наибольших размеров метастатических очагов в печени на 5% (с 60 до 57 мм). С учетом положительной динамики лечение продолжено. Переносимость комбинации рибоциклиба с летрозолом у больной удовлетворительная: отмечалась нейтропения II степени тяжести и тромбоцитопения I степени, которые самостоятельно регрессировали в течение недельного перерыва между приемами препарата.
Оценка динамики на фоне терапии рибоциклибом с летрозолом проведена 22.05.2019. По результатам физикального осмотра и УЗИ (рис. 2): полный регресс новообразования шейки матки. По данным КТ органов брюшной полости отмечено уменьшение суммы наибольших размеров метастатических очагов в печени на 5% (с 60 до 57 мм). С учетом положительной динамики лечение продолжено. Переносимость комбинации рибоциклиба с летрозолом у больной удовлетворительная: отмечалась нейтропения II степени тяжести и тромбоцитопения I степени, которые самостоятельно регрессировали в течение недельного перерыва между приемами препарата.
В июле 2019 г. (после 4-го курса приема ингибитора CDК4/6 в сочетании с летрозолом) вновь проведена очередная оценка динамики, где по данным КТ органов брюшной полости от 29.07.2019 выявлено уменьшение суммы размеров метастатических очагов в печени на 26% (наиболее крупный уменьшился с 60 до 44 мм). Осмотр гинеколога не выявил изменений в шейке матки, по данным УЗИ органов малого таза изменений также не было обнаружено. Кроме того, исчез болевой синдром в костях таза. В настоящее время пациентка продолжает данную терапию и ведет привычный образ жизни, занимается спортом, работает.
Обсуждение
Таким образом, приведенный клинический случай демонстрирует несколько интересных с клинической точки зрения моментов. Дольковый РМЖ может давать отдаленные метастазы редкой локализации (в данном случае – в шейку матки), что представляет сложности в дифференциальной диагностике между метастатическим процессом и синхронным/метахронным раком.
Показано, что добавление к эндокринотерапии в течение 3 месяцев ингибиторов CDК4/6 позволяет добиваться хорошего клинического ответа. Безусловно, оптимальной стратегией является изначальное применение комбинации ингибиторов ароматазы и CDK4/6.
Отсутствие чувствительности к лекарственным препаратам, выявленное методом индивидуальной оценки лекарственной чувствительности и устойчивости с использованием сфероидов, не всегда совпадает с эффективностью терапии в реальной клинической практике, несмотря на высокую чувствительность (95,5%) и специфичность (80,4%) метода [19]. Однако следует отметить, что химиочувствительность опухолевых клеток зависит от многих генетических и эпигенетических факторов на уровне клетки и организма, что может выступать в качестве интегративного прогностического показателя ответа опухоли конкретного пациента на проводимую химиотерапию.
Усиленная CDК4/6-ингибиторами эндокринотерапия сопровождается высокой эффективностью за счет объективного ответа со стороны висцеральных метастазов, а также позволяет сохранять качество жизни пациента на счет приемлемого профиля токсичности и быстрого купирования клинических симптомов, обусловленных опухолевым процессом.
Заключение
Представленное клиническое наблюдение демонстрирует случай множественного метастатического поражения при РМЖ костной системы и висцеральных органов, в т.ч. редкую локализацию метастаза в шейке матки. Ключевую роль в оценке характера поражения и выборе лечебной тактики сыграли результаты морфологического исследования.
Применение комбинации ингибиторов ароматазы и CDК4/6 продемонстрировало приемлемую токсичность, высокую клиническую эффективность в отношении висцеральных метастазов, а также возможность купирования болевого синдрома, обусловленного метастатическим поражением костей.
Информированное согласие
Пациенткой дано информированное согласие на представление данного клинического случая.


