Осознание значимости влияния микробиоты на здоровье человека приходит в современную медицину постепенно. Организм человека представляет собой «суперорганизм», включающий симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, вирусов и архибактерий. «Метагеном» данного «суперорганизма» состоит из генов собственно Homo sapiens и генов (микробиом), присутствующих в геномах микроорганизмов, населяющих тело человека [1, 2]. На сегодняшний день убедительно доказано, что в организме взрослого человека находится около 100 трлн бактерий и более квадриллиона вирусов, что в 10–100 раз превышает общее число его соматических и зародышевых клеток [2–8]. В то же время нельзя не отметить, что в организме человека все функции прямо или опосредованно связаны с активностью колонизирующих его многочисленных микроорганизмов [2, 5–8].
Например, накоплены данные, что микробиота наряду с морфофункциональной адаптацией желудочно-кишечного тракта влияет на процессы созревания иммунной системы и формирует ось взаимодействия кишечник–мозг (центральная нервная система [ЦНС]; рис. 1).
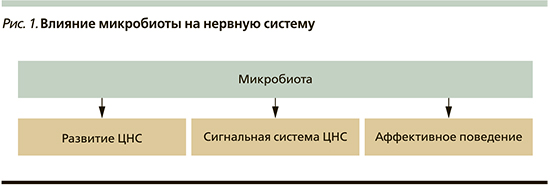
Известно, что синтетическая активность микробиоты по продукции разнообразных сигнальных молекул (регуляторные амины, пептидные нейромодуляторы) заслуженно находится на втором месте после собственно мозговой ткани [9]. Продукция нейротрансмиттеров микробиотой происходит в количествах, нередко превышающих содержание этих соединений в сыворотке крови человека. Многие исследователи едины во мнении, что симбиотическая кишечная микробиота способна активно участвовать в накоплении общего пула соответствующих нейромедиаторов и как следствие – в регуляции нервно-психической деятельности млекопитающих [2, 10, 11].
Влияние микробиоты на нервную систему происходит с помощью нескольких механизмов, в т.ч. посредством продукции значительного количества сигнальных молекул и короткоцепочечных жирных кислот (КЦЖК), которые участвуют в модуляции экспрессии генов путем подавления деацетилирования гистоновых белков и обладают разными значимыми эффектами на функционирование ЦНС (табл. 1, 2) [12].

К КЦЖК относятся кислоты, содержащие 2, 3, 4 и 5 атомов углерода – ацетат, пропионат, бутират и пентаноат, образующиеся в результате микробной ферментации сложных полисахаридов (крахмалы и пищевые волокна) в толстой кишке. КЦЖК через портальную циркуляцию попадают в кровоток и далее транспортируются в органы и ткани, участвуя в процессах регуляции и обеспечивая межклеточное взаимодействие, включая регуляцию экспрессии генов [13, 14]. Такие КЦЖК, как пропионат и бутират, способны модулировать функциональную активность головного мозга, участвуя в контроле над аппетитом и поддержании энергетического гомеостаза через регуляцию продукции нейропептидов [15]. При этом бутират преимущественно абсорбируется на поверхности кишечного эпителия, тогда как ацетат и пропионат попадают в системную циркуляцию [16].
В целом суммируя накопленные данные, ниже представлены механизмы взаимодействия микробиоты и ЦНС:
- Нейрональное взаимодействие – микроорганизмы могут передавать информацию в головной мозг через n. vagus [17];
- Изменение обмена триптофана – предшественника нейротрансмиттера серотонина. При избыточной активации кинуренинового пути метаболизма триптофана (вследствие повышенного образования провоспалительных цитокинов, приема кортикостероидов) снижается концентрация серотонина. Показан положительный эффект применения пробиотиков, приводящий к снижению концентрации кинуренина [18];
- Гормональное взаимодействие в результате высвобождения регуляторных пептидов из энтероэндокринных клеток кишечника. Высвобождение пептидов находится под контролем кишечной микробиоты, что было продемонстрировано на безмикробных животных [19];
- Взаимодействие посредством КЦЖК, влияющих на активность иммунной и нервной (симпатический отдел) систем [20].
Принципиальные нарушения в функционировании системы «микробиота–ЦНС» неизбежно происходят вследствие дисбаланса кишечного микробиоценоза. Изменения в синергетической связи между хозяином и микробиотой могут иметь серьезные последствия, приводя к возникновению или усугублению уже имеющихся метаболических расстройств и нарушениям со стороны как нервной, так и пищеварительной систем [21, 22].

С возрастом и под влиянием значительного количества неблагоприятных факторов дисбаланс кишечной микробиоты способствует возникновению эндотоксимии из-за резко увеличенного поступления из пищеварительной системы в кровь эндотоксинов грамотрицательных и мурамилдипептидов грамположительных бактерий, являющихся мощнейшим индуктором хронического воспаления в организме человека [2, 23, 24].
Нарушение микробного пейзажа кишечника способствует изменению количества нейромедиаторов микробного происхождения, что может привести к развитию целого ряда заболеваний.
В настоящее время накоплено достаточно доказательств, указывающих на дисбиоз кишечника как на фактор риска возникновения нарушений когнитивных функций и развития широкого спектра психических заболеваний, включая нейропсихиатрические состояния [25, 26], такие как расстройства аутистического спектра, депрессия и шизофрения [27, 28]. В случае дисбиоза конституцио-нальный спектр КЦЖК значительно изменяется и характеризуется повышением уровня пропионовой кислоты [27]. Сходные изменения выявлены у детей с аутизмом. Предполагается, что повышение уровня пропионата негативно влияет на функциональные возможности нервной системы [29].
В то же время нарушения микробиоты через выработку биологически активных субстанций, участвующих в углеводном и липидном обменах, способствуют системному воспалению и развитию ожирения как пускового кластера метаболического синдрома (МС) [30–34].
Всемирная организация здравоохранения (ВОЗ) считает МС «глобальной эпидемией» современности. По расчетам экспертов, к 2025 г. МС будет страдать каждый второй житель планеты, а число пациентов в мире превысит 300 млн [35, 36].
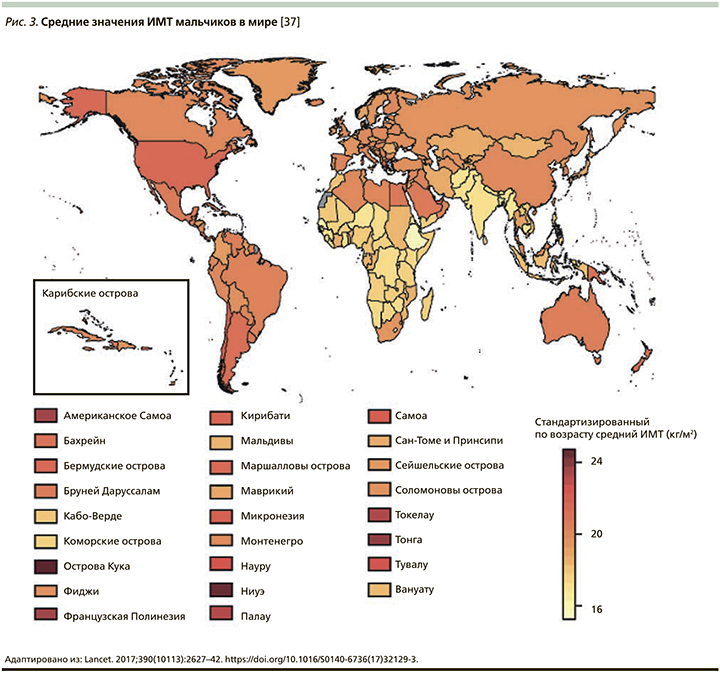
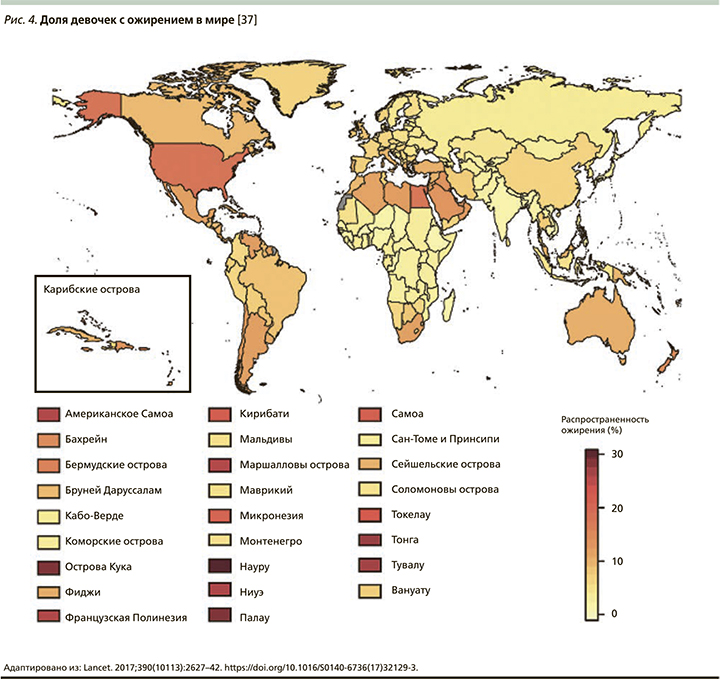
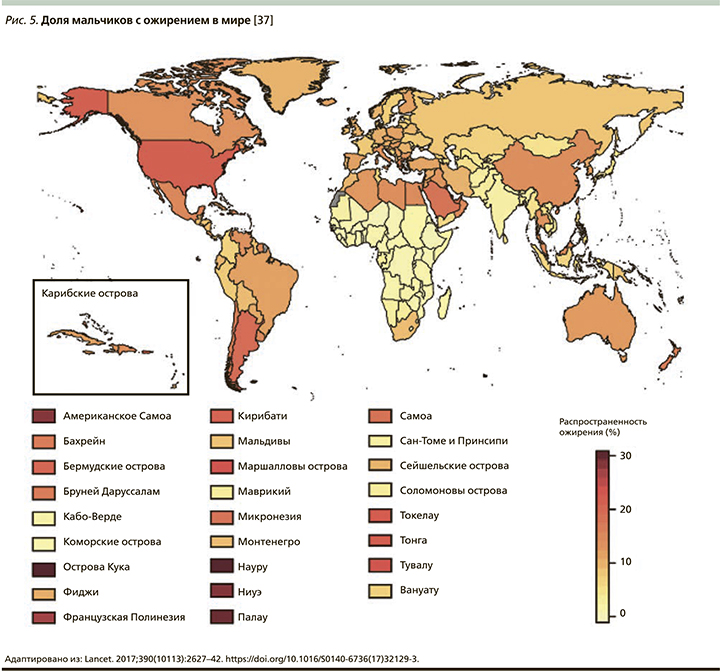
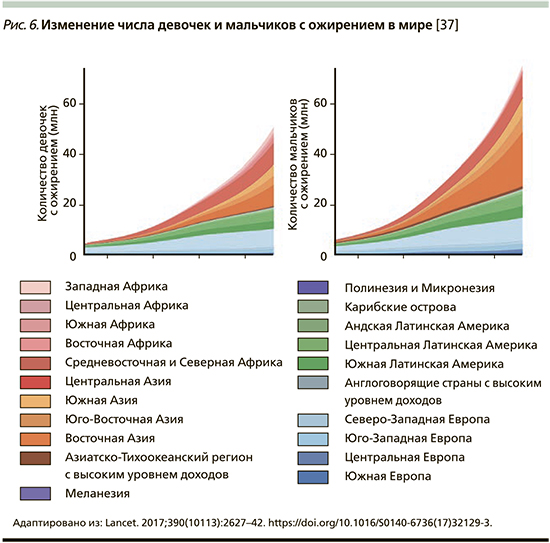
В конце 2017 г. в журнале Lancet Международной коллаборацией по факторам риска неинфекционных заболеваний (NCD Risk Factor Collaboration – NCD-RisC) была опубликована статья с сообщением, что число детей и подростков, страдающих ожирением, возросло за последние сорок лет в 10 раз [37]. Данное исследование было проведено ВОЗ совместно с Имперским колледжем Лондона (Imperial College London). Под эгидой NCD-RisC специалисты из разных стран проанализировали показатели массы тела и роста почти 130 млн человек, из которых 31,5 млн были в возрасте от 5 до 19 лет. Ученые объединили данные 2416 региональных исследований, а затем, используя байесовскую иерархическую модель, проследили за изменением значений индекса массы тела (ИМТ) во всем мире в период с 1975 по 2016 г. Анализ включал жителей из 200 стран. Выяснилось, что показатели детского и подросткового ожирения в мире возросли с менее чем 1% процента в 1975 г. до примерно 6% среди девочек и 8% среди мальчиков в 2016 г. Согласно полученным данным, в 2016 г. страдали от ожирения 50 млн девочек и 74 млн мальчиков. Совокупный показатель вырос с 11 млн в 1975 г. до 124 млн детей и подростков в 2016 г. Кроме того, 213 млн детей в возрасте 5–19 лет имели в 2016 г. избыточную массу тела, но не прошли порог значения ИМТ для ожирения (рис. 2–6) [37].
По мнению специалистов при сохранении данной тенденции в ближайшие 5 лет число детей и подростков с ожирением превысит таковое их сверстников с умеренно или значительно пониженной массой тела [37].
На данном этапе исследователи едины во мнении: ожирение является облигатным и инициирующим кластером для формирования МС. Согласно современной трактовке, МС представляет собой симптомокомплекс, включающий артериальную гипертензию, сахарный диабет (СД) или нарушение толерантности к глюкозе, повышение уровней триглицеридов, липопротеидов низкой плотности, снижение содержания липопротеидов высокой плотности. Для установки данного диагноза необходимо наличие наряду с основным кластером в виде абдоминального ожирения двух дополнительных составляющих [36, 38, 39].
Логично предположить, что помимо собственного негативного влияния нарушений микробиоты на нервную систему, описанного выше, психо-интеллектуальное функционирование пациентов будет также находиться под воздействием МС. Нельзя не отметить, что количество исследований по оценке интеллектуальных аспектов пациентов с метаболическими нарушениями немногочисленно, находится в стадии накопления [40]. Большинство таких работ проведены в отношении страдающих ожирением пациентов с умственной отсталостью вплоть до синдрома Дауна или с выраженным когнитивным дефицитом другого генеза [41–44].
Исследования поперечного типа показали, что ожирение у подростков и взрослых ассоциировано с более низким уровнем интеллекта (IQ), чем у контрольных лиц с нормальной массой тела [45–47]. У лиц с ожирением в среднем возрасте существует более высокая вероятность когнитивного снижения и деменции в последующие годы, чем у людей с нормальной массой тела [48–50]. В исследовании продольного типа оказалось, что у тучных лиц с признаками МС избыточного снижения интеллекта не наблюдается, а вероятность ожирения была выше только у тех, кто имел низкий интеллект уже с 3 лет [51].
По результатам объективного исследования интеллекта у пациентов с морбидным ожирением, обратившихся за проведением бариатрической операции, не было выявлено значимых ассоциаций между IQ и ИМТ, IQ и окружностью талии; уровень интеллекта в целом у всех обследуемых соответствовал средней возрастной норме и не отличался от такового у здоровых лиц [52].
У больных СД, получающих инсулин, выявлен несколько меньший интеллект (за счет снижения преимущественно вербального IQ) по сравнению со здоровыми лицами, причем очень небольшая часть этих различий связана с перенесенными повторными тяжелыми гипогликемиями и гораздо большее значение авторы придают социальному влиянию СД [53].
В одном из отечественных исследований проведена оценка невербального интеллекта у больных СД, при этом разницы в балльной оценке показателя у пациентов с диабетической энцефалопатией и без нее выявлено не было, а уровень интеллекта в целом находился в «хорошей норме» [54].
В отделении терапевтической эндокринологии ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» (Москва) активно разрабатывали гипотезу о влиянии интеллекта на эффективность лечения СД, коррекцию массы тела и других факторов риска у больных СД [40]. Авторами проведено исследование для оценки возможных связей между уровнем интеллекта, компенсацией углеводного обмена, контролем артериального давления и степенью ожирения у больных СД 2 типа. Заключение по результатам проведенной работы свидетельствовало, что уровень интеллекта больных СД 2 типа не играет роли в контроле таких факторов риска, как масса тела и артериальное давление. Контроль гликемии у большинства пациентов данной категории не зависит от уровня их интеллекта и образования; значимо лучшего контроля гликемии достигают лишь пациенты с высоким уровнем IQ. Кроме того, исследование позволило предположить, что важнейшим фактором снижения уровня интеллекта у больных СД 2 типа служит хроническая ишемия головного мозга, т.е. цереброваскулярная болезнь [40].
Заключение
Современные научные данные свидетельствуют в пользу того, что микробиота оказывает влияние на все функции организма, а ее продуценты могут приводить к развитию ряда заболеваний, включая МС. Поскольку на нервную систему и психо-интеллектуальное функционирование негативно влияют как сигнальные молекулы, вырабатываемые микробиотой, так и собственно метаболические нарушения, целесообразно рассмотрение данных нарушений в рамках единого патологического процесса с общими клинико-патогенетическими звеньями. Интегративный подход к указанной комплексной патологии в рамках современных тенденций развития медицинской науки будет способствовать более адекватному и эффективному ведению больных данной категории.


