Повышение эффективности методов вспомогательных репродуктивных технологий является актуальной задачей современной репродуктивной медицины [1]. Известно, что эффективность программы экстракорпорального оплодотворения (ЭКО) во многом зависит от функциональной зрелости и готовности эндометрия к имплантации, а также от синхронизации с развитием эмбриона. В работах последних лет обсуждается неблагоприятное воздействие овариальной стимуляции в программе ЭКО на имплантационный потенциал эндометрия, что проявляется преждевременной секреторной трансформацией и дискоординацией созревания эндометрия, нарушением рецептивности в «окно имплантации», и как следствие – к неудачам имплантации даже при переносе эмбрионов высокого качества [2, 3].
В последние годы предметом активного обсуждения исследователей является феномен преждевременной лютеинизации (ПЛ) – повышение концентраций сывороточного прогестерона (Р) в день введения триггера овуляции) и механизмы его влияния на рецептивность эндометрия в циклах овариальной стимуляции. ПЛ потенцирует негативное влияние овариальной стимуляции на эндометрий и усугубляет нарушение его рецептивности [4]. Ряд исследований свидетельствуют об отсутствии имплантации эмбрионов при опережении развития эндометрия более, чем на 3 дня согласно критериям Noyes [5, 6]. Прямые доказательства негативного влияния повышенных концентраций преовуляторного Р на эндометрий были показаны лишь в единичных исследованиях при анализе профиля экспрессии мРНК генов маркеров рецептивности [3, 6, 7], что требует продолжения исследований.
 Цель исследования: оценить влияние концентраций сывороточного Р в день введения триггера овуляции на рецептивность эндометрия в программе ЭКО.
Цель исследования: оценить влияние концентраций сывороточного Р в день введения триггера овуляции на рецептивность эндометрия в программе ЭКО.
Материал и методы исследования
В исследование включены 293 пациентки, обратившиеся для проведения программы ЭКО в 1-ое гинекологическое отделение ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в период с октября 2011 г. по май 2014 г.
Стимуляцию суперовуляции проводили по стандартному длинному протоколу с использованием препаратов рекомбинантного фолликулостимулирующего гормона и человеческого менопаузального гонадотропина. В день введения овуляторной дозы хорионического гонадотропина человека 10000 МЕ определяли сывороточную концентрацию Р. Для верификации ПЛ использовали пороговый уровень сывороточного Р≥4,77 нмоль/л (1,5 нг/мл; коэффициент пересчета 3,18) [8].
Группу исследования для изучения состояния эндометрия составили 36 женщин, из них 17 пациенток с трубно – перитонеальным и/или мужским (субфертильная сперма) факторами бесплодия, которым был отменен перенос эмбрионов, и 19 доноров ооцитов. Аспирационная пайпель – биопсия эндометрия проводилась из области дна матки с помощью аспирационной кюретки Pipelle de Cornier (Laboratoire C.C.D., Франция) в день трансвагинальной пункции яичников. В зависимости от уровня р в день введения триггера овуляции пациентки были разделены: 1-я группа (n=16) – Р≥4,77 нмоль/л; 2-я группа (n=20) – Р<4,77 нмоль/л.
Проведено морфологическое, иммуногистохимическое (ИГХ) и молекулярно – генетическое исследования эндометрия. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 ч. Образцы были обработаны по общепринятой стандартной методике и заключены в парафин. Срезы толщиной 4 мкм готовили на роторных микротомах и окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводилось в световом микроскопе при увеличении от х50 до х600. Гистологическое датирование эндометрия, оценку процента клеток поверхностного эпителия с наличием зрелых пиноподий осуществляли в световом микроскопе при увеличении х400 в 5 полях зрения. ИГХ реакции проводили на серийных депарафинированных срезах толщиной 3–4 мкм по общепринятым методикам (DAKO protocols).
Определение стероидных рецепторов проводили с использованием мышиных моноклональных антител к эстрогеновым (ЭР)α (клон 1D5 RTU «DAKO», Дания) и прогестероновым рецепторам (ПР)-А (клон 636 RTU«DAKO», Дания). Для выявления экспрессии лейкемия ингибирующего фактора (LIF) использовали первичные антитела к LIF (R@DSystems, USA, clone: 9824, 1:100).
Анализ результатов ИГХ реакций для ЭРα и ПР-А проводили с учетом количества окрашенных клеток и интенсивности окраски в железах и строме эндометрия, используя метод гистологического счета Н-score по формуле: HS=1a±2b±3c, где а – процент слабо окрашенных клеток, b–процент умеренно окрашенных клеток, с – процент интенсивно окрашенных клеток; 1,2,3 – интенсивность окрашивания, выраженная в баллах.
Степень выраженности экспрессии ЭРα и ПР-А расценивали следующим образом: 0–10 баллов – отсутствие экспрессии, 11–100 баллов – слабая экспрессия, 101–200 баллов – умеренная экспрессия, 201–300 баллов – выраженная экспрессия. Рассматривали также коэффициент ПР/ЭР, рассчитанный по строме.
Пиноподии оценивались, как изобилующие, умеренные и незначительные в зависимости от процента занимаемой ими поверхности эндометрия (> 50, 20–50 и <20 соответственно).
Результаты ИГХ реакции для LIF оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (-) – 0 баллов, менее 5% (±) – 0,5 баллов, менее 20% (+) – 2 балла, от 20 до 40% (++) – 4 балла, более 40% (+++) – 6 баллов.
Датирование эндометрия проводили по критериям Noeyes [9]. День аспирации ооцитов расценивали как 14-й день условного 28-дневного цикла.
Образцы эндометрия для молекулярно-генетического исследования после взятия были помещены в пробирки со средой для стабилизации РНК (раствор гуанидинизотиоцината). Оценку уровня экспрессии мРНК 22 генов, включающих цитокины (IL1В, IL2, LIF, LIFR, IL8, IL15, IL18, TNFА), ростовые факторы (HBEGF, IGFBP1, IGF1, VEGFА, VEGFА изоформа 189), матриксную металлопротеиназу MMP11, циклооксигеназу PTGS2, иммунные маркеры (CD56, CD 68), рецептор эстрогена (ESR1) и прогестерона (PGR), гены гомеобокса (MSX1/HOX7, HOXA10, HOXA11) проводили с помощью количественной полимеразной цепной реакции с предварительной стадией обратной транскрипции в режиме реального времени («ДНК-Технология», Россия). Для выделения нуклеиновых кислот использовали наборы «Проба НК». Метод основан на лизисе клеток в 4М растворе гуанидинтиоционата и осаждении нуклеиновых кислот изопропанолом в присутствии соосадителя с последующими отмывками этанолом и ацетоном. Реакцию обратной транскрипции проводили в объеме 40 мкл. В качестве праймеров для обратной транскрипции использовали оригинальные специфические олигонуклеотиды и обратную транскриптазу М-MuLV. Реакцию проводили при температуре 40°С в течение 30 минут, с последующей инактивацией обратной транскриптазы при 95°С в течение 5 минут. Амплификацию осуществляли в режиме реального времени с измерением уровня флуоресценции по каналу FAM на каждом цикле при температуре отжига праймеров. Реакцию ставили в двух повторах для каждой точки. Уровень экспрессии исследуемых генов определялся относительно референсных значений генов В2М GUSB и TBP методом сравнения пороговых циклов (метод ΔСq).
 Статистический анализ результатов проводили с использованием программы IPM SРSS Statistics, версия 21. Для сравнения непараметрических данных применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2×2, 2×3 и 2×4 (для сравнения частот встречаемости признаков в анализируемых группах). Результаты представлены как среднее ± стандартная ошибка среднего (М±m). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
Статистический анализ результатов проводили с использованием программы IPM SРSS Statistics, версия 21. Для сравнения непараметрических данных применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2×2, 2×3 и 2×4 (для сравнения частот встречаемости признаков в анализируемых группах). Результаты представлены как среднее ± стандартная ошибка среднего (М±m). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
Результаты исследования
Анализ морфологической структуры эндометрия в зависимости от концентрации Р в день триггера овуляции показал, что при развитии ПЛ ни у одной пациентки эндометрий не соответствовал дню цикла, в 93,6% случаев наблюдалось опережение созревания эндометрия и в 6,3% – отставание (рис. 1).
При этом по критериям Noyes эндометрий в день аспирации ооцитов соответствовал 17,6±0,6 дню цикла, то есть наблюдалось более существенное опережение его развития, чем в группе с нормальным уровнем Р (3,9±0,6 и 2,3±0,3дней; р=0,048 ) (таблица).
Зрелые пиноподии в день аспирации ооцитов выявлялись с одинаковой частотой у пациенток с нормальным и повышенным уровнем преовуляторного Р (95 и 93,7%; р=0,918), при этом их количество было существенно выше у пациенток с ПЛ (Ме 25 и 15%; р=0,026), что можно расценить как достоверный признак раннего открытия «окна имплантации».
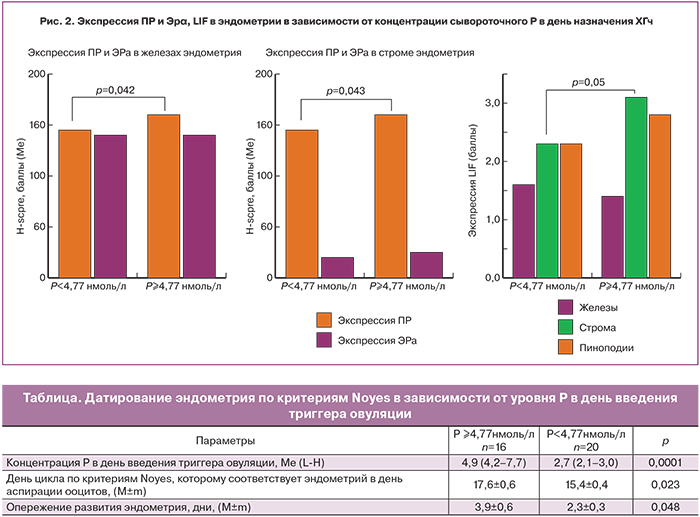
Оценка экспрессии рецепторов ПР и ЭРα (рис. 2) в эндометрии в зависимости от уровня Р в день триггера показала статистически значимую разницу экспрессии ПР в железах и строме. При нормальном уровне Р в день введения триггера овуляции экспрессия ПР в железах колебалась от 10 до 180%, медиана составила 145%. В группе с повышенным уровнем Р – от 120 до 200%, медиана – 160% (р=0,042). При нормальной концентрации преовуляторного Р экспрессия ПР в строме находилась в пределах от 10 до 220% (медиана 145%), при повышенном Р – от 120 до 200% (медиана 160%; р=0,043).
Экспрессия ЭРα как в железах, так и в строме была сопоставима между группами. Также не было выявлено различий в коэффициенте ПР/ЭРα в строме эндометрия (медиана 7 и 9; р=0,237). Экспрессия LIF в строме эндометрия была существенно выше у пациенток в повышенным уровнем Р (3,2±0,5 и 1,6±0,4 баллов; р=0,05).
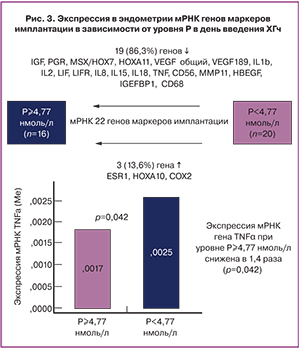
Результаты молекулярно-генетического исследования показали, что при развитии ПЛ наблюдается менее активная экспрессия мРНК 19 (86,3%) генов и более активная мРНК 3 (13,6%) генов маркеров имплантации. При этом экспрессия мРНК гена TNFА была снижена в 1,4 раза (р=0,042) (рис. 3).
В ряде работ показано, что опережение созревания эндометрия более чем на 3 дня (по критериям Noyes) является критическим и негативно влияет на эффективность программы ЭКО [5, 6, 10]. В связи с этим нами был проведен сравнительный анализ профиля экспрессии мРНК генов маркеров рецептивности в эндометрии при опережении развития эндометрия более (n=11) и менее чем на 3 дня (n=25).
Было выявлено, что при опережении развития эндометрия более чем на 3 дня существенно снижается экспрессия мРНК ключевых генов маркеров имплантации: HOXA11 – в 1,8 раза (р=0,022), IGFBP1 – в 5 раз (р=0,028), CD68 – в 1,7 раза (р=0,043) (рис. 4). Экспрессия остальных маркеров рецептивности была сопоставима между группами.
Таким образом, оценка эндометрия в день аспирации ооцитов показала, что у пациенток с ПЛ наблюдается опережение созревания эндометрия в среднем на 3,9±0,6 дня, ранняя экспрессия LIF преимущественно в строме эндометрия, умеренная экспрессия ПР в железах и строме, появление зрелых пиноподий более чем на 20% поверхности эпителия, изменение профиля экспрессии мРНК генов маркеров имплантации, что является подтверждением нарушения рецептивности эндометрия и прогностическими факторами неудач имплантации в программе ЭКО.
Обсуждение
Наличие рецептивного эндометрия является важным фактором успеха имплантации в программах ВРТ.
Полученные результаты подтверждают мнение других исследователей [11, 12], что развитие ПЛ потенцирует негативное влияние овариальной стимуляции на эндометрий. Так, данные гистологического датирования эндометрия по критериям Noyes показали, что при повышенных концентрациях преовуляторного Р наблюдалось более существенное опережение его развития, чем в группе с нормальным уровнем Р (3,9±0,6 и 2,3±0,3 дня; р=0,048).
Анализ результатов ИГХ исследования показал, что более выраженная экспрессия ПР как в железах, так и в строме эндометрия наблюдалась при развитии ПЛ, чем при нормальном уровне Р в день введения триггера. Экспрессия ЭРα не зависела от концентраций Р и была сопоставима между группами.
Полученные данные об экспрессии стероидных рецепторов в день трансвагинальной пункции яичников свидетельствуют о смещении «окна имплантации» вперед при повышенных концентрациях Р в день введения триггера овуляции, что согласуется с результатами других исследователей [13, 14]. Экспрессия LIF в строме эндометрия зависела от уровня Р в день введения триггера овуляции и была в 2,5 раза выше в группе женщин с концентрацией Р≥4,77 нмоль/л, по сравнению с аналогичным показателем в группе с нормальным уровнем Р, что отражает нарушение рецептивности эндометрия при развитии ПЛ.
Анализ экспрессии мРНК генов в день забора ооцитов в зависимости от концентрации преовуляторного р показал, что при повышении Р более 4,77 нмоль/л существенно снижалась (в 1,4 раза) экспрессия мРНК гена провоспалительного цитокина TNFА. В ряде работ показана роль TNFА в успешной имплантации эмбриона, в том числе при проведении программ ЭКО [15, 16]. Так, C. Boomsma и соавт. (2009) при изучении экспрессии генов в эндометрии, полученном непосредственно перед переносом эмбрионов наблюдали позитивную корреляцию между уровнем экспрессии TNFА и частотой клинической беременности [15]. Экспериментальные исследования A.Z. Szostek и соавт. (2014) показали, что экспрессия TNFА в эпителиальных клетках эндометрия регулируется сывороточной концентрацией Р и эстрадиола [16].
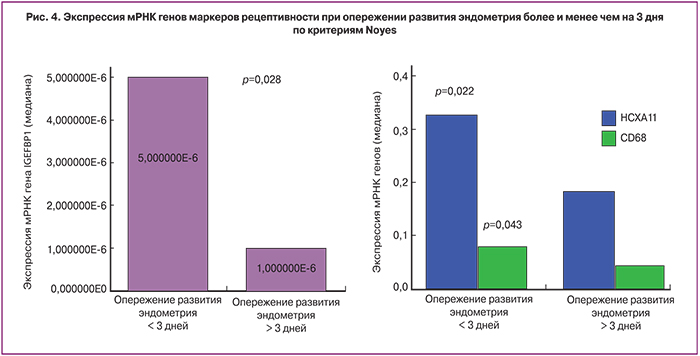
Наиболее интересным является то, что при опережении развития эндометрия более чем на 3 дня значительно снижалась экспрессия мРНК генов таких маркеров рецептивности, как HOXA11, IGFBP1 и CD68. Данные D. Haouzi и соавт. (2009) подтверждают, что в эндометрии стимулированных циклов экспрессия 22% генов снижается, что свидетельствует о частичном подавлении экспрессии генов при стимуляции функции яичников [17]. В исследовании I. Van Vaerenbergh и соавт. (2009) также было обнаружено, что при опережении развития эндометрия более чем на 3 дня изменяется профиль экспрессии генов маркеров рецептивности [12].
Изучение особенностей экспрессии генов гомеобокса представляет особый интерес, поскольку известно, что процесс синхронизации между развитием эмбриона и рецептивным эндометрием регулируется молекулярным механизмом опосредованным гомеобоксными (НOXА) генами, которые кодируют факторы транскрипции. По данным D. Vitielle и соавт. (2007) экспрессия генов HOXA 10 и HOXA 11 в эндометрии достигает максимума в «окно имплантации» естественного цикла и напрямую зависит от секреции половых стероидов [18]. При этом H.S. Taylor и соавт. (2003) не выявили изменений экспрессии HOXA 10 в эндометрии стимулированных циклов в протоколах с антагонистами и агонистами гонадотропин-рилизинг гормона [19]. С другой стороны, B.W. Rackow и соавт. (2008) предполагают, что антагонисты гонадотропин рилизинг гормона снижают экспрессию HOXA 10 в строме эндометрия [20]. P. Sirayapiwat и соавт. (2013) не подтверждают эти данные [21]. В нашем исследовании экспрессия генов гомеобокса в день трансвагинальной пункции была сопоставима с «окном имплантации» естественного цикла и не зависела от уровня Р в день введения триггера. При этом экспрессия HOXA 11 была существенно ниже при опережении созревания эндометрия более чем на 3 дня. I. Van Vaerenbergh и соавт. (2009) наблюдали менее активную экспрессию гена HOXA10 в случае опережения развития эндометрия, а ряд других генов имели более активную экспрессию [12].
Помимо снижения экспрессии генов HOXA 11 в случае опережения развития эндометрия, отмечено также снижение экспрессии мРНК гена фактора роста IGFBP1 и гена CD68. IGFBP1 относят к семейству эпидермальных факторов роста и рассматривают его как важный маркер рецептивности. Данных о влиянии овариальной стимуляции и концентраций сывороточного Р на экспрессию мРНК гена IGFBP1 в доступной литературе мы не нашли. Имеются сообщения о том, что у пациенток при наступлении беременности в цикле ЭКО экспрессия мРНК гена IGFBP1 была значительно выше, чем в группе женщин с отрицательным результатом программы [22]. I. Van Vaerenbergh и соавт. (2011) исследовали экспрессию IGFBP4 в эндометрии, полученном в день аспирации ооцитов, и обнаружили существенные различия в группе пациенток с концентрацией Р 1–1,5 нг/мл и ≥1,5 нг/мл [6]. Экспрессия гена цитокина CD68 изучалась в исследовании D. Haouzi и соавт. (2014), в котором наблюдалось существенное его увеличение у пациенток с повышенным Р в день введения триггера овуляции [23]. Однако мы не выявили зависимости экспрессии CD68 от уровня преовуляторного Р.
Заключение
Таким образом, результаты исследования эндометрия, полученного в день аспирации ооцитов показало, что при возникновении ПЛ в цикле овариальной стимуляции происходит опережение развития эндометрия. Эндометрий в день аспирации ооцитов при ПЛ соответствует 17,6 дню цикла по критериям Noyes, опережая развитие на 3,9 дня. Обнаружение секреторной трансформации, зрелых пиноподий, изменение экспрессии стероидных рецепторов и LIF подтверждают негативное влияние ПЛ на рецептивность эндометрия, что может приводить к неудачам имплантации. Скрининг уровня р в день введения триггера овуляции является фактором прогноза готовности эндометрия к переносу эмбрионов. При превышении порогового уровня р (≥1,5 нг/мл) целесообразна отмена переноса в лечебном цикле и криоконсервации эмбрионов.



