摘要: 目的:探讨全身免疫炎症指数(Systemic Immune-Inflammation Index, SII)对出血转化(Hemorrhagic Transformation, HT)和急性缺血性卒中患者发病90天后的神经功能预后的预测价值。方法:本研究筛选2020年8月至2021年8月烟台毓璜顶医院急诊内科收治的首次发病24小时内的脑梗死患者的临床资料进行回顾性分析。根据患者发病1周内是否发生HT将患者分为HT组、非HT组。根据入院3小时内完成的NIHSS评分分为轻度组(NIHSS ≤ 5)、中重度组(NIHSS ≥ 6),根据AIS患者发病90天后的改良Rankin量表评分分别将轻度组与中重度组患者分为预后良好组(mRS评分 ≤ 2分)和预后不良组(mRS评分 ≥ 3分)。通过单因素及多因素Logistic回归分析AIS患者发生HT及患者发病90 d预后的独立危险因素,使用ROC曲线评估SII对HT及预后不良的预测价值。结果:1) 多因素Logistic回归分析显示,在校正性别、年龄等混杂因素后,SII (OR = 1.874. 95% CI 1.126~1.438, P = 0.013)是AIS患者发生HT的独立危险因素。2) 多因素Logistic回归分析显示,在校正了性别、年龄等混杂因素后,在轻度卒中患者中,SII (OR = 1.009. 95% CI 1.002~1.023, P = 0.012)是AIS患者预后不良的独立危险因素。在中重度卒中患者中,SII (OR = 1.001. 95% CI 0.982~1.001, P = 0.042)同样是AIS患者预后不良的独立危险因素。3) 构建ROC曲线发现SII、NLR、PLR预测HT的AUC值为0.857、0.832、0.848 (P < 0.001),且差异有统计学意义(P < 0.05)。SII、NLR、PLR预测患者预后不良的AUC值为0.750、0.704、0.747 (P < 0.001),SII与NLR的差异有统计学意义(P < 0.05),与PLR的差异无统计学意义(P > 0.05)。结论:SII是首次脑梗死患者发生HT及90 d预后的危险因素,且SII在预测脑梗死发生HT较NLR及PLR更加准确,SII在预测发病90天预后方面与PLR准确性基本相同,两者均比NLR更加准确。
Abstract:
Objective: To investigate the predictive value of Systemic Immune-inflammation Index (SII) for hemorrhagic transformation (HT) and neurological prognosis 90 days after the onset of acute ischemic stroke. Methods: The clinical data of patients with cerebral infarction who were admitted to the emergency medicine department of Yantai Yuhuangding Hospital within 24 hours of the first onset from August 2020 to August 2021 were retrospectively selected and analyzed. The patients were divided into HT group and non-HT group according to whether HT occurred within 1 week of onset. According to the NIHSS score completed within 3 hours of admission, they were divided into mild group (NIHSS ≤ 5) and moderate-severe group (NIHSS ≥ 6). According to the modified Rankin Scale scores after 90 days onset of AIS, the patients in the mild group and the moderate-severe group were divided into a good prognosis group (mRS score ≤ 2 points) and a poor prognosis group (mRS score ≥ 3 points). Univariate and multivariate Logistic regression was used to analyze the independent risk factors of HT in AIS patients and the prognosis of patients at 90 days after onset. The receiver operating characteristic curve (ROC) was used to evaluate the predictive value of SII for HT and poor prognosis. Results: 1) Multivariate Logistic regression analysis showed that after adjusting for confounding factors such as gender and age, SII (OR = 1.874. 95% CI 1.126~1.438, P = 0.013) was an independent risk factor for HT in AIS patients. 2) Multivariate Logistic regression analysis showed that after adjusting for confounding factors such as gender and age, among patients with mild stroke, SII (OR = 1.009. 95% CI 1.002~1.023, P = 0.012) was an independent risk factor for poor prognosis of AIS patients. Among patients with moderate to severe stroke, SII (OR = 1.001. 95% CI 0.982~1.001, P = 0.042) were also independent risk factors of poor prognosis in AIS patients. 3) The ROC curve was constructed and it was found that the AUC values of SII, NLR, and PLR for predicting HT were 0.857, 0.832, and 0.848 (P < 0.001), and the differences were statistically significant (P < 0.05). The AUC values of SII, NLR, and PLR for predicting poor prognosis of patients were 0.750, 0.704, and 0.747 (P < 0.001). It was found that SII in predicting poor prognosis was more accurate than NLR (P < 0.05), but there was no statistical difference between the accuracy of PLR (P > 0.05). Conclusion: SII is a risk factor for HT and 90-day prognosis in patients with first cerebral infarction, and SII is more accurate than NLR and PLR in predicting HT in cerebral infarction. SII is basically the same as PLR in predicting 90-day prognosis, and both are more accurate than NLR more precise.
1. 前言
SII是基于中性粒细胞、淋巴细胞和血小板计数构建的,可以同时评估患者的炎症和免疫状态。SII作为一种容易获得的指标,一直是诊断或预测疾病的研究热点。SII最早由Hu发现,并被认为可以预测肝细胞癌术后的预后 [1],Hu的研究表面SII对肝细胞癌的预测能力比那些仅使用一或者两种细胞亚型的方法更敏感。在初步研究中,较高的SII与胃肠道肿瘤、肺癌、乳腺癌患者的不良预后密切相关 [2] [3] [4] [5]。迄今SII在心血管疾病中得到很好的应用,已有多项研究报道SII与慢性心力衰竭和冠心病患者的不良结局相关 [6]。
由于炎症在许多疾病中起着重要作用,目前人们对脑血管疾病的炎症过程持续关注。Hou的研究表明SII与AIS的严重程度相关,在评估方面可能比NLR和PLR更加合理有效 [7]。曾喜等学者研究表明AIS患者的SII水平是SAP的独立危险因素 [8]。然而SII与AIS的预后以及HT的关系尚未见报道。
2. 研究对象及方法
2.1. 研究对象
本研究数据来源于脑卒中防治工程管理专项数据库,连续纳入了2020年8月至2021年8月烟台毓璜顶医院急诊内科且符合急性缺血性卒中诊断标准的患者,收集患者一般资料及临床资料。
纳入标准1) 年龄满18周岁;2) 首次卒中,且符合《中国各类主要脑血管病诊断要点2019》中缺血性卒中的诊断标准 [9];3) 发病24小时内,且NIHSS评分 ≤ 22分;4) 发病48小时内完成头部核磁共振成像,弥散加权像或CT检测到相关病变。
排除标准1) 既往由脑梗死或脑出血病史患者;2) 脑梗死早期给予再灌注治疗(静脉溶栓或机械取栓);3) 妊娠期或哺乳期的患者;4) 合并严重心(根据纽约心脏协会心功能评分为III或IV级或超声心动图显示左壁射血分数40%)、肺(血氧饱和度低于90%,有呼吸急促、发绀、血气分析异常等症状)、肝脏(学期丙氨酸转氨酶水平 > 10倍参考区间上限)、肾脏(血清肌酐 > 443 μmol/L)和肿瘤疾病;5) 有自身免疫性疾病病史;6) 确诊时存在感染(体温大于37.5℃,白细胞计数高于9.5 × 109/L)。
2.2. 资料收集
收集患者的一般资料及临床资料,包括性别、年龄、高血压病、糖尿病、房颤病史,卒中病因分型,入院时NIHSS评分,是否发生出血转化,发病后90天的mRS评分。收集入院24小时内的外周静脉血常规检查中的白细胞、中性粒细胞、淋巴细胞、血小板数值,生化检查中的肌酐、空腹血糖、胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、同型半胱氨酸、糖化血红蛋白、国际标准化比值。HT诊断标准参考《中国急性脑梗死后出血转化诊治共识2019》 [10]。所有检验项目由我院专业的检验医师完成,根据血常规结果计算SII值(×109/L),
其中,P、N和L分别是外周血小板、中性粒细胞和淋巴细胞计数。
2.3. 随访及分组
由未参与该项研究纳入工作的经统一培训过的内科医师对所有患者进行发病24小时内的NIHSS评分及90天后的电话随访或面访。根据患者入院时NIHSS评分将患者分为轻度卒中组(NIHSS评分 ≤ 5分)、中重度卒中组(NIHSS评分 ≥ 6分) [7]。根据AIS患者发病后1周内是否发生HT将患者分为HT组、非HT组 [10]。根据AIS患者发病90天后的mRS评分将轻度组与中重度组患者分为预后良好组(mRS评分 ≤ 2分)和预后不良组(mRS评分 ≥ 3分) [11]。
2.4. 统计学方法
采取SPSS25.0软件进行统计分析,符合正态分布的计量资料用均数 ± 标准差(x ± s)表示,两组间比较使用t检验进行分析;非正态分布的计量资料采用中位数和四分位数表示[M(P25~P75)],两组间比较使用Mann Whitney U检验进行分析;计数资料以频率(n)和百分比(%)表示,组间比较使用卡方检验或Fisher精确检验。使用多因素Logistic回归分析影响患者住院期间发生HT、发病后90天神经功能预后的相关性,用ROC曲线和AUC值来评估SII、NLR、PLR预测AIS患者发病90天后的神经功能预后、是否发生HT的精确度。以P < 0.05为差异具有统计学意义。
3. 结果
3.1. SII与HT的关系
3.1.1. 两组患者基线资料比较
与非HT组患者相比,HT组患者年龄更大,入院时NIHSS评分更高,预后不良患者更多。HT组患者入院后白细胞计数、中性粒细胞百分比、血小板计数、NLR、PLR、SII较非HT组更高,淋巴细胞百分比较HT组低。两组以上差异具有统计学意义(P < 0.05),其余差异均无统计学意义(见表1)。

Table 1. Comparison of general and clinical data of patients in different severity groups
表1. 不同严重程度组患者一般资料及临床资料比较
3.1.2. AIS患者发生HT的多因素Logistic回归分析
将表3中具有统计学意义的变量进行多因素Logistic回归分析,在未校正混杂因素时,NLR (OR = 1.264. 95% CI 1.163~1.528, P < 0.001)、PLR (OR = 1.016. 95% CI 1.006~1.023, P = 0.05)、SII (OR = 2.246. 95% CI 1.932~2.453, P < 0.001)是AIS患者发生HT的危险因素。在校正了性别、年龄等混杂因素后,结果显示NLR (OR = 1.141. 95% CI 1.032~1.249, P = 0.005)、SII (OR = 1.874. 95% CI 1.126~1.438, P = 0.013)仍是AIS患者发生HT的独立危险因素(见表2)。

Table 2. Multivariate Logistic regression analysis of HT in patients with AIS
表2. AIS患者发生HT的多因素Logistic回归分析
模型1:未校正混杂因素;模型2:校正性别、年龄、既往高血压、糖尿病、房颤、空腹血糖、甘油三酯等混杂因素。
3.1.3. SII、NLR、PLR对AIS患者发生HT的预测价值分析
构建ROC曲线发现SII预测HT的AUC值为0.857 (P < 0.001),SII处于截断值728.03 × 109时,预测HT的敏感度为79.2%,特异度为82.6%。NLR评分预测HT的AUC值为0.832 (P < 0.001),NLR处于截断值2.83时,预测HT的敏感度为83%,特异度为75.6%。PLR评分预测HT的AUC值为0.848 (P < 0.001),PLR处于截断值8.64时,预测HT的敏感度为88.7%,特异度为69%。通过MedCalc 19.0软件对比后发现,SII预测HT的准确性与NLR、PLR预测HT的准确性差异有统计学意义(P < 0.05) (见图1、表3)。
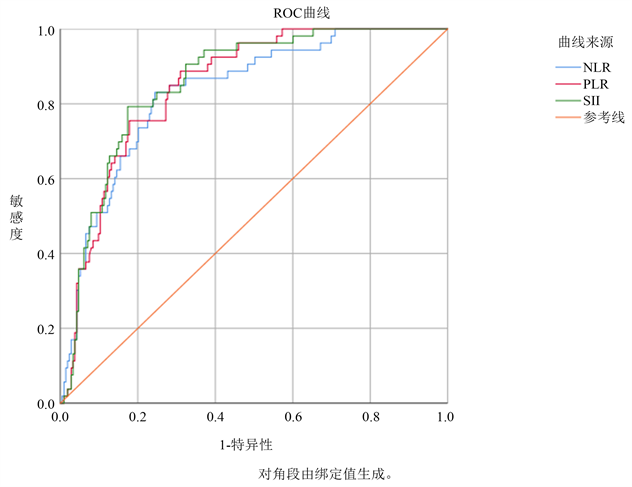
Figure 1. ROC curves of SII, NLR, PLR predicted 7-day HT
图1. SII、NLR、PLR预测7天HT的ROC曲线

Table 3. Analysis of the predictive value of SII, NLR, and PLR for HT in patients with AIS
表3. SII、NLR、PLR对AIS患者发生HT的预测价值分析
3.2. SII与AIS患者预后的关系
3.2.1. 不同严重程度组两组患者基线资料比较
在轻度组内,与预后良好组患者相比,预后不良组患者发生HT的患者较多。预后不良组的中性粒细胞百分比、血小板计数、NLR、PLR、SII较预后良好组更高,预后不良组淋巴细胞百分比较低。两组之间上述指标差异有统计学意义(P < 0.05)。在中重度组内,与预后良好组患者相比,预后不良组的中性粒细胞百分比、血小板计数、NLR、PLR、SII较高,预后不良组淋巴细胞百分比较低。两组之间上述指标差异有统计学意义(P < 0.05) (见表4)。

Table 4. Comparison of general and clinical data of patients in different prognostic groups
表4. 不同预后组患者一般资料及临床资料比较
3.2.2. AIS患者预后不良影响因素的多因素Logistic回归分析
将表6中具有统计学意义的变量进行多因素Logistic回归分析,在轻度卒中组内,未校正混杂因素时,NLR (OR = 1.379. 95% CI 2.003~4.060, P < 0.001)、PLR (OR = 1.951. 95% CI 1.556~2.047, P < 0.05)、SII (OR = 1.028. 95% CI 1.013~1.043, P < 0.001)是AIS患者预后不良的危险因素。在校正了性别、年龄等混杂因素后NLR (OR = 1.126. 95% CI 1.326~3.218, P = 0.02)、SII (OR = 1.009. 95% CI 1.002~1.023, P = 0.012)仍是AIS患者预后不良的独立危险因素(见表5)。在中重度卒中组内,未校正混杂因素时,NLR (OR = 1.304. 95% CI 1.134~1.642, P = 0.035)、PLR (OR = 1.139. 95% CI 1.072~1.210, P = 0.041)、SII (OR = 1.008. 95% CI 1.001~1.002, P = 0.026)是AIS患者预后不良的危险因素。在校正了性别、年龄等混杂因素后NLR (OR = 1.145. 95% CI 1.112~1.348, P < 0.05)、SII (OR = 1.001. 95% CI 0.982~1.001, P = 0.042)仍是AIS患者预后不良的独立危险因素(见表5)。

Table 5. Multivariate Logistic regression analysis of poor prognosis of AIS
表5. AIS预后不良的多因素Logistic回归分析
模型1:未校正混杂因素;模型2:校正性别、年龄、既往高血压、糖尿病、房颤、空腹血糖、甘油三酯等混杂因素。
3.2.3. SII、NLR、PLR对AIS患者预后不良的预测价值分析
构建ROC曲线发现SII预测AIS患者预后不良的AUC值为0.750 (P < 0.001),SII处于截断值449.76 × 109时,预测预后不良的敏感度为83.7%,特异度为67.3%。NLR预测AIS患者预后不良的AUC值为0.704 (P < 0.001),NLR处于截断值2.83时,预测预后不良的敏感度为93.9%,特异度为43.3%。PLR预测AIS患者预后不良的AUC值为0.747 (P < 0.001),PLR处于截断值8.31时,预测预后不良的敏感度为95.9%,特异度为58.1%。通过MedCalc 19.0软件对比后发现,SII预测AIS患者预后不良的准确性与NLR预测AIS患者预后不良的准确性差异有统计学意义(P < 0.05),与PLR预测AIS患者预后不良的准确性无统计学差异(P > 0.05) (见图2、表6)。
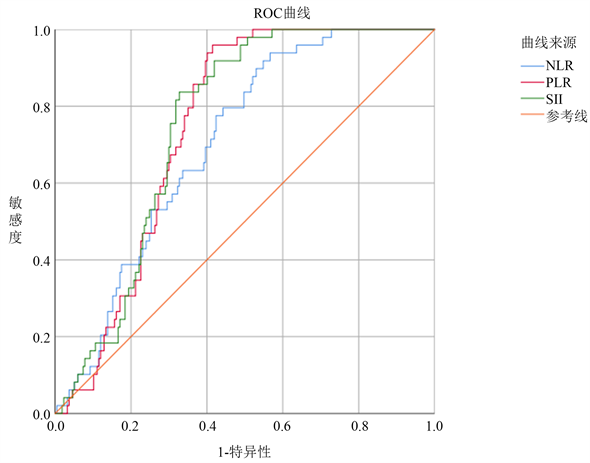
Figure 2. ROC curves of SII, NLR, and PLR predicting poor prognosis at 90 days
图2. SII、NLR、PLR预测90天预后不良的ROC曲线

Table 6. Analysis of the predictive value of SII, NLR, and PLR for poor prognosis in patients with AIS
表6. SII、NLR、PLR对AIS患者预后不良的预测价值分析
4. 讨论
本研究回顾性地收集了2020年8月至2021年8月入住烟台毓璜顶医院急诊内科的急性缺血性卒中患者,对这些患者临床资料进行统计学分析后发现,SII是AIS患者入院后发生HT及90天后预后不良的危险因素,SII对HT和90天后预后不良具有预测作用,且较传统经典炎性指数NLR、PLR的预测效果更准确。
SII与AIS患者预后相关的原因之一可能是急性缺血性卒中发生时的免疫炎性改变。在以往的文献中报道了多种与炎性相关的指数,如NLR、PLR、PNR等,它们均被证实与急性缺血性卒中的严重程度及预后相关。张瑞瑞等人的一项Meta分析显示NLR可以预测急性缺血性卒中后出血转化及3个月死亡率 [12]。胡静洁等人的一项前瞻性研究发现PLR、NLR与卒中后抑郁显著相关,为卒中后抑郁的早期发现提供了线索 [13]。急性缺血性卒中发生后不但会引起脑组织内免疫细胞的激活,同样会加速外周免疫细胞通过血脑屏障浸润缺血脑组织,加重了缺血性脑损伤和神经功能障碍 [14]。这个过程涉及多种免疫炎性细胞,例如中性粒细胞、淋巴细胞、血小板等。
急性缺血性卒中发生后的6~24小时内中性粒细胞便迁移至缺血脑组织的血管周围 [15]。它除了清除坏死细胞碎片外,还会通过释放多种炎性因子导致脑水肿、血脑屏障破坏等,从而进一步加重缺血脑组织损伤。其中主要包括MMPs、活性氧(ROS)、髓过氧化物酶、弹性酶、组织蛋白酶G等 [16]。中性粒细胞已经被证实是基质金属蛋白酶的主要来源,MMPs可之间作用于紧密连接蛋白,打开血管腔内的血脑屏障或被内皮细胞吸收从而作用于基底膜增加血脑屏障的通透性 [17]。Zhao等人一项动物实验报告指出在大鼠的急性缺血性卒中模型中,通过阻止中性粒细胞浸润的治疗减少了缺血脑组织中MMPs的释放 [18],另外一项Gautier等人的实验发现在大鼠的缺血性卒中模型中抑制或者耗尽中性粒细胞可以降低缺血性卒中后血脑屏障的破坏及出血转化的发生率 [19] [20]。
脑梗死患者脑组织中淋巴细胞聚集发生的比中性粒细胞晚,大约发生在急性缺血性脑梗死后的3~6天 [21]。本研究虽然未收集到发病3~6天的淋巴细胞计数值,但仍观察到脑梗死早期中重度组患者淋巴细胞绝对值的降低。较低水平的淋巴细胞与长期预后不良相关,其可能的机制包括淋巴细胞的减少代表着身体处于应激状态,另外淋巴细胞的相对减少反映了皮质醇水平和交感神经兴奋 [22],这样可以增加促炎细胞因子的产生,加重脑组织缺血性损伤。淋巴细胞主要包括B细胞和T细胞,特别是CD4+、CD8+ T细胞和γδT细胞,通过产生促炎细胞因子,如干扰素-γ和IL-17,在炎症反应中发挥重要作用 [23]。而Treg细胞通过释放抗炎细胞因子IL-10通过IL-10/JAK/STAT、P13K和MAPK途径起到神经保护作用 [24]。虽然目前还不清楚哪种亚型的淋巴细胞在脑梗死发生后的病理生理中起主导作用,但是淋巴细胞整体缺少对脑梗死的严重程度及预后是具有负面作用的。
血小板在血管受损后快速聚集,在止血和血栓形成过程中起着重要作用,另外血小板还参加免疫炎性反应。血小板可以通过改变P-选择素或CD40的表面表达直接与循环白细胞相互作用,形成血小板–白细胞聚集物,激活对缺血组织的固有免疫 [25]。
综上所述,考虑到免疫炎性反应的复杂性,临床当中选取多种炎性及免疫细胞测量后的比值,比如NLR、PLR、SII,这些比值更能综合准确地反应固有免疫与适应性免疫之间的平衡。SII是由NLR和PLR改进而来,在NLR (或PLR)的基础上加入了血小板(或中性粒细胞)计数,能够更加准确地评估脑卒中的出血转化的发生及预后不良。
本研究的不足:① 本研究是单中心研究且样本量较小,可能会有一定程度上的选择偏倚。② 本研究仅收集了患者入院时的SII值,缺少对SII随时间变化的动态监测。③ 本研究试图减少混杂因素对结局的影响,但多元logistic回归分析中仍有不能完全排除的混杂因素。④ 本研究的随访的时间过短,需要更进一步地探究SII与急性缺血性卒中患者长期预后的关系。
基金项目
烟台市科技发展计划项目(2020MGGY080)。
NOTES
*通讯作者。