1. 前言
根据统计数据,胃腺癌(Stomach adenocarcinoma, STAD)被列为全球第五大最常见的癌症,且排在癌症相关死亡病因的第三位 [1]。据估计,2015年中国新增病例67.91万例,死亡49.8万人,大约90%~95%的胃癌是腺癌。根据肿瘤位于胃–食管交界处(贲门)的位置,胃癌被细分为贲门癌和非贲门癌 [2]。在世界范围内,亚洲是STAD的发病率最高的区域。而在所有亚洲国家中,中国的STAD发病率最高,占全球STAD病例的49.9%。在欧洲国家,5年存活率从10%到30%不等,在中国,从30.2%到35.9%不等。胃癌的预后与肿瘤的分期密切相关,早期胃癌的五年生存率高达95%以上 [3]。但早期胃癌多无明显症状和体征,我国早期胃癌的诊断率不足20%。为提高胃癌患者的预后,早期诊断尤为关键 [4]。
为了更好地了解肿瘤遗传构成对临床预后影响,科研人员已经建立了全基因组的基因表达谱,如癌症基因组图谱(The Cancer Genome Atlas, TCGA)等,以研究肿瘤基因表达与患者表型、生存率之间的关系。虽然胃腺癌相关发生机制已经进行了广泛的研究,但胃腺癌的发生、发展、病原学仍有待阐明。考虑到胃腺癌的高发病率和高死亡率,利用现有癌症相关公共数据库进行数据分析有助于胃癌的早期诊断及治疗,并可在一定程度上判断患者的预后。过去十年来基因组技术的快速发展揭示了CNV对人类基因组遗传变异的重要贡献,并在越来越多的人类疾病中发挥作用,如自闭症、精神分裂症、抑郁症、癫痫等。拷贝数变异(Copy number variation, CNV)指的是一种拷贝数异常变化的结构变异,涉及的DNA片段通常长于1 kb,并导致基因组的获得(复制或插入换位)、丢失(缺失)或复杂的重排。平均而言,每个人的基因组中有超过1000个CNV,大约400万bp。CNV可涉及一个或多个基因,其可通过干扰编码区或改变基因的拷贝数从而影响等位基因。
本研究基于TCGA数据库对胃腺癌患者基因进行分析,筛选出影响预后的CNV相关基因,并使用现有的临床数据进行验证,以明确胃腺癌患者预后的相关预测指标。
2. 材料与方法
2.1. 利用TCGA数据库筛选基因目标基因
从TCGA数据库下载胃腺癌患者的RNA序列数据(https://TCGA-data.nci.nih.gov/TCGA/)。利用R语言包对下载数据进行分析。以p < 0.05为标准,根据TCGA数据库中患者的预后结果对各基因的CNV进行筛选。
2.2. 筛选hub基因并进行生存分析
获得与临床预后数据相关的基因的CNV后,利用cytoscape (版本3.7.1)软件中cytoHubba插件对相关CNV中各基因进行hub基因的筛选。并筛选出排名前10的hub基因。分别对10个基因做生存分析。
2.3. 利用组织标本对筛选基因进行验证
收集自2019.1月~2021.4月就诊于我院进行胃镜检查及病理活检或行内镜下粘膜下剥离术(ESD)治疗患者118例进行分析调查。其中男性68例,女性50例,年龄31~72岁,平均年龄(46.12 ± 4.43)岁。根据病理结果将患者分为实验组(ESD术后病理诊断证实为早期胃癌)及对照组(经胃镜检查及病理活检证实正常胃粘膜者),其中实验组42例,对照组76例。对各样本行免疫组化标记目标蛋白。所有患者均无其他消化道肿瘤,无心、肾、肝功能衰竭。该研究经过我院伦理委员会的批准,所有患者均签署知情同意书。
2.4. 免疫组化
PTEN蛋白表达定位于细胞核,阳性表达根据显色程度,以细胞核出现褐色颗粒为判断标准,胞核无褐色,背景一致,为阴性(−),细胞核呈褐色,定位清晰为阳性(+) [5]。Villin染色结果判定:光镜下观察吸收细胞膜纹状缘及或胞浆弥漫或颗粒状被染成棕黄色为阳性细胞,在400倍高倍镜下,每张切片随机取5个视野计算阳性细胞数,取其平均数,并根据阳性细胞数的多少进行半定量分级,参照Barnes半定量法即分别对每张切片的阳性细胞数及阳性细胞着色程度进行分级记分,结果以两项乘积表示。染色强度分数标准:无色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。同样物镜观察阳性细胞数,高倍视野阳性细胞数 < 5%为阴性记0分,5%~25%记为1分,26%~50%为2分,51%~75%记为3分,>75%为4分;两者相乘1~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++) [6]。
2.5. 统计
采用SPSS23.0进行统计学分析。计量资料符合正态分布的,使用t检验进行统计。计数资料使用卡方检验进行分析。以p < 0.05表示为有统计学意义。
3. 结果
3.1. 利用TCGA数据库筛选与预后相关的CNV
利用TCGA数据中CNV数据库对STAD患者进行分析,使用R对数据进行批量处理,我们发现共有29个基因拷贝数(CNV)与胃腺癌发生存在可能相关(详见表1)。
3.2. 筛选hub基因
利用cytoscapte软件中的cytoHubba插件对结果1中胃腺癌相关基因进行hub基因筛选,可得到排名前10的hub基因(详见表2)。

Table 2. CNV related ranking hub gene
表2. CNV相关排名hub基因
3.3. 利用hub基因做生存曲线
利用筛选出的hub基因做生存曲线,发现PTEN及Villin的表达量与患者预后存在相关性(图1,图2)。PTEN低表达患者的生存率低于高表达患者,Villin高表达患者的生存率均低于低表达患者(p < 0.05)。
3.4. 两组患者标本PTEN及Villin表达比较
对患者的标本进行免疫组化标记目的蛋白PTEN及Villin,并根据结果比较对照组及实验组中两种蛋白表达的差异。由比较结果可知,在实验组中,PTEN的表达低于对照组,而Villin的表达则高于对照组(表3,表4)。

Figure 1. The survival rate of patients with low PTEN expression in gastric adenocarcinoma patients was lower than that of patients with high expression, p < 0.05
图1. 胃腺癌患者中PTEN低表达者生存率低于高表达患者,p < 0.05
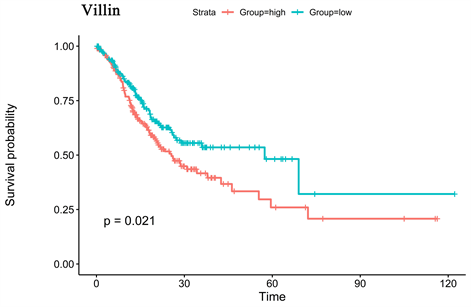
Figure 2. The survival rate of patients with high Villin expression in gastric adenocarcinoma patients was lower than that of patients with normal expression, p < 0.05
图2. 胃腺癌患者中Villin高表达者生存率低于正常表达患者,p < 0.05

Table 3. PTEN expression of each sample
表3. 各样本PTEN表达情况

Table 4. Villin expression of each sample
表4. 各样本Villin表达情况
4. 讨论
在本研究中,通过生物信息学分析,我们通过比较基因拷贝数变异筛选出了与胃腺癌发生相关的潜在基因。为了进一步明确这些基因在胃腺癌发生中的权重,我们利用cytoscape软件中的cytoHubba插件对筛选出的潜在基因进行权重的排序,并得出排名前10的基因。接下来利用生存分析曲线明确了10个基因中与预后相关的基因,即PTEN和Villin,上述PTEN的低表达和Villin的高表达与胃腺癌患者的生存率呈负相关。为了进一步明确利用上述生物信息学方法做出的推断,我们利用临床样本进行免疫组化染色,并比较在非胃腺癌患者及胃腺癌患者中PTEN及Villin的表达情况。免疫组化的结果与生物信息学分析的结果一致,即PTEN在胃腺癌患者中的表达量减少,而Villin在胃腺癌患者癌组织中表达量增加。
PTEN是迄今为止发现的第一个具有双特异性磷酸酯酶活性的抑癌基因,位于人染色体10q23.3,含9个外显子和8个内含子,编码403个氨基酸组成的蛋白质 [7]。PTEN是一个高度保守的蛋白,参与胚胎的正常发育,抑制肿瘤血管的生成,阻滞或诱导细胞凋亡,抑制细胞生长、转化、粘附、铺展及迁移,促进细胞调亡,对肿瘤生长、侵袭和转移具有负调控作用,并可通过与其它抑癌基因协同、上调抑瘤因子及下调促瘤因子的表达发挥抑瘤作用 [8] [9]。PTEN在胃癌、肺癌、乳腺癌、前列腺癌、胰腺癌、头颈部癌与口腔癌等多种肿瘤中表达缺失或低表达,与肿瘤的发生发展密切相关 [10] [11]。罗文等研究发现PTEN蛋白在正常组织表达85.94% (55/64)明显高于癌前病变51.85% (28/54)与胃癌20.71% (29/140) (p < 0.05),而癌前病变表达显著高于胃癌(p < 0.05) [12]。甘伟平等研究发现早期胃癌组织中PTEN阳性表达率(45.8%)显著低于癌旁组织(88.9%)与正常组织(100.0%),不同分化程度、分期、预后及有无淋巴结转移者癌组织中PTEN表达水平差异有统计学意义,提示PTEN不仅参与了胃癌的分化和预后,还参与了胃癌分期、淋巴结转移 [13] [14]。目前普遍认为的PTEN抑癌机制有如下几条途径协同完成:1) 通过使PIP3去磷酸化负调控PI3K/Akt途径调节细胞的增殖与凋亡平衡;2) 通过对局灶黏附激酶(FAK)的去磷酸化抑制细胞转移和侵袭;3) 通过抑制促细胞分裂素激活的蛋白激酶(MAPK)细胞信号传导途径抑制细胞的生长和分化 [11] [12]。
Villin基因存在于2号染色体q35-36区,由25,000个碱基组成 [15]。Villin是一种钙离子依赖的具有捆绑、切割、带帽和成核等多种功能的肌动蛋白连接蛋白,它主要在拥有刷状缘结构的消化系统和泌尿系统等上皮有表达,在肿瘤组织中表达仅限于上皮性肿瘤,具有严格的组织特异性,因此,Villin是胃肠道肿瘤相对敏感的特异性标志 [16]。王见璋等研究发现Villin在慢性胃病伴肠上皮化生、胃上皮内瘤变及胃癌组的阳性率分别为72.7% (16/22),72% (18/25),90.9% (20/22),明显高于慢性胃炎组的阳性率38.1% (8/21),其结果表明Villin在胃癌的发生、发展过程中起到了重要的作用 [17]。
尽管胃癌的发病率和死亡率都在下降,而且针对胃癌的流行病学、病理学、分子机制及治疗选择和策略都有重大进展,但是胃癌的诊治仍是临床工作中的重大难题,也给患者和社会带来巨大负担。我们的研究表明PTEN及Villin可能与胃腺癌的发生及预后存在密切关系,故在进一步的研究中,我们将继续深入,阐明其在胃腺癌发生及发展中的具体机制,并明确其是否可以作为胃腺癌早期防治的生物标志。
基金项目
福建中医药大学校管课题,课题编号:X2019026-学科。
NOTES
*通讯作者。