修回日期: 2020-04-13
接受日期: 2020-04-21
在线出版日期: 2020-05-08
肠道菌群的稳定在维持机体健康中发挥重要作用, 当便秘引起肠道菌群失衡时, 它通过干扰胆汁酸(bile acids, BAs)的合成影响脂质消化、吸收过程; 肠道菌群代谢物短链脂肪酸(short chain fatty acids, SCFAs)减少可破坏肠道黏膜屏障的完整性, 且SCFAs的受体不能被激活, 此外, 氧化三甲胺(trimethylamine oxide, TMAO)产生量增多影响脂质代谢过程中关键酶的表达, 进一步影响脂质转运、清除过程. 本文就便秘状态下肠道菌群通过BAs、SCFAs、TMAO的变化介导脂代谢紊乱的机制作一综述.
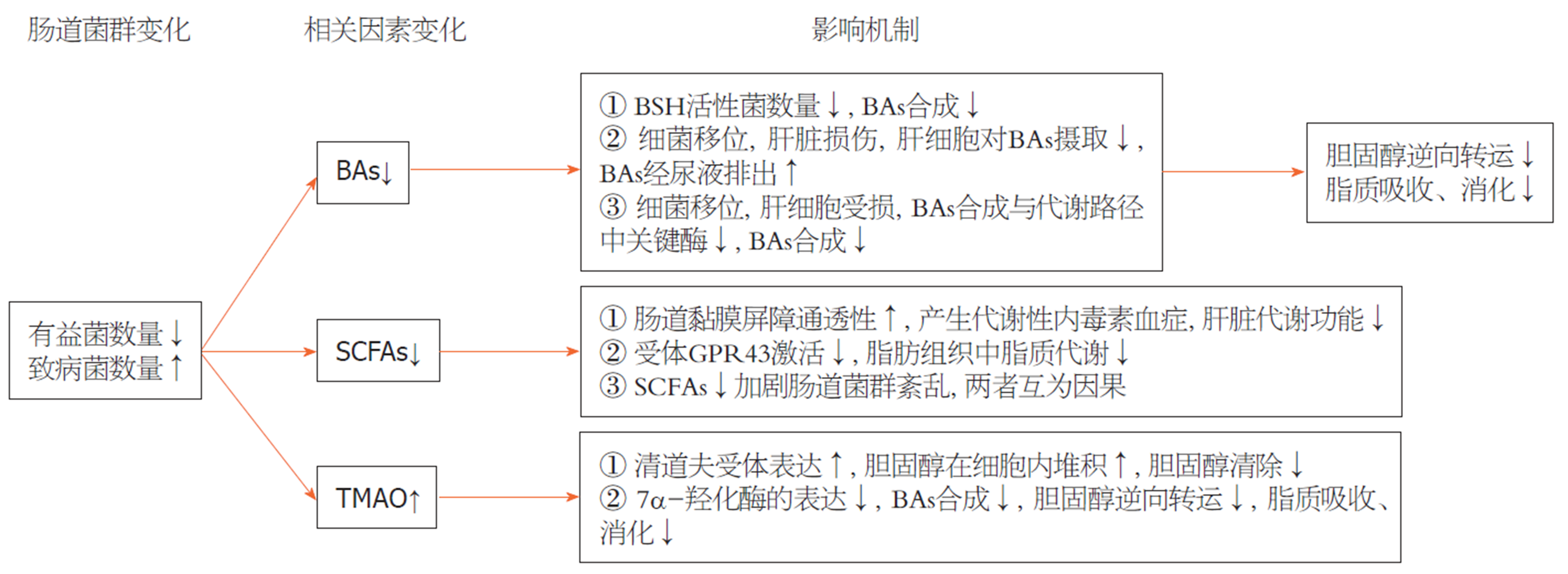
核心提要: 肠道菌群的稳定在维持机体健康中发挥重要作用, 在便秘状态下, 常常存在肠道菌群失衡, 肠道内双歧杆菌、拟杆菌、乳杆菌等有益菌数量减少, 可能从以下几个方面影响机体脂代谢过程: (1)减少胆汁酸(bile acids, BAs)的生成, 减少胆固醇向BAs的转化, 同时减弱BAs对脂质消化、吸收的促进作用; (2)肠道菌群代谢物短链脂肪酸(short chain fatty acids, SCFAs)产量减少, 导致紧密连接蛋白受损, 肠道黏膜屏障通透性增加, 肠道细菌细胞组成成分--脂多糖进入肠肝循环, 影响肝脏代谢功能; SCFAs的受体不能被激活, 从而减弱其对脂肪组织中脂质代谢的促进功能; (3)氧化三甲胺(trimethylamine oxide, TMAO)产生量增加影响清道夫受体及7α-羟化酶的表达, 改变机体对胆固醇的代谢.
引文著录: 徐玉洁, 张亚峰, 许翠萍. 便秘状态下肠道菌群变化对脂代谢的影响. 世界华人消化杂志 2020; 28(9): 341-346
Revised: April 13, 2020
Accepted: April 21, 2020
Published online: May 8, 2020
The stability of gut microbiota plays an important role in maintaining the health of the body. The gut microbiota is imbalanced when constipation occurs, thus affecting the process of lipid digestion and absorption by interfering with the synthesis of bile acids (BAs). The decrease of short chain fatty acids (SCFAs), a metabolite of gut microbiota, can destroy the integrity of the intestinal mucosal barrier, and their receptors cannot be activated. In addition, the increase of trimethylamine oxide (TMAO) alters the expression of key enzymes in lipid metabolism, and further affects the lipid transport and clearance. This article reviews the mechanism for changes of gut microbiota in constipation to mediate lipid metabolism disorders with regard to changes in BAs, SCFAs, and TMAO.
- Citation: Xu YJ, Zhang YF, Xu CP. Effect of changes of gut microbiota in constipation on lipid metabolism. Shijie Huaren Xiaohua Zazhi 2020; 28(9): 341-346
- URL: https://www.wjgnet.com/1009-3079/full/v28/i9/341.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i9.341
自1958年诺贝尔奖获得者Lederberg[1]提出"人体是与微生物共生的超级生物体"以来, 越来越多的报道表明人体共生微生物参与多种疾病的病理生理过程, 对人体健康发挥着重要作用[2]. 绝大多数共生微生物生活在人体肠道内, 称为"肠道菌群"[3], 研究发现[4-7]便秘患者与健康对照者的肠道黏膜及粪便菌群组成存在显著差异; 另外, Nicholson教授等[8,9]提出: 人体代谢由自身基因与共生微生物基因共同作用, 肠道菌群通过肠肝循环参与人体生理代谢, 对代谢性疾病的发病过程及疾病进展产生影响. 目前有关便秘时肠道菌群改变对脂代谢的影响少见详细阐述, 本文就便秘状态下肠道菌群变化对脂代谢的影响作一综述.
在抗生素被应用于临床后的1950年, 我国魏曦教授指出: "在抗生素降临的光辉背后, 必须重视其带来的菌群失调的阴影"[10], 至2017年地球微生物组计划的提出, 众多研究人员对16S rRNA基因进行测序, 分析了不同环境中细菌的多样性[11]. 研究发现[12,13], 人体正常肠道内寄居着超过1000种细菌, 重量可达1-2 kg, 细胞总数达到1014个, 约为人体自身细胞数量的10倍.
在正常生理情况下, 肠道菌群种类及比例保持动态平衡, 与宿主之间相互作用, 发挥营养、代谢、免疫、屏障等功能[14], 而在一定条件下, 肠道菌群中存在的潜在致病菌可能成为机体感染的起因[15]. 在许多疾病的发生及发展过程中, 肠道菌群之间的平衡被打破, 其结构与组成比例发生改变, 导致严重的临床症状[16].
脂代谢是指脂类物质在小肠内消化、吸收, 由肝脏转化, 经淋巴系统进入血循环(通过脂蛋白转运), 储存于脂肪组织, 需要时被组织利用的过程. 肝脏是脂代谢能力最强的核心器官.
脂代谢受遗传、饮食、运动、药物等因素影响, 脂代谢异常会导致肝脏、血液及其他组织中脂质及其代谢产物质和量的变化, 诱发肥胖、脂肪肝、血脂异常等脂代谢紊乱相关疾病, 其具体机制尚不明确, 有文献报道肠道菌群能直接或间接影响脂代谢过程[17].
便秘是一种(组)症状, 表现为排便困难和(或)排便次数减少、粪便干硬[18]. 便秘是全球范围内常见疾病之一, 全球各个地区所报道的便秘患病率在0.7%-79%之间[19], 相较于西方国家, 我国成人便秘的患病率较低, 为4.0%-10.0%[18]. 便秘严重影响患者的生活质量及身心健康, 其病因复杂, 发病机制不明确, 防治效果不理想[20].
临床研究证明, 便秘患者多存在肠道菌群失衡, 微生态制剂可以调节肠道菌群失衡, 促进肠道蠕动和恢复胃肠动力, 可作为便秘的长期辅助用药[5]. 我国毕洪玲等[21]研究发现便秘患者粪便中的双歧杆菌、乳杆菌、拟杆菌等有益菌均显著减少, 而梭杆菌、肠杆菌显著增加; 国外学者研究发现[22], 成人便秘患者粪便中双歧杆菌属、乳酸杆菌属等优势菌群的数量较健康人群显著减少, 同时大肠埃希菌、肠杆菌科(克雷伯菌等)、金黄色葡萄球菌和真菌等潜在致病菌数量显著增加; Zhu等[6]应用16SrRNA技术研究发现便秘患者粪便中普氏菌属丰度降低, 厚壁菌门菌属增加; Kim等[23]研究发现与健康对照组相比, 便秘患者粪便中的有益菌--双歧杆菌、拟杆菌数量明显减少, 乳酸菌、大肠杆菌和梭状芽孢杆菌所占比例无显著差异.
胆汁酸(bile acids, BAs)分子同时具有亲水性和疏水性, 能有效降低脂/水两相间的表面张力, 使其具有更强的乳化作用, 促进脂质消化、吸收和转运, 调节能量平衡. BAs在肝细胞内以胆固醇为原料在7α-羟化酶的催化下合成, 随胆汁排至肠道, 约95% BAs在回肠末端通过肠细胞的顶膜钠离子依赖性胆汁酸转运体(apical sodium dependent bile acid transporter, ASBT)重吸收回到肝脏, 弥补肝细胞合成BAs能力的不足.
胆汁酸盐水解酶(bile salt hydrolase, BSH)存在于肠道主要细菌中, 可将一部分初级BAs进行去结合(去除甘氨酸或牛磺酸缀合物)生成次级BAs, 阻止BAs经ASBT的再摄取[24]. Song等[25]对人体微生物组中的BSH进行了分类鉴定, 发现在117属591株人类肠道细菌中存在27.52%的菌株含有BSH类似物, 其中, 双歧杆菌[26]、乳杆菌[27,28]、拟杆菌[29]等都具有BSH活性. 便秘患者的粪便在肠道内滞留时间延长, 导致肠道菌群失衡, 双歧杆菌、拟杆菌、乳杆菌等产BSH的细菌数量减少, BSH活性降低, 过多的初级BAs经肠肝循环作为启动子通过负反馈调节机制抑制7α-羟化酶基因的表达[30], 从而减少BAs的生成[31], 减少胆固醇向BAs的转化. 此外, 便秘患者肠道内潜在致病菌数量增加, 产生大量内毒素, 引起肠道黏膜屏障破坏, 肠道内细菌移位和过量的内毒素经"肠-肝轴"进入门静脉系统, 肝脏内巨噬细胞等被这些毒素激活, 释放炎性因子, 造成肝脏损伤, 导致肝细胞对BAs的摄取障碍, 血液循环中BAs浓度升高, 大量BAs经尿液排出[32]; 肝细胞损伤常常伴随着BAs合成与代谢途径中关键酶的活性下降或缺失, 致使BAs的合成不足. 因此, 便秘患者肠道细菌的变化可通过破坏BAs稳态, 削弱机体对脂质的吸收、消化, 同时干扰体内胆固醇的逆向转运与代谢.
越来越多研究证据表明肠道菌群可以通过释放短链脂肪酸(short chain fatty acids, SCFAs)成为宿主健康的主要贡献者. 尽管宿主肝脏代谢可以产生SCFAs, 但实验发现无菌小鼠体内SCFAs浓度较低, 可以证明肠道(尤其是结肠)是产生SCFAs的主要场所[33]. SCFAs是由肠道内双歧杆菌、乳杆菌、拟杆菌等有益菌发酵膳食纤维和抗性淀粉后产生的代谢物, 主要包括乙酸、丙酸和丁酸[34]. SCFAs具有为肠道细胞提供能量、保护肠道黏膜屏障、改善肠道菌群环境及调控宿主能量代谢等功能[35].
SCFAs信号转导机制主要有两种: 抑制组蛋白脱乙酰酶和激活G蛋白偶联受体(G-protein-coupled receptor, GPCRs). GPCRs, 特别是GPR43、GPR41已被鉴定为SCFAs的受体[36]. 肠道外, GPR43在白色脂肪组织(white adipose tissue, WAT)中大量表达[37], 研究发现, GPR43基因敲除小鼠在正常饮食情况下出现肥胖, 在脂肪组织中特异表达GPR43的小鼠即使在高脂肪饮食中也表现得更瘦, 表明SCFAs介导的GPR43激活可以抑制脂肪组织中的脂肪积聚, 并促进了其他组织中脂质代谢[38].
动物研究显示[36], 静脉注射的SCFAs约3%能通过血脑屏障立即被吸收, 激活下丘脑神经元产生持续的饱腹感, 减少食物摄入; 同时SCFAs能促进脂肪氧化, 从而预防因饮食导致的高甘油三酯血症、肝脂肪变性和肥胖等. 有学者[39]在针对12名血糖正常的超重/肥胖男性的临床试验中, 采用直肠给药的方式给予三种常见SCFAs的混合物, 结果显示三种SCFAs的混合物能够有效控制体重、促进空腹脂肪氧化、增加静息能量消耗、改善糖脂代谢紊乱. 王源源等[40]对小鼠分别给予正常饲料、高脂饲料及添加丙酸和丁酸的高脂饲料喂养4 mo后, 比较小鼠血浆甘油三酯/总胆固醇浓度、脂肪和肝脏组织细胞形态、脂质代谢相关基因的表达变化, 结果发现与高脂饲料组相比, 添加丙酸和丁酸的高脂饲料能够抑制小鼠体重增加和肝脏脂肪积聚, 降低血浆甘油三酯和总胆固醇水平, 同时减少脂质代谢相关基因的表达量, 其中的机制可能是丙酸和丁酸能通过促进脂肪分解和氧化抑制小鼠的体重增加.
SCFAs被结肠细胞吸收之后进入线粒体的三羧酸循环中, 产生ATP为细胞提供能量. 丁酸是结肠上皮细胞的主要能量来源, 它还能抑制肠道内病原菌的生长繁殖, 增加有益菌群丰度; 此外, 丁酸盐能够通过激活AMP激活蛋白激酶, 改变紧密连接蛋白的表达, 增强肠道黏膜屏障功能, 以此保持肠道的完整性. 有研究表明[41]肠道内有益菌的比例与个体健康状态呈正相关: 健康成年人肠道内有益菌比例约为25%, 体格健壮人群可高达70%, 而在便秘患者肠道内有益菌仅有15%. 便秘患者常常存在膳食纤维进食少等不良饮食习惯, 肠道内膳食纤维底物不足, 无法产生足量SCFAs, 同时肠道细菌失衡, 可能从几个方面影响脂质代谢: 紧密连接蛋白受损, 肠道黏膜屏障通透性增加, 肠道细菌细胞组成成分--脂多糖进入肠肝循环, 发生代谢性内毒素血症, 影响肝脏代谢功能; 缺乏足够SCFAs激活WAT中的GPR43, 从而减弱其对脂肪组织中脂质代谢的促进功能; SCFAs减少加剧肠道菌群失衡, 有益菌数量减少致使SCFAs的生成障碍, 两者互为因果, 进一步引起便秘症状及脂代谢异常状态的加重. 需要指出的是, 由于大多研究数据来源于动物和体外研究, SCFAs在人类脂代谢中的功能还有待进一步研究.
食物中胆碱、卵磷脂及肉碱等物质在肠道代谢产生三甲胺(trimethylamine, TMA), TMA经肠道吸收进入肝脏, 在肝脏黄素单氧化酶的作用下生成氧化三甲胺(trimethylamine oxide, TMAO)[42]. 研究发现经抗生素处理的实验动物体内TMAO浓度显著降低, 证实肠道细菌TMA裂解酶是TMAO产生的主要动力[43]. 家禽、鱼类、蛋类、红肉等食物是TMAO的主要来源[42].
目前关于TMAO的研究多与动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease, ASCVD)相关, 诸多研究发现[44-46]血清TMAO水平升高常常增加心血管事件的风险, 动物研究发现[42]TMAO是动脉粥样硬化的直接诱因. 而脂质代谢紊乱所致血脂水平异常是ASCVD的重要危险因素[47]. 基于TMAO与ASCVD之间的联系, 有学者发现TMAO可上调清道夫受体的表达, 导致胆固醇在细胞内堆积, 促进泡沫细胞的形成并减少胆固醇的清除; 此外, TMAO能降低7α-羟化酶的表达, 抑制胆固醇向肝脏的逆转运过程, 不仅阻碍了胆固醇和脂蛋白的代谢[45], 同时减少了BAs的合成, 从而影响脂质的消化和吸收.
多数关于便秘患者肠道菌群变化的研究有结论: 便秘患者肠道内拟杆菌、双歧杆菌、乳杆菌等有益菌数量减少. 若根据肠道菌群组成将受试对象分为不同肠型[48]时, 富集拟杆菌肠型者的血浆TMAO水平更低[45]. 由此推断: 便秘患者肠道内拟杆菌等有益菌丰度降低, 潜在致病菌数量增加, 引起血浆中TMAO水平升高, 通过对清道夫受体及7α-羟化酶的影响, 改变机体对胆固醇的代谢.
本文从BAs、SCFAs、TMAO三个方面综述了便秘状态下肠道菌群变化对机体脂代谢的影响(图1). 从肠道菌群变化的角度, 研究便秘状态下肠道黏膜屏障受损、细菌移位的机制, 肠道菌群代谢产物变化及其影响脂代谢的靶点和通路, 采用微生态制剂预防、治疗便秘, 重建肠道菌群进而改善机体脂代谢状态是一种新的临床诊疗思路. 然而, 便秘状态下肠道菌群变化复杂, 其与机体代谢功能的联系尚未充分明确, 亟待进一步深入研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 山西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:王禹乔 电编:刘继红
| 2. | O'Hara AM, Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006;7:688-693. [PubMed] [DOI] |
| 3. | 廖 秦平, 牛 小溪. 人体微生态研究现状与展望. 中国实用妇科与产科杂志. 2017;33:777-778. [DOI] |
| 4. | Chassard C, Dapoigny M, Scott KP, Crouzet L, Del'homme C, Marquet P, Martin JC, Pickering G, Ardid D, Eschalier A, Dubray C, Flint HJ, Bernalier-Donadille A. Functional dysbiosis within the gut microbiota of patients with constipated-irritable bowel syndrome. Aliment Pharmacol Ther. 2012;35:828-838. [PubMed] [DOI] |
| 5. | Choi CH, Chang SK. Alteration of gut microbiota and efficacy of probiotics in functional constipation. J Neurogastroenterol Motil. 2015;21:4-7. [PubMed] [DOI] |
| 6. | Zhu L, Liu W, Alkhouri R, Baker RD, Bard JE, Quigley EM, Baker SS. Structural changes in the gut microbiome of constipated patients. Physiol Genomics. 2014;46:679-686. [PubMed] [DOI] |
| 7. | Parthasarathy G, Chen J, Chen X, Chia N, O'Connor HM, Wolf PG, Gaskins HR, Bharucha AE. Relationship Between Microbiota of the Colonic Mucosa vs Feces and Symptoms, Colonic Transit, and Methane Production in Female Patients With Chronic Constipation. Gastroenterology. 2016;150:367-79.e1. [PubMed] [DOI] |
| 8. | Nicholson JK, Holmes E, Wilson ID. Gut microorganisms, mammalian metabolism and personalized health care. Nat Rev Microbiol. 2005;3:431-438. [PubMed] [DOI] |
| 9. | Nicholson JK. Global systems biology, personalized medicine and molecular epidemiology. Mol Syst Biol. 2006;2:52. [PubMed] [DOI] |
| 11. | Thompson LR, Sanders JG, McDonald D, Amir A, Ladau J, Locey KJ, Prill RJ, Tripathi A, Gibbons SM, Ackermann G, Navas-Molina JA, Janssen S, Kopylova E, Vázquez-Baeza Y, González A, Morton JT, Mirarab S, Zech Xu Z, Jiang L, Haroon MF, Kanbar J, Zhu Q, Jin Song S, Kosciolek T, Bokulich NA, Lefler J, Brislawn CJ, Humphrey G, Owens SM, Hampton-Marcell J, Berg-Lyons D, McKenzie V, Fierer N, Fuhrman JA, Clauset A, Stevens RL, Shade A, Pollard KS, Goodwin KD, Jansson JK, Gilbert JA, Knight R; Earth Microbiome Project Consortium. A communal catalogue reveals Earth's multiscale microbial diversity. Nature. 2017;551:457-463. [PubMed] [DOI] |
| 12. | Bengmark S. Ecological control of the gastrointestinal tract. The role of probiotic flora. Gut. 1998;42:2-7. [PubMed] [DOI] |
| 13. | Thaiss CA, Zmora N, Levy M, Elinav E. The microbiome and innate immunity. Nature. 2016;535:65-74. [PubMed] [DOI] |
| 14. | Cebra JJ, Periwal SB, Lee G, Lee F, Shroff KE. Development and maintenance of the gut-associated lymphoid tissue (GALT): the roles of enteric bacteria and viruses. Dev Immunol. 1998;6:13-18. [PubMed] [DOI] |
| 16. | Johnson SA, Nicolson SW, Jackson S. The effect of different oral antibiotics on the gastrointestinal microflora of a wild rodent (Aethomys namaquensis). Comp Biochem Physiol A Mol Integr Physiol. 2004;138:475-483. [PubMed] [DOI] |
| 17. | 饶 翀, 肖 新华. 肠道菌群和脂代谢异常. 中华临床医师杂志(电子版). 2016;10:1053-1055. [DOI] |
| 19. | Mugie SM, Benninga MA, Di Lorenzo C. Epidemiology of constipation in children and adults: a systematic review. Best Pract Res Clin Gastroenterol. 2011;25:3-18. [PubMed] [DOI] |
| 20. | Wald A. Constipation: Advances in Diagnosis and Treatment. JAMA. 2016;315:185-191. [PubMed] [DOI] |
| 22. | Khalif IL, Quigley EM, Konovitch EA, Maximova ID. Alterations in the colonic flora and intestinal permeability and evidence of immune activation in chronic constipation. Dig Liver Dis. 2005;37:838-849. [PubMed] [DOI] |
| 23. | Kim SE, Choi SC, Park KS, Park MI, Shin JE, Lee TH, Jung KW, Koo HS, Myung SJ; Constipation Research group of Korean Society of Neurogastroenterology and Motility. Change of Fecal Flora and Effectiveness of the Short-term VSL#3 Probiotic Treatment in Patients With Functional Constipation. J Neurogastroenterol Motil. 2015;21:111-120. [PubMed] [DOI] |
| 24. | Wahlström A, Sayin SI, Marschall HU, Bäckhed F. Intestinal Crosstalk between Bile Acids and Microbiota and Its Impact on Host Metabolism. Cell Metab. 2016;24:41-50. [PubMed] [DOI] |
| 25. | Song Z, Cai Y, Lao X, Wang X, Lin X, Cui Y, Kalavagunta PK, Liao J, Jin L, Shang J, Li J. Taxonomic profiling and populational patterns of bacterial bile salt hydrolase (BSH) genes based on worldwide human gut microbiome. Microbiome. 2019;7:9. [PubMed] [DOI] |
| 26. | Kim GB, Miyamoto CM, Meighen EA, Lee BH. Cloning and characterization of the bile salt hydrolase genes (bsh) from Bifidobacterium bifidum strains. Appl Environ Microbiol. 2004;70:5603-5612. [PubMed] [DOI] |
| 27. | Corzo G, Gilliland SE. Bile salt hydrolase activity of three strains of Lactobacillus acidophilus. J Dairy Sci. 1999;82:472-480. [PubMed] [DOI] |
| 28. | Wang Z, Zeng X, Mo Y, Smith K, Guo Y, Lin J. Identification and characterization of a bile salt hydrolase from Lactobacillus salivarius for development of novel alternatives to antibiotic growth promoters. Appl Environ Microbiol. 2012;78:8795-8802. [PubMed] [DOI] |
| 29. | Stellwag EJ, Hylemon PB. Purification and characterization of bile salt hydrolase from Bacteroides fragilis subsp. fragilis. Biochim Biophys Acta. 1976;452:165-176. [PubMed] [DOI] |
| 30. | Jones ML, Martoni CJ, Ganopolsky JG, Labbé A, Prakash S. The human microbiome and bile acid metabolism: dysbiosis, dysmetabolism, disease and intervention. Expert Opin Biol Ther. 2014;14:467-482. [PubMed] [DOI] |
| 31. | Kliewer SA, Mangelsdorf DJ. Bile Acids as Hormones: The FXR-FGF15/19 Pathway. Dig Dis. 2015;33:327-331. [PubMed] [DOI] |
| 33. | Høverstad T, Midtvedt T. Short-chain fatty acids in germfree mice and rats. J Nutr. 1986;116:1772-1776. [PubMed] [DOI] |
| 34. | Kasubuchi M, Hasegawa S, Hiramatsu T, Ichimura A, Kimura I. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation. Nutrients. 2015;7:2839-2849. [PubMed] [DOI] |
| 35. | Hu J, Lin S, Zheng B, Cheung PCK. Short-chain fatty acids in control of energy metabolism. Crit Rev Food Sci Nutr. 2018;58:1243-1249. [PubMed] [DOI] |
| 36. | Tan J, McKenzie C, Potamitis M, Thorburn AN, Mackay CR, Macia L. The role of short-chain fatty acids in health and disease. Adv Immunol. 2014;121:91-119. [PubMed] [DOI] |
| 37. | Stoddart LA, Smith NJ, Jenkins L, Brown AJ, Milligan G. Conserved polar residues in transmembrane domains V, VI, and VII of free fatty acid receptor 2 and free fatty acid receptor 3 are required for the binding and function of short chain fatty acids. J Biol Chem. 2008;283:32913-32924. [PubMed] [DOI] |
| 38. | Kimura I, Ozawa K, Inoue D, Imamura T, Kimura K, Maeda T, Terasawa K, Kashihara D, Hirano K, Tani T, Takahashi T, Miyauchi S, Shioi G, Inoue H, Tsujimoto G. The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43. Nat Commun. 2013;4:1829. [PubMed] [DOI] |
| 39. | Canfora EE, van der Beek CM, Jocken JWE, Goossens GH, Holst JJ, Olde Damink SWM, Lenaerts K, Dejong CHC, Blaak EE. Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial. Sci Rep. 2017;7:2360. [PubMed] [DOI] |
| 41. | Motevaseli E, Dianatpour A, Ghafouri-Fard S. The Role of Probiotics in Cancer Treatment: Emphasis on their In Vivo and In Vitro Anti-metastatic Effects. Int J Mol Cell Med. 2017;6:66-76. [PubMed] [DOI] |
| 42. | Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, Feldstein AE, Britt EB, Fu X, Chung YM, Wu Y, Schauer P, Smith JD, Allayee H, Tang WH, DiDonato JA, Lusis AJ, Hazen SL. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011;472:57-63. [PubMed] [DOI] |
| 43. | Demarquoy J, Georges B, Rigault C, Royer MC, Clairet A, Soty M, Lekounoungou S, Le Borgne F. Radioisotopic determination of L-carnitine content in foods commonly eaten in Western countries. Food Chem. 2004;86:137-142. [DOI] |
| 44. | Wang Z, Tang WH, Buffa JA, Fu X, Britt EB, Koeth RA, Levison BS, Fan Y, Wu Y, Hazen SL. Prognostic value of choline and betaine depends on intestinal microbiota-generated metabolite trimethylamine-N-oxide. Eur Heart J. 2014;35:904-910. [PubMed] [DOI] |
| 45. | Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, Britt EB, Fu X, Wu Y, Li L, Smith JD, DiDonato JA, Chen J, Li H, Wu GD, Lewis JD, Warrier M, Brown JM, Krauss RM, Tang WH, Bushman FD, Lusis AJ, Hazen SL. Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med. 2013;19:576-585. [PubMed] [DOI] |
| 46. | Tang WH, Wang Z, Levison BS, Koeth RA, Britt EB, Fu X, Wu Y, Hazen SL. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk. N Engl J Med. 2013;368:1575-1584. [PubMed] [DOI] |