修回日期: 2020-03-22
接受日期: 2020-03-28
在线出版日期: 2020-04-08
miR-888-5p高表达于原发性肝细胞癌(hepatocellular carcinoma, HCC)组织及HCC细胞系, 可促进肿瘤细胞侵袭及转移, 与疾病分期及预后不良相关. 然而HCC患者血清中miR-888-5p的表达水平尚未被检测, 血清miR-888-5p对于HCC诊断及预后判断相关价值尚未被评估.
检测HCC患者血清中miR-888-5p表达水平, 探究其对HCC的诊断价值及与临床特征之间的关系.
收集68例HCC患者、46例慢性乙型病毒性肝炎(chronic hepatitis B, CHB)患者、43例肝硬化(liver cirrhosis, LC)患者及40例同期健康体检者, 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)法检测血清中miR-888-5p表达量, 受试者工作特征(receiver operating characteristic, ROC)曲线评估其诊断HCC的价值, 并分析与HCC临床特征之间的关系.
HCC患者血清中miR-888-5p表达量较CHB、LC及健康者显著上调(P<0.05). ROC曲线提示, 联合检测ROC曲线下面积(area under curve, AUC)为0.907, 敏感性91.18%, 特异性72.50%)对HCC诊断价值优于分别检测血清miR-888-5p (AUC = 0.737, 敏感性79.41%, 特异性62.50%)及甲胎蛋白(alpha-fetoprotein, AFP)(AUC = 0.819, 敏感性73.53%, 特异性97.50%), 且对AFP阴性HCC也具有较高的诊断价值: AUC = 0.793, 敏感性90.90%, 特异性62.50%. 此外, miR-888-5p表达水平与HCC肺转移相关(P = 0.01).
血清miR-888-5p对HCC及AFP阴性HCC具有较高诊断价值, 与AFP联合检测诊断价值更高. miR-888-5p表达水平与HCC肺转移相关,有望成为HCC早期诊断及评估预后的新型血清学分子标志物.
核心提要: 血清miR-888-5p在HCC患者血清中高表达,有助于HCC及AFP阴性HCC患者进行早期诊断, 其表达水平与HCC肺转移相关, 可提示预后. miR-888-5p具有成为HCC早期诊断、临床决策指导以及评估预后的一种血清学分子指标的潜力.
引文著录: 裴苗苗, 卢敏, 毛华. 原发性肝细胞癌血清中miR-888-5p的表达及临床意义. 世界华人消化杂志 2020; 28(7): 247-253
Revised: March 22, 2020
Accepted: March 28, 2020
Published online: April 8, 2020
MiR-888-5p is highly expressed in hepatocellular carcinoma (HCC) tissues and cell lines, and it can promote tumor invasion and metastasis and is related to disease stage and poor prognosis. However, the clinical value of serum miR-888-5p levels in the diagnosis and prognosis of HCC remains unclear.
To detect serum miR-888-5p in patients with HCC and investigate its diagnostic value and correlation with clinical characteristics of HCC.
A total of 197 subjects were enrolled, consisting of 68 HCC patients, 46 chronic hepatitis B (CHB) patients, 43 liver cirrhosis (LC) patients, and 40 healthy volunteers. Serum miR-888-5p levels were measured by quantitative real-time polymerase chain reaction (qRT-PCR). The diagnostic value of miR-888-5p and its correlation with clinical features were assessed.
Compared with CHB patients, LC patients, and healthy controls, serum miR-888-5p increased significantly in HCC patients (P < 0.05). Receiver operating characteristic curve (ROC) analysis demonstrated that the area under the ROC curve (AUC) of miR-888-5p combined with alpha-fetoprotein (AFP) in discriminating HCC patients from healthy controls was 0.907 (sensitivity: 91.18%; specificity: 72.50%), higher than that of either AFP (AUC = 0.819; sensitivity: 73.53%; specificity: 97.50%) or miR-888-5p alone (AUC = 0.737; sensitivity: 79.41%; specificity: 62.50%). Serum miR-888-5p maintained its diagnostic efficiency in AFP negative HCC patients with an AUC of 0.793 (sensitivity: 90.90%; specificity: 62.50%). Serum miR-888-5p levels were significantly associated with pulmonary metastasis (P = 0.01) of HCC.
Serum miR-888-5p has high diagnostic value for HCC, and combined detection of serum miR-888-5p and AFP could improve the diagnostic efficiency. MiR-888-5p also has good diagnostic value for AFP negative HCC, and it is closely related to lung metastasis of HCC. MiR-888-5p is expected to become a new serum marker for early diagnosis and prognosis evaluation of HCC.
- Citation: Pei MM, Lu M, Mao H. Clinical significance of serum miR-888-5p in patients with primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2020; 28(7): 247-253
- URL: https://www.wjgnet.com/1009-3079/full/v28/i7/247.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v28.i7.247
肝癌是全球极为好发的高致死性消化系统异质性肿瘤, 2017年国家癌症中心[1]发布数据表明, 我国HCC的发病率高达28.17/10万, 为第三大常见肿瘤, 死亡率为24.70/10万, 低于肺癌, 居癌症相关死因的第二位. 肝癌可分为肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管细胞癌、肝细胞-胆管细胞混合性癌和纤维板层样肝癌, 其中HCC占90%[2]. 由于缺少灵敏且特异度高的筛查及早期诊断方法, 超多半数的HCC患者在初次确诊时已处于中晚期, 预后不佳. miRNA是基因转录后表达的重要调控因子, 可在HCC发生早期即稳定表达于外周循环, 参与调控HCC细胞增殖和分化、凋亡、侵袭和转移[3,4]. 研究证实miR-888-5p为致癌miRNA, 广泛参与调节HCC的发生及进展[5,6]. 目前尚无HCC与血清miR-888-5p的相关报道, 本研究采用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)法检测HCC、慢性乙型病毒性肝炎(chronic hepatitis B, CHB)、肝硬化(liver cirrhosis, LC)患者以及健康人群血清中miR-888-5p的表达水平, 观察不同人群之间其表达量是否存在统计学差异, 探讨其表达水平与HCC患者临床特征之间的关系, 寻求一种无创、便捷、可重复性高的血清学诊断及预后相关分子生物指标.
1.1.1 纳入与排除标准: (1)HCC患者: ①影像学或肝穿活检病理初次确诊的乙型肝炎病毒(hepatitis B virus, HBV)相关HCC患者; ②未接受手术、放化疗、靶向药物治疗等肿瘤相关治疗; ③无肺、心、脑、肾等重要脏器功能不全; ④无同时合并其他部位恶性肿瘤; ⑤无重大精神疾患者; (2)LC患者: ①腹部B超、CT等证实的HBV相关LC者; ②无恶性肿瘤病史; ③无肺、心、脑、肾等重要脏器功能不全; (3)CHB患者: ①乙肝两对半、腹部B超等诊断明确者; ②无恶性肿瘤病史; ③无肺、心、脑、肾等器官功能不全; (4)健康对照组: ①无其他系统癌症病史; ②无肺、心、脑、肾等重要脏器功能不全; ③无重大精神疾患者. 本实验符合国家医学伦理学标准, 经我院伦理审查委员会审查并批准, 所有待检者于实验开始前已知情同意并签字.
1.1.2 一般材料: 血清/血浆miRNA提取试剂盒(美杰生物科技有限公司, 广州); PrimeScript RT reagent Kit (perfect Real Time)试剂盒(瑞真生物技术有限公司, 广州); TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus); qPCR试剂Ⅱ(瑞真生物技术有限公司, 广州); 茎环法miRNA qRT-PCR引物(锐博生物科技有限公司, 广州); 以秀丽隐线虫miR-39-3p作为外参, 由上海生生物工程有限公司合成(序列: UCACCGGGUGUAAAUCAGCUUG).
1.1.3 临床样本的收集与处理: 选取2019-04/2019-11南方医科大学珠江医院消化内科、肿瘤科及肝胆科住院首次确诊的HCC患者共68例, CHB46例, LC43例及同期健康体检者40例. 受试者的一般资料见表1, 各组年龄及性别构成比均无统计学差异(P>0.05). 受试者禁食8 h后用静脉采血专用真空试管采集5 mL外周静脉血, 室温下3000 r/min离心15 min后分离血清, 然后将血清在4 ℃, 17000 g离心10 min, 吸取上清液作为检测样品,将其分装至1.5 mL无酶管, 保存至-80 ℃冰箱备用.
| HCC | LC | CHB | 健康对照组 | |
| 例数 | 68 | 43 | 46 | 40 |
| 平均年龄(岁) | 56.07±11.49 | 56.14±10.61 | 54.93±8.49 | 53.13±9.52 |
| 性别 | ||||
| 男 | 48 (70.6) | 32 (74.4) | 31 (67.4) | 25 (62.5) |
| 女 | 20 (29.4) | 11 (25.6) | 15 (32.6) | 15 (37.5) |
1.2.1 miRNA的提取与cDNA的合成: 从-80 ℃冰箱中取出冻存血清样品冰上解冻, 提取500 μL血清中miRNA.按照反转录试剂盒的说明书, 反应体系10 μL: miRNA 7 μL, 5×Prime Script Buffer 2 μL, Prime Script Enzyme Mix I 0.5 μL, RT Primer 0.5 μL, 反应条件: 42 ℃ 15 min, 85 ℃ 5 s, 4 ℃ 30 min, 将miRNA进行反转录合成cDNA, cDNA模板立即进行qRT-PCR.
1.2.2 qRT-PCR检测miR-888-5p表达水平: 应用BIO-RAD qRT-PCR仪, 按照试剂盒说明书, 反应体系20 μL: cDNA 4 μL, SYBR Premix Ex Taq Ⅱ 10 μL, PCR Forward Primer (10 μmol/L) 0.8 μL, PCR Reverse Primer 0.8 μL (10 μmol/L), Rnase-Free Water 4.4 μL. qRT-PCR反应条件(两步法): 预变性95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s, 共40个循环; 溶解曲线: 95 ℃ 1 min, 65 ℃ 5 s, 95 ℃ 5 min; 实验设置3个复孔, 取其平均值, 记录循环荧光阈值(cyclic threshold, CT). miR-888-5p组间相对表达量以2-△△CT表示, △△CT = mean(实验组目的基因CT值-实验组外参CT值)-mean(对照组目的基因CT值-对照组内参基因CT值)[7].
统计学处理 基于预实验, 采用公式n = Ψ2(∑(Si2)/K)/[∑(Xi均-X均)2/(K-1)]计算得出每组实验对象至少40例. 运用SPSS 20.0统计分析软件, 计量资料以P50[P25,P75]表示, 计数资料以频数及率表示, 组间比较采用非参数秩和检验, P<0.05表示有统计学差异. 受试者工作特征(receiver operating characteristic, ROC) 曲线评估诊断效能.
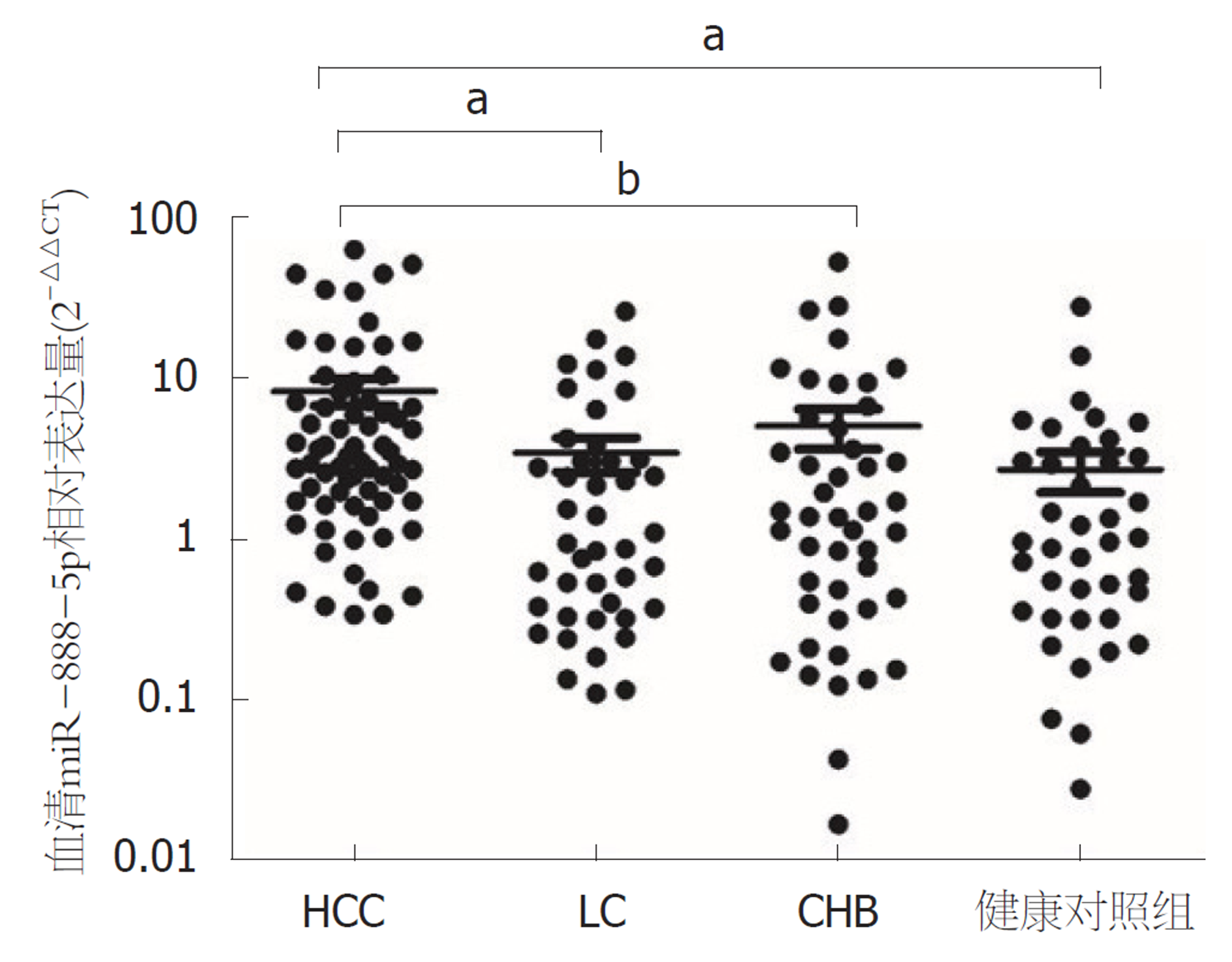
采用2-△△CT法计算血清miR-888-5p相对表达量, HCC患者血清miR-888-5p最高表达量为62.90, 最低为0.34; LC患者中表达量最高为26.08, 最低为0.11; CHB患者miR-888-5p最高表达量为52.52, 最低为0.02; 健康对照最高表达量为27.95, 最低则为0.03. HCC组血清miR-888-5p表达量明显高于LC组、CHB组及健康对照组(P<0.01), 差异有统计学意义; 而LC、CHB及健康对照组三组之间比较, 无显著统计学差异(P>0.05)(图1).
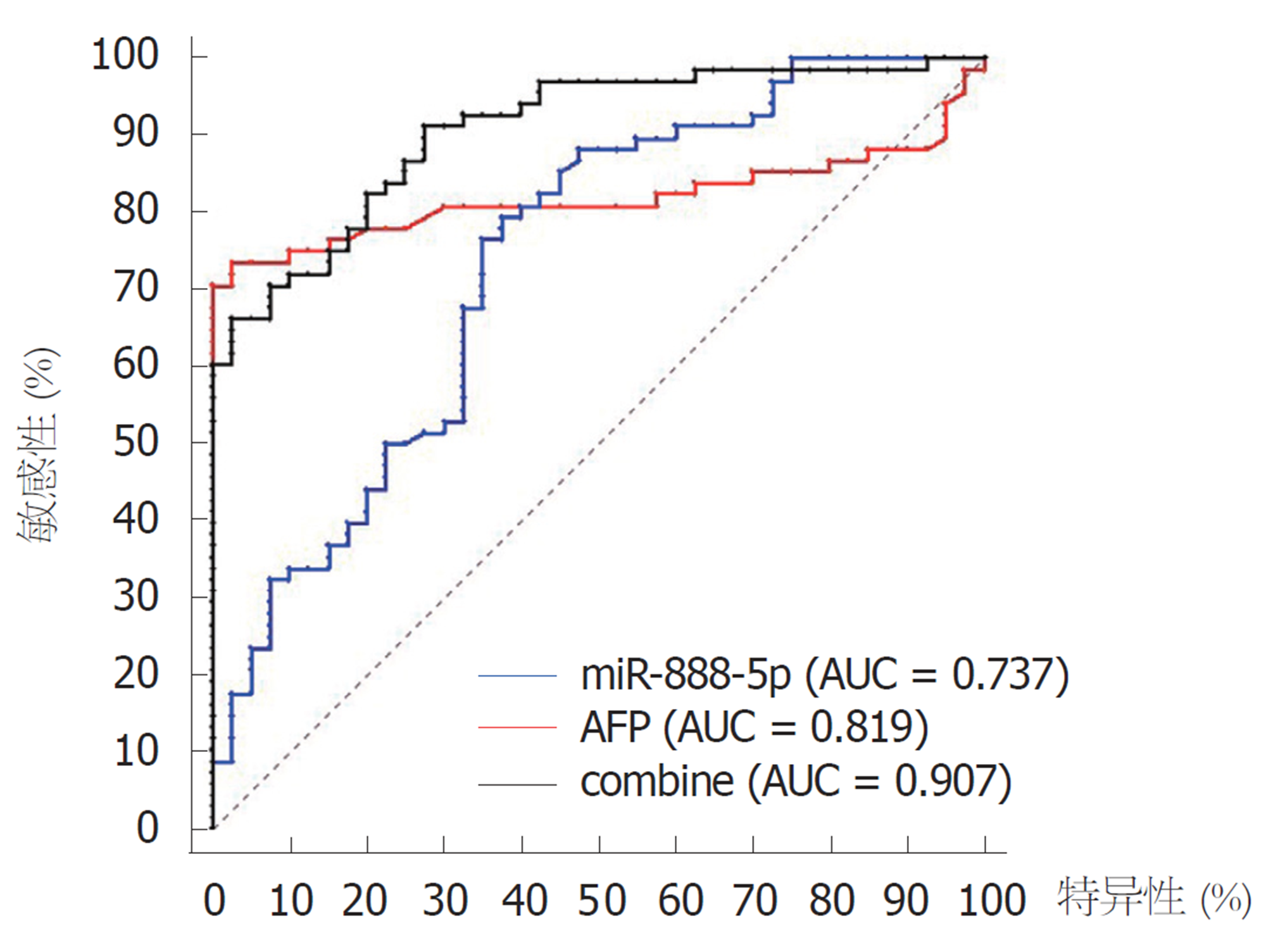
血清miR-888-5p对于诊断HCC的ROC曲线下面积(area under curve, AUC)为0.737(95%CI: 0.643-0.817; 敏感性: 79.41%, 特异性: 62.50%), AFP的AUC为0.819(95%CI: 0.734-0.887; 敏感性: 73.53%,特异性: 97.50%), 联合两者检测AUC为0.907(95%CI: 0.835-0.954; 敏感性: 91.18%, 特异性: 72.50%). miR-888-5p诊断HCC具有较高的AUC及敏感性, 与AFP联合检测AUC及敏感性均得以提高, 可获得更高诊断价值(图2、表2).
| AUC | 95%CI | Youde指数 | 敏感性 | 特异性 | |
| miR-888-5p | 0.737 | 0.643-0.817 | 0.419 | 79.41 | 62.50 |
| AFP | 0.819 | 0.734-0.887 | 0.710 | 73.53 | 97.50 |
| combine | 0.907 | 0.835-0.954 | 0.637 | 91.18 | 72.50 |
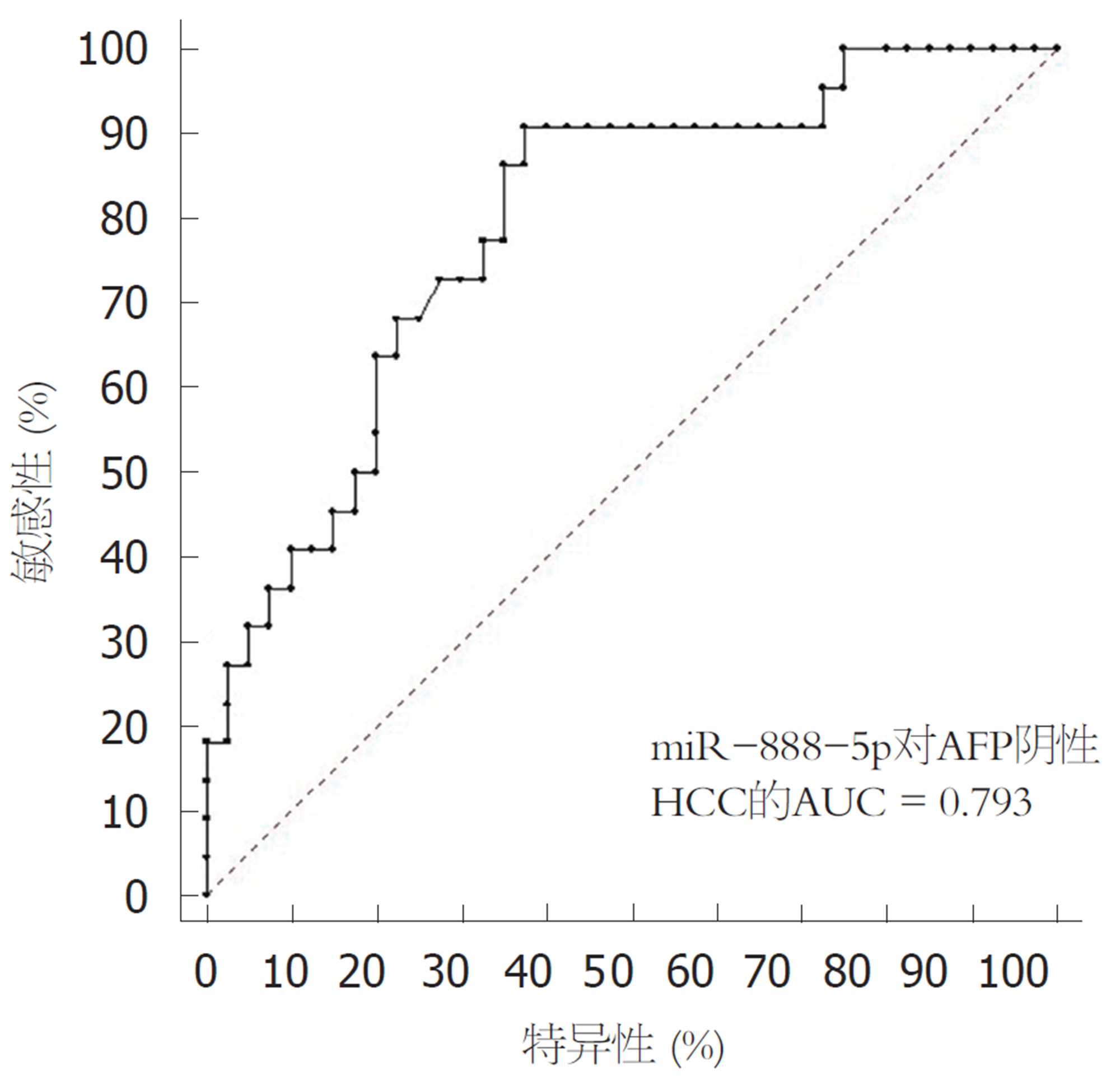
以AFP20 μg/L为界将68例HCC患者分为AFP阳性及AFP阴性HCC两组. 对22例AFP阴性患者绘制ROC曲线所得AUC为0.793(95%CI: 0.671-0.885; 敏感性: 90.90%, 特异性: 62.50%), miR-888-5p对AFP阴性HCC患者具备良好的诊断效能(图3).
HCC血清miR-888-5p的表达水平与患者的性别、年龄、AFP、LC、Child分级、肿瘤直径、肿瘤数目、肝内转移、门静脉癌栓、淋巴结转移、TNM分级及巴塞罗那分期均无明显相关性(P>0.05), 而与肺转移相关(P = 0.01)(表3).
| 临床特征 | 例数 | miR-888-5p | ||
| M [P25, P75] | z值 | P值 | ||
| 性别 | -0.37 | 0.71 | ||
| 男 | 48 | 2.98 (1.65, 6.89) | ||
| 女 | 20 | 3.79 (1.81, 8.90) | ||
| 年龄(岁)1 | -1.53 | 0.13 | ||
| ≥56 | 32 | 3.81 (2.46, 7.90) | ||
| <56 | 36 | 2.64 (1.27, 6.84) | ||
| AFP(μg/L) | -1.75 | 0.08 | ||
| ≥20 | 46 | 2.72 (1.35, 6.72) | ||
| <20 | 22 | 4.40 (2.61, 15.99) | ||
| 肝硬化 | -1.32 | 0.19 | ||
| 有 | 40 | 2.75 (1.65, 6.20) | ||
| 无 | 28 | 5.02 (2.17, 7.90) | ||
| Child分级 | 2.24 | 0.33 | ||
| A级 | 47 | 3.96 (1.72, 10.37) | ||
| B级 | 17 | 2.58 (1.67, 3.79) | ||
| C级 | 4 | 2.85 (1.62, 13.24) | ||
| 肿瘤数目(个) | -0.43 | 0.67 | ||
| ≥3 | 49 | 2.91 (1.72, 7.66) | ||
| <3 | 19 | 3.81 (1.39, 6.59) | ||
| 肿瘤直径(cm) | -0.03 | 0.97 | ||
| ≥5 | 49 | 2.94 (1.51, 8.81) | ||
| <5 | 19 | 3.63 (2.19, 5.19) | ||
| 肝内转移 | -1.25 | 0.21 | ||
| 是 | 50 | 2.77 (1.70, 7.13) | ||
| 否 | 18 | 4.38 (2.11, 11.03) | ||
| 门静脉癌栓 | -1.59 | 0.11 | ||
| 有 | 27 | 2.19 (1.02, 6.04) | ||
| 无 | 41 | 3.81 (2.40, 8.81) | ||
| 淋巴结转移 | -1.27 | 0.20 | ||
| 有 | 27 | 2.91 (1.13, 5.90) | ||
| 无 | 41 | 3.77 (1.86, 9.93) | ||
| 肺部转移 | -2.44 | 0.01a | ||
| 有 | 15 | 2.47 (0.83, 2.91) | ||
| 无 | 53 | 3.81 (1.84, 9.93) | ||
| TNM分期 | -1.34 | 0.18 | ||
| Ⅰ+Ⅱ | 34 | 3.81 (2.19, 8.47) | ||
| Ⅲ+Ⅳ | 34 | 2.64 (1.21, 6.74) | ||
| 巴塞罗那分期 | 2.40 | 0.50 | ||
| A期 | 17 | 3.81 (2.55, 12.57) | ||
| B期 | 19 | 3.47 (1.72, 8.14) | ||
| C期 | 18 | 2.49 (1.46, 7.98) | ||
| D期 | 14 | 2.64 (1.21, 5.85) | ||
文献报道[8], 中国聚集着全球55%的肝癌病例, 每年平均约有38.3万人死于肝癌, 肝癌死亡病例占全球肝癌死亡总人数的51%. 由于HCC具有高度异质性、进展迅速、侵袭度高、易转移等恶性生物学行为及早期临床症状隐匿、现有筛查诊断方法敏感性与特异性不足, 多数患者失去早期手术根治良机, 手术切除率仅为10%-20%左右, 高达70%的患者于手术后5年内复发, 其中2/3复发于术后2年内, 5年总体生存率仅为7%-10%[9]. 早在20世纪末, WHO提出了癌症的"3个1/3"相关策略, 目前看来, 优化HCC筛查方法提高HCC早期检出率, 是改善预后, 降低死亡率最有效、最根本的策略.
miRNA为真核细胞内高度保守长度约为21-25个核苷酸的内源性非编码单链小分子RNA, 通过与靶基因的3'端非翻译区进行完全性或不完全互补结合, 引起靶mRNA降解或者抑制翻译, 靶基因转录后表达水平改变, 广泛调控细胞生长、分化、凋亡及细胞信号转导等生命活动, 其表达失调与恶性肿瘤等多种疾病密切相关[10,11]. 据文献报道[12], miRNA可在HCC进程中扮演着抑癌基因和癌基因的重要角色. Murakami等[13]首次报道了miRNA在HCC中的异常表达模式, 认为miRNA表达异常是HCC发生、进展的共同生物学征. 愈来愈多的研究证实[14-17], 循环miRNA可长期稳定存在, 不被内源性RNA酶降解, 亦能耐受极端酸碱环境及温度, 以上特性为我们的研究奠定了实验可行性的基础.
miR-888-5p是miR-888基因家族成员之一[18], 在HCC中发挥致癌作用. 本研究采用qRT-PCR法检测, 相对定量法分析血清中miR-888-5p表达水平, 结果表明HCC患者血清中miR-888-5p表达量较CHB、LC及对照组显著升高(P<0.05). 进一步绘制ROC曲线分析发现, 血清miR-888-5p诊断HCC的AUC为0.7379(敏感性为79.41%, 特异性为62.50%), AFP的AUC则为0.819(敏感性73.53%、特异度97.50%); 而联合两者检测AUC高达0.907, 灵敏度高达91.18%, 特异性为72.50%. miR-888-5p对HCC诊断的灵敏度较AFP高, 而AFP则具有较高特异性, 联合检测两者的诊断效能及敏感性更高, 更具临床诊断价值. 以AFP = 20 μg/L为分界, 将68例HCC分为AFP阳性组(46例)及AFP阴性(22例)两组, 分析miR-888-5p对于AFP阴性HCC患者的诊断价值, 所得AUC为0.793, 敏感性90.90%, 特异性62.50%, 可见miR-888-5p对AFP阴性HCC患者具有较高的敏感性及诊断效能, 且miR-888-5p表达水平与AFP无明显相关性(P = 0.08), 其有望成为AFP阴性HCC患者补充诊断的分子指标, 但仍需后续多中心、大样本实验进一步加以验证.
miR-888-5p在人类常见多种肿瘤中发挥类似原癌基因的生物学作用[19-21]. 在HCC中, 其可上调癌细胞MMP-2和MMP-9表达水平, 抑制p53抑癌基因的表达, 促进癌细胞迁移和侵袭[5]. Li等[6]研究提示miR-888-5p可通过靶向抑制Smad4, 促进HCC细胞迁移和侵袭, 新发现的miR-888/Smad4轴为研究HCC的进展提供了新思路, 并提供了一个潜在的治疗靶点. 我们通过分析发现HCC患者血清miR-888-5p的表达水平与患者的性别、年龄、AFP、LC、Child分级、肿瘤大小、肿瘤数目、肝内转移、门静脉癌栓、淋巴结转移、TNM分级及巴塞罗那分期无明显相关(P>0.05), 而与肺部转移相关(P = 0.01), 说明miR-888-5p可能参与调控HCC浸润及转移等生物分子机制, 且血清miR-888-5P不受患者性别年龄等因素干扰, 能够客观提示HCC细胞转移情况. 我国学者黄湘俊等[22]研究结果显示miR-888-5p在HCC组织中表达高于癌旁组织, 且HCC分期分级越高, 其相应的表达水平越高, 说明其与HCC患者高度侵袭能力密不可分, miR-888-5p高表达可能是HCC浸润转移的重要步骤. 然而该实验标本为手术切除所得, 组织标本取材复杂、有创、耗时、费力, 我们通过探究HCC患者血清miR-888-5p水平得出了一致的结论, 提示血清miR-888-5p有望替代组织细胞学miRNA的检测, 成为一种新型、无损、可重复性高、可全面实时监测的HCC预后相关肿瘤分子标志物, 用于指导后续临床工作.
肝癌是我国常见的消化系统高度异质恶性实体瘤, 临床症状不典型、进展快、易转移, 现有血清学筛查手段缺乏灵敏度及特异性, 早期诊断率低下, 导致高死亡率, 预后极差的严峻局面. miRNA是一类广泛调控基因转录后表达的调控因子, 其结构简单、不转录、不被加工后修饰, 具有时序性、组织细胞特异性, 并可于肿瘤发病早期稳定表达于外周循环, 可帮助鉴别肿瘤起源组织, 且与肿瘤临床病理类型相关. 近年来, 相关文献报道miR-888-5p在原发性肝细胞癌(hepatocellular carcinoma, HCC)组织及细胞中高表达, 发挥致癌作用, 然而HCC患者血清中miR-888-5p表达水平及其作为HCC循环肿瘤分子标志物的价值仍未被探讨.
目前国内外研究大多聚焦于miR-888-5p与HCC组织细胞的基础研究, 本实验通过检测HCC患者、慢性乙型病毒性肝炎(chronic hepatitis B, CHB)患者、肝硬化(liver cirrhosis, LC)患者及健康人四组受试者血清中miR-888-5p表达水平, 评价其用于HCC早期诊断、病情评估及预后判断的临床应用价值.
本研究通过收集临床血清学样品, 检测血清miR-888-5p表达水平, 比较HCC患者与对照组之间其表达水平是否存在差异, 进一步绘制受试者工作特征(receiver operating characteristic, ROC)曲线评价血清miR-888-5p对于HCC诊断的价值, 并分析了血清miR-888-5p与HCC患者临床病理特征之间的关系, 旨在验证血清miR-888-5p可否成为一种灵敏、特异、无损且实用价值高的循环肿瘤分子标志物.
按照纳入排除标准收集68例HCC患者、46例CHB患者、43例LC患者以及40例同期健康体检者, qRT-PCR相对定量法检测血清中miR-888-5p表达量, 2-△△CT法计算组间miR-888-5p相对表达水平, 组间数据差异性比较采用秩和检验, ROC曲线评估miR-888-5p用于诊断HCC的价值, 同时分析miR-888-5p与HCC临床特征之间的关系.
本研究发现HCC患者血清miR-888-5p显著高表达, miR-888-5p对于诊断HCC具有良好的诊断价值, 且对甲胎蛋白(alpha-fetoprotein, AFP)阴性HCC患者具有辅助诊断价值, 联合检测miR-888-5p与AFP诊断价值更高.此外miR-888-5p与HCC远处转移密切相关, 但仍需后续动态监测miR-888-5p水平, 长期随访以证实miR-888-5p与预后之间的关系.
本研究首次检测了HCC患者血清miR-888-5p表达水平, miR-888-5p对于HCC患者及AFP阴性HCC患者具有临床诊断价值, 且可提示预后, 有望成为HCC肿瘤特异性循环分子标志物.
由于本研究为单中心研究, 样本量有限, 数据来源单一, 未检测HCC治疗前后血清miR-888-5p的动态变化, 以及同时期HCC患者组织及细胞中miR-888-5p表达水平; 未根据HCC相关病因详细分组分析血清miR-888-5p对不同病因所致HCC的临床应用价值, 因此仍需日后进行多中心、大样本、更深入的研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
编辑:王禹乔 电编:刘继红
| 1. | Chen W, Zheng R, Zhang S, Zeng H, Zuo T, Xia C, Yang Z, He J. Cancer incidence and mortality in China in 2013: an analysis based on urbanization level. Chin J Cancer Res. 2017;29:1-10. [PubMed] [DOI] |
| 2. | Intaraprasong P, Siramolpiwat S, Vilaichone RK. Advances in Management of Hepatocellular Carcinoma. Asian Pac J Cancer Prev. 2016;17:3697-3703. [PubMed] [DOI] |
| 3. | Zhang Y, Li T, Qiu Y, Zhang T, Guo P, Ma X, Wei Q, Han L. Serum microRNA panel for early diagnosis of the onset of hepatocellular carcinoma. Medicine (Baltimore). 2017;96:e5642. [PubMed] [DOI] |
| 4. | Qi J, Wang J, Katayama H, Sen S, Liu SM. Circulating microRNAs (cmiRNAs) as novel potential biomarkers for hepatocellular carcinoma. Neoplasma. 2013;60:135-142. [PubMed] [DOI] |
| 5. | Hao E, Yu J, Xie S, Zhang W, Wang G. Up-regulation of miR-888-5p in hepatocellular carcinoma cell lines and its effect on malignant characteristics of cells. J Biol Regul Homeost Agents. 2017;31:163-169. [PubMed] |
| 6. | Li YB, Sun FN, Ma XY, Qu H, Yu Y. MiR-888 promotes cell migration and invasion of hepatocellular carcinoma by targeting SMAD4. Eur Rev Med Pharmacol Sci. 2019;23:2020-2027. [PubMed] [DOI] |
| 7. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 8. | Tanaka M, Katayama F, Kato H, Tanaka H, Wang J, Qiao YL, Inoue M. Hepatitis B and C virus infection and hepatocellular carcinoma in China: a review of epidemiology and control measures. J Epidemiol. 2011;21:401-416. [PubMed] [DOI] |
| 9. | Kulik L, El-Serag HB. Epidemiology and Management of Hepatocellular Carcinoma. Gastroenterology. 2019;156:477-491.e1. [PubMed] [DOI] |
| 10. | Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell. 2009;136:215-233. [PubMed] [DOI] |
| 11. | Ebert MS, Sharp PA. Roles for microRNAs in conferring robustness to biological processes. Cell. 2012;149:515-524. [PubMed] [DOI] |
| 12. | Xie KL, Zhang YG, Liu J, Zeng Y, Wu H. MicroRNAs associated with HBV infection and HBV-related HCC. Theranostics. 2014;4:1176-1192. [PubMed] [DOI] |
| 13. | Murakami Y, Yasuda T, Saigo K, Urashima T, Toyoda H, Okanoue T, Shimotohno K. Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues. Oncogene. 2006;25:2537-2545. [PubMed] [DOI] |
| 14. | Yu DC, Li QG, Ding XW, Ding YT. Circulating microRNAs: potential biomarkers for cancer. Int J Mol Sci. 2011;12:2055-2063. [PubMed] [DOI] |
| 15. | Chen X, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, Zhang Y, Chen J, Guo X, Li Q, Li X, Wang W, Zhang Y, Wang J, Jiang X, Xiang Y, Xu C, Zheng P, Zhang J, Li R, Zhang H, Shang X, Gong T, Ning G, Wang J, Zen K, Zhang J, Zhang CY. Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases. Cell Res. 2008;18:997-1006. [PubMed] [DOI] |
| 16. | Mitchell PS, Parkin RK, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, Peterson A, Noteboom J, O'Briant KC, Allen A, Lin DW, Urban N, Drescher CW, Knudsen BS, Stirewalt DL, Gentleman R, Vessella RL, Nelson PS, Martin DB, Tewari M. Circulating microRNAs as stable blood-based markers for cancer detection. Proc Natl Acad Sci USA. 2008;105:10513-10518. [PubMed] [DOI] |
| 17. | Filella X, Foj L. miRNAs as novel biomarkers in the management of prostate cancer. Clin Chem Lab Med. 2017;55:715-736. [PubMed] [DOI] |
| 18. | Hovey AM, Devor EJ, Breheny PJ, Mott SL, Dai D, Thiel KW, Leslie KK. miR-888: A Novel Cancer-Testis Antigen that Targets the Progesterone Receptor in Endometrial Cancer. Transl Oncol. 2015;8:85-96. [PubMed] [DOI] |
| 19. | Huang S, Chen L. MiR-888 regulates side population properties and cancer metastasis in breast cancer cells. Biochem Biophys Res Commun. 2014;450:1234-1240. [PubMed] [DOI] |
| 20. | Lewis H, Lance R, Troyer D, Beydoun H, Hadley M, Orians J, Benzine T, Madric K, Semmes OJ, Drake R, Esquela-Kerscher A. miR-888 is an expressed prostatic secretions-derived microRNA that promotes prostate cell growth and migration. Cell Cycle. 2014;13:227-239. [PubMed] [DOI] |
| 21. | Gao SJ, Chen L, Lu W, Zhang L, Wang L, Zhu HH. miR-888 functions as an oncogene and predicts poor prognosis in colorectal cancer. Oncol Lett. 2018;15:9101-9109. [PubMed] [DOI] |