修回日期: 2018-12-21
接受日期: 2018-12-30
在线出版日期: 2019-01-28
分析嗜酸性胃肠炎(eosinophilic gastroenteritis, EG)的临床特点、诊断要点、治疗预后.
回顾性分析2013-06/2018-08郑州大学第一附属医院最终诊断为88例EG患者的临床资料.
88例患者中男:女 = 1.2:1, 年龄14-73岁, 平均年龄45.1岁. 腹痛为最多见症状, 73.3%患者过敏原筛查阳性, 部分患者内镜阴性, 常见内镜异常主要有充血、糜烂、溃疡、息肉等, 病理可见胃肠道内大量嗜酸性粒细胞(eosinophilic granulocyte, EoS)浸润, 其中盲肠平均值最高, 质子泵抑制剂治疗有效, 激素治疗起效快, 但易反复.
EG发病机制仍不明确, 过敏原在其中发挥重要作用, 临床表现不典型, 外周血以及骨髓涂片EoS增高可支持诊断, 影像学及内镜不特异, 病理是诊断关键, 激素治疗可以获得良好效果, 但具体剂量及疗程尚无统一意见.
核心提要: 嗜酸性胃肠道疾病发病率日渐增多, 各国共识、指南近期也得到了更新. 本文参照最新指南, 结合最新研究成果, 总结我院过去5年嗜酸性胃肠炎患者的诊治及预后, 探讨新观念下嗜酸性胃肠道炎的临床特点, 以指导临床治疗.
引文著录: 于政洋, 李东颖, 李建生. 嗜酸性胃肠炎的临床分析. 世界华人消化杂志 2019; 27(2): 94-100
Revised: December 21, 2018
Accepted: December 30, 2018
Published online: January 28, 2019
To analyze the clinical features, diagnosis, and prognosis of eosinophilic gastroenteritis (EG).
A retrospective analysis was performed of clinical data of 88 cases with EG at our hospital between June 2013 and August 2018.
Eighty-eight patients were included, with a male to female ratio of 1.2:1. The patients ranged in age from 14 to 73 years, with a mean age 45.1 years. Abdominal pain was the most common symptom, 73.3% of patients had positive allergen screening results, and some patients had negative endoscopic findings. Common endoscopic abnormalities were mainly congestion, erosion, ulcers, polyps and so on, and pathological examination revealed a large number of eosinophils infiltrated in the gastrointestinal tract, with the highest average value detected in the cecum. Treatment with proton pump inhibitors was effective. Glucocorticoid therapy was useful, but the disease could recur.
The pathogenesis of EG is still unclear, although it is known that allergens play an important role in it. The clinical manifestations are atypical. An increase of eosinophilic granulocytes in peripheral blood and bone marrow smear can support the diagnosis. Imaging and endoscopic manifestations are not specific. Pathology is the key to diagnosis. Glucocorticoid therapy can obtain good results, but there have been no unified criteria on the specific dosage and course of treatment .
- Citation: Yu ZY, Li DY, Li JS. Clinical analysis of eosinophilic gastroenteritis. Shijie Huaren Xiaohua Zazhi 2019; 27(2): 94-100
- URL: https://www.wjgnet.com/1009-3079/full/v27/i2/94.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i2.94
嗜酸性胃肠炎(eosinophilic gastroenteritis, EG)是嗜酸性胃肠道疾病(eosinophilic gastrointestinal disorders, EGID)中的一类, 是以大量嗜酸性粒细胞(eosinophilic granulocyte, EoS)浸润消化道管壁为特征的一类少见消化道疾病. 目前该病的病因及发病机制尚不明确. 临床表现、实验室检查、影像学表现及内镜表现均不具有特异性. 根据近年资料, 该病的发病率逐年增多[1,2]. 本研究通过对我院过去5年诊断为EG的患者进行回顾性研究, 分析该病的临床特征、治疗以及预后.
郑州大学第一附属医院2013-06/2018-08确诊EG的88名患者. 诊断标准[3,4]: (1)存在消化道受累的症状. (2)内镜下活检发现一处或多处EoS大量浸润(本研究纳入标准: EoS浸润食管≥15/HPF, 胃肠≥20/HPF). (3)排除寄生虫、炎症性肠病、消化道恶性肿瘤、血液疾病等其他可能导致消化道内EoS增多的疾病.
对纳入患者的临床资料进行分析: 年龄、性别、过敏情况(过敏史及血清学检查)、临床表现、实验室检查、影像学检查、内镜表现、病理、治疗及其预后等.
统计学处理 应用SPSS 17.0软件进行数据分析, 计量资料以mean±SD表示.
本研究共收集到于郑州大学第一附属医院2013-06/2018-08确诊EG的患者共88名, 男48人, 女40人, 男:女 = 1.2:1, 男性比例略高于女性. 年龄14-73岁, 平均年龄45.1 岁±14.0 岁, 30-50岁患者共计45人, 占51.1%. 既往有过敏史者15人, 占17.0%, 主要为抗菌药物(头孢类、青霉素类、磺胺类等)、中药或中成药、海鲜等. 明确的合并有其他变应性疾病者3人(哮喘1人, 荨麻疹2人). 本研究纳入患者已排除消化道原发肿瘤及转移肿瘤, 另有3人合并有其他系统肿瘤: 膀胱乳头状尿路上皮癌1人, 甲状腺癌术后2人.
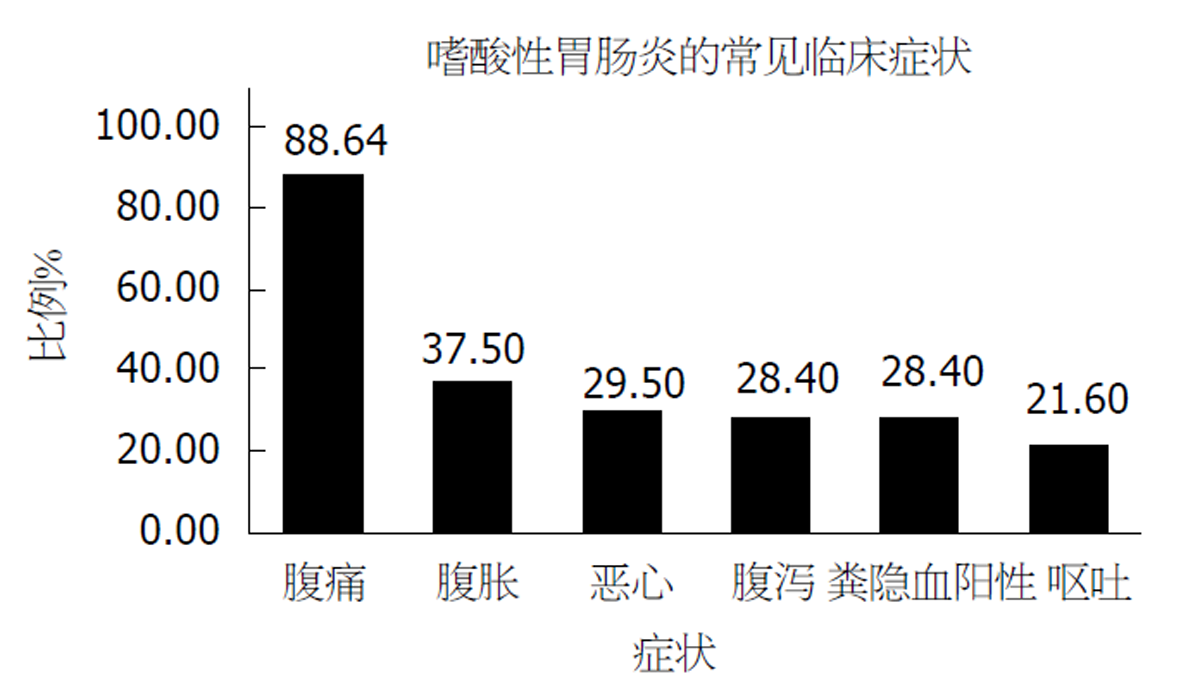
腹痛为最多见症状, 共78人, 占88.6%, 常见为上腹部间断隐痛不适, 多与进食、排便无关, 就诊前腹痛急性加重, 合并有消化性溃疡的患者会出现规律性上腹痛. 其余常见症状有: 腹胀, 恶心, 腹泻, 便血(粪便隐血阳性), 呕吐(图1). 其他伴随症状有反酸、上腹烧灼感、纳差、嗳气、消瘦、发热等. 1例患者最突出临床表现胸痛, 首诊于心内科. 1例患者十二指肠水平段梗阻致严重恶心、呕吐, 就诊于外科行胃空肠吻合术. 另外, 有1例患者有黏液血便, 最初诊断为炎症性肠病.
血常规: 血红蛋白及血小板正常, 多数患者白细胞升高, 以EoS为主, 最大29.66×109/L, 将(0.02-0.52)×109/L作为EoS计数的参考值范围, 88例患者中EoS计数升高的有70人, 占总数79.5%, 平均值(4.72±6.27)×109/L. IgE定量: 共有51人行免疫球蛋白检查, 将(0-240) IU/mL作为IgE的参考值范围, 有11人IgE升高, 占比21.6%, 范围248.7-2500 IU/mL(我院IgE检查最大可达到2500 IU/mL), 中位数为704.9 IU/mL. 过敏原: 共有60人行过敏原筛查, 44人发现异常, 占73.3%, 部分患者有多个过敏原, (表1和表2)食物过敏原中最多为鸡蛋, 其次有大豆、西红柿、小麦、花生、牛奶、蟹, 其他有榛子/开心果、虾等; 呼吸道过敏原中最多见为青霉, 其次有梧桐、榆树、尘螨、狗上皮, 其他阳性过敏原有蟑螂、艾蒿、猫毛、蒲公英、蚊子、烟草屑等. 寄生虫检查仅4例患者异常, 并且均为IgG阳性: 旋毛虫抗体IgG、肺吸虫抗体IgG、弓形虫抗体IgG、囊虫抗体IgG. 共40人行骨髓涂片检查, EoS比例多表现为不同程度升高, 按骨髓涂片中EoS比例4.0%为参考值范围上限, 有37例患者EoS比例增高, 占92.5%, 范围4.8%-72.4%, 涂片均显示EoS形态正常, 分叶核升高为主, 请示血液科会诊后均不考虑血液系统疾病.
| 过敏原 | 阳性(%) |
| 鸡蛋 | 35.00 |
| 大豆 | 13.33 |
| 西红柿 | 13.33 |
| 牛奶 | 11.67 |
| 花生 | 11.67 |
| 小麦 | 11.67 |
| 蟹 | 8.33 |
| 过敏原 | 阳性(%) |
| 点青霉 | 36.67 |
| 梧桐 | 25.00 |
| 榆树 | 20.00 |
| 尘螨 | 18.33 |
| 狗上皮 | 15.00 |
| 蟑螂 | 13.33 |
| 艾蒿 | 8.33 |
| 猫毛 | 6.67 |
| 豚草 | 6.67 |
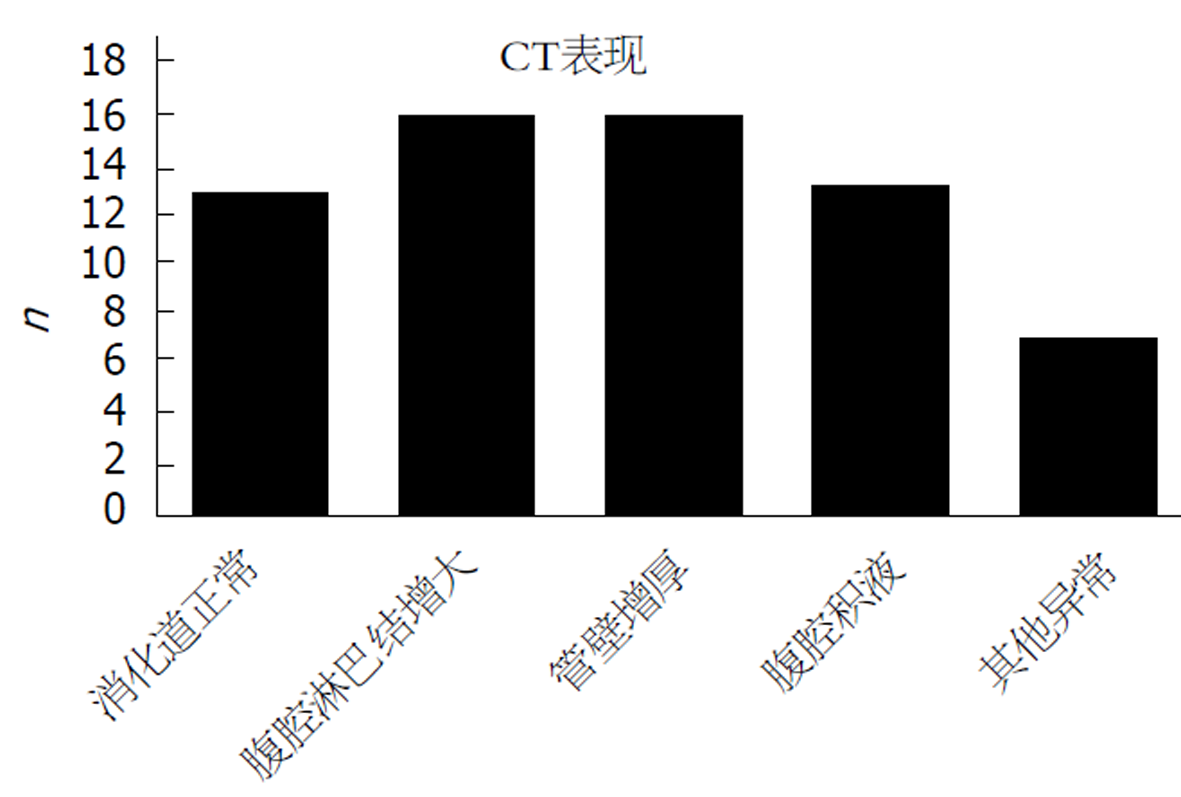
共62人行腹部CT检查, 16例患者存在腹腔淋巴结增大, 肠系膜淋巴结增大最常见(14例), 部分患者腹膜后淋巴结、腹股沟淋巴结、肝胃间及肝门部淋巴结肿大; 16例患者消化道管壁增厚; 发现腹腔积液13人(其中1人合并有右侧少量胸腔积液, 5人提示腹腔大量积液)(图2).其他少见异常有: 肠腔狭窄2人(均位于小肠); 肠管积液/积气1人; 乙状结肠肠腔扩张1人, 直肠末端高密度影1人; 1例CTE提示降结肠、乙状结肠黏膜密度增高; 1例提示右腹部炎性高密度影. 消化道正常共13人(其中8人发现肝囊肿/肝小血管瘤, 脂肪肝1人, 肾囊肿1人, 宫腔积液1人).
行胃镜检查有82人: 胃镜检查阴性有21人, 占25.6%. 胃镜检查发现异常共61人, 最常见异常为充血/红斑样变(共33人, 主要集中在胃、十二指肠); 发现糜烂共30人, 溃疡7人, 胃壁/肠壁水肿6人, 隆起/息肉样变9人, 其中1例表现为痘疮样隆起、顶端糜烂, 另有1例患者胃壁表现为串珠样结节样隆起, 表面糜烂, 十二指肠壁为小结节样隆起. 其他少见胃镜表现有: 黏膜粗糙、颗粒样变等. 另有1例患者内镜提示十二指肠狭窄.
行结肠镜检查有70人, 其中结肠镜正常者43人, 占61.4%. 结肠镜异常共27人: 最常见异常为隆起/息肉样变, 共13人, 其次为糜烂9人, 充血7人, 少见结肠镜表现为: 溃疡、水肿、颗粒样变等.
病理: 88例患者中病理检查行EoS计数的共85人. 胃镜取病理共76人, 结肠镜取病理共61人: 具体分布见表3.
2.6.1 食物剔除: 过敏原检查异常共44例, 嘱患者避免再次进食或接触过敏原. 其中采用食物剔除配合对症治疗(黏膜保护剂、促动力药、消化酶及益生菌)共11人, 治疗后症状改善不明显6人, 转为其他方案治疗, 其余5人症状改善, 其中有1例患者进食鸡蛋后症状再发.
2.6.2 质子泵抑制剂: 质子泵抑制剂(proton pump inhibitor, PPI)治疗有效者15人(病变仅累及上消化道). 予以静脉应用标准剂量PPI, 连续7-10 d, 症状改善, 外周血EoS计数减低. 1例合并有十二指肠溃疡致呕血的患者应用PPI合并生长抑素治疗后溃疡愈合, EoS浸润数量减少.
2.6.3 激素治疗: (1)应用静脉激素者14人, 甲强龙针30-80 mg/d, 连用3-8 d症状缓解后改为等量口服激素治疗, 静脉激素治疗后复查1例大量腹腔积液的患者腹水明显减少, 1例患者右腹部炎性高密度影消失, 1例不完全肠梗阻的患者恢复正常排气排便, 复查发现肠梗阻消失. (2)初始应用甲泼尼龙片口服治疗者10人, 均表现出良好反应, 剂量20-48 mg/d, 每5-10 d减量4 mg, 或者维持初始剂量1 mo后开始减量, 1例患者治疗1月后复查病理提示胃肠道内EoS浸润较前减少. (3)初始应用强的松片口服治疗者41人, 剂量20-40 mg/d, 每5-12 d减量5 mg, 效果良好, 1例大量嗜酸性腹水合并胸水的患者治疗后胸腹水均明显减少. 另有1例患者激素反应良好, 遵医嘱规律服药, 因进食银耳后症状再发, 继续激素治疗得到缓解. 本研究中1例72岁男性患者激素治疗效果良好, 停药后疾病复发再次予以激素治疗, 仍能获得良好反应, 但该患者病情反复发作, 长期反复应用激素治疗, 最终出现严重感染合并感染性休克.
2.6.4 其他治疗方案: 3例患者应用氯雷他定治疗, 症状无明显改善, 转为其他治疗方案.
EG的概念最早是由Kaijser[5]在1937年提出的. 该病最初报道主要来自北美及欧洲, 近年来亚非拉地区开始有越来越多的病例报道, 统计数据来看该病发病率逐渐增多, 并且是发病人数真正的增加, 而非是认识普及导致的报道增多[1,2,6,7]. 根据EoS浸润的深度, 可以分为黏膜型、肌型及浆膜型[8], 称为Klein分型, 常规内镜检查难以对肌层、浆膜层行活检, 因此该病实际发病人数可能更多. 我院资料来看, 2014年诊断EG共15人, 2015年21人, 2016年18人, 2017年18人, 数量变化不大. 该病各年龄段均有发病, 年龄主要集中于30-50岁, 男性发病率高于女性, 比例约为1.5:1[9-11]. 本组研究资料的发病年龄14-73岁, 30-50岁患者占半数以上, 男女比例1.2:1, 与文献报道有一定差异. 有文献显示38%-45%的患者同时合并有其他过敏性疾病, 特别是女性或儿童[11]. 本研究统计的88例患者中3例明确合并有其他过敏性疾病, 比例明显低于文献报道水平, 可能与回顾性研究部分资料不完整有关.
目前该病真正的病因及机制不明, 普遍认为该病是在过敏原刺激下, 经局部免疫介导促使EoS在消化道管壁不同程度浸润并引起消化道症状[1]. 过敏原通过激活T细胞, 后者分化为Th2细胞并释放多种细胞介质: IL-3、IL-5、IL-13和GM-CSF等, 可以促使EoS聚集[12-14]. 过敏原还可以通过刺激B细胞产生IgE, 后者与肥大细胞表面的Fc受体结合, 诱导肥大细胞脱颗粒, 也可促进EoS聚集[15-17]. 本研究中17.0%的患者既往有明确的食物或药物过敏史, 在过敏原检测中有高达73.3%的患者发现异常, 去除过敏原可以缓解症状, 再次接触致敏食物会复发, 可以认为过敏原在该病的发生、再发过程中起到重要作用. 提示明确过敏原, 并彻底避免其接触是治疗该病的有效手段. 本研究中仍有16人过敏原筛查阴性, 根据文献报道可能是罕见的过敏原或者已经产生耐受[18].
该病的临床表现及EoS浸润部位及深度有关, 累及食管常见症状有吞咽困难[19], 累及胃、小肠时最常见症状为腹痛, 其他有恶心、呕吐、腹泻、梗阻[20,21]、消化道出血、低蛋白血症及营养不良等, 累及结肠时可出现腹痛、腹泻、便血[3,22]等. 黏膜型主要为腹痛、腹泻、消化道出血、营养不良、低蛋白血症及贫血; 肌型表现为食管狭窄、胃肠道梗阻; 浆膜型主要表现为腹膜炎及特征性腹水. 从本研究来看, 最常见表现为腹痛, 其次有腹胀、恶心、腹泻、便血、呕吐等, 临床症状不典型. 少见的有以胸痛为首发症状的患者, 临床工作中应当与心脏、肺部疾病相鉴别.
从实验室检查来看, 有统计发现70%-80%的患者外周血EoS比例及数量增多[1]. 本研究统计数据显示79.5%的患者外周血EoS计数升高, 与报道相符, 并且部分患者治疗后外周血EoS计数减低, 提示外周血EoS水平可以用于辅助诊断及评估治疗效果. 根据目前推测的发病机制来看, 该病与IgE密切相关, 但本研究显示仅21.6%的患者血清IgE升高, 大部分患者IgE正常, 一方面提示IgE并非该病的血清标志物, 另一方面提示该病的发生可能存在其他机制. 本研究发现, 多数患者骨髓涂片可见EoS比值增高, 细胞形态及大小正常, 不存在异型性, 骨髓液涂片可以作为支持诊断及鉴别诊断的依据. 特别应注意与高EoS综合征相鉴别, 该病可导致多系统损害, 累及消化道表现可出现类似EG的症状及病理学表现, 区别在于该病病情进展快、病死率高、预后差[23,24], 临床工作应当注意.
尽管内镜表现缺乏特异性, 内镜检查仍是诊断该病的重要一步. 根据本研究来看有大约1/4的患者胃镜正常, 半数以上的患者结肠镜正常. 常见内镜异常主要有充血、糜烂、溃疡、息肉等. 诊断主要依赖病理学检查. 活检组织内大量EoS浸润是诊断的主要条件, 因而确定消化道内正常存在的EoS数量十分必要. 一项纳入33例健康志愿者的研究显示, 正常食管未发现EoS, 自胃至盲肠, 数量逐渐增多, 盲肠至直肠数量逐渐减低[25]. 一项在亚洲健康人群中的研究结论基本一致: 食管(0.07±0.43)/HPF, 胃(12.18±11.39)/HPF, 右结肠(36.59±15.50)/HPF, 左结肠(8.53±7.83)/HPF[26]. 目前诊断标准为食管黏膜中最密集部位应≥15/HPF[1], 胃肠道无统一标准, 目前最常使用的诊断标准为≥20/HPF, 也有学者认为将标准定为>30/HPF或者高于正常值的2倍, 甚至更高, 或者根据消化道不同区域制定不同的界值[27]. 本研究发现胃镜活检十二指肠球部及降部EoS平均值高, 结肠镜下回肠末端及回盲部EoS平均值高, 一方面可以认为该病更易累及上述部位, 活检发现EoS大量浸润的可能性更高, 另一方面可能是受到人体消化道正常EoS分布的影响. 本研究认为在当前诊断标准下, 在上述部位活检不容易漏诊, 但分区域设定病理诊断界值会更有意义.
治疗方面, 有报道称3/4的患者通过6种食物剔除(奶、豆类、小麦、蛋、坚果、鱼)可以诱发组织学缓解, 4种食物剔除(奶、豆类、小麦、蛋)可以让半数患者缓解[1]. 尽管经验性食物剔除治疗可能是一种治疗的有效手段, 往往患者依从性差, 合并营养成分缺乏, 一旦再次接触致敏食物后很快再次复发, 饮食治疗的最终目的应该确定具体何种成分会诱发该病, 并单纯针对这类食物进行剔除[28]. 本研究根据患者过敏史及过敏原检查结果, 制定个体化的食物剔除方案, 仍然有一定效果, 可作为轻症患者的首选方案. PPI反应性食管EoS增多症(PPI-REE)在免疫及分子生物学特征方面与EG相似, 目前认为这是嗜酸性食管炎的一个亚类. 根据本研究结果, PPI对累及食管、胃的患者有效, 可以缓解症状, 部分患者可以达到组织学缓解. 但有研究报道长期应用可以维持缓解, 但停药会出现组织学或者症状学的复发[29,30]. 目前糖皮质激素是治疗该病的主要药物, 本研究显示激素应用后患者症状迅速改善, 同时也发现部分患者病情易反复. 目前激素用量尚无统一意见. 长期大量全身激素应用可以带来多种不良后果: 骨质疏松、股骨头坏死、感染等, 本研究有1例患者因病情反复, 长期应用大量激素, 最终出现严重感染、感染性休克. 在治疗过程中, 应警惕激素可能带来的副作用.
科学发展带来了很多新型治疗方案, 有文献报道单克隆抗体[Benralizumab、Mepolizumab(美泊利单抗)、Reslizumab、Vedolizumab(维多珠单抗)等][31,32], 粪菌移植[33]等对该病也有效果.
总之, EG是一种以消化道内EoS浸润为主要特征的消化道疾病, 腹痛为最常见临床表现, 多数患者实验室检查可发现外周血EoS计数、骨髓涂片中的EoS比例升高, 这可以辅助诊断. 该病内镜表现不特异, 部分患者内镜表现正常. 病理发现EoS大量浸润为主要诊断依据(食管≥15/HPF, 胃肠≥20/HPF), 十二指肠球部降部、回肠末端及回盲部活检更易得到阳性结果. 该病主要呈慢性病程, 易反复发作, 全身应用糖皮质激素治疗快速、有效, 但长期不良反应多. PPI和食物剔除对部分患者有效. 相信随着基础研究的深入和临床医师的重视, EGID患者会得到更好的诊治.
嗜酸性胃肠炎(eosinophilic gastroenteritis, EG)的概念已有80余年的历史, 近几年来随着该病发病人数的增多及临床医师意识的提高, 相关病例报道也逐年增多. 然而该病病因及发病机制, 诊断标准和治疗方法仍有很多争议. 尽管有食物剔除、糖皮质激素治疗、质子泵抑制剂(proton pump inhibitor, PPI)治疗等多种治疗方案, 该病易反复发作的特性严重影响患者的日常生活及治疗依从性. 大样本的病例分析可以更好的总结该病的临床特点, 从而为该病的诊治提供有价值的临床资料.
本文主要研究EG的临床特点及治疗方案, 拟探讨该病的发病因素、总结临床表现的特点、归纳检验检查结果的共同点, 以协助明确该病的发病机制, 确立该病的诊治标准.
本研究主要目标: 总结嗜酸性胃肠道疾病患者的临床特点, 包括性别、年龄、过敏史、其他变应性疾病合并情况、临床症状、外周血嗜酸性粒细胞(eosinophilic granulocyte, EoS)计数、血清IgE水平、骨髓涂片结果、腹部CT、内镜表现、病理结果、治疗手段及预后. 通过回顾性研究, 基本完成了上述目标, 对该病的临床诊治起到一定的指导作用.
本研究搜集过去5年于郑州大学第一附属医院确诊为EG的患者, 共计88例, 通过回顾性分析, 总结患者的临床特点. 数据处理采用SPSS 17.0软件.
本研究达到预期目标. EG患者男性略多于女性, 比例1.2:1, 平均年龄45.1 岁±14.0 岁, 30-50岁患者占半数以上. 腹痛为最常见临床症状. 约80%的患者外周血EoS计数升高. 20%左右的患者血清IgE水平升高. 过敏原检测有70%以上存在异常, 鸡蛋为最常见食物过敏原. 90%以上的患者骨髓涂片可见EoS比例升高, 但形态正常. 腹部影像学检查发现腹腔淋巴结增大、消化道管壁增厚以及腹腔积液最常见. 内镜表现无特异性, 部分患者内镜阴性发现. 病理检查可见EoS可累及消化道各处, 胃镜下十二指肠活检发现异常的可能性大, 结肠镜下回盲部活检发现异常的可能性大. 食物剔除、PPI应用及口服激素都是该病的有效治疗手段.
EG临床症状、影像学及内镜检查均无特异性, 病理活检意义最大. 该病可累及胃肠道各处, 本研究发现十二指肠及回盲部取活检发现异常的比例更高, 提示对于临床上高度怀疑EG的患者在上述部位留取活检可能阳性率更高. PPI反应性食管EoS增多症现已成为EG的一个亚类, PPI可以用于嗜酸性胃炎的患者, 根据我院数据, PPI对于大约17%的患者有效. 经验性食物剔除或目标性食物剔除有一定应用价值, 就我院数据来看, 效果不佳. 口服激素治疗最普遍, 可以快速有效的控制病情, 但病情易反复, 长期激素治疗会带来严重不良后果.
本研究属于回顾性研究, 统计结果可能存在偏倚. 未来可以采用前瞻性的研究方法, 获得更详实的数据, 并且在治疗方面采用安慰剂做对照以及盲法, 可以更有效的评估治疗效果. 目前有文献报道部分单克隆抗体对治疗EG有效, 粪菌移植也有一定价值, 未来会有更丰富、更有效的治疗方案可供临床医师选择.
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Lucendo AJ, Molina-Infante J, Arias Á, von Arnim U, Bredenoord AJ, Bussmann C, Amil Dias J, Bove M, González-Cervera J, Larsson H, Miehlke S, Papadopoulou A, Rodríguez-Sánchez J, Ravelli A, Ronkainen J, Santander C, Schoepfer AM, Storr MA, Terreehorst I, Straumann A, Attwood SE. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017;5:335-358. [PubMed] [DOI] |
| 2. | Hruz P, Straumann A, Bussmann C, Heer P, Simon HU, Zwahlen M, Beglinger C, Schoepfer AM; Swiss EoE study group. Escalating incidence of eosinophilic esophagitis: a 20-year prospective, population-based study in Olten County, Switzerland. J Allergy Clin Immunol. 2011;128:1349-1350.e5. [PubMed] [DOI] |
| 3. | Steinbach EC, Hernandez M, Dellon ES. Eosinophilic Esophagitis and the Eosinophilic Gastrointestinal Diseases: Approach to Diagnosis and Management. J Allergy Clin Immunol Pract. 2018;6:1483-1495. [PubMed] [DOI] |
| 4. | Ishihara S, Kinoshita Y, Schoepfer A. Eosinophilic Esophagitis, Eosinophilic Gastroenteritis, and Eosinophilic Colitis: Common Mechanisms and Differences between East and West. Inflamm Intest Dis. 2016;1:63-69. [PubMed] [DOI] |
| 5. | Tien FM, Wu JF, Jeng YM, Hsu HY, Ni YH, Chang MH, Lin DT, Chen HL. Clinical features and treatment responses of children with eosinophilic gastroenteritis. Pediatr Neonatol. 2011;52:272-278. [PubMed] [DOI] |
| 6. | Ballou S, Taft T, Keefer L. Disease-specific self-efficacy in the eosinophilic gastrointestinal disorders. J Health Psychol. 2015;20:1027-1036. [PubMed] [DOI] |
| 7. | Ferreira CT, Vieira MC, Furuta GT, Barros FCLF, Chehade M. Eosinophilic esophagitis-Where are we today? J Pediatr (Rio J). 2018;. [PubMed] [DOI] |
| 8. | Klein NC, Hargrove RL, Sleisenger MH, Jeffries GH. Eosinophilic gastroenteritis. Medicine (Baltimore). 1970;49:299-319. [PubMed] |
| 9. | Spergel JM, Book WM, Mays E, Song L, Shah SS, Talley NJ, Bonis PA. Variation in prevalence, diagnostic criteria, and initial management options for eosinophilic gastrointestinal diseases in the United States. J Pediatr Gastroenterol Nutr. 2011;52:300-306. [PubMed] [DOI] |
| 10. | Cianferoni A, Spergel JM. Eosinophilic Esophagitis and Gastroenteritis. Curr Allergy Asthma Rep. 2015;15:58. [PubMed] [DOI] |
| 11. | Jensen ET, Martin CF, Kappelman MD, Dellon ES. Prevalence of Eosinophilic Gastritis, Gastroenteritis, and Colitis: Estimates From a National Administrative Database. J Pediatr Gastroenterol Nutr. 2016;62:36-42. [PubMed] [DOI] |
| 12. | Gupte AR, Draganov PV. Eosinophilic esophagitis. World J Gastroenterol. 2009;15:17-24. [PubMed] |
| 13. | Shukla A, Mishra A, Venkateshaiah SU, Manohar M, Mahadevappa CP, Mishra A. Elements Involved In Promoting Eosinophilic Gastrointestinal Disorders. J Genet Syndr Gene Ther. 2015;6. [PubMed] [DOI] |
| 14. | Blanchard C, Mingler MK, Vicario M, Abonia JP, Wu YY, Lu TX, Collins MH, Putnam PE, Wells SI, Rothenberg ME. IL-13 involvement in eosinophilic esophagitis: transcriptome analysis and reversibility with glucocorticoids. J Allergy Clin Immunol. 2007;120:1292-1300. [PubMed] [DOI] |
| 15. | Straumann A, Bauer M, Fischer B, Blaser K, Simon HU. Idiopathic eosinophilic esophagitis is associated with a T(H)2-type allergic inflammatory response. J Allergy Clin Immunol. 2001;108:954-961. [PubMed] [DOI] |
| 16. | Nanagas VC, Kovalszki A. Gastrointestinal Manifestations of Hypereosinophilic Syndromes and Mast Cell Disorders: a Comprehensive Review. Clin Rev Allergy Immunol. 2018;. [PubMed] [DOI] |
| 17. | Mishra A. Significance of Mouse Models in Dissecting the Mechanism of Human Eosinophilic Gastrointestinal Diseases (EGID). J Gastroenterol Hepatol Res. 2013;2:845-853. [PubMed] [DOI] |
| 18. | Ishimura N, Furuta K, Sato S, Ishihara S, Kinoshita Y. Limited role of allergy testing in patients with eosinophilic gastrointestinal disorders. J Gastroenterol Hepatol. 2013;28:1306-1313. [PubMed] [DOI] |
| 20. | 王 志勇, 吴 建良, 孙 丽伟, 郭 赟, 付 金龙. 以幽门梗阻为首发表现的嗜酸粒细胞性胃炎1例并文献复习. 第二十四届全国中西医结合消化系统疾病学术会议论文集. 2012;420-420. |
| 22. | Hirano I. How to Approach a Patient With Eosinophilic Esophagitis. Gastroenterology. 2018;155:601-606. [PubMed] [DOI] |
| 23. | Kim HP, Dellon ES. An Evolving Approach to the Diagnosis of Eosinophilic Esophagitis. Gastroenterol Hepatol (NY). 2018;14:358-366. [PubMed] |
| 25. | Talley NJ, Shorter RG, Phillips SF, Zinsmeister AR. Eosinophilic gastroenteritis: a clinicopathological study of patients with disease of the mucosa, muscle layer, and subserosal tissues. Gut. 1990;31:54-58. [PubMed] |
| 26. | Mehta P, Furuta GT. Eosinophils in Gastrointestinal Disorders: Eosinophilic Gastrointestinal Diseases, Celiac Disease, Inflammatory Bowel Diseases, and Parasitic Infections. Immunol Allergy Clin North Am. 2015;35:413-437. [PubMed] [DOI] |
| 27. | Baek MS, Mok YM, Han WC, Kim YS. A patient with eosinophilic gastroenteritis presenting with acute pancreatitis and ascites. Gut Liver. 2014;8:224-227. [PubMed] [DOI] |
| 28. | Lucendo AJ, Arias A. Treatment of adult eosinophilic esophagitis with diet. Dig Dis. 2014;32:120-125. [PubMed] [DOI] |
| 29. | Molina-Infante J, Ferrando-Lamana L, Ripoll C, Hernandez-Alonso M, Mateos JM, Fernandez-Bermejo M, Dueñas C, Fernandez-Gonzalez N, Quintana EM, Gonzalez-Nuñez MA. Esophageal eosinophilic infiltration responds to proton pump inhibition in most adults. Clin Gastroenterol Hepatol. 2011;9:110-117. [PubMed] [DOI] |
| 30. | Gutiérrez-Junquera C, Fernández-Fernández S, Cilleruelo ML, Rayo A, Román E. The Role of Proton Pump Inhibitors in the Management of Pediatric Eosinophilic Esophagitis. Front Pediatr. 2018;6:119. [PubMed] [DOI] |
| 31. | Wechsler JB, Hirano I. Biological therapies for eosinophilic gastrointestinal diseases. J Allergy Clin Immunol. 2018;142:24-31.e2. [PubMed] [DOI] |
| 32. | Kim HP, Reed CC, Herfarth HH, Dellon ES. Vedolizumab Treatment May Reduce Steroid Burden and Improve Histology in Patients With Eosinophilic Gastroenteritis. Clin Gastroenterol Hepatol. 2018;16:1992-1994. [PubMed] [DOI] |
| 33. | Dai YX, Shi CB, Cui BT, Wang M, Ji GZ, Zhang FM. Fecal microbiota transplantation and prednisone for severe eosinophilic gastroenteritis. World J Gastroenterol. 2014;20:16368-16371. [PubMed] [DOI] |