修回日期: 2019-08-16
接受日期: 2019-09-02
在线出版日期: 2019-09-08
FHL2是一种参与信号转导和基因转录的支架蛋白, 具有FHL蛋白典型的结构特征. FHL2含有四个半LIM结构域, 不同的LIM结构域可以与不同的蛋白质结合, 从而激活或者抑制转录因子如P53、血清应答因子等的活性, 进而影响肿瘤的发生发展. 既往研究发现, FHL2在肿瘤发生发展中具有复杂的生物学作用, 在不同类型肿瘤中发挥促癌或抑癌的作用. 本文就FHL2在消化系统恶性肿瘤中的研究进展作一概述.
核心提要: FHL2是一种重要的支架蛋白, 本文主要研究FHL2在消化系统恶性肿瘤中的表达. 目前已知FHL2在结直肠癌、胃癌、胰腺癌、胆管癌中高表达, 在肝癌中低表达, 而在食管癌中没有研究. 食管癌发病率高, 研究FHL2在食管癌中的表达有一定的临床意义.
引文著录: 朱翠翠, 康海锋, 仇建伟, 钱俊波, 刘宏斌, 张冬梅. FHL2在消化系统恶性肿瘤中的研究进展. 世界华人消化杂志 2019; 27(17): 1083-1087
Revised: August 16, 2019
Accepted: September 2, 2019
Published online: September 8, 2019
FHL2 is a scaffold protein that regulates signal transduction and gene transcription, and it has typical structural features of FHL proteins. Each FHL protein contains four half-LIM domains, and different LIM domains can bind to different proteins, which can activate or inhibit the activities of transcription factors such as P53 and serum response factors, and then influences the development of tumors. Previous studies have found that FHL2 has a complex biological role in tumorigenesis, and may promote or suppress tumor development in different types of tumors. In this article, we review the role of FHL2 in digestive system malignancies.
- Citation: Zhu CC, Kang HF, Qiu JW, Qian JB, Liu HB, Zhang DM. Role of FHL2 in digestive system malignancies. Shijie Huaren Xiaohua Zazhi 2019; 27(17): 1083-1087
- URL: https://www.wjgnet.com/1009-3079/full/v27/i17/1083.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v27.i17.1083
近年来, 全球恶性肿瘤的总体发病率呈逐年上升趋势, 而我国恶性肿瘤的发病率以年均3%-5%的速度增长, 其中消化系统恶性肿瘤表现尤为明显[1]. 食管癌、胃癌、肝癌、结直肠癌这四种消化系统恶性肿瘤占前十位恶性肿瘤死亡总数的40.75%[2]. 随着我国内镜、手术、放化疗等治疗手段的不断进步, 消化系统恶性肿瘤患者的预后已得到了很大的改善, 但是整体预后仍不理想, 死亡率仍居高不下, 因此我们有必要来探索消化系统恶性肿瘤的潜在生物标志物和治疗靶点. 恶性肿瘤的发病机制包括原癌基因的激活、抑癌基因的失活、凋亡调控基因与DNA修复基因的异常等. FHL2作为重要的细胞增殖、凋亡、分化调节蛋白, 与恶性肿瘤的关系逐渐受到关注, 其在宫颈癌[3]、舌鳞状细胞癌[4]、白血病[5,6]、胶质母细胞瘤[7]等恶性肿瘤中均有相关研究, 本文主要阐述FHL2在消化系统恶性肿瘤中的表达及功能.
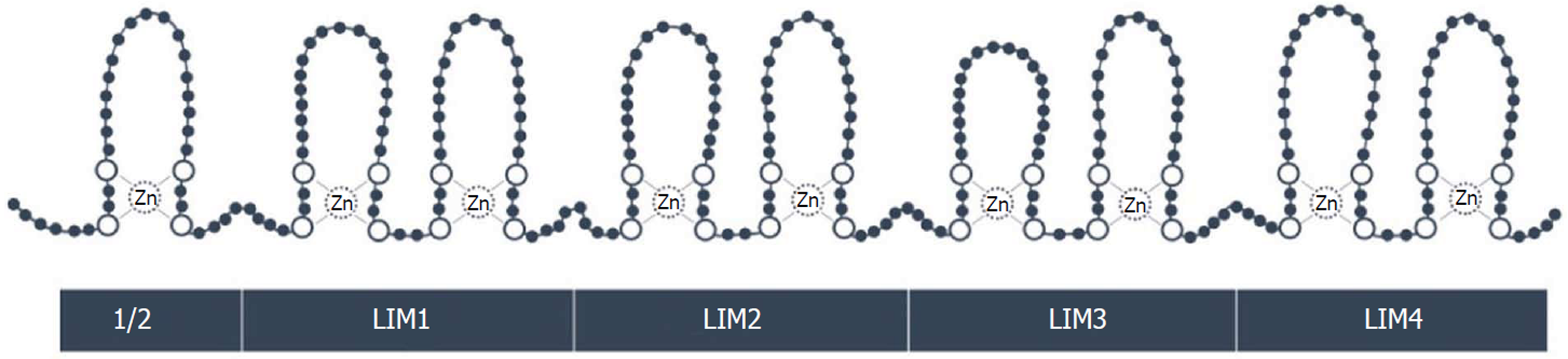
FHL蛋白家族共发现5个成员: FHL1、FHL2、FHL3、FHL4和FHL5, 其中FHL1、FHL2在不同的组织中均有表达, 目前发现FHL1、FHL2、FHL3主要在肌肉中表达, FHL4和FHL5只在睾丸中表达, 其中以FHL2研究最为深入[8]. FHL2是FHL蛋白家族的第二个成员, 又称为DRAL或SLIM3, 该蛋白由fhl2基因编码, 定位于染色体2q12-14的区域, 由7个外显子和6个内含子组成, 其中前3个外显子为非编码序列, 后4个外显子为编码序列, 被翻译成279个氨基酸的蛋白质[9]. 该基因有两种启动子, 分别为启动子1a和启动子1b, 启动子1a调控fhl2转录变异体4, 启动子1b调控转录变异体1、2、3、5, 其中启动子1b的活性显著高于1a[10]. FHL2相对分子量仅有32 kDa, 由四个半富含半胱氨酸的LIM结构域构成(图1), 这种独特的结构可以与50多种不同的蛋白质分子相互作用, 发挥衔接蛋白或支架蛋白的作用, 参与调节信号转导, 细胞存活, 运动与粘附等进程[11-17].
FHL2作为衔接子或支架蛋白参与调节多个细胞内信号通路和基因转录, 发挥重要的生物学功能. FHL2在体内受许多肿瘤相关因子的调控, 目前已知的有p53、血清反应因子(serum response factors, SRF)、细胞外信号调节激酶2(extracellular regulated protein kinases, ERK2)、周期蛋白D1(cyclin D1)等[9]. FHL2蛋白定位于黏着斑、细胞质和细胞核中, fhl2基因启动子区含有抑癌基因p53作用位点, p53的表达可激活fhl2基因的转录, 这主要是通过启动子1a来完成的[9]. 在恶性肿瘤中, FHL2具有组织依赖或细胞依赖性, 在不同的组织或细胞中所发挥的作用不同, 引起的效应也不同. FHL2这种双重性质的主要原因是FHL2可以作为多种转录因子的转录共激活因子促进雄激素受体、AP-1、CREB、BRCA1和WT-1等的活性, 也可作为多种转录因子的转录共抑制因子抑制ERK2、PLZF、Nur77、E4F1、FOXO1等的活性[3]. FHL2蛋白含有磷酸化位点和糖基化位点, 但目前关于FHL2翻译后修饰和突变仍是个谜. 此外, FHL2还可以参与Rho信号途径、Wnt信号途径等.
Wang等[18]通过免疫印迹和免疫组织化学检测了15例结直肠癌患者和15例正常患者, 研究发现, 与癌旁组织相比, FHL2在结直肠癌中表达显著增高. Verset等[19]通过免疫组织化学检测了296结直肠癌患者, 结果证实了FHL2高表达与结直肠癌手术患者的总体生存率、淋巴转移相关[20]. 这是由于FHL2在上皮-间质转化(epithelial to mesenchymal transition, EMT)中发挥了关键作用.
转化生长因子-β(transforming growth factor-β, TGF-β)是一种EMT诱导剂, 可促进FHL2和波形蛋白(vimentin)的表达, 抑制E-钙粘蛋白(E-cadherin)的表达[17]. 其中TGF-β1是促进结直肠癌侵袭的信号分子, 诱导EMT的发生[21]. 进一步研究发现Krüppel样转录因子8(Krüppel-like factor 8, KLF8)是FHL2的转录因子: TGF-β1可通过刺激转录因子KLF8诱导FHL2的表达, 即FHL2表达受TGF-β1的正向调控, 促进结直肠癌细胞的增殖及EMT, 这可能是结直肠癌侵袭和转移的主要调控机制[21]. FHL2 siRNA转染的SW480细胞中显示E-cadherin高表达, 而Vimentin、MMP-9、twist和Snail为低表达, 但是在DLD1中诱导FHL2的过表达时, 却获得了相反的结果[17]. 转录因子Snail1是EMT过程中的主要调节因子之一, 可抑制E-cadherin并在几种肿瘤类型中过表达[22]. 研究发现FHL2与Snail1相互作用, 促进Snail核积聚, 进而调节结直肠癌中E-cadherin的转录表达[23]. FHL2也能够与β-连环蛋白相互作用, 在结肠癌细胞中FHL2能够通过阻止其磷酸化介导的降解来诱导β-连环蛋白的核积累[17].
此外, FHL2的高表达对结直肠癌细胞维持其恶性表型是必需的: 抑制Lovo结直肠癌细胞中的FHL2表达可诱导细胞分化, 抑制原癌基因(survivin, cox-2, hTERT, c-jun等)转录, 抑制肿瘤细胞体外增殖活性及体内致癌能力[18]. FHL2在结直肠细胞系HT-29中过表达时, 可导致细胞周期的停滞[21]. 然而, 当在HT29中建立FHL2的过表达时, 发现与对照组相比, 促进E-钙粘蛋白表达, 抑制FHL2表达细胞的增殖[24]. 因此, FHL2在结直肠癌细胞系中作为诱导细胞分化的癌基因发挥作用[21].
另一方面, FHL2也可通过调节蛋白质复合物的磷酸化状态来抑制膜相关E-钙粘蛋白-β-连环蛋白复合物的形成. 膜相关的E-钙粘蛋白-β-连环蛋白复合物的结构完整性是诱导EMT的重要决定因素, 这就阐明了FHL2在癌症迁移和侵袭中的作用[21].
FHL2在胃癌组织中呈现高表达, 发挥癌基因活性作用. 刘霖[25]采用了免疫组化染色法检测了41例胃癌患者和36例慢性胃炎患者的胃黏膜组织中的FHL2蛋白的表达情况, 结果显示胃癌组织中FHL2的表达阳性率达到85.4%, 显著高于对照组慢性胃炎组织(P<0.05), 结果提示FHL2蛋白过表达与胃癌发生发展密切相关.
在胃癌AGS细胞系中, FHL2可以与XIAP相关因子1(X-linked inhibitor of apoptosis protein-associated factor 1, XAF1)相互作用, 其中XAF1被称为肿瘤抑制因子, 位于N末端的锌指簇是唯一的结构域结构. Zhang等[26]使用酵母双杂交系统检测发现, 肿瘤抑制因子XAF1和FHL2相互作用,认为FHL2是XAF1的结合蛋白, 且发现XAF1可通过降低TCF/β-连环蛋白转录复合物启动子的活性从而降低FHL2的转录活性.
与结直肠癌相反, FHL2蛋白在肝细胞癌组织及细胞株中均呈现低表达[27]. 在肝癌细胞Hep3B中, 过表达FHL2可下调cyclin D1、促进p21和p27表达, 导致细胞周期阻滞、细胞运动的降低和细胞凋亡的抑制. 此外, 过表达FHL2可通过抑制EMT而减弱细胞迁移、侵袭, 进一步发现FHL2在抑制肝癌细胞增殖的同时也可对抗多柔比星诱导的细胞凋亡[27]. Ding等[28]在HepG2肝癌细胞中同样证实了FHL2的这种抗增殖的特性, 且发现FHL2通过酪蛋白激酶1/Smad通路促进抑癌基因p21转录、抑制原癌基因c-myc表达, 进而发挥抑癌作用.
FHL2在肝癌细胞中表现出抗增殖的特性, 同时又发挥抗凋亡功能, 这种维持稳态的双向调控作用在FHL2转基因小鼠中得到更为直观的体现. Apo-FHL2小鼠模型显示肝脏中FHL2转录水平较野生型增加11至17倍, 通过诱导肝细胞增殖和凋亡而加速肝细胞转换使得肝脏大小基本正常. Apo-FHL2小鼠肝细胞促增殖基因cyclin D1及促凋亡基因p53同时出现高表达水平, 肝脏部分切除术后再生能力加快. 上调FHL2后发现炎症及肝硬化指标均明显增加. 虽然Apo-FHL2小鼠没有自发肿瘤, 但在合并其他易感基因累积突变情况下, 致肝癌风险增加[29].
FHL2蛋白在胰腺导管腺癌组织中高表达. 与癌旁组织相比, 胰腺癌组织内有高水平FHL2 mRNA; 免疫组织化学证实FHL2主要定位于细胞质和细胞核. 敲除FHL2可抑制胰腺癌细胞存活、增殖及放射抗性, 促进细胞凋亡. 与此同时, FHL2缺失可致细胞内MEK/ERK信号传导增强, 且可强烈诱导cyclin D1, cyclin E, cyclin A和cyclin B1的表达; 联合敲除FHL2和MEK1对于胰腺癌细胞恶性表型的抑制效果好于单独FHL2的缺失, 表明MEK1位于FHL2调控通路的下游[14]. KRAS突变常见于胰腺导管腺癌[30,31]. 然而, 目前尚缺乏FHL2参与KRAS信号传导的相关数据.
FHL2在胆管癌细胞中高表达. 用免疫组织化学方法检测了35例胆管癌组织、10例正常胆管黏膜组织中的FHL2蛋白的表达, 在胆管癌组织中FHL2蛋白阳性表达率达91.4%, 显著高于胆管正常黏膜组织的10.0%, 且其阳性表达率随胆管癌的淋巴转移和周围组织浸润深度而增加[32]. 这就提示FHL2可协同Snail1负性调控钙粘蛋白从而促进肿瘤细胞的生物学行为.
FHL2是重要的支架蛋白和衔接蛋白, 通过调节信号转导和基因转录参与细胞黏附、侵袭 、增殖、凋亡以及分化等生理病理过程. 除了上文我们所提及的, FHL2在宫颈癌、舌鳞状细胞癌、急性白血病、胶质母细胞瘤中均为高表达, 即促进肿瘤细胞的增殖、侵袭、转移. 而在神经母细胞瘤中, FHL2通过抑制Id2促进细胞分化, 发挥抑癌活性的作用. 总之, FHL2在不同肿瘤中的表达水平不同, 发挥着促癌或抑癌活性的作用, FHL2这种双重特性可能与其在不同细胞类型中与不同功能的蛋白相互作用有关.
消化系统肿瘤中FHL2既有促癌作用也有抑癌作用, 迄今为止, 没有相关文献报道过FHL2在食管癌中的表达情况. 全球食管癌的发病率位列全部恶性肿瘤的第六位, 死亡率位居第四位, 而我国食管癌占全球的70%以上[33].我国食管癌90%以上病理类型是鳞状细胞癌, FHL2在宫颈鳞癌、舌鳞状细胞癌中均为高表达, 所以我们推断FHL2在食管鳞状细胞癌中的表达可能为高表达, 当然这需要相关实验数据来佐证. 此外, 目前也没有相关文献提及与FHL2相关的外周血的检测, 是否可以通过检测FHL2相关的可溶性分子来间接检测FHL2? 比如FHL2可调节ADAM-17质膜定位, 而后者是一个剪切酶, 可以促进IL-6、EGFR等的脱落, 那么我们是否可以通过检测这些分子来判断食管鳞癌患者的预后? 食管鳞癌患者FHL2蛋白的测定是否可以对治疗方案有帮助还需进一步研究. 综上, 进一步深入研究FHL2在食管鳞状细胞癌中的表达及相关信号通路将有助于阐明FHL2在食管鳞状细胞癌中发生发展的分子机制, 并为食管鳞状细胞癌的临床诊疗提供新的理论依据及潜在分子治疗靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:王禹乔 电编:刘继红
| 3. | Jin X, Jiao X, Jiao J, Zhang T, Cui B. Increased expression of FHL2 promotes tumorigenesis in cervical cancer and is correlated with poor prognosis. Gene. 2018;669:99-106. [PubMed] [DOI] |
| 4. | Wang Q, Wang X, Tian X, Tang R, Xu X. Four and a half LIM domains 2 contributes to the development of human tongue squamous cell carcinoma. J Mol Histol. 2016;47:105-116. [PubMed] [DOI] |
| 5. | Lu W, Yu T, Liu S, Li S, Li S, Liu J, Xu Y, Xing H, Tian Z, Tang K, Rao Q, Wang J, Wang M. FHL2 interacts with iASPP and impacts the biological functions of leukemia cells. Oncotarget. 2017;8:40885-40895. [PubMed] [DOI] |
| 6. | Cheng Z, Dai Y, Pang Y, Jiao Y, Zhao H, Zhang Z, Qin T, Hu N, Zhang Y, Ke X, Chen Y, Wu D, Shi J, Fu L. Enhanced expressions of FHL2 and iASPP predict poor prognosis in acute myeloid leukemia. Cancer Gene Ther. 2019;26:17-25. [PubMed] [DOI] |
| 7. | Sun L, Yu S, Xu H, Zheng Y, Lin J, Wu M, Wang J, Wang A, Lan Q, Furnari F, Cavenee W, Purow B, Li M. FHL2 interacts with EGFR to promote glioblastoma growth. Oncogene. 2018;37:1386-1398. [PubMed] [DOI] |
| 8. | Shi X, Bowlin KM, Garry DJ. Fhl2 interacts with Foxk1 and corepresses Foxo4 activity in myogenic progenitors. Stem Cells. 2010;28:462-469. [PubMed] [DOI] |
| 11. | Xue YL, Meng XQ, Ma LJ, Yuan Z. Plumbagin exhibits an anti-proliferative effect in human osteosarcoma cells by downregulating FHL2 and interfering with Wnt/β-catenin signalling. Oncol Lett. 2016;12:1095-1100. [PubMed] [DOI] |
| 12. | Hua G, He C, Lv X, Fan L, Wang C, Remmenga SW, Rodabaugh KJ, Yang L, Lele SM, Yang P, Karpf AR, Davis JS, Wang C. The four and a half LIM domains 2 (FHL2) regulates ovarian granulosa cell tumor progression via controlling AKT1 transcription. Cell Death Dis. 2016;7:e2297. [PubMed] [DOI] |
| 13. | Yan Q, Zhang W, Wu Y, Wu M, Zhang M, Shi X, Zhao J, Nan Q, Chen Y, Wang L, Cheng T, Li J, Bai Y, Liu S, Wang J. KLF8 promotes tumorigenesis, invasion and metastasis of colorectal cancer cells by transcriptional activation of FHL2. Oncotarget. 2015;6:25402-25417. [PubMed] [DOI] |
| 14. | Zienert E, Eke I, Aust D, Cordes N. LIM-only protein FHL2 critically determines survival and radioresistance of pancreatic cancer cells. Cancer Lett. 2015;364:17-24. [PubMed] [DOI] |
| 15. | Ebrahimian T, Arfa O, Simeone S, Lemarié CA, Lehoux S, Wassmann S. Inhibition of four-and-a-half LIM domain protein-2 increases survival, migratory capacity, and paracrine function of human early outgrowth cells through activation of the sphingosine kinase-1 pathway: implications for endothelial regeneration. Circ Res. 2014;114:114-123. [PubMed] [DOI] |
| 16. | Boateng LR, Bennin D, De Oliveira S, Huttenlocher A. Mammalian Actin-binding Protein-1/Hip-55 Interacts with FHL2 and Negatively Regulates Cell Invasion. J Biol Chem. 2016;291:13987-13998. [PubMed] [DOI] |
| 17. | Zhang W, Jiang B, Guo Z, Sardet C, Zou B, Lam CS, Li J, He M, Lan HY, Pang R, Hung IF, Tan VP, Wang J, Wong BC. Four-and-a-half LIM protein 2 promotes invasive potential and epithelial-mesenchymal transition in colon cancer. Carcinogenesis. 2010;31:1220-1229. [PubMed] [DOI] |
| 18. | Wang J, Yang Y, Xia HH, Gu Q, Lin MC, Jiang B, Peng Y, Li G, An X, Zhang Y, Zhuang Z, Zhang Z, Kung HF, Wong BC. Suppression of FHL2 expression induces cell differentiation and inhibits gastric and colon carcinogenesis. Gastroenterology. 2007;132:1066-1076. [PubMed] [DOI] |
| 19. | Verset L, Tommelein J, Moles Lopez X, Decaestecker C, Mareel M, Bracke M, Salmon I, De Wever O, Demetter P. Epithelial expression of FHL2 is negatively associated with metastasis-free and overall survival in colorectal cancer. Br J Cancer. 2013;109:114-120. [PubMed] [DOI] |
| 20. | Al-Nomani L, Friedrichs J, Schüle R, Büttner R, Friedrichs N. Tumoral expression of nuclear cofactor FHL2 is associated with lymphatic metastasis in sporadic but not in HNPCC-associated colorectal cancer. Pathol Res Pract. 2015;211:171-174. [PubMed] [DOI] |
| 21. | Cao CY, Mok SW, Cheng VW, Tsui SK. The FHL2 regulation in the transcriptional circuitry of human cancers. Gene. 2015;572:1-7. [PubMed] [DOI] |
| 22. | De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression. Nat Rev Cancer. 2013;13:97-110. [PubMed] [DOI] |
| 23. | Zhang W, Wang J, Zou B, Sardet C, Li J, Lam CS, Ng L, Pang R, Hung IF, Tan VP, Jiang B, Wong BC. Four and a half LIM protein 2 (FHL2) negatively regulates the transcription of E-cadherin through interaction with Snail1. Eur J Cancer. 2011;47:121-130. [PubMed] [DOI] |
| 24. | Amann T, Egle Y, Bosserhoff AK, Hellerbrand C. FHL2 suppresses growth and differentiation of the colon cancer cell line HT-29. Oncol Rep. 2010;23:1669-1674. [PubMed] [DOI] |
| 26. | Zhang W, Yang Y, Jiang B, Peng J, Tu S, Sardet C, Zhang Y, Pang R, Hung IF, Tan VP, Lam CS, Wang J, Wong BC. XIAP-associated factor 1 interacts with and attenuates the trans-activity of four and a Half LIM protein 2. Mol Carcinog. 2011;50:199-207. [PubMed] [DOI] |
| 27. | Ng CF, Ng PK, Lui VW, Li J, Chan JY, Fung KP, Ng YK, Lai PB, Tsui SK. FHL2 exhibits anti-proliferative and anti-apoptotic activities in liver cancer cells. Cancer Lett. 2011;304:97-106. [PubMed] [DOI] |
| 28. | Ding L, Wang Z, Yan J, Yang X, Liu A, Qiu W, Zhu J, Han J, Zhang H, Lin J, Cheng L, Qin X, Niu C, Yuan B, Wang X, Zhu C, Zhou Y, Li J, Song H, Huang C, Ye Q. Human four-and-a-half LIM family members suppress tumor cell growth through a TGF-beta-like signaling pathway. J Clin Invest. 2009;119:349-361. [PubMed] [DOI] |
| 29. | Nouët Y, Dahan J, Labalette C, Levillayer F, Julien B, Jouvion G, Cairo S, Vives FL, Ribeiro A, Huerre M, Colnot S, Perret C, Nhieu JT, Tordjmann T, Buendia MA, Wei Y. The four and a half LIM-only protein 2 regulates liver homeostasis and contributes to carcinogenesis. J Hepatol. 2012;57:1029-1036. [PubMed] [DOI] |
| 30. | Reid MD, Saka B, Balci S, Goldblum AS, Adsay NV. Molecular genetics of pancreatic neoplasms and their morphologic correlates: an update on recent advances and potential diagnostic applications. Am J Clin Pathol. 2014;141:168-180. [PubMed] [DOI] |
| 31. | Heestand GM, Kurzrock R. Molecular landscape of pancreatic cancer: implications for current clinical trials. Oncotarget. 2015;6:4553-4561. [PubMed] [DOI] |
| 33. | Li F, Zhu D, Yang Y, Wu K, Zhao S. Overexpression of calcyphosine is associated with poor prognosis in esophageal squamous cell carcinoma. Oncol Lett. 2017;14:6231-6237. [PubMed] [DOI] |