修回日期: 2018-06-06
接受日期: 2018-07-15
在线出版日期: 2018-09-18
肠神经胶质细胞(enteric glial cells, EGCs)是肠神经系统的重要组成部分, 在维持胃肠道功能方面发挥着重要作用. 营养和支持胃肠神经元, 参与胃肠道内神经活动的整合和调节以及参与肠道炎症反应, 直接或间接调节胃肠道运动功能. 研究肠神经胶质细胞对胃肠神经的影响以及在肠道炎症所致胃肠道运动障碍中的作用, 有助于揭示肠神经胶质细胞对胃肠道动力影响的作用机制.在临床上, EGCs具有作为多种胃肠道运动功能障碍性疾病的治疗靶点的应用前景.本文将对EGCs对胃肠道运动功能的影响进行综述.
核心提要: 胃肠道运动受肠神经系统的调节, 胃肠道炎症也影响胃肠道运动功能, 导致运动功能障碍. 肠神经胶质细胞(enteric glial cells, EGCs)具有保护胃肠道肠神经元的作用, 并参与胃肠道炎症反应, 直接或间接调节胃肠道运动功能. EGCs的异常是导致胃肠道运动功能障碍的重要因素之一, 阐明EGCs在胃肠道运动功能中的作用为临床的治疗提供理论依据.
引文著录: 许英, 谢明征, 梁国刚. 肠神经胶质细胞与胃肠道运动功能研究进展. 世界华人消化杂志 2018; 26(26): 1537-1544
Revised: June 6, 2018
Accepted: July 15, 2018
Published online: September 18, 2018
Enteric glial cells (EGCs) are an important part of the enteric nervous system and play an important role in maintaining gastrointestinal function. They can nourish and support gastrointestinal neurons, participate in the integration and regulation of neural activities in the gastrointestinal tract, mediate intestinal inflammation, and directly or indirectly regulate gastrointestinal motor function. Investigating the effect of EGCs on neurons and their role in intestinal inflammation caused by gastrointestinal movement disorders may help to reveal the mechanism underlying the impact of EGCs on gastrointestinal dynamics. In clinical practice, EGCs have the potential to be used as a therapeutic target for various gastrointestinal motor function disorders. This review will summarize current knowledge regarding the effect of EGCs on gastrointestinal motor function.
- Citation: Xu Y, Xie MZ, Liang GG. Enteric glial cells and gastrointestinal motility. Shijie Huaren Xiaohua Zazhi 2018; 26(26): 1537-1544
- URL: https://www.wjgnet.com/1009-3079/full/v26/i26/1537.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i26.1537
肠神经胶质细胞(enteric glial cells, EGCs)是肠神经系统(enteric nervous system, ENS)的重要组成部分. 越来越多的研究表明, EGCs除了具有营养、支持和保护肠神经元的作用外还在胃肠道运动的调节中起着关键性作用[1]. 胃肠道运动功能受多种因素的影响, 主要接受外来的自主神经系统(交感、副交感神经)和存在于胃肠道内的ENS的调节, 且ENS比自主神经系统更为重要[2]. 胃肠道的炎症性疾病会导致胃肠道运动功能障碍. 动物实验研究已经证明了胃肠道黏膜炎症与肠动力之间的关系, 在肠黏膜发生炎症时胃肠动力也会发生改变, 导致胃肠动力减弱[3]. Bassotti等[4]指出溃疡性结肠炎病人肠道动力发生异常, 表现为结肠收缩力减弱、而强力的收缩波增加, 即结肠收缩频率可能増加. 在临床中, 胃肠道运动功能障碍是消化系统疾病最常见的症状, 恢复胃肠道动力也是治疗消化系统疾病的关键. 因此, 深入探讨EGCs对肠神经的保护作用及对胃肠道运动功能的影响, 以及在胃肠道炎症所致的胃肠运动功能障碍中的作用具有重要意义.
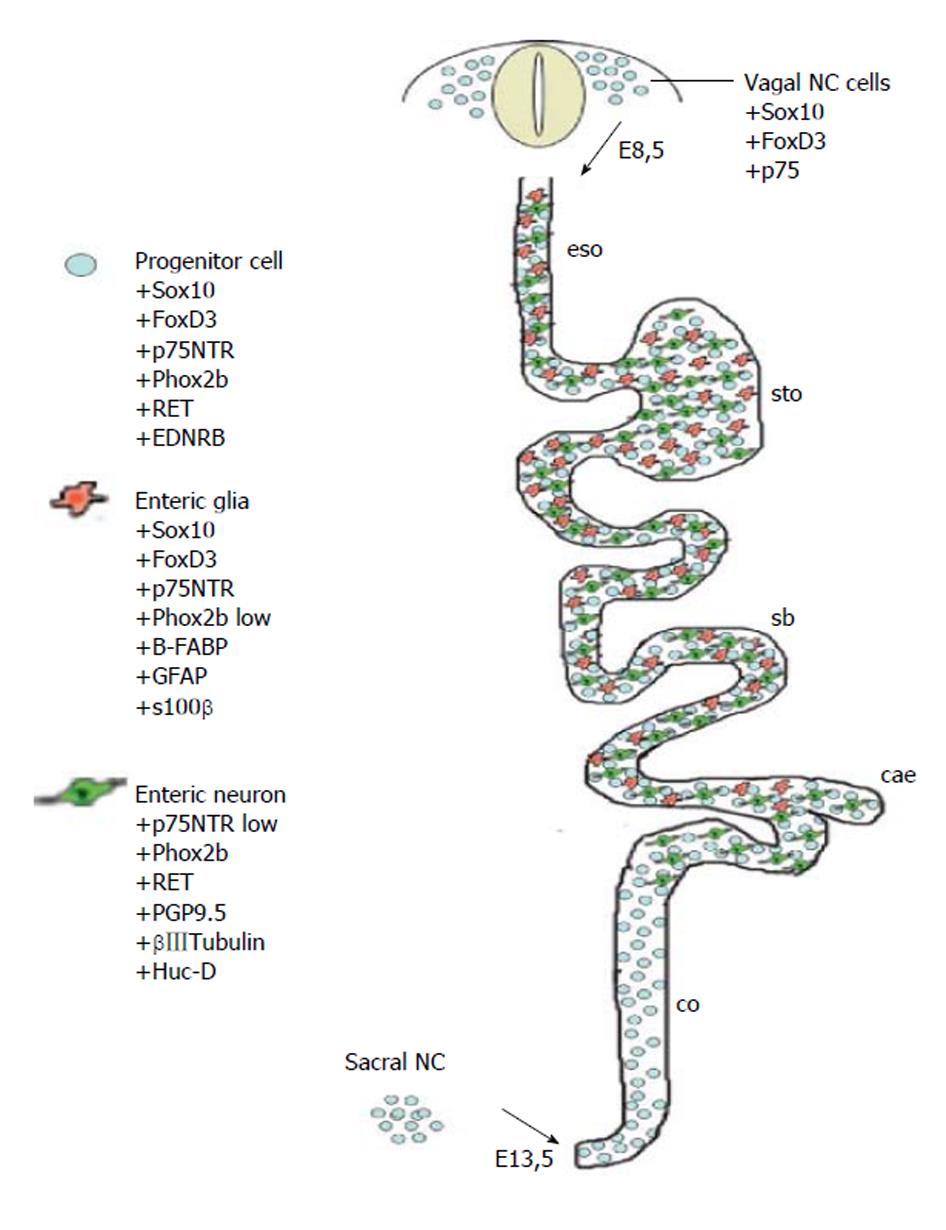
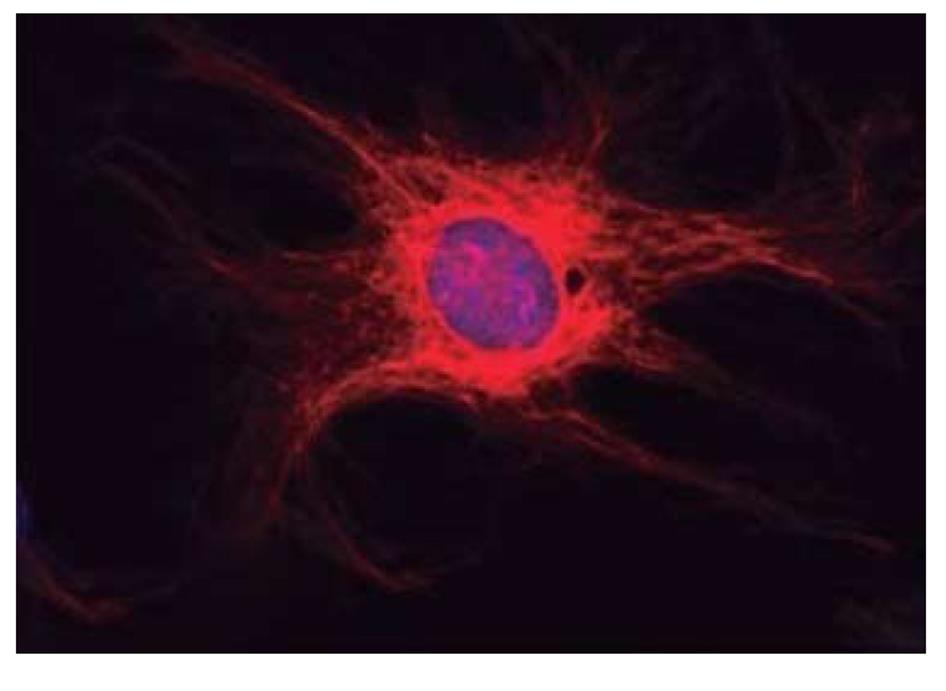
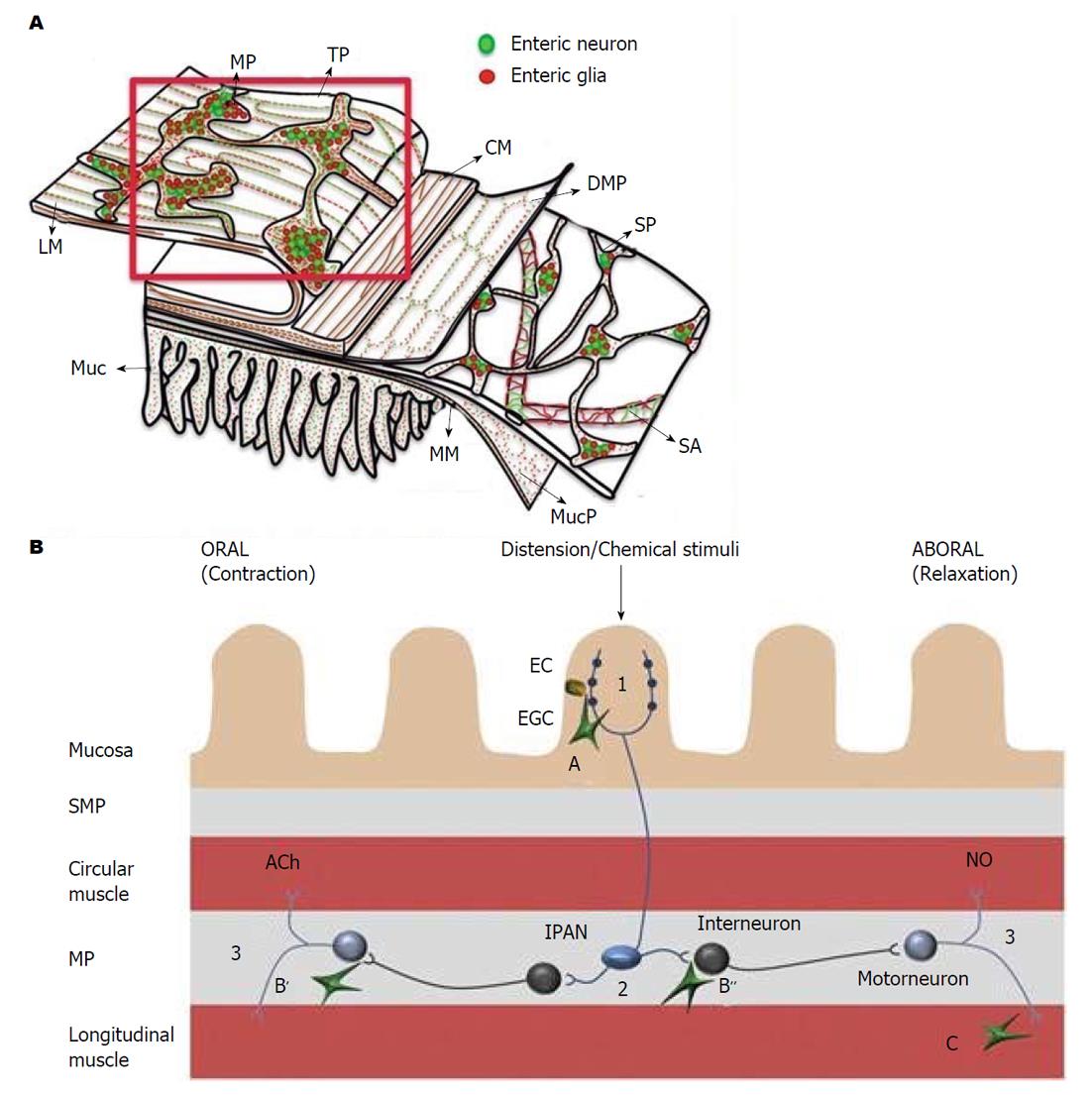
EGCs是ENS的主导细胞之一, 和肠神经元共同组成ENS, 其数量约是肠神经元细胞的4倍, 对ENS的信号传递起着重要的整合作用[5,6]. EGCs分布于肠道的黏膜层、黏膜下神经丛、肌间神经丛和肌层, 肠外也分布于胃黏膜固有层(图1)[7,8]. EGCs伸出多个突起与神经元和EGCs之间相互连接,在整个胃肠道形成广泛的网络结构[9]. 成熟的EGCs表达胶质原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、钙结合蛋白S100β、Sox8/9/10等[10,11]. 通过免疫荧光技术标记GFAP来检测EGCs, 结果显示正常的EGCs胞体内含有大量大小、形状不同的突触, 其围绕着细胞核呈现清晰、连续、细长的形态, 分布在细胞体边缘(图2)[8]. EGCs与中枢神经系统的星形胶质细胞具有相似的形态结构和功能, 但是EGCs不像神经元一样容易兴奋, 它们不产生动作电位, 而是通过形成广泛的连接网络, 利用复杂的钙离子信号来整合微环境中的神经元、胶质细胞、免疫细胞、或其他细胞传递的信息[5,12]. EGCs与胃肠道内的肠神经元、平滑肌细胞和肠上皮细胞相邻,可影响神经网络调控胃肠道运动功能和肠上皮功能并影响胃肠道功能紊乱(图3A和B)[8,13].
EGCs是肠神经系统的重要组成部分, 众多的研究表明EGCs对肠神经元具有保护作用, 能增强肠神经对胃肠道功能的调节作用. Abdo等[14]在神经细胞与EGCs联合培养及EGCs敲除等实验中发现特定敲除EGCs后, 每个神经节上的神经元数量减少. 对其进一步研究发现EGCs对神经的直接保护作用是通过释放还原性谷胱甘肽实现的, 在生理状态下和肠内神经病变疾病中都发挥着重要的作用.还有实验研究发现EGCs也可借助其分泌的胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor, GDNF)发挥对肠神经元的保护的作用[15]. 在胚胎大鼠肠神经与EGCs间接共培养实验中发现EGCs在肠神经元轴突形成和神经元之间突触的连接起着关键性作用, 在缺乏EGCs培养肠神经时发现肠神经元轴突的复杂性和突触的密度明显下降, EGCs对肠神经元发育成熟的调节是通过嘌呤信号P2Y1受体和GDNF依赖信号通路实现的[16]. 将编码GDNF基因的腺病毒载体导入结肠炎的动物模型中, 发现炎症得到控制, 并且对损伤的ENS具有修复作用[17]. Böttner等[18]从神经突触方面研究ENS, 发现GDNF可通过促进神经突触的生长发育及增加突触素的表达来促进ENS的完善. 另外免疫组织和免疫细胞学研究证实胃肠壁内ENS的神经元能够合成和释放许多有神经活性的多肽, 胃肠道运动功能的神经调节可通过这些神经活性肽发挥作用. 研究表明大鼠和人的EGCs可以应答Ach、5-HT、ATP信号并且被激活参与胃肠道运动调节[19]. 存在于胃肠道的ENS对胃肠道运动的调节作用比自主神经系统更为重要, ENS神经元的减少、神经递质的缺乏或过多都会引起胃肠运动功能障碍性疾病的发生, 例如贲门失弛缓症、先天性巨结肠、慢传输型便秘等[20]. EGCs对肠神经的保护作用提高了肠神经对胃肠道运动功能的调节, 同时减轻了神经病变导致的胃肠道运动功能障碍.
胃肠道炎症时, 肠道稳态遭到破坏, 直接或间接影响到胃肠道运动功能, 而胃肠道运动功能障碍会进一步加重肠道炎症反应, 甚至引发全身炎症反应. 最近的一系列研究显示EGCs在炎症性疾病肠道动力的改变中作为一种新兴因素起着重要的作用[21]. 研究发现术后胃肠道炎症反应尤其是炎性介质的作用对术后肠梗阻(postoperative ileus, POI)的持续存在起着关键性作用[22]. POI的持续存在主要取决于肠肌层内的炎症程度. 胃肠道手术可以激活巨噬细胞, 诱发白细胞聚集, 并释放出各种炎性介质和细胞因子, 在多种细胞因子如TNF-a、IL-1、IL-6、IL-8等作用下诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、环氧合酶2(cyclooxygenase-2, COX-2)激活并产生大量的NO、前列腺素等, 对肠道平滑肌产生抑制作用. 这些炎症细胞、炎性介质及细胞因子可相互促进, 引起炎性介质的过度释放产生炎性介质的级联反应, 加速组织器官的损害, 使得术后肠梗阻持续存在[6]. 在细菌性腹膜炎时, 大量炎性介质的释放会导致抗炎和促炎因子失去平衡, 免疫状态失调, 小肠肌层和肌间隙大量炎性细胞浸润, 氮能神经和胆碱能神经元减少, ICC网络结构遭到破坏, ICC与肠神经之间的相互连接被破坏, 最终导致胃肠道运动功能障碍[23]. Kinoshita等[24]观察了大鼠结肠炎模型, 发现炎症肠段ICC网络、肌间神经丛几乎完全消失, 代之以大量巨噬细胞, 环肌条节律性收缩及蠕动反射受到显著抑制. 但是胃肠道炎症所致胃肠道运动功能障碍的具体机制还不是很清楚, 近年来研究发现EGCs可能在炎症性肠病肠道动力异常发病机制方面起着重要作用. 有研究表明在肠道炎症过程中ENS的完整性遭到破坏、EGCs网络破坏、肠神经元的轴突变性和肠神经元坏死相继发生[25].
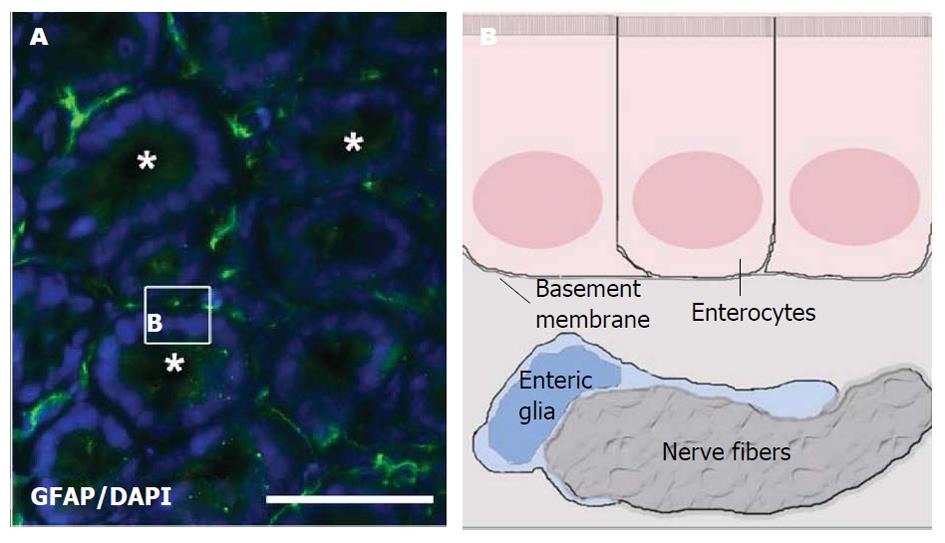
研究表明EGCs在胃肠道黏膜屏障的保护、炎症反应、神经传递、肠道血流、肠道动力等很多方面都发挥着重要的作用. EGCs广泛分布于肠黏膜肠上皮细胞周围, 保护肠黏膜屏障(图4)[8]. 研究发现EGCs的缺失会导致肠道炎性疾病的发生, EGCs数量的减少会引起肠道通透性增加和肠道屏障功能障碍[26]. 研究发现条件性敲除GFAP表达阳性的EGCs可明显增加转基因小鼠肠黏膜的通透性, 破坏黏膜的完整性, 产生肠上皮屏障(intestinal epithelial barrier, IEB)功能障碍及促炎症因子释放并诱发暴发性肠炎[27]. 肠屏障功能障碍会进一步导致胃肠道动力异常.
随着研究的深入, 发现EGCs可以分泌多种因子参与调控IEB功能, 如S-亚硝基谷胱甘肽(S-nitrosog-lutathione, GSNO)、转移生长因子-β(transforming growth factor-beta, TGF-β)、促生长上皮因子(epidermal growth factor, EGF)等. 这些因子可以通过改善肠道紧密连接蛋白、营养肠上皮细胞来调整肠屏障功能[28]. GSNO可促进肠黏膜紧密连接蛋白occludin、ZO-1和P-MLC的表达, 降低肠黏膜通透性, 缓解肠道炎症反应, 发挥保护肠黏膜屏障作用[29]. GSNO还可通过抑制NF-κB炎症信号通路来抑制促炎细胞因子如IL-1β、IL-6、TNF-α(tumor necrosis factor-α, TNF-α)等的产生[30]. GDNF可与肠道上皮细胞上的GFR-α2受体结合, 通过激活MAPK和AKT信号通路抑制肠道上皮细胞的凋亡, 上调ZO-1蛋白的表达. 通过激活P13k/AKT通路抑制肠黏膜NF-κB、p65而抑制TNF-α、IL-1β等炎性细胞因子的分泌, 改善肠道炎症[31]. 肖卫东等[32]在联合培养肠上皮细胞和EGCs并给予脂多糖(lipopolysaccharide, LPS)刺激的实验研究中发现EGCs通过上调紧密结合蛋白TJ而减弱了由LPS刺激导致的肠上皮细胞-6(intestinal epithetlial cells-6, IEC-6)屏障功能的丧失. 还有研究表明EGCs也可通过肠道神经-内分泌-免疫网络对肠道炎症反应起调节作用, 即EGCs通过肠神经元间接作用于肠道免疫系统并影响肠道炎症的发生发展, 也可通过自身分泌的神经营养因子、神经多肽以及细胞因子等神经递质直接作用于肠黏膜免疫细胞, 改善肠道炎症反应[33,34]. 在胃肠道炎症导致肠道损伤时, EGCs则可以调节免疫细胞的活化使其数目增多并且传递迷走神经的抗炎信号给肠道免疫细胞, 发挥抗炎作用, 修复肠道屏障. 另外在炎症情况下, 上皮细胞的凋亡、减少会增加GDNF的吸收, 而EGCs的激活则使GDNF的表达增加, GDNF可通过抗凋亡作用对神经元及肠上皮细胞产生较强的保护作用[35,36]. 因此目前研究观点认为在胃肠道炎症所致的胃肠运动功能障碍中, EGCs可以通过改善肠道炎症来促进胃肠道运动功能的恢复. 同时EGCs在肠道炎症中保护了肠上皮细胞屏障的完整性, 维持了肠道内稳态, 有利于恢复胃肠道炎症所致运动功能异常. 在胃肠道炎症发生时EGCs还可以通过保护肠神经减少肠神经元凋亡来改善胃肠道运动功能.
越来越多的研究表明EGCs参与胃肠道运动的调节并起着关键性作用. EGCs功能障碍和数量缺失会导致胃肠动力异常, 影响胃肠蠕动, 导致胃肠排空、运输减慢[1]. 实验表明在体内条件性敲除EGCs可延迟胃肠道排空、降低肠道传输速率[37]. 在研究便秘患者胃肠道运动障碍时也发现EGCs释放的ATP为ICC调节慢波运动提供了反馈, 而便秘患者EGCs的缺失则加重了起搏信号的损害, 使得胃肠运动减弱. 同样ICC的减少会损害肠道运动的起搏信号, 使胃肠道运动功能障碍. 肠肌间神经丛和黏膜下神经丛EGCs的减少导致了严重便秘患者的治疗难度[38-40]. 还有研究发现结肠憩室疾病所致胃肠运动功能障碍病人的黏膜下层和肠肌间神经丛中EGCs和ICC数量减少、结肠平滑肌肥大导致结肠运动功能障碍[41].在先天性严重慢波需手术缓解的便秘患者体内结肠和小肠的EGCs数量出现了显著的减少, EGCs畸形、数量减少都会导致肠道通透性增加和屏障功能障碍, 进一步加重患者的便秘程度[29]. Boesmans等[20]研究发现在结肠炎时肠道运动功能发生紊乱, EGCs可通过调控肠神经元的凋亡来调节肠道动力异常, 进一步研究发现这与缝隙链接蛋白-43(connexin-43, Cx43)的激活有关. 与正常小鼠相比, 敲除小鼠Cx43蛋白表达基因后, 其结肠运输时间显著延长, 结肠收缩力下降, 收缩频率减少[42]. 在Cx43蛋白通道关闭后, EGCs胞内的钙离子浓度降低, 影响肠神经与EGCs之间的信号转导, 使胃肠道运动减慢[43]. 由此可见EGCs在胃肠道运动功能调节方面发挥巨大作用.
胃肠动力的基础研究是治疗胃肠动力障碍性疾病的基础.胃肠道运动功能受肠神经调节, 肠神经作用于胃肠道平滑肌调节胃肠道运动功能, 而Cajal间质细胞(interstritial cell of cajal, ICC)被认为是胃肠道运动的"起搏细胞"及神经信号传导的"中介细胞". 解剖结构关系上ICC 位于神经末梢和平滑肌之间, 是连接肠神经和平滑肌的"桥梁", 对胃肠道动力的产生和调节具有作用. 肠神经-ICC-平滑肌细胞网络作为胃肠道运动功能的基本单位, 对胃肠道运动功能起着关键性作用[44]. EGCs对肠神经的保护作用保证了胃肠道神经-ICC-平滑肌细胞网络的完整性, 使得肠神经信号及胃肠道运动的起搏信号顺利传递并作用于胃肠道平滑肌细胞发挥胃肠道运动功能的调节作用. 运用共聚焦显微镜观察细菌性腹膜炎大鼠小肠全厚肌层标本, 发现细菌性腹膜炎大鼠小肠肌层中肠神经-ICC-平滑肌细胞网络的细胞数目减少, 网络结构紊乱, 小肠运动功能损伤和肠神经-ICC-平滑肌细胞网络损伤有关[23]. 因此, EGCs可能是通过保护肠神经、调节肠神经-ICC-平滑肌细胞网络影响胃肠道的运动功能. 还有研究指出EGCs调控肠道运动的机制可能与其受到肠道快反应神经递质(如乙酰胆碱、五羟色胺、ATP等)调控有关[20]. Gautron等[45]发现肌间神经丛EGCs可能通过接受胆碱能神经支配进而调控胃肠道运动. EGCs对胃肠道运动的具体调节机制如何还有待于进一步研究. 明确其作用机制, 在将来则可以研制针对EGCs及针对与其调节胃肠道运动功能相关因子的药物进行治疗. 现在研究已经表明目前常用的促进胃肠动力的药物如奥美拉唑、莫沙比利等药物可以提高CX43蛋白的浓度促进胃肠道运动的恢复, 而EGCs细胞内钙离子反应需要CX43蛋白介导发挥胃肠道调控功能[43,46].
胃肠道运动功能障碍是临床消化系统疾病的常见病症, 恢复胃肠道运动功能是其治疗的关键. EGCs作为ENS的重要组成部分, 通过营养支持保护肠神经, 使其在生理和病理情况下都更好地发挥胃肠道调节作用, 并促进胃肠道动力恢复. 在肠道炎症性疾病中EGCs可保护肠上皮屏障, 通过自分泌GDNF、GSNO等及抗原呈递作用等发挥抗炎作用, 减轻肠道炎症, 恢复胃肠道运动功能. 深入研究EGCs, 尤其是从EGCs对肠神经的保护作用和缓解肠道炎症的作用机制方面, 可以为临床治疗胃肠道炎症性疾病和胃肠道运动功能障碍性疾病提供理论依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 辽宁省
同行评议报告分类
A级 (优秀): A
B级 (非常好): B, B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Bassotti G, Villanacci V, Antonelli E, Morelli A, Salerni B. Enteric glial cells: new players in gastrointestinal motility? Lab Invest. 2007;87:628-632. [PubMed] [DOI] |
| 2. | Furness JB. The enteric nervous system and neurogastroen-terology. Nat Rev Gastroenterol Hepatol. 2012;9:286-294. [PubMed] [DOI] |
| 3. | Collins SM. The immunomodulation of enteric neuromu-scular function: implications for motility and inflammatory disorders. Gastroenterology. 1996;111:1683-1699. [PubMed] |
| 4. | Bassotti G, Antonelli E, Villanacci V, Baldoni M, Dore MP. Colonic motility in ulcerative colitis. United European Gastroenterol J. 2014;2:457-462. [PubMed] [DOI] |
| 5. | Neunlist M, Rolli-Derkinderen M, Latorre R, Van Landeghem L, Coron E, Derkinderen P, De Giorgio R. Enteric glial cells: recent developments and future directions. Gastroenterology. 2014;147:1230-1237. [PubMed] [DOI] |
| 6. | Ochoa-Cortes F, Turco F, Linan-Rico A, Soghomonyan S, Whitaker E, Wehner S, Cuomo R, Christofi FL. Enteric Glial Cells: A New Frontier in Neurogastroenterology and Clinical Target for Inflammatory Bowel Diseases. Inflamm Bowel Dis. 2016;22:433-449. [PubMed] [DOI] |
| 7. | De Giorgio R, Giancola F, Boschetti E, Abdo H, Lardeux B, Neunlist M. Enteric glia and neuroprotection: basic and clinical aspects. Am J Physiol Gastrointest Liver Physiol. 2012;303:G887-G893. [PubMed] [DOI] |
| 8. | Juliana de Mattos Coelho-Aguiar, Ana Carina Bon-Frauches, Ana Lucia Tavares Gomes, Carla Pires Verissimo, Diego Pinheiro Aguiar, Diana Matias, Beatriz Bastos de Moraes Thomasi, Antoniella Souza Gomes, Gerly Anne de Castro Brito, Vivaldo Moura-Neto. The Enteric Glia Identity and Functions. GLIA. 2015;. [PubMed] [DOI] |
| 9. | Liu YA, Chung YC, Pan ST, Shen MY, Hou YC, Peng SJ, Pasricha PJ, Tang SC. 3-D imaging, illustration, and quantitation of enteric glial network in transparent human colon mucosa. Neurogastroenterol Motil. 2013;25:e324-e338. [PubMed] [DOI] |
| 10. | Cirillo C, Sarnelli G, Esposito G, Turco F, Steardo L, Cuomo R. S100B protein in the gut: the evidence for enteroglial-sustained intestinal inflammation. World J Gastroenterol. 2011;17:1261-1266. [PubMed] [DOI] |
| 11. | Boesmans W, Lasrado R, Vanden Berghe P, Pachnis V. Heterogeneity and phenotypic plasticity of glial cells in the mammalian enteric nervous system. Glia. 2015;63:229-241. [PubMed] [DOI] |
| 13. | Grubišić V, Gulbransen BD. Enteric glia:the most alimentary of all glia. J Physiol. 2017;595:557-570. [PubMed] [DOI] |
| 14. | Abdo H, Derkinderen P, Gomes P, Chevalier J, Aubert P, Masson D, Galmiche JP, Vanden Berghe P, Neunlist M, Lardeux B. Enteric glial cells protect neurons from oxidative stress in part via reduced glutathione. FASEB J. 2010;24:1082-1094. [PubMed] [DOI] |
| 15. | Heanue TA, Pachnis V. Enteric nervous system development and Hirschsprung's disease: advances in genetic and stem cell studies. Nat Rev Neurosci. 2007;8:466-479. [PubMed] [DOI] |
| 16. | Le Berre-Scoul C, Chevalier J, Oleynikova E, Cossais F, Talon S, Neunlist M, Boudin H. A novel enteric neuron-glia coculture system reveals the role of glia in neuronal development. J Physiol. 2017;595:583-598. [PubMed] [DOI] |
| 17. | Liu GX, Yang YX, Yan J, Zhang T, Zou YP, Huang XL, Gan HT. Glial-derived neurotrophic factor reduces inflammation and improves delayed colonic transit in rat models of dextran sulfate sodium-induced colitis. Int Immunopharmacol. 2014;19:145-152. [PubMed] [DOI] |
| 18. | Böttner M, Harde J, Barrenschee M, Hellwig I, Vogel I, Ebsen M, Wedel T. GDNF induces synaptic vesicle markers in enteric neurons. Neurosci Res. 2013;77:128-136. [PubMed] [DOI] |
| 19. | Sharkey KA. Emerging roles for enteric glia in gastrointestinal disorders. J Clin Invest. 2015;125:918-925. [PubMed] [DOI] |
| 20. | Boesmans W, Cirillo C, Van den Abbeel V, Van den Haute C, Depoortere I, Tack J, Vanden Berghe P. Neurotransmitters involved in fast excitatory neurotransmission directly activate enteric glial cells. Neurogastroenterol Motil. 2013;25:e151-e160. [PubMed] [DOI] |
| 21. | Yu YB, Li YQ. Enteric glial cells and their role in the intestinal epithelial barrier. World J Gastroenterol. 2014;20:11273-11280. [PubMed] [DOI] |
| 22. | Savidge TC, Sofroniew MV, Neunlist M. Starring roles for astroglia in barrier pathologies of gut and brain. Lab Invest. 2007;87:731-736. [PubMed] [DOI] |
| 24. | Kinoshita K, Horiguchi K, Fujisawa M, Kobirumaki F, Yamato S, Hori M, Ozaki H. Possible involvement of muscularis resident macrophages in impairment of interstitial cells of Cajal and myenteric nerve systems in rat models of TNBS-induced colitis. Histochem Cell Biol. 2007;127:41-53. [PubMed] [DOI] |
| 25. | Reisfeld R. Video-assisted thoracic surgery sympathectomy for hyperhidrosis. Arch Surg. 2005;140:99. [PubMed] [DOI] |
| 26. | Bassotti G, Villanacci V, Maurer CA, Fisogni S, Di Fabio F, Cadei M, Morelli A, Panagiotis T, Cathomas G, Salerni B. The role of glial cells and apoptosis of enteric neurones in the neuropathology of intractable slow transit constipation. Gut. 2006;55:41-46. [PubMed] [DOI] |
| 27. | Liberman AM. When theories of speech meet the real world. J Psycholinguist Res. 1998;27:111-122. [PubMed] [DOI] |
| 28. | Hu S, Zhao ZK, Liu R, Wang HB, Gu CY, Luo HM, Wang H, Du MH, Lv Y, Shi X. Electroacupuncture activates enteric glial cells and protects the gut barrier in hemorrhaged rats. World J Gastroenterol. 2015;21:1468-1478. [PubMed] [DOI] |
| 29. | Xiao W, Wang W, Chen W, Sun L, Li X, Zhang C, Yang H. GDNF is involved in the barrier-inducing effect of enteric glial cells on intestinal epithelial cells under acute ischemia reperfusion stimulation. Mol Neurobiol. 2014;50:274-289. [PubMed] [DOI] |
| 30. | Li Z, Zhang X, Zhou H, Liu W, Li J. Exogenous S-nitrosog-lutathione attenuates inflammatory response and intestinal epithelial barrier injury in endotoxemic rats. J Trauma Acute Care Surg. 2016;80:977-984. [PubMed] [DOI] |
| 31. | Vargas-Leal V, Bruno R, Derfuss T, Krumbholz M, Hohlfeld R, Meinl E. Expression and function of glial cell line-derived neurotrophic factor family ligands and their receptors on human immune cells. J Immunol. 2005;175:2301-2308. [PubMed] [DOI] |
| 32. | Xiao WD, Chen W, Sun LH, Wang WS, Zhou SW, Yang H. The protective effect of enteric glial cells on intestinal epithelial barrier function is enhanced by inhibiting inducible nitric oxide synthase activity under lipopolysaccharide stimulation. Mol Cell Neurosci. 2011;46:527-534. [PubMed] [DOI] |
| 34. | Aaron K, Chow , Brian D, Gulbransen . Potential roles of enteric glia in bridging neuroimmune communication in the gut. Am J Physiol Gastrointest Liver Physiol. 2017;312:G145-G152. [PubMed] [DOI] |
| 35. | Langness S, Kojima M, Coimbra R, Eliceiri BP, Costantini TW. Enteric glia cells are critical to limiting the intestinal inflammatory response after injury. Am J Physiol Gastrointest Liver Physiol. 2017;312:G274-G282. [PubMed] [DOI] |
| 36. | Brown IA, McClain JL, Watson RE, Patel BA, Gulbransen BD. Enteric glia mediate neuron death in colitis through purinergic pathways that require connexin-43 and nitric oxide. Cell Mol Gastroenterol Hepatol. 2016;2:77-91. [PubMed] [DOI] |
| 37. | Nasser Y, Fernandez E, Keenan CM, Ho W, Oland LD, Tibbles LA, Schemann M, MacNaughton WK, Rühl A, Sharkey KA. Role of enteric glia in intestinal physiology: effects of the gliotoxin fluorocitrate on motor and secretory function. Am J Physiol Gastrointest Liver Physiol. 2006;291:G912-G927. [PubMed] [DOI] |
| 38. | Burnstock G, Lavin S. Interstitial cells of Cajal and purinergic signalling. Auton Neurosci. 2002;97:68-72. [PubMed] [DOI] |
| 39. | Bassotti G, Villanacci V, Nascimbeni R, Asteria CR, Fisogni S, Nesi G, Legrenzi L, Mariano M, Tonelli F, Morelli A. Colonic neuropathological aspects in patients with intractable constipation due to obstructed defecation. Mod Pathol. 2007;20:367-374. [PubMed] [DOI] |
| 40. | Mendes CE, Palombit K, Vieira C, Silva I, Correia-de-Sá P, Castelucci P. The Effect of Ischemia and Reperfusion on Enteric Glial Cells and Contractile Activity in the Ileum. Dig Dis Sci. 2015;60:2677-2689. [PubMed] [DOI] |
| 41. | Won KJ, Suzuki T, Hori M, Ozaki H. Motility disorder in experimentally obstructed intestine: relationship between muscularis inflammation and disruption of the ICC network. Neurogastroenterol Motil. 2006;18:53-61. [PubMed] [DOI] |
| 42. | Doherty TJ. Postoperative ileus: pathogenesis and treatment. Vet Clin North Am Equine Pract. 2009;25:351-362. [PubMed] [DOI] |
| 43. | McClain J, Grubišić V, Fried D, Gomez-Suarez RA, Leinninger GM, Sévigny J, Parpura V, Gulbransen BD. Ca2+ responses in enteric glia are mediated by connexin-43 hemichannels and modulate colonic transit in mice. Gastroenterology. 2014;146:497-507.e1. [PubMed] [DOI] |
| 44. | Lee SE, Wi JS, Min YI, Jung C, Ahn KY, Bae CS, Kim BY, Park SS, Oh CS, Weninger WJ. Distribution and three-dimensional appearance of the interstitial cells of Cajal in the rat stomach and duodenum. Microsc Res Tech. 2009;72:951-956. [PubMed] [DOI] |
| 45. | Gautron L, Rutkowski JM, Burton MD, Wei W, Wan Y, Elmquist JK. Neuronal and nonneuronal cholinergic structures in the mouse gastrointestinal tract and spleen. J Comp Neurol. 2013;521:3741-3767. [PubMed] [DOI] |
| 46. | 郭 璇, 谭 华梁, 王 小娟, 周 恒, 徐 寅, 刘 芸, 颜 丽花, 李 田田. 舒胃汤对功能性消化不良大鼠Cx43蛋白的分布及Cajal间质细胞的修复与再生的影响. 中国中西医结合消化杂志. 2014;22:652-661. [DOI] |