修回日期: 2017-09-19
接受日期: 2017-09-24
在线出版日期: 2017-10-18
探讨5-烷基间苯二酚(5-alkylresorcinols, 5ARs)诱导人结直肠癌细胞凋亡及与BCL2、Bax、PARP1和Caspase3表达的影响.
体外细胞实验应用5ARs直接对HT29、HCT116进行干预诱导. 利用倒置相差显微镜观察5ARs对HT29、HCT116干预后细胞形态的变化. CCK8法测定不同浓度5ARs诱导人HT29及HCT116抑制率. Annexin V-FITC/PI流式细胞术检测5ARs诱导人HT29及HCT116凋亡. Western-blot检测分析不同浓度5ARs诱导HT29及HCT116后凋亡相关蛋白变化(BCL2、Bax、PARP1和Caspase3).
5ARs可呈浓度依赖性地抑制HT29及HCT116增殖(P<0.05); 5ARs可诱导HT29及HCT116凋亡, 并可增强Bax、PARP1和Caspase3表达, 抑制BCL2表达, 并提高Bax/BCL2的比值比例(P<0.05).
5ARs可诱导HT29及HCT116凋亡, 并且可能与激活Bax、PARP1和Caspase3表达及增加Bax/BCL2比值比例相关.
核心提要: 本实验证实了5-烷基间苯二酚(5-alkylresorcinols, 5ARs)可诱导HT29及HCT116凋亡, 并且可能与激活Bax、Caspase3、PARP1表达、释放及增加Bax/BCL2比值比例相关, 为进一步研究5ARs抗肿瘤的分子机制提供实验依据和理论资料, 为预防和治疗结肠癌提供实验资料.
引文著录: 杨春, 李恒, 李海, 王宇峰, 孟玲, 杨银学. 5-烷基间苯二酚诱导人结直肠癌细胞凋亡的机制探讨. 世界华人消化杂志 2017; 25(29): 2621-2630
Revised: September 19, 2017
Accepted: September 24, 2017
Published online: October 18, 2017
To investigate the mechanism of 5-alkylresorcinols (5ARs)-induced apoptosis by detecting the effect on BCL2, Bax, PARP1 and Caspase3 expression patterns in colon cancer cell lines.
After HT29 and HCT 116 cells were treated with different concentrations of 5ARs, cell morphological changes were observed by phase-contrast microscopy, cell proliferation and apoptosis phenotypes were evaluated by Cell Counting Kit-8 (CCK8) and Annexin V-FITC/PI flow cytometric assays, respectively, and the protein levels of BCL2, Bax, PARP1 and Caspase3 were detected by Western blotting assays.
CCK8 assays indicated that the proliferation of HT29 and HCT 116 cells treated with different concentrations of 5ARs was significantly decreased (P < 0.05), and treatment with 5ARs increased the apoptosis of HT29 and HCT 116 cells. 5ARs suppressed BCL2 expression and elevated the levels of Bax, PARP1, Caspase3 and the ratio of BAX to BCL2 in colon cancer cells.
5ARs can induce the apoptosis of HT29 and HCT 116 cells in vitro, possibly by enhancing BAX, PARP1 and Caspase3 expression and elevating the ratio of BAX to BCL2 in colon cancer cells.
- Citation: Yang C, Li H, Li H, Wang YF, Meng L, Yang YX. Mechanism study of 5-alkylresorcinols-induced colon cancer cell apoptosis in vitro. Shijie Huaren Xiaohua Zazhi 2017; 25(29): 2621-2630
- URL: https://www.wjgnet.com/1009-3079/full/v25/i29/2621.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i29.2621
结直肠癌作为影响人类健康的一种重大疾病, 长期以来一直是临床和基础医学研究的热点. 在世界范围内, 其发病率和死亡率均位居各种癌症的前三位[1]. 结直肠癌发生发展大部分均有明确的癌前病变, 经息肉腺瘤或扁平腺瘤过渡而癌变并发展为进展性癌甚至远处扩散, 历时可达20余年. 大肠癌发生发展的时间窗为化学预防和筛查发现早期病变提供了可能[2].
细胞凋亡是细胞的一种基本生物学现象, 在多细胞生物去除不需要的或异常的细胞中起着必要的作用[3]. 它在生物体的进化、内环境的稳定以及多个系统的发育中起着重要的作用. 细胞凋亡不仅是一种特殊的细胞死亡类型, 而且具有重要的生物学意义及复杂的分子生物学机制.
凋亡是多基因严格控制的过程, 这些基因在种属之间非常保守, 如Bcl-2家族、caspase家族、癌基因如c-myc、抑癌基因p53等, 随着分子生物学技术的发展对多种细胞凋亡的过程有了相当的认识, 但是迄今为止凋亡过程确切机制尚不完全清楚[4]. 而凋亡过程的紊乱可能与许多疾病的发生有直接或间接的关系. 如肿瘤[5]、自身免疫性疾病[6]等, 能够诱发细胞凋亡的因素很多, 如射线、药物等[7,8].
麦麸在预防结肠癌的发生和发展过程中具有重要作用, 有证据证明, 食用麦麸可降低大肠癌风险[9]. 烷基间苯二酚(alkylresorcinols, ARs)是Wenkert等首次在小麦、黑麦中发现的一类特殊的酚类脂, 具有两亲性. ARs特殊的两亲性使其具有的抑菌、提高生物膜的稳定性、抗肿瘤、抗氧化等多种生理功能及其作为摄入小麦、黑麦等全谷物食品特殊的生物标记等用途受到研究者的广泛关注[10]. Howe等[11]和Trock等[12]对结直肠癌发生率和摄入食用纤维进行了病例对照研究, 发现增加食用纤维量可以显著降低结直肠癌的发生. Freudenheim等[13]也发现增加谷物来源的不溶性纤维比增加蔬菜和水果来源的可溶性纤维更能降低大肠癌的风险.
虽然大多数动物和人体试验均显示了麦麸与降低大肠癌发生风险的关系, 并且麦麸油的主要成分5-烷基间苯二酚(5-alkylresorcinols, 5ARs)具有强烈的抑制结肠癌细胞增殖的作用, 但有关ARs的抗肿瘤活性的机制尚未阐明,本实验旨在具体研究5ARs诱导结直肠癌细胞凋亡及与Bax、BCL2、Caspase3和PARP1表达的影响, 并进一步探讨其可能的具体作用机制.
1.1.1 实验试剂: FBS、McCoy'5A细胞培养液购自南京市凯基生物有限公司; 山羊抗兔二抗、山羊抗鼠二抗购自Thermo Fisher Scientific; PS、PAGE、SDS、CCK8试剂盒、BCA蛋白提取试剂盒、BCA蛋白定量试剂盒、Annexin V-FITC/PI凋亡检测试剂盒购自GIBCO-Invitrogen(Carlsbad, CA, United States); 脱脂牛奶、ECL、TEMED购自Thermo Fisher Scientific; 0.45 μm PVDF膜、Bax、BCL2、Caspase3、PARP1和β-actin抗体购自Santa Cruz Biotechnology(Santa Cruz, CA); 5ARs C17:0购自上海源叶生物公司; 甲醇、TBST、Tris-甘氨酸缓冲液购自广州化学试剂有限公司; PBS购自银川恒鑫生物试剂公司; 30%聚丙烯酰胺购自Sigma-Aldrich(St.Louis, MO, United States).
1.1.2 实验仪器: 超净工作台(Bio-Rad, 型号: ESCO AC67); CO2培养箱(Bio-Rad, 型号: 02793-867); 高速冷冻离心机(CBS, 型号: 2236); 全自动高压锅(Bio-Rad, 型号: MLS-4011); 液氮罐(Bio-Rad, 型号: 5438R); 凝胶成像仪(美国Bio-Rad, GEL DOC2015); 倒置相差荧光显微镜(美国Bio-Rad, 型号: 665); 电子天平(美国Thermo, 型号: BT796s); 紫外可见酶标仪(美国Bio-Rad Laboratories, 型号: Discover.V39); 水平摇床(常州普天仪器, 型号: HY-8).
1.1.3 实验细胞: 人结直肠细胞(HT29、HCT116)购自美国ATCC细胞库(Manassas, VA); 细胞培养条件: 10%胎牛血清的McCoy'5A培养基、PS(100 U/mL链霉素和100 μg/mL青霉素), 置于37 ℃、95%O2、5%CO2细胞温室培养箱中培养.
1.2.1 细胞复苏与常规培养: 取出实验室液氮罐中冻存的HT29、HCT116, 立即放入37.5 ℃水浴锅中, 不断摇动促进细胞液融化, 待细胞液完全融化后立即转移至超净台, 并吸取冻存管液至10 mL离心管离心1000 r/min, 5 min, 弃上清, 加入含有10% FBS的McCoy'5A培养基轻轻吹打, 再将细胞液转移至含有完全培养基的培养皿中, 置于37 ℃、5%CO2培养箱中培养24 h, 用倒置相差显微镜下观察细胞的贴壁生长情况, 选择隔1 d换1次培养液. 当细胞密度达到90%以上时, 用不含EDTA的胰酶消化收集细胞, 1:3传代, 取对数生长期的细胞作为实验用.
1.2.2 分组药物干预: 设两组药物干预组: 分别选用浓度为0、5、10、15、20 μmol/L的5ARs分别干预HT29和HCT116, 于37 ℃、5%CO2培养箱中培养24 h, 利用倒置相差显微镜观察不同浓度的5ARs对两组细胞增殖的影响及细胞形态的变化.
1.2.3 CCK8法绘制5ARs抑制细胞增殖曲线: 细胞计数板计数不同分组细胞数, 接种到96孔板内, 按比例1:2依次用培养基稀释成一个细胞浓度, 一般做3-5个细胞浓度梯度, 每孔建议4个复孔. 接种后培养2-4 h使细胞贴壁, 加入CCK试剂培养24 h, 37 ℃温箱孵育1 h, 在酶标仪上应用490 nm测定光吸收值OD值, 并计算: 细胞抑制率 = (对照孔OD值-实验孔OD值)/对照孔OD值×100%, 并绘制两组不同浓度5ARs干预后的细胞抑制率曲线.
1.2.4 提取细胞蛋白, 并测定蛋白含量: 将上述两组细胞于37 ℃、5%CO2培养箱中培养24 h, 用BCA提取试剂盒提取细胞蛋白, 按照每4 μL蛋白样品加入1 μL 5×SDS-PAGE蛋白上样缓冲液的比例, 混合蛋白样品和蛋白上样缓冲液, 于100 ℃水浴锅中煮5-10 min充分变性蛋白质以备用.
1.2.5 Annexin V-FITC/PI流式细胞术检测细胞凋亡: 取上述两组细胞2000 r/min, 5 min离心, PBS冲洗细胞3次, 贴壁细胞用不含EDTA的胰酶消化收集, 收集10×104以上细胞. 加入500 μL的Bingding Buffer重新悬浮细胞, 并先后加入等比例的l Annexin V-FITC和5 μL Propidium lodide 混匀, 室温、避光、反应10 min, 立即在1 h内应用流式细胞仪L3通道观察检测细胞凋亡.
1.2.6 Western-Blot 检测蛋白表达: 根据所提取蛋白浓度调整分离胶和浓缩胶至合适比例, 将蛋白样品经聚丙烯酰胺凝胶100 V电泳约1.5 h, 然后电转液中湿性电转80 V、1.5 h, 电转至PVDF膜, 4%脱脂奶粉37 ℃封闭1 h, 摇床摇匀, 加入抗体Caspase3(1:1000稀释)、PARP1抗体(1:1500稀释)、Bax抗体(1:2000稀释)、BCL2(1:2000稀释)、β-actin(1:1500稀释), 4 ℃摇床60 r/min 12 h. 1%TBST洗膜, 加入相应二抗, 室温孵育1 h, 再予1%TBST洗膜后加入适宜剂量ECL显色液在暗室凝胶成像仪下曝光成像, 并用Image J软件进行图像分析.
统计学处理 采用SPSS20.0统计软件进行数据处理, 实验数据以mean±SD表示, 两组间比较采用两样本t检验, 多组间比较采用方差分析, P≤0.05为差异具有统计学意义.
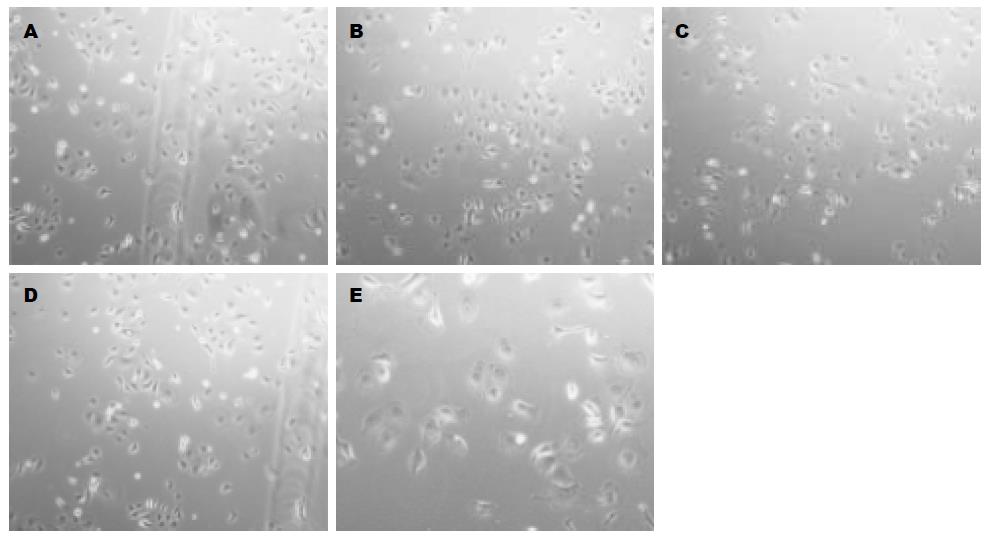
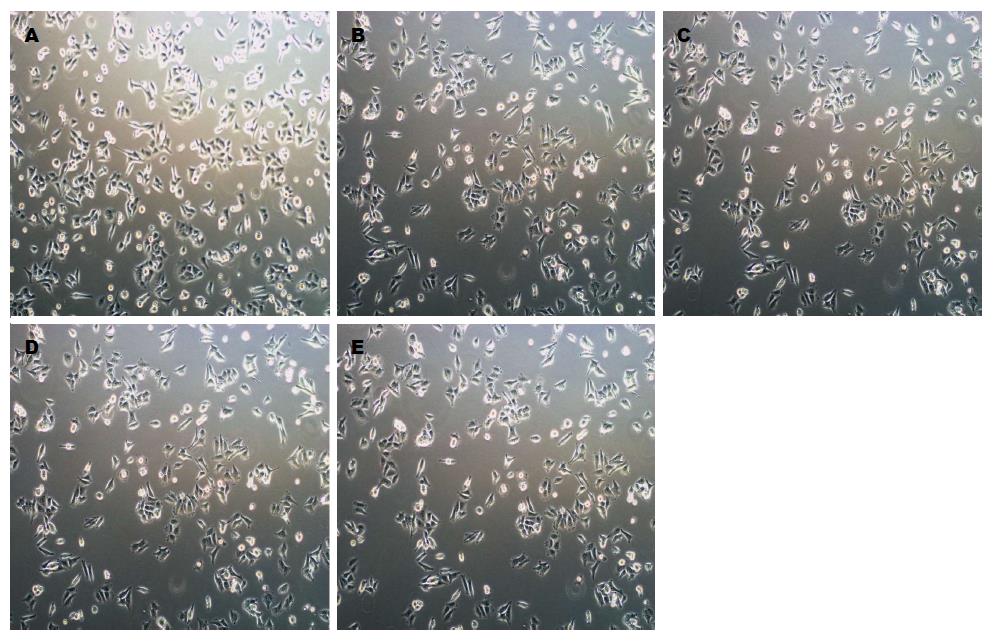
将不同浓度5ARs干预HT29、HCT116后, 置于37 ℃、5%CO2培养箱中培养中培养24 h, 在倒置相差显微镜下观察细胞的数量及形态变化(放大100×100倍). 结果显示(图1, 2), 与对照组相比, HT29和HCT116组随着5ARs浓度的升高, 细胞数明显减少.
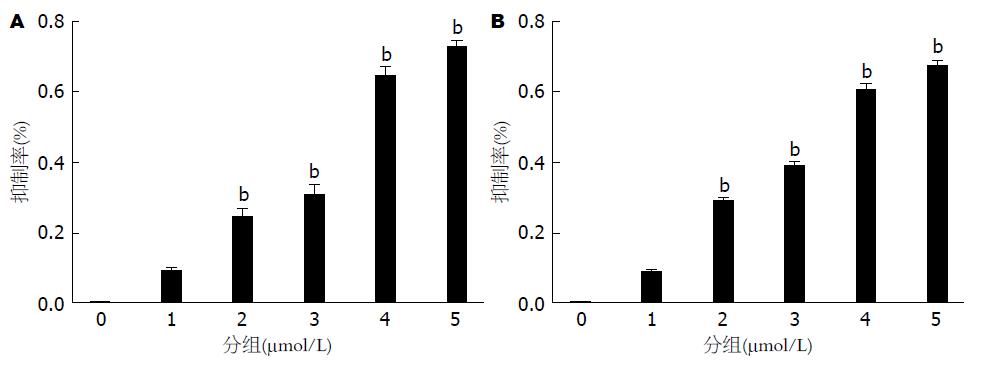
上述不同药物干预组, 分别置于37 ℃、5%CO2培养箱中培养24 h, CCK8法检测细胞抑制率与空白对照组相比差异有统计学意义(P<0.05). 结果显示(图3A), 与阴性对照组相比, HT29-5ARs(5 μmol/L)组、HT29-5ARs(10 μmol/L)组、HT29-5ARs(15 μmol/L)组及HT29-5ARs(20 μmol/L)组抑制率明显增加, 尤其是HT29-5ARs(20 μmol/L)组抑制率更为明显(P<0.05); 随着5ARs的浓度升高, 可不同程度地抑制HT29增殖(P<0.05). 结果显示(图3B), 与阴性对照组相比, HCT116-5ARs(5 μmol/L)组、HCT116-5ARs(10 μmol/L)组、HCT116-5ARs(15 μmol/L)组及HCT116-5ARs(20 μmol/L)组抑制率明显增加, 尤其是HCT116-5ARs(20 μmol/L)组抑制率更为明显(P<0.05); 随着5ARs的浓度升高, 可不同程度地抑制HCT116增殖(P<0.05).
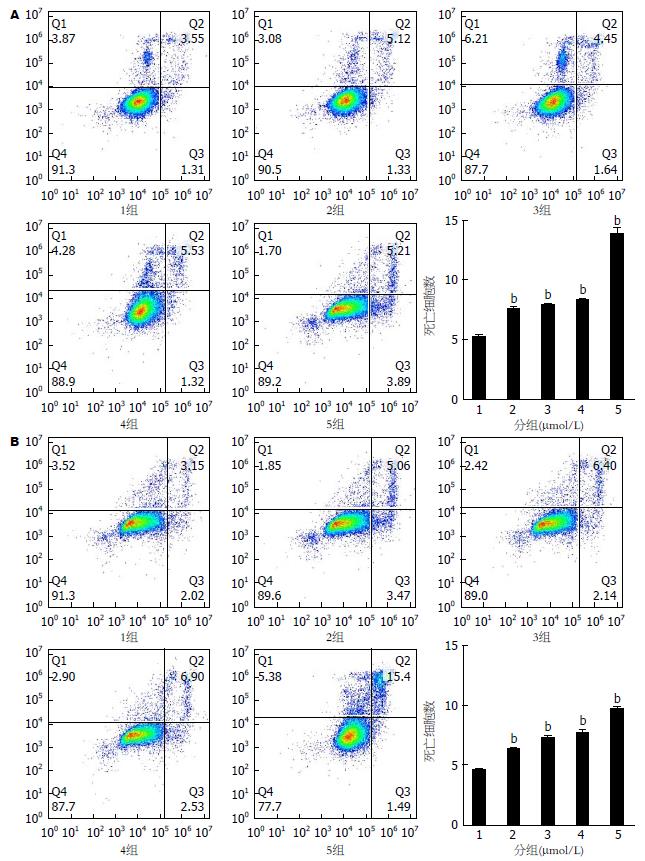
将上述两组细胞分别应用流式细胞仪L3通道检测. 从Annexin V-FITC/PI荧光双参数点图可以观察(图4), 其中右上象限和右下象限为死亡细胞. 在HT29各分组细胞中, 随着5ARs的浓度增加, 右下象限和右上象限死亡细胞数明显不同程度增加(图4A); 在HCT116各分组细胞中, 随着5ARs的浓度增加, 右下象限和右上象限死亡细胞数也明显增多(图4B).
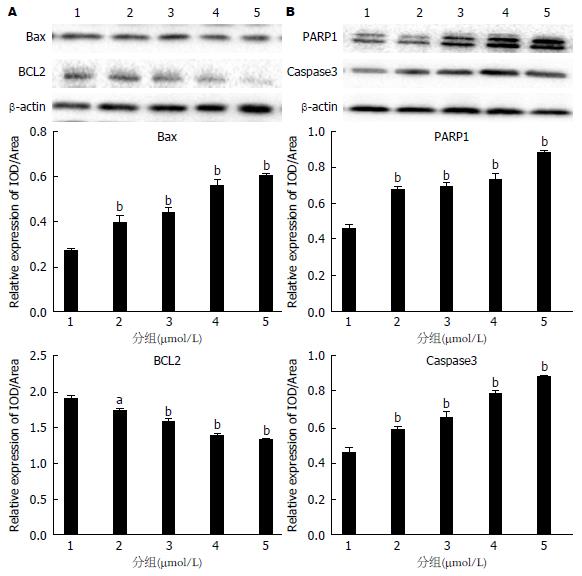
如图5所示, 与对照组(1组)比较, Western-blot检测不同浓度的5ARs对Caspase3、PARP1、Bax表达呈现不同程度升高(P<0.05), 但随着5ARs的浓度升高, Western-blot检测BCL2的表达逐渐降低(P<0.05).
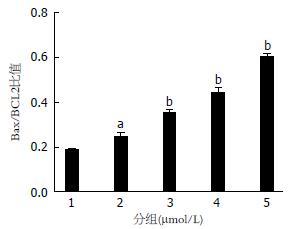
如图6所示, 与对照组(1组)相比, 随着5ARs浓度的升高, Bax/BCL2比值逐渐升高, 差异具有统计学意义(P<0.05).
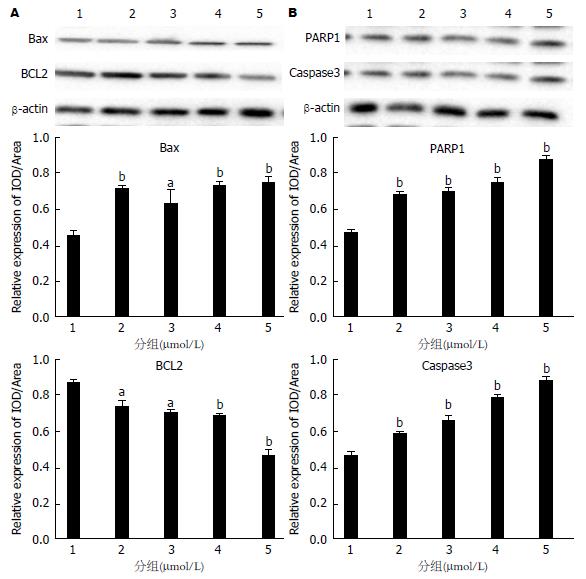
如图7所示, 与对照组(1组)比较, Western-blot检测不同浓度的5ARs对Caspase3、PARP1、Bax表达呈现不同程度升高(P<0.05), 但随着5ARs的浓度升高, Western-blot检测BCL2的表达逐渐降低(P<0.05).
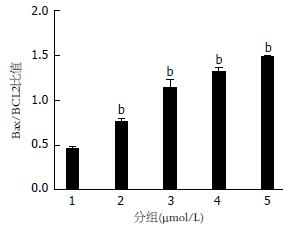
如图8所示, 与对照组(1组)相比, 随着5ARs浓度的升高, Bax/BCL2比值逐渐升高, 差异具有统计学意义(P<0.05).
Bcl-2蛋白家族[14]是一个特别的家族, 目前已发现25种Bcl-2家族同源蛋白, 其成员中有些促进凋亡, 如Bad、Bid、Bax, 有些成员阻止细胞凋亡, 如Bcl-2、 Bcl-x、Bcl-w. Bcl-2能够阻止细胞色素c从线粒体释放到细胞质, 从而抑制了细胞凋亡. Bcl-2基因最初是在非霍奇金滤泡状B细胞淋巴瘤中分离出来的, 它是在14号与18号染色体易位的断点上被发现的[15]. 有报道[16]称Bcl-2存在于线粒体外膜、核膜和内质网膜上.
细胞凋亡有两条途径[17]: 外源性凋亡途径和内源性凋亡途径. 外源性凋亡途径, 又称为死亡受体通路, 是由胞外肿瘤坏死因子(tumor necrosis factor, TNF)超家族的死亡配体如TNFa、FasL/CD95L、TWEAK和TRAIL引发的. 这些配体和相关的细胞表面死亡受体(分别是TNFR、Fas/CD95、DR3、DR4/DRS)结合, 使受体三聚化并激活, 三聚化的死亡受体通过死亡域募集衔接蛋白如TRADD和/或FADD[18]. 内源性凋亡途径, 又称为线粒体/细胞色素C介导的通路, 线粒体是细胞生命活动控制中心, 它不仅是细胞呼吸链和氧化磷酸化的中心, 而且是细胞凋亡调控中心. 实验表明了细胞色素C从线粒体释放是细胞凋亡的关键步骤. 释放到细胞浆的细胞色素C在dATP存在的条件下能与凋亡相关因子1结合, 使其形成多聚体, 并促使pro-caspase-9与其结合形成凋亡小体, 之后激活caspase-9, 被激活的caspase-9能激活其它的Bax、Caspase3、PARP1等, 从而诱导细胞凋亡[19].
ARs是小麦、黑麦中的一类特殊的酚类脂, 具有两亲性. ARs是1、3间苯二酚苯环5位被含奇数个碳原子的烷基取代的一类衍生物的总称. 诸多谷物中, 仅小麦、黑麦等麦类中含有大量的ARs, 干燥的麦粒中其含量约为0.015%-0.3%, 在这类谷物的酚类化合物中占有相当的比重. ARs特殊的两亲性使其具有的抑菌、提高生物膜的稳定性、抗肿瘤、抗氧化等多种生理功能受到研究者的广泛关注. 5ARs能够降低一些间接诱导物质的诱导性[20], 与花青素相比较, ARs能够有效地抑制淋巴细胞培养中诱导物的诱导速率和频率. Gasiorowski等[21]通过埃姆斯实验检测了ARs降低四种标准诱导物的诱导效应, 发现其效果非常显著. 在姐妹染色体杂交试验中, ARs能够显著地降低染色体交换的频率. 经进一步研究发现, ARs能够加速具有遗传毒性的被损伤细胞的死亡速率, 抑制癌细胞形成. 还有研究表明ARs对过氧化氢引起的结肠癌细胞氧化损伤具有抑制作用, 癌细胞排泄物生殖毒性也因ARs的加入有所降低, 而这些毒性与结肠癌直接相关[22]. 我们的研究显示: 5ARs可呈浓度依赖性地抑制结肠癌细胞HT29及HCT116增殖(P<0.05); 5ARs可诱导HT29及HCT116凋亡, 并可增强Bax、PARP1和Caspase3表达, 抑制BCL2表达, 并提高Bax/BCL2的比值比例(P<0.05).
总而言之, 本实验证实了5ARs可诱导HT29及HCT116凋亡, 并且可能与激活Bax、Caspase3、PARP1表达、释放及增加Bax/BCL2比值比例相关, 为进一步研究5ARs抗肿瘤的分子机制提供实验依据和理论资料, 为预防结肠癌提供实验资料. 但是, 结直肠肿瘤的发生发展其分子机制十分复杂, 所以对应用5ARs作为对结直肠肿瘤的预防作用仍需进一步评估风险.
结直肠癌作为影响人类健康的一种重大疾病, 长期以来一直是临床和基础医学研究的热点. 在世界范围内, 其发病率和死亡率均位居各种癌症的前三位. 凋亡是多基因严格控制的过程, 这些基因在种属之间非常保守, 如Bcl-2家族、caspase家族、癌基因如c-myc、抑癌基因p53等, 随着分子生物学技术的发展对多种细胞凋亡的过程有了相当的认识, 但是迄今为止凋亡过程确切机制尚不完全清楚.
大多数动物和人体试验均显示了麦麸与降低大肠癌发生风险的关系, 并且麦麸油的主要成分5-烷基间苯二酚(5-alkylresorcinols, 5ARs)具有强烈的抑制结肠癌细胞增殖的作用, 但有关5ARs的抗肿瘤活性的机制尚未阐明,本实验旨在具体研究5ARs诱导结直肠癌细胞凋亡及与Bax、BCL2、Caspase3和PARP1表达的影响, 并进一步探讨其可能的具体作用机制.
ARs特殊的两亲性使其具有的抑菌、提高生物膜的稳定性、抗肿瘤、抗氧化等多种生理功能及其作为摄入小麦、黑麦等全谷物食品特殊的生物标记等用途受到研究者的广泛关注. 5ARs能够降低一些间接诱导物质的诱导性, 与花青素相比较, ARs能够有效地抑制淋巴细胞培养中诱导物的诱导速率和频率. Gasiorowski等通过埃姆斯实验检测了ARs降低四种标准诱导物的诱导效应, 发现其效果非常显著. 在姐妹染色体杂交试验中, ARs能够显著地降低染色体交换的频率. 经进一步研究发现, ARs能够加速具有遗传毒性的被损伤细胞的死亡速率, 抑制癌细胞形成.
大多数动物和人体试验均显示了麦麸与降低大肠癌发生风险的关系, 但有关ARs的抗肿瘤活性的机制尚未阐明. 本实验创新点是拟通过细胞实验阐明5ARs的体外抗肿瘤活性及5ARs诱导结肠肿瘤凋亡的分子靶标.
本实验证实了5ARs可诱导HT29及HCT116凋亡, 并且可能与激活Bax、Caspase3、PARP1表达、释放及增加Bax/BCL2比值比例相关, 为进一步研究5ARs抗肿瘤的分子机制提供实验依据和理论资料, 为预防和治疗结肠癌提供实验资料.
Bcl-2: B淋巴细胞瘤-2基因简称bcl-2(B-cell lymphoma-2), 是细胞凋亡研究中最受重视的癌基因之一. 目前Bcl-2是凋亡分子机制研究的主要靶分子. 随着对Bcl-2以及凋亡本身研究的日渐深入, Bcl-2的作用机制和凋亡的分子机制最终被阐明, 从而提高对与凋亡有关的疾病的认识和诊治水平. 在哺乳动物细胞中, 调节线粒体外膜通透性, 大多数定位在线粒体外膜上, 或受到信号刺激后转移到线粒体外膜上. 根据其功能可分为两组: Bcl-2, Bcl-xl, Bcl-w等抑制细胞凋亡; Bax, Bak, Noxa等促进细胞凋亡. 关于Bcl-2家族调控线粒体外膜通透性的机制, 假说之一是, 细胞接受凋亡信号后促凋亡因子Bax和Bak发生寡聚化, 从细胞质中转移到线粒体外膜上, 并与膜上的电压依赖阴离子通道相互作用, 使通道开放到足以使线粒体内的凋亡因子如细胞色素c等释放到细胞质基质中, 引起细胞死亡.
丁永斌, 博士, 主任医师, 南京医科大学第一附属医院普外科; 李正荣, 博士, 副教授, 主任医师, 南昌大学附属第一医院胃肠外科; 郑建勇, 博士, 副教授, 副主任医师, 第四军医大学西京消化病医院消化外科
关于5ARs对诱导人结直肠癌细胞凋亡以及相关蛋白表达的研究目前国内外研究较少, 本实验中作者通过直接干预、CCK8法、流式细胞术和Western-blot多个体外实验验证了5ARs对人结直肠癌细胞凋亡的影响及对BCL2、Bax、PARP1和Caspase3表达的影响. 文章立意有一定的新颖性.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 宁夏回族自治区
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑:马亚娟 电编:李瑞芳
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 2. | 董 宁宁, 宋 莉, 李 卓玉, 肖 红. 滴滴涕对人大肠癌DLD1细胞上皮间充质转化的影响. 中国药理学与毒理学杂志. 2017;31:172-178. |
| 3. | 徐 德梅. 卤代醌类化合物介导肝细胞炎症反应、内质网应激和凋亡的信号通路分析. 重庆: 西南大学 2015; . |
| 4. | Miekus K, Jarocha D, Trzyna E, Majka M. Role of I-TAC-binding receptors CXCR3 and CXCR7 in proliferation, activation of intracellular signaling pathways and migration of various tumor cell lines. Folia Histochem Cytobiol. 2010;48:104-111. [PubMed] [DOI] |
| 5. | Parikka K, Rowland IR, Welch RW, Wähälä K. In vitro antioxidant activity and antigenotoxicity of 5-n-alkylresorcinols. J Agric Food Chem. 2006;54:1646-1650. [PubMed] [DOI] |
| 6. | Landberg R, Kamal-Eldin A, Andersson R, Aman P. Alkylresorcinol content and homologue composition in durum wheat (Triticum durum) kernels and pasta products. J Agric Food Chem. 2006;54:3012-3014. [PubMed] [DOI] |
| 8. | Billottet C, Quemener C, Bikfalvi A. CXCR3, a double-edged sword in tumor progression and angiogenesis. Biochim Biophys Acta. 2013;1836:287-295. [PubMed] [DOI] |
| 9. | Adlercreutz H. Western diet and Western diseases: some hormonal and biochemical mechanisms and associations. Scand J Clin Lab Invest Suppl. 1990;201:3-23. [PubMed] [DOI] |
| 10. | Levin KE, Dozois RR. Epidemiology of large bowel cancer. World J Surg. 1991;15:562-567. [PubMed] [DOI] |
| 11. | Howe GR, Benito E, Castelleto R, Cornée J, Estève J, Gallagher RP, Iscovich JM, Deng-ao J, Kaaks R, Kune GA. Dietary intake of fiber and decreased risk of cancers of the colon and rectum: evidence from the combined analysis of 13 case-control studies. J Natl Cancer Inst. 1992;84:1887-1896. [PubMed] [DOI] |
| 12. | Trock B, Lanza E, Greenwald P. Dietary fiber, vegetables, and colon cancer: critical review and meta-analyses of the epidemiologic evidence. J Natl Cancer Inst. 1990;82:650-661. [PubMed] [DOI] |
| 13. | Freudenheim JL, Graham S, Horvath PJ, Marshall JR, Haughey BP, Wilkinson G. Risks associated with source of fiber and fiber components in cancer of the colon and rectum. Cancer Res. 1990;50:3295-3300. [PubMed] |
| 14. | Shen D, Cao X. Potential role of CXCR3 in proliferation and invasion of prostate cancer cells. Int J Clin Exp Pathol. 2015;8:8091-8098. [PubMed] |
| 15. | Korniejewska A, McKnight AJ, Johnson Z, Watson ML, Ward SG. Expression and agonist responsiveness of CXCR3 variants in human T lymphocytes. Immunology. 2011;132:503-515. [PubMed] [DOI] |
| 16. | Li L, Chen J, Lu ZH, Yu SN, Luo YF, Zhao WG, Ma YH, Jia CW. Significance of chemokine receptor CXCR3 expression in breast cancer. Zhonghua Binglixue Zazhi. 2011;40:85-88. [PubMed] |
| 17. | Wu Z, Huang X, Han X, Li Z, Zhu Q, Yan J, Yu S, Jin Z, Wang Z, Zheng Q. The chemokine CXCL9 expression is associated with better prognosis for colorectal carcinoma patients. Biomed Pharmacother. 2016;78:8-13. [PubMed] [DOI] |
| 18. | Ruiz-Garcia E, Scott V, Machavoine C, Bidart JM, Lacroix L, Delaloge S, Andre F. Gene expression profiling identifies Fibronectin 1 and CXCL9 as candidate biomarkers for breast cancer screening. Br J Cancer. 2010;102:462-468. [PubMed] [DOI] |
| 19. | Thompson CC, Ashcroft FJ, Patel S, Saraga G, Vimalachandran D, Prime W, Campbell F, Dodson A, Jenkins RE, Lemoine NR. Pancreatic cancer cells overexpress gelsolin family-capping proteins, which contribute to their cell motility. Gut. 2007;56:95-106. [PubMed] [DOI] |
| 21. | Gasiorowski K, Szyba K, Brokos B, Kozubek A. Antimutagenic activity of alkylresorcinols from cereal grains. Cancer Lett. 1996;106:109-115. [PubMed] [DOI] |
| 22. | Wang L, Yang S, Cao J, Zhao S, Wang W. Microencapsulation of Ginger Volatile Oil Based on Gelatin/Sodium Alginate Polyelectrolyte Complex. Chem Pharm Bull (Tokyo). 2016;64:21-26. [PubMed] [DOI] |