修回日期: 2016-06-18
接受日期: 2016-06-28
在线出版日期: 2017-01-08
随着我国人民生活水平的提高, 溃疡性结肠炎的发病越来越多. 近年的研究发现溃疡性结肠炎的发病与肠道菌群异常有密切关系. 肠道菌群有1013-1014个细菌体, 比人体细胞数量多出一个数量级, 这些细菌与人体健康有密切关系, 被认为是人体的一个虚拟器官. 溃疡性结肠炎的发病与机体的免疫功能异常有关, 而肠道菌群对免疫系统有重要的调控作用. 肠道菌群移植是一种古老的治疗方法, 有效的肠道菌群移植可重构患者的肠道菌群, 矫正畸变的免疫功能, 促进机体功能恢复正常. 本文就近年来肠道菌群与溃疡性结肠炎的关系及肠道菌群移植对溃疡性结肠炎的影响, 结合作者本人的经验进行简要综述.
核心提要: 溃疡性结肠炎的发病与肠道菌群及免疫功能的异常有密切关系, 肠道菌群也对免疫系统有重要影响. 肠道菌群移植可纠正宿主异常的肠道菌群, 从而影响免疫功能及溃疡性结肠炎的发生和发展.
引文著录: 金博. 肠道菌群移植与溃疡性结肠炎. 世界华人消化杂志 2017; 25(1): 23-30
Revised: June 18, 2016
Accepted: June 28, 2016
Published online: January 8, 2017
With the continuous improvement of the living standards of Chinese people, the incidence of ulcerative colitis in China has been increasing. Recent studies have demonstrated that the pathogenesis of ulcerative colitis is closely related with the aberrance of intestinal microbiota of the host. Intestinal microbiota is composed of 1013-1014 bacterial cells, whose number is ten times of the number of human cells in the body. These bacteria significantly affect the health of the body, and are regarded as a virtual organ of the body. The pathogenesis of ulcerative colitis is related to the malfunction of the host immunity. Intestinal microbiota regulates the immune activities and hence affects the onset of ulcerative colitis. Fecal microbiota transplantation is an ancient regimen which is able to repopulate the intestinal microbiota of the recipient, and thus to rectify the aberrant immune function and to restore the physiological function of the body. In the current paper, we review the relationship between intestinal microbiota and ulcerative colitis and the effects of fecal microbiota transplantation on ulcerative colitis.
- Citation: Jin B. Fecal microbiota transplantation in ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2017; 25(1): 23-30
- URL: https://www.wjgnet.com/1009-3079/full/v25/i1/23.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i1.23
溃疡性结肠炎是炎症性肠病的一种, 是消化内科临床较为常见疾病之一. 最初溃疡性结肠炎在西方欧美国家比较多见, 而在亚洲国家少见. 随着亚洲国家工业化进程的发展, 溃疡性结肠炎在亚洲国家的发病率逐年上升, 如香港居民溃疡性结肠炎的发病率从1997年到2006年上升了3倍[1], 大陆居民的发病率虽然尚无准确统计, 但近年来随着国家经济的发展和生活质量的提高, 溃疡性结肠炎的发病也越来越多[2].
溃疡性结肠炎发病机制目前仍不清楚. 虽然溃疡性结肠炎的首次报道至今已有160余年, 但其发病机制至今仍在探索中. 随着近年来分子遗传学、分子生物学以及免疫学等学科的发展, 人们对溃疡性结肠炎的认识不断深入. 已有许多实验研究表明, 环境因素、遗传因素、肠道微生物、免疫因素与溃疡性结肠炎的发生密切相关. 目前认为机体的免疫系统与肠道微生物的相互作用可能是结肠炎症发生和迁延不愈的最重要原因之一[3,4].
由于溃疡性结肠炎的发病机制仍未阐明, 目前的临床治疗主要是使用抗炎药物如5-氨基水杨酸制剂及免疫抑制剂如糖皮质激素、硫唑嘌呤等, 近年来单克隆抗体药物等新型药物也在溃疡性结肠炎的治疗中发挥了重要作用, 如阻断α肿瘤坏死因子的Infliximab, Adalimumab及Golimumab等, 但仍有部分溃疡性结肠炎患者对这些治疗反应欠佳. 另外对于上述治疗有效的患者来说, 也需要长期维持治疗, 而且容易复发, 对患者的身心影响极大, 对社会医疗资源也是很大的花费. 因此, 近年来对溃疡性结肠炎的新疗法进行了很多有益的探索.
肠道菌群是包括肠道内的细菌和真菌等多种微生物的总称. 肠道菌群移植是将健康人的肠道菌通过上消化道或下消化道途径注入受者的肠道, 使之在受者的肠道内定植和繁殖, 从而改变受者肠道菌群的构成, 达到改变受者肠道的微生态, 从而影响受者的免疫和代谢功能, 产生治疗效果的目的. 由于新鲜粪便的一半以上是由肠道菌群组成, 因此肠道菌群移植最常用的方式是粪便菌群移植, 这也是近年来引起广泛重视的一种治疗探索. 肠道菌群移植是一种古老的疗法, 在公元四世纪我国晋代葛洪的《肘后备急方》中即有"并善, 又绞粪汁, 饮数合至一二升, 谓之黄龙汤, 陈久者佳. "的记载, 西方最早的临床应用是1958年用于治疗伪膜性肠炎[5,6]. 但这种疗法一直未受到重视, 直到2013年初van Nood等[7]在新英格兰医学杂志发表了用此种方法治疗复发性难辨梭状芽胞杆菌肠炎的随机对照实验结果. 该研究将患者分为3组, 即万古霉素加洗肠并肠道菌群移植组, 万古霉素组及万古霉素加洗肠组. 中期分析的结果表明, 在接受菌群移植的16例患者中有13例在首次肠道菌群移植后即痊愈, 另外3例患者接受了第2次菌群移植后有2例痊愈, 治愈率达94%(15/16), 而万古霉素治疗组的13例患者有4例痊愈(31%), 万古霉素加洗肠组13例患者有3例被治愈(23%). 鉴于伦理考虑, 作者中止了该项临床实验, 全部患者都转为肠道菌群移植治疗[7]. 此文的报道引起了学术界对这种古老疗法的关注[8,9], 也引发了应用肠道菌群移植治疗其他多种疾病的思考和探索[10,11].
鉴于肠道菌群在炎症性肠病的发生和发展中发挥重要作用, 且溃疡性结肠炎患者常并发难辨梭状芽胞杆菌肠炎的事实, 医疗界开始探索肠道菌群移植治疗溃疡性结肠炎的可行性[12-15].
溃疡性结肠炎的发病与免疫系统功能紊乱有密切关系, 探索其治疗方法就需要了解该方法对免疫功能的影响和调控作用. 近年来对肠道菌群影响机体生理功能的认识越来越深入, 肠道菌群已经被认为是机体不可或缺的一个重要虚拟器官, 在机体的能量代谢、免疫系统的发生和功能调控等多个方面发挥重要作用[16]. 肠道菌群是由1000种以上的细菌所构成, 约含有1013-1014个细菌体, 比人类体细胞数量多出一个数量级, 所包括的基因数是人类基因组基因数量的100倍以上[17,18], 人粪便中约一半是肠道微生物[19]. 肠道菌群所包含的细菌大多数为厌氧菌, 且大多数品种(50%-90%)是不可培养的[16]. 不同个体的肠道菌群构成不同, 同一个个体的不同年龄段, 肠道菌群的种类也有差别[20].
人的肠道内有上万亿的细菌, 1 g粪便中含有1011个菌体[21]. 用16sRNA测序方法分析发现肠道菌群主要归属于四个菌门, 即拟杆菌门、厚壁菌门、放线菌门和变形菌门[22]. 肠道菌群与免疫系统的相互作用, 一方面对抗致病菌发挥对机体的保护作用, 另一方面诱导对共生菌的免疫耐受以维护肠道内环境的稳定, 这个过程被称为定植抵抗[23].
肠道菌群对于肠道黏膜的正常发育和黏膜免疫功能有重要的影响. 无菌小鼠的肠黏膜绒毛毛细血管发育不良, 黏膜相关淋巴组织的发育及抗体的产生也出现缺陷, 黏膜固有层细胞数减少, 肠系膜淋巴结生发中心浆细胞数量减少. 肠道菌群还可通过病原相关分子模式调节Toll样受体在免疫细胞的表达, 并通过Toll样受体激活核因子-κB信号通路及促进炎性细胞因子及α和β干扰素的产生, 从而增加共刺激分子在抗原提呈细胞表面的表达, 进而激活T细胞[20]. 因此肠道菌群不仅对天然免疫有调控作用, 而且也对适应性免疫有重要作用. 另外, 肠道菌群还参与机体的能量代谢和物质代谢. 肠道菌群的失调会导致机体各种疾病的发生.
肠道微生物与机体免疫系统的相互作用主要是通过Toll样受体介导的. 与在机体的其他部位激活Toll样受体所不同的是, 正常情况下胃肠道黏膜固有层的巨噬细胞和树突状细胞的Toll样受体激活后, 移行到肠道Peyer's集合淋巴结, 激活T细胞, 促进调节性T淋巴细胞(regulatory T cell, Treg)的激活和分化, 并产生白介素-10、转化生长因子-β等抑制性细胞因子, 诱导机体对肠道菌群的免疫耐受性, 称为黏膜耐受或口服耐受[24]. 许多因素可以引起肠道菌群的失调, 如现代生活方式导致的饮食结构的改变, 现代药物的使用如抗生素、制酸剂、质子泵抑制剂、非固醇类抗炎药物等. 肠道菌群失调导致侵袭性细菌过增长, 产生大量抗原引起病理性的免疫反应和肠道黏膜通透性的增加. 肠道的抗原提呈细胞及黏膜上皮细胞因免疫反应失控而产生大量的免疫活性细胞因子, 导致Th1和Th17细胞分化、激活和增殖, 而Treg细胞功能降低, 导致肠道炎症的发生[25].
肠道菌群移植常采用粪菌移植的方式, 是将健康捐献者的粪便混悬液输注到患者的胃肠道内以达到治疗疾病的目的[26]. 目前调控肠道菌群的方法有三种, 即: (1)应用益生元促进肠道有益菌的生长; (2)补充益生菌; (3)健康人肠道菌群移植, 重构患者的肠道菌群[27]. 由于肠道菌群由超过1000种以上的细菌组成, 而目前对于绝大多数肠道菌的作用缺乏认识, 因此, 益生元和益生菌的使用虽然取得了一定的效果, 但并没有达到理想的疗效. 近年来, 粪便菌群的移植成为患者肠道菌群重构的主要手段之一, 用于重构已发生异常的肠道菌群[28].
肠道菌群移植治疗溃疡性结肠炎的报道目前仍然较少, 在2012年以前全球共有17篇使用肠道菌群移植治疗炎症性肠病的报道, 共治疗炎症性肠病患者41例(其中27例溃疡性结肠炎, 12例克罗恩病, 2例未分类), 均为个案报道. 患者接受肠道菌群移植后, 随访时间为2 wk至13年, 76%的患者(19/25)症状明显减轻, 76%的患者(13/17)可以停止药物治疗, 63%的患者(15/24)病情完全缓解, 其中有15例患者伴有难辨梭状芽胞杆菌肠炎全部治愈[29]. 从这些个案报道的结果来看, 肠道菌群移植治疗溃疡性结肠炎的疗效或许优于药物治疗[17].
2015年Gastroenterology同时报道了肠道菌群移植治疗溃疡性结肠炎的两项双盲随机对照实验研究结果. 一项由荷兰医师进行的TURN试验, 是一个单中心的双盲随机对照研究, 共纳入50例轻中度溃疡性结肠炎患者, 研究对象排除了伴有难辨梭状芽胞杆菌感染者及近30 d内应用抗生素或益生菌者, 按照1:1的比例随机分为接受捐献者粪便悬液的治疗组和接受自体粪便悬液的对照组, 患者经鼻-十二指肠管途径, 共接受2次各500 mL粪便混悬液的输入, 两次治疗间隔3 wk, 结果在临床症状改善和内镜下黏膜病变的改善方面, 两组都没有统计学差异, 12 wk后进一步分析发现治疗组有效的患者肠道菌群与其捐赠者类似, 而无效的患者其肠道菌群构成无明显改变[30]. 这种现象也被其他研究报告[31]证实. 本项临床试验在进行第2次中期分析时, 由于疗效不佳, 被数据安全监控委员会建议中止. 另外一项临床试验是由加拿大医师进行的单中心双盲随机对照研究. 治疗组和对照组分别纳入38例和37例溃疡性结肠炎患者, 排除了感染性因素导致溃疡性结肠炎发作的患者及6 wk内服用过抗生素及益生菌的患者, 允许继续使用常规药物如5-氨基水杨酸、糖皮质激素、免疫抑制剂或肿瘤坏死因子拮抗剂, 健康捐献者粪便50 g加300 mL饮用水充分混匀、过滤, 取50 mL滤液给予治疗组患者保留灌肠, 1次/wk, 共6 wk, 对照组患者用50 mL水同样保留灌肠, 在治疗前及第7周时行乙状结肠镜检查, 比较两组患者的Mayo积分、炎症性肠病问卷积分及生活质量问卷积分的差异. 治疗组的缓解率为9/38(24%), 对照组为2/37(5%), 两组比较有显著差异(P = 0.03), 但没有患者能达到Mayo内镜积分为0的状态, 在症状和生活质量改善方面两组患者没有显著差异. 进一步分析发现来自某个捐献者的粪菌治疗效果显著好于其他捐献者. 随访显示在第7周时病情缓解的9例患者在第52周时仍有8例患者保持病情缓解, 其中4例患者停止药物治疗. 同样地, 该项试验由于没有达到预期的主要疗效指标, 在中期分析时被数据监控和安全委员会建议停止[32]. 类似的研究[33]同样表明, 4例儿童溃疡性结肠炎患者接受单次经鼻胃管途径粪菌移植后, 临床症状及粪便钙卫蛋白及血清C-反应蛋白、血细胞压积及白蛋白水平均无改善.
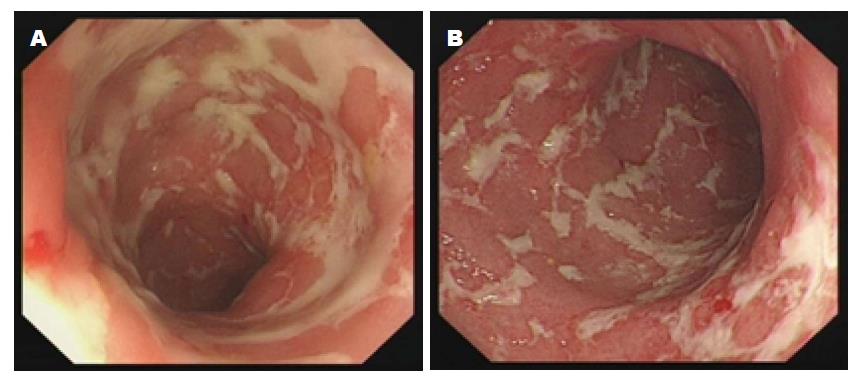
我们也对肠道菌群移植治疗溃疡性结肠炎患者进行了初步的临床观察. 我们采用健康捐献者粪便50-100 g, 按5 mL/g粪便的比例用灭菌生理盐水制成粪便混悬液, 经过滤除渣后的粪菌悬液, 离心浓缩成50-100 mL体积后, 给予溃疡性结肠炎患者保留灌肠. 考虑到前述的研究采用的肠道菌群移植次数较少, 间隔较长(共2次, 间隔3 wk; 共6次, 1次/wk; 单次), 移植的肠道菌群或许不能在患者的肠道内占据优势地位, 因此, 我们增加了移植的频率和总次数, 采用5次/wk, 连续治疗2 wk, 患者共接受肠道菌群移植10次, 以期移植的肠道菌群有足够的数量, 能够在患者的肠道占据优势菌群的地位. 治疗结束1 mo后复查结肠镜. 从初步的观察结果看, 我们接受肠道菌群移植的患者在移植治疗结束1 mo后, 内窥镜下观察结肠黏膜病变无显著的改善, 仍呈现充血、溃疡及脓苔的征象(图1).
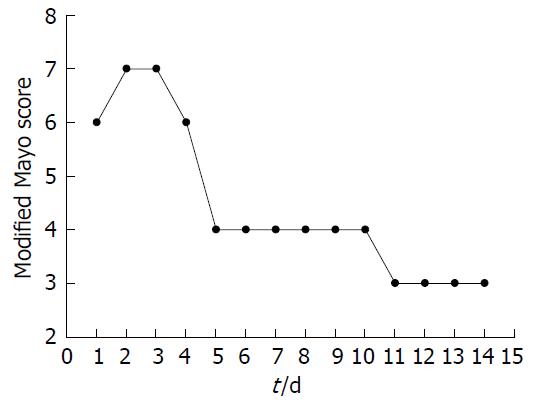
但患者的主观症状如排便次数、大便性状、排便急迫等均有明显改善, 尤其是排便次数及排便急迫感改善明显. 有的患者肠道菌群移植治疗前排便急迫, 经常来不及走到厕所即便溺在裤内, 每天排稀便3次以上, 肠道菌群移植治疗后该患者每天排便1次, 为成型便, 便溺在裤内的现象未再发生, 生活质量有显著提高, 粪便中脓血虽有减少, 但仍然存在, 无结肠镜结果的改良Mayo评分有明显改善(图2).
在溃疡性结肠炎的治疗中, 肠道菌群移植的疗效报道不尽相同. 最近报道的一项Meta分析, 纳入了11项研究报告(包括2项随机对照研究, 1项开放的病例对照研究和8项队列研究)共133例溃疡性结肠炎患者, 结果表明肠道菌群移植治疗溃疡性结肠炎的临床缓解率为30.4%, 通过上消化道或下消化道进行菌群移植没有显著差别, 单次移植或多次移植对于溃疡性结肠炎的临床缓解率也没有显著的影响[34]. 但也有报道[35]说明重复的肠道菌群移植或许优于单次移植治疗. 虽然肠道菌群移植治疗溃疡性结肠炎的临床缓解率并不理想, 但对于患者的生活质量还是有比较明显的改善[36], 安全性好, 操作方便[37], 这也与我们观察的结果类似. 从现有的报道结果来看, 来自不同捐赠者的肠道菌群对患者的疗效是有差别的, 不同的患者对肠道菌群移植的治疗反应也不尽相同, 目前尚不了解肠道菌群中的哪种/哪些种细菌对溃疡性结肠炎产生治疗作用, 规范的肠道菌群移植究竟是使用捐赠者的全部粪菌, 还是选择有效的几种菌群在体外混合后进行移植[38], 也不明确什么样的溃疡性结肠炎患者对肠道菌群移植有较好的治疗反应. 今后的研究应该解决这两方面的问题, 使肠道菌群移植治疗溃疡性结肠炎转变成肠道菌种移植治疗某种有特殊适应证的溃疡性结肠炎患者, 使肠道菌群移植治疗溃疡性结肠炎成为一种更有针对性的治疗方法. 从目前的资料看, 鉴于肠道菌群移植对于难辨梭状芽胞杆菌肠炎的明确疗效[39,40], 对于伴有难辨梭状芽胞杆菌感染的炎症性肠病患者或许是更好的选择[23,41].
肠道菌群移植后, 由于肠道菌群组成的改变, 可能会导致受者黏膜细胞基因表达的改变[42], 肠道黏膜免疫功能的改变[43], 肠道生态环境的改变[44], 以及机体代谢的改变[45], 这不仅影响到胃肠道疾病的变化, 也影响到胃肠道外其他疾病的病程[46]. 因此肠道菌群移植带来的受者的病理和生理的改变, 也需要长期的观察.
另外, 由于肠道菌群的多样性和不确定性, 目前肠道菌群移植的治疗规范难以制定. 肠道菌群究竟是作为一种药物来管理, 还是作为一种人体的组织器官来管理, 也有较大争议. 美国食品药物管理局在2012年将人类粪便归类为药物, 但由于粪便成分的高度可变性及其广泛的可获得性, 使其作为药品管理难以实施[47-50], 也难以制订相应的治疗指南[51]. 这些问题都制约着肠道菌群移植的规范化及其具体应用, 有效菌种的明确及治疗对象的明确, 不仅会使这种治疗方法更加规范, 也会使管理更为规范[52].
溃疡性结肠炎的发病与肠道菌群有密切的关系, 但究竟是哪种细菌导致了溃疡性结肠炎的发生目前尚无明确的结论, 因此肠道菌群移植治疗溃疡性结肠炎也只能是一种临床的探索性试验, 无法按照特定的菌群进行扩增或移植. 但从目前的临床试验结果看, 来自某些捐献者的肠道菌群移植后, 疗效明显好于其他捐献者的肠道菌群, 说明有某些特定的菌群对疗效产生决定性的影响[32].
早期的某些个案报道显示肠道菌群移植治疗溃疡性结肠炎的疗效显著, 这可能是由于这些个案报道的作者只选择了有效的病例进行报道, 而治疗无效的病例则被放弃报道的缘故. 从目前的几项小规模的随机对照临床试验的结果看, 肠道菌群移植治疗溃疡性结肠炎具有一定的疗效, 但远不像原先想象的那样疗效显著. 从我们的观察结果看, 短时间内多次肠道菌群移植有助于移植菌群在患者肠道占据优势地位, 对于缓解患者的临床症状是有效的, 但与单次移植相比是否有差别, 还需要进一步的观察, 另外肠道菌群移植对于黏膜病变是否有改善还需更长时间的观察.
总之, 在肠道菌群移植对于溃疡性结肠炎的治疗方面, 还有很多的未解之谜, 还需要大量的临床和基础研究去探索和规范化[53].
肠道菌群变化可影响机体的免疫功能, 与溃疡性结肠炎的发病有密切关系, 改变肠道菌群的组成, 可能会对溃疡性结肠炎的治疗发挥有益的作用.
肠道菌群是人体的重要组成部分, 被认为是人体的虚拟器官, 对机体的免疫和代谢都有重要的影响, 与多种疾病密切相关, 溃疡性结肠炎的发病被认为与肠道菌群和机体免疫功能异常密切相关, 是近年来研究的热点之一.
2015年Gastroenterology上发表的2篇粪菌移植治疗溃疡性结肠炎的随机对照研究, 是近年来发表的较为权威的2篇论文. 这两项研究的结果均提示粪菌移植的疗效与捐赠者及患者的因素有密切关系.
肠道菌群移植治疗溃疡性结肠炎是目前研究的热点之一. 本文总结了目前最新的研究报道, 并结合了作者自己的初步研究结果, 分析了肠道菌群移植治疗溃疡性结肠炎的进展及影响疗效的可能因素.
本文通过总结相关研究的结果, 分析了影响肠道菌群移植治疗溃疡性结肠炎疗效的相关因素, 提出了此类研究目前尚未解决的问题, 为今后的研究指出了方向.
粪菌移植: 将捐赠者新鲜粪便中的菌群通过淘洗、过滤、离心等方法分离出来, 通过上消化道或下消化道途径移植到受者肠道, 使其在受者肠道生长、繁殖, 从而改变受者肠道菌群的组成和内环境, 达到治疗的作用.
李宁, 主任医师, 南京军区南京总医院(金陵医院)普通外科; 刘刚, 主任医师, 天津医科大学总医院普通外科; 张涛, 副主任医师, 广西中医药大学附属瑞康医院消化内科
本文充分综述了本学科的研究进展, 内容丰富, 论述得当, 对粪菌移植与溃疡性结肠炎的关系做了较为详细的阐述. 参考文献较新, 语言流畅, 详略得当.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
编辑:于明茜 电编:李瑞芳
| 1. | Prideaux L, Kamm MA, De Cruz PP, Chan FK, Ng SC. Inflammatory bowel disease in Asia: a systematic review. J Gastroenterol Hepatol. 2012;27:1266-1280. [PubMed] [DOI] |
| 2. | Wang YF, Ouyang Q, Hu RW. Progression of inflammatory bowel disease in China. J Dig Dis. 2010;11:76-82. [PubMed] [DOI] |
| 3. | Borody TJ, Campbell J. Fecal microbiota transplantation: current status and future directions. Expert Rev Gastroenterol Hepatol. 2011;5:653-655. [PubMed] [DOI] |
| 4. | Ordás I, Eckmann L, Talamini M, Baumgart DC, Sandborn WJ. Ulcerative colitis. Lancet. 2012;380:1606-1619. [PubMed] [DOI] |
| 5. | Eiseman B, Silen W, Bascom GS, Kauver AJ. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. 1958;44:854-859. [PubMed] |
| 6. | Cutolo LC, Kleppel NH, Freund HR, Holker J. Fecal feedings as a therapy in Staphylococcus enterocolitis. N Y State J Med. 1959;59:3831-3833. [PubMed] |
| 7. | van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, Visser CE, Kuijper EJ, Bartelsman JF, Tijssen JG. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med. 2013;368:407-415. [PubMed] [DOI] |
| 8. | Kelly CP. Fecal microbiota transplantation--an old therapy comes of age. N Engl J Med. 2013;368:474-475. [PubMed] [DOI] |
| 9. | Cammarota G, Ianiro G, Bibbò S, Gasbarrini A. Fecal microbiota transplantation: a new old kid on the block for the management of gut microbiota-related disease. J Clin Gastroenterol. 2014;48 Suppl 1:S80-S84. [PubMed] [DOI] |
| 10. | Singh R, Nieuwdorp M, ten Berge IJ, Bemelman FJ, Geerlings SE. The potential beneficial role of faecal microbiota transplantation in diseases other than Clostridium difficile infection. Clin Microbiol Infect. 2014;20:1119-1125. [PubMed] [DOI] |
| 11. | Aroniadis OC, Brandt LJ. Intestinal microbiota and the efficacy of fecal microbiota transplantation in gastrointestinal disease. Gastroenterol Hepatol (N Y). 2014;10:230-237. [PubMed] |
| 12. | Sha S, Liang J, Chen M, Xu B, Liang C, Wei N, Wu K. Systematic review: faecal microbiota transplantation therapy for digestive and nondigestive disorders in adults and children. Aliment Pharmacol Ther. 2014;39:1003-1032. [PubMed] [DOI] |
| 13. | Matsuoka K, Mizuno S, Hayashi A, Hisamatsu T, Naganuma M, Kanai T. Fecal microbiota transplantation for gastrointestinal diseases. Keio J Med. 2014;63:69-74. [PubMed] [DOI] |
| 14. | Kahn SA, Goeppinger SR, Rubin DT. Fecal microbiota transplantation: an interest in IBD? Nestle Nutr Inst Workshop Ser. 2014;79:101-114. [PubMed] [DOI] |
| 15. | Borody TJ, Brandt LJ, Paramsothy S. Therapeutic faecal microbiota transplantation: current status and future developments. Curr Opin Gastroenterol. 2014;30:97-105. [PubMed] [DOI] |
| 16. | Borody TJ, Khoruts A. Fecal microbiota transplantation and emerging applications. Nat Rev Gastroenterol Hepatol. 2012;9:88-96. [PubMed] [DOI] |
| 17. | Borody TJ, Campbell J. Fecal microbiota transplantation: techniques, applications, and issues. Gastroenterol Clin North Am. 2012;41:781-803. [PubMed] [DOI] |
| 18. | Guinane CM, Cotter PD. Role of the gut microbiota in health and chronic gastrointestinal disease: understanding a hidden metabolic organ. Therap Adv Gastroenterol. 2013;6:295-308. [PubMed] [DOI] |
| 19. | De Cruz P, Prideaux L, Wagner J, Ng SC, McSweeney C, Kirkwood C, Morrison M, Kamm MA. Characterization of the gastrointestinal microbiota in health and inflammatory bowel disease. Inflamm Bowel Dis. 2012;18:372-390. [PubMed] [DOI] |
| 20. | Purchiaroni F, Tortora A, Gabrielli M, Bertucci F, Gigante G, Ianiro G, Ojetti V, Scarpellini E, Gasbarrini A. The role of intestinal microbiota and the immune system. Eur Rev Med Pharmacol Sci. 2013;17:323-333. [PubMed] |
| 21. | Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science. 2006;312:1355-1359. [PubMed] [DOI] |
| 22. | Zoetendal EG, Vaughan EE, de Vos WM. A microbial world within us. Mol Microbiol. 2006;59:1639-1650. [PubMed] [DOI] |
| 23. | van Nood E, Speelman P, Nieuwdorp M, Keller J. Fecal microbiota transplantation: facts and controversies. Curr Opin Gastroenterol. 2014;30:34-39. [PubMed] [DOI] |
| 24. | Jin B, Sun T, Yu XH, Yang YX, Yeo AE. The effects of TLR activation on T-cell development and differentiation. Clin Dev Immunol. 2012;2012:836485. [PubMed] |
| 25. | Shim JO. Gut microbiota in inflammatory bowel disease. Pediatr Gastroenterol Hepatol Nutr. 2013;16:17-21. [PubMed] [DOI] |
| 26. | Brandt LJ, Aroniadis OC. An overview of fecal microbiota transplantation: techniques, indications, and outcomes. Gastrointest Endosc. 2013;78:240-249. [PubMed] [DOI] |
| 27. | Verbeke KA, Boesmans L, Boets E. Modulating the microbiota in inflammatory bowel diseases: prebiotics, probiotics or faecal transplantation? Proc Nutr Soc. 2014;73:490-497. [PubMed] [DOI] |
| 28. | Seekatz AM, Aas J, Gessert CE, Rubin TA, Saman DM, Bakken JS, Young VB. Recovery of the gut microbiome following fecal microbiota transplantation. MBio. 2014;5:e00893-e00814. [PubMed] [DOI] |
| 29. | Anderson JL, Edney RJ, Whelan K. Systematic review: faecal microbiota transplantation in the management of inflammatory bowel disease. Aliment Pharmacol Ther. 2012;36:503-516. [PubMed] [DOI] |
| 30. | Rossen NG, Fuentes S, van der Spek MJ, Tijssen JG, Hartman JH, Duflou A, Löwenberg M, van den Brink GR, Mathus-Vliegen EM, de Vos WM. Findings From a Randomized Controlled Trial of Fecal Transplantation for Patients With Ulcerative Colitis. Gastroenterology. 2015;149:110-118.e4. [PubMed] [DOI] |
| 31. | Damman CJ, Brittnacher MJ, Westerhoff M, Hayden HS, Radey M, Hager KR, Marquis SR, Miller SI, Zisman TL. Low Level Engraftment and Improvement following a Single Colonoscopic Administration of Fecal Microbiota to Patients with Ulcerative Colitis. PLoS One. 2015;10:e0133925. [PubMed] [DOI] |
| 32. | Moayyedi P, Surette MG, Kim PT, Libertucci J, Wolfe M, Onischi C, Armstrong D, Marshall JK, Kassam Z, Reinisch W. Fecal Microbiota Transplantation Induces Remission in Patients With Active Ulcerative Colitis in a Randomized Controlled Trial. Gastroenterology. 2015;149:102-109.e6. [PubMed] [DOI] |
| 33. | Suskind DL, Singh N, Nielson H, Wahbeh G. Fecal microbial transplant via nasogastric tube for active pediatric ulcerative colitis. J Pediatr Gastroenterol Nutr. 2015;60:27-29. [PubMed] [DOI] |
| 34. | Sun D, Li W, Li S, Cen Y, Xu Q, Li Y, Sun Y, Qi Y, Lin Y, Yang T. Fecal Microbiota Transplantation as a Novel Therapy for Ulcerative Colitis: A Systematic Review and Meta-Analysis. Medicine (Baltimore). 2016;95:e3765. [PubMed] [DOI] |
| 35. | Cui B, Li P, Xu L, Zhao Y, Wang H, Peng Z, Xu H, Xiang J, He Z, Zhang T. Step-up fecal microbiota transplantation strategy: a pilot study for steroid-dependent ulcerative colitis. J Transl Med. 2015;13:298. [PubMed] [DOI] |
| 36. | Wei Y, Zhu W, Gong J, Guo D, Gu L, Li N, Li J. Fecal Microbiota Transplantation Improves the Quality of Life in Patients with Inflammatory Bowel Disease. Gastroenterol Res Pract. 2015;2015:517597. [PubMed] [DOI] |
| 37. | Scaldaferri F, Pecere S, Petito V, Zambrano D, Fiore L, Lopetuso LR, Schiavoni E, Bruno G, Gerardi V, Laterza L. Efficacy and Mechanisms of Action of Fecal Microbiota Transplantation in Ulcerative Colitis: Pitfalls and Promises From a First Meta-Analysis. Transplant Proc. 2016;48:402-407. [PubMed] [DOI] |
| 38. | Petrof EO, Khoruts A. From stool transplants to next-generation microbiota therapeutics. Gastroenterology. 2014;146:1573-1582. [PubMed] [DOI] |
| 39. | Youngster I, Russell GH, Pindar C, Ziv-Baran T, Sauk J, Hohmann EL. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection. JAMA. 2014;312:1772-1778. [PubMed] [DOI] |
| 40. | Kelly CR, Ihunnah C, Fischer M, Khoruts A, Surawicz C, Afzali A, Aroniadis O, Barto A, Borody T, Giovanelli A. Fecal microbiota transplant for treatment of Clostridium difficile infection in immunocompromised patients. Am J Gastroenterol. 2014;109:1065-1071. [PubMed] [DOI] |
| 41. | Aratari A, Cammarota G, Papi C. Fecal microbiota transplantation for recurrent C. difficile infection in a patient with chronic refractory ulcerative colitis. J Crohns Colitis. 2015;9:367. [PubMed] [DOI] |
| 42. | Kellermayer R, Nagy-Szakal D, Harris RA, Luna RA, Pitashny M, Schady D, Mir SA, Lopez ME, Gilger MA, Belmont J. Serial fecal microbiota transplantation alters mucosal gene expression in pediatric ulcerative colitis. Am J Gastroenterol. 2015;110:604-606. [PubMed] [DOI] |
| 43. | Pamer EG. Fecal microbiota transplantation: effectiveness, complexities, and lingering concerns. Mucosal Immunol. 2014;7:210-214. [PubMed] [DOI] |
| 44. | Khoruts A, Weingarden AR. Emergence of fecal microbiota transplantation as an approach to repair disrupted microbial gut ecology. Immunol Lett. 2014;162:77-81. [PubMed] [DOI] |
| 45. | Woting A, Blaut M. The Intestinal Microbiota in Metabolic Disease. Nutrients. 2016;8:202. [PubMed] [DOI] |
| 46. | Konturek PC, Haziri D, Brzozowski T, Hess T, Heyman S, Kwiecien S, Konturek SJ, Koziel J. Emerging role of fecal microbiota therapy in the treatment of gastrointestinal and extra-gastrointestinal diseases. J Physiol Pharmacol. 2015;66:483-491. [PubMed] |
| 47. | Vyas D, Aekka A, Vyas A. Fecal transplant policy and legislation. World J Gastroenterol. 2015;21:6-11. [PubMed] [DOI] |
| 48. | Moore T, Rodriguez A, Bakken JS. Fecal microbiota transplantation: a practical update for the infectious disease specialist. Clin Infect Dis. 2014;58:541-545. [PubMed] [DOI] |
| 49. | Kump PK, Krause R, Allerberger F, Högenauer C. Faecal microbiota transplantation--the Austrian approach. Clin Microbiol Infect. 2014;20:1106-1111. [PubMed] [DOI] |
| 50. | Kelly CR, Kunde SS, Khoruts A. Guidance on preparing an investigational new drug application for fecal microbiota transplantation studies. Clin Gastroenterol Hepatol. 2014;12:283-288. [PubMed] [DOI] |
| 51. | Bourlioux P. Faecal microbiota transplantation: Key points to consider. Ann Pharm Fr. 2015;73:163-168. [PubMed] [DOI] |
| 52. | Ianiro G, Bibbò S, Scaldaferri F, Gasbarrini A, Cammarota G. Fecal microbiota transplantation in inflammatory bowel disease: beyond the excitement. Medicine (Baltimore). 2014;93:e97. [PubMed] [DOI] |
| 53. | Wang ZK, Yang YS, Chen Y, Yuan J, Sun G, Peng LH. Intestinal microbiota pathogenesis and fecal microbiota transplantation for inflammatory bowel disease. World J Gastroenterol. 2014;20:14805-14820. [PubMed] [DOI] |