修回日期: 2016-01-14
接受日期: 2016-02-02
在线出版日期: 2016-03-18
目的: 观察过表达CXCR4的骨髓间充质干细胞治疗2,4,6-三硝基苯磺酸诱导的实验性结肠炎的效果及其潜在的免疫作用机制.
方法: 从♀SD大鼠骨髓中分离骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)并使用流式细胞术鉴定. 通过慢病毒技术使BMSCs表达GFP(green fluorescent protein-GFP, Ad-GFP-BMSCs)或共表达CXCR4和GFP(Ad-CXCR4-BMSCs), 32只大鼠被随机分成4组(n = 8): 空白组、模型组、Ad-GFP-BMSCs组、Ad-CXCR4-BMSCs组. 采用TNBS诱导实验性结肠炎, 尾静脉注射Ad-CXCR4-BMSCs或Ad-GFP-BMSCs. 治疗1 wk, 收集结肠组织进行HE染色和病理学分析. PCR检测结肠部位干扰素-γ(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-6和IL-10的mRNA表达, Western blot检测信号传导子及转录激活子(signal transducer and activator of transcription, STAT)-3和磷酸化STAT-3蛋白表达, 免疫组织化学检测磷酸化STAT3蛋白表达.
结果: 相对于空白组, 模型组结肠部位的IFN-γ、TNF-α、IL-6和IL-10的mRNA表达显著上升, STAT-3及磷酸化STAT-3的蛋白表达明显上升(P<0.05). 系统治疗1 wk后, 相对于模型组, Ad-GFP-BMSCs组大鼠的临床症状及结肠病理损害并没有得到有效的缓解. 相对于Ad-GFP-BMSCs组, Ad-CXCR4-BMSCs组大鼠结肠组织的IFN-γ、TNF-α、IL-6的mRNA表达显著下降, IL-10的mRNA表达显著上升(P<0.05); STAT3及磷酸化STAT-3的蛋白表达显著下降(P<0.05).
结论: 过表达CXCR4的BMSCs可能通过抗炎及免疫调节机制来缓解实验性结肠炎, 这可能为BMSC缓解IBD提供可靠的理论依据.
核心提示: 前期研究虽已证实SDF-1α/CXCR4轴能够有效的促进骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)归巢于受损结肠部位, 但其具体的治疗机制尚不清楚. 本研究探讨过表达CXCR4的BMSCs可能通过抗炎及免疫调节机制来缓解实验性结肠炎, 这可能为BMSC缓解炎症性肠病提供可靠的理论依据.
引文著录: 刘星星, 范恒, 唐庆, 寿折星, 陶玲, 张丽娟, 左冬梅. 过表达CXCR4的间充质干细胞缓解实验性结肠炎. 世界华人消化杂志 2016; 24(8): 1233-1240
Revised: January 14, 2016
Accepted: February 2, 2016
Published online: March 18, 2016
AIM: To investigate the role of SDF-1α/CXCR4 axis in the therapeutic effects of lentivirus-preconditioned bone mesenchymal stem cells (BMSCs) for 2,4,6-trinitrobenzene sulfonic acid (TNBS)- induced colitis in rats.
METHODS: BMSCs were isolated from Sprague-Dawley (SD) rats and identified by flow cytometry. Lentivirus transfection was applied to over-express CXCR4/GFP (Ad-CXCR4-BMSCs) or null/GFP (Ad-GFP-BMSCs) in BMSCs. Thirty-two SD rats were randomly divided into four groups (n = 8): a control group, a model group, an Ad-GFP-BMSCs group and an Ad-CXCR4-BMSCs group. The rats were grouped to receive various treatments by tail vein injections. On day 1, colitis was induced by the TNBS administration. On day 12, animals were anesthetized and submitted to a laparotomy under sterile conditions. The distal colon was then opened longitudinally, slightly cleaned in physiological saline for faecal residue removal, and tissue samples were harvested and analyzed for various studies.
RESULTS: One week after intravenous administration, Ad-GFP-BMSCs failed to colonize in the inflamed colon and had no beneficial effect in TNBS-induced colitis. Instead, Ad-CXCR4-BMSCs signally ameliorated both clinical and microanatomical severity of colitis. Immunofluorescence and Western blot showed that Ad-CXCR4-BMSCs migrated toward inflamed colon was more efficient than Ad-GFP-BMSCs. The therapeutic effect of Ad-CXCR4-BMSCs was mediated by the suppression of pro-inflammatory cytokines and STAT3 phosphorylation in injured colon.
CONCLUSION: Our data indicate that over-expression of CXCR4 promotes the in vivo mobilization and engraftment of BMSCs into inflamed colon where these cells can function as an anti-inflammatory and immunomodulatory component of the immune system in TNBS-induced colitis.
- Citation: Liu XX, Fan H, Tang Q, Shou ZX, Tao L, Zhang LJ, Zuo DM. Intravenous administration of mesenchymal stem cells overexpressing CXCR4 protects against experimental colitis in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(8): 1233-1240
- URL: https://www.wjgnet.com/1009-3079/full/v24/i8/1233.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i8.1233
炎症性肠病(inflammatory bowel disease, IBD), 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 是一种治疗手段比较有限且易复发的消化系统疾病, 临床表现以腹痛、腹泻、黏液血便为主, 他被世界卫生组织列为难治性疾病之一. 流行病学资料显示IBD影响了超过250万的欧洲人种, 在其他人群中患病率也在逐年上升[1]. 最新研究表明异常的免疫和炎症应答是IBD发病的关键机制[2,3]. 慢性炎症破坏了肠道上皮层并形成了黏膜溃疡, 抑制炎症的过程伴随着肠道组织重塑[4]. 炎症和免疫系统是由多种细胞因子调控的, 比如干扰素-γ(interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-2、IL-6、IL-17、IL-4、IL-10、HLA-g和转化生长因子β(transforming growth factor-β, TGF-β)[5-8]. 这些细胞因子通过JAK激酶和信号传导子及转录激活子(signal transducer and activator of transcription, STAT)来发挥其生物学功能. STAT3在天然和获得性免疫应答中都起重要的作用[9], 最近有许多的研究[10,11]在探讨STAT在IBD中扮演的作用, 在人类IBD患者和实验性结肠炎中, STAT3都出现强烈的磷酸化[12]. 这些研究都表明STAT3在IBD的病理过程中扮演着至关重要的作用. 在前期研究[13]中, 我们证实了SDF-1/CXCR4轴能够有效的促进过表达CXCR4的骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)归巢于三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid, TNBS)诱导的结肠炎受损结肠部位的效率. 接下来我们将通过观察IBD结肠部位细胞因子表达, 重点讨论系统性注射BMSCs在治疗实验性结肠炎中潜在的作用机制.
8-10周龄大鼠32只♀SPF级SD大鼠, 体质量250 g±30 g, 购自湖北省疾病预防控制中心[许可证号: SCXK(鄂)2010-0057], LentivirusNull/CXCR4和LentivirusGFP/CXCR4(上海吉凯基因, GOSL29538); TRIzol裂解液(上海碧云天生物技术公司); 兔抗大鼠STAT3多克隆抗体(Abcam); 兔抗大鼠磷酸化STAT3(Abcam); 羊抗兔IgG二抗(Beyotime); Goldview核酸染料(北京百泰克生物公司); 即用型免疫组织化学试剂盒(上海迈新生物科技有限公司); 苏木精和曙红(hematoxylin and eosin, HE)染色试剂盒(北京索莱宝科技有限公司); 荧光显微镜(Nikon).
1.2.1 实验分组及治疗: 在1 wk的驯化期后, 32只♀SD大鼠被随机分成4组(n = 8): 空白组、模型组、Ad-GFP-BMSCs组和Ad-CXCR4-BMSCs组. 在整个实验过程中, 每天记录大鼠的DAI, 每组大鼠都通过尾静脉注射治疗. 第1天, 除空白组外, 其余3组均给予TNBS诱导结肠炎. 第4天, 结肠炎组大鼠分别接受PBS、Ad-GFP-BMSCs(2×106/mL)或Ad-CXCR4-BMSCs(2×106/mL)各1 mL. 第11天, 大鼠禁食24 h后行麻醉剖腹手术. 迅速取下完整结肠并测量其长度, 然后末端结肠被纵向打开, 用生理盐水轻微冲洗结肠, 收集结肠并用于多种研究. 其中一部分4%多聚甲醛固定, 石蜡包埋切片并HE染色, 镜下观察标本病理学改变; 另一部分标本组织液氮冰冻保存备用.
1.2.2 Western blot检测: 将结肠标本与液氮充分混合研磨, 利用RIPA裂解液充分裂解收集的研磨组织, 组织裂解液13000 r/min, 4 ℃离心10 min, 取上清获得结肠总蛋白萃取物. 取各样品蛋白萃取物上样行SDS-PAGE电泳, 设定电压为100 V, 进入分离胶后, 设定电压为150 V, 当样品缓冲液中的溴酚蓝指示剂到达凝胶底部时, 终止电泳. 根据Marker切下目的条带, 转移缓冲液平衡30 min, 剪和凝胶同样大小的PVDF膜和滤纸, PVDF膜浸在甲醇中2 s后, 和滤纸一起浸泡于印迹缓冲液中10 min, 然后按红色电极(+)-白色板-海绵-3层滤纸-PVDF膜-凝胶-3层滤纸-海绵-黑色板-黑色电极(-)顺序安置, 将槽中加入印迹缓冲液, 按上冰盒, 75 V, 1 h. 用含5%脱脂牛奶的TBST封闭液室温摇床封闭PVDF膜2 h, 先后加入抗-STAT3抗体和抗-磷酸化STAT3, 4 ℃过夜, 然后分别加入酶标羊抗兔Ig-G2抗并进行化学发光分析.
1.2.3 RT-PCR检测: 设计引物序列如表1. 抽提结肠标本的总RNA, 总RNA的抽提根据美国英杰公司的试剂盒操作说明书进行. 并用分光光度计测量RNA的浓度, RNA逆转录体系: 2 μL Total RNA、1 μL Oligo dT(5 μg/μL)1 μL、ddH2O 6 μL混匀后离心, 70 ℃温浴5 min, 立即插入到0 ℃冰水浴中1 min, 离心后每个反应管中加入11 μL的RT反应液: 5×RT Buffer 4 μL、RNase 0.5 μL、M-MLV 1 μL、dNTP(2.5 mmol/L)2 μL, ddH2O 3.5 μL. 逆转录条件: 42 ℃ 1 h, 70 ℃ 10 min, 得到cDNA. RT-PCR反应体系: SYBR premix ex taq 10 μL, 上下游引物(5 μmol/μL) 1 μL, cDNA 1 μL, ddH2O 7.5 μL; 反应条件: 预变性95 ℃ 15 s, 95 ℃ 5 s, 60 ℃ 30 s, 共40个循环. 以GAPDH为内参, 对IL-6、TNF-α、INF-γ、IL-10的产物相对定量, 读取Ct值, 使用2-△△Ct方法进行相对定量分析.
| 基因 | 上游引物 | 下游引物 |
| IL-6 | GTCTCGAGCCCACCAGGAACG | AGGGAAGGCAGTGGCTGTCAAC |
| TNF-α | TGGGTCCAACTCCGGGCTCA | TGGAATCCTTGCCGGTGGCG |
| IFN-γ | ACAACCCACAGATCCAGCAC | CCAGAATCAGCACCGACTCC |
| IL-10 | TTGAACCACCCGGCATCTAC | CCAAGGAGTTGCTCCCGTTA |
| GAPDH | GGGGCTCTCTGCTC CTCCCTG | CGGCCAAATCCGTTCACACCG |
1.2.4 免疫组织化学检测: 采用免疫组织化学染色(SP法): 常规石蜡包埋, 切片, 二甲苯脱蜡, 乙醇水化, 微波炉高压修复抗原, 冷却, 3%H2O2灭活内源性过氧化物酶, PBS洗涤, 组织画圈, 圈内滴加5%正常山羊血清封闭液, 清除封闭液后再滴加兔抗鼠磷酸化STAT3多克隆抗体, 4 ℃湿盒内过夜, PBS洗涤, 滴加二抗, 室温静置, PBS洗涤, DAB显色, 光镜下显色, 待颜色满意后, 蒸馏水冲洗终止显色, 苏木精复染, 乙醇分化, 氨水返蓝15 s; 乙醇脱水干燥, 二甲苯透明, 中性树胶封片, 显微镜下观察免疫组织化学结果, 用图像分析软件Image-Pro Plus 6.0进行图像分析, 以黄色或棕黄色染色为阳性表达.
统计学处理 实验计量数据以mean±SE表示, 两组间差异采用t检验, 多组间均数差异采用单因素方差分析, 采用SPSS18.0统计软件进行分析, 以P<0.05为差异有统计学意义.
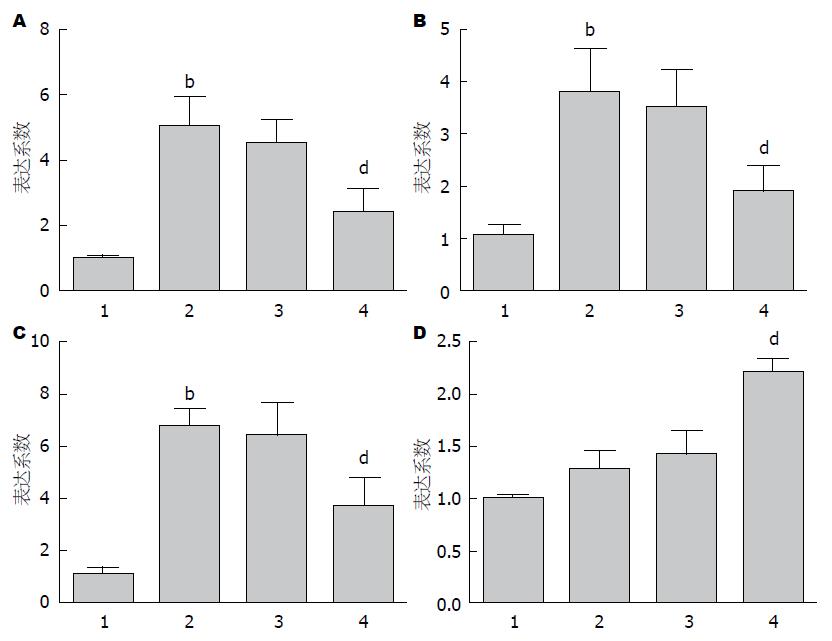
通过RT-PCR检测发现, 在第11天, 结肠炎组大鼠受损结肠部位的促炎因子如IFN-γ、TNF-α和IL-6显著增加, 通过系统注射Ad-CXCR4-BMSCs治疗后则显著的下降了IFN-γ(2.37±1.85 vs 5.01±2.23, P = 0.49, 图1A)、TNF-α(1.74±0.84 vs 3.93±1.92, P = 0.03, 图1B)和IL-6(3.71±2.63 vs 6.78±1.64, P = 0.03, 图1C)的mRNA表达. 同时, 相对于模型组, 抗炎因子IL-10的mRNA表达则明显上调(图1D). 但是值得注意的是, Ad-CXCR4-BMSCs治疗后, IL-10的mRNA表达差异并无统计学意义(1.42±0.60 vs 1.27±0.45, P = 0.64).
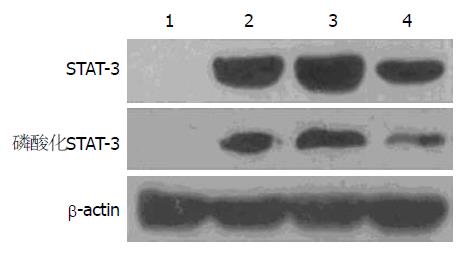
Western blot结果表明, 在第11天, 空白组大鼠结肠部位几乎观察不到STAT3和磷酸化STAT3蛋白表达, 而结肠炎大鼠受损结肠部位STAT3和磷酸化STAT3蛋白都是强烈表达的. 系统注射Ad-CXCR4-BMSCs, 而非Ad-GFP-BMSCs, 能显著的下调STAT3和磷酸化STAT3蛋白表达(图2).
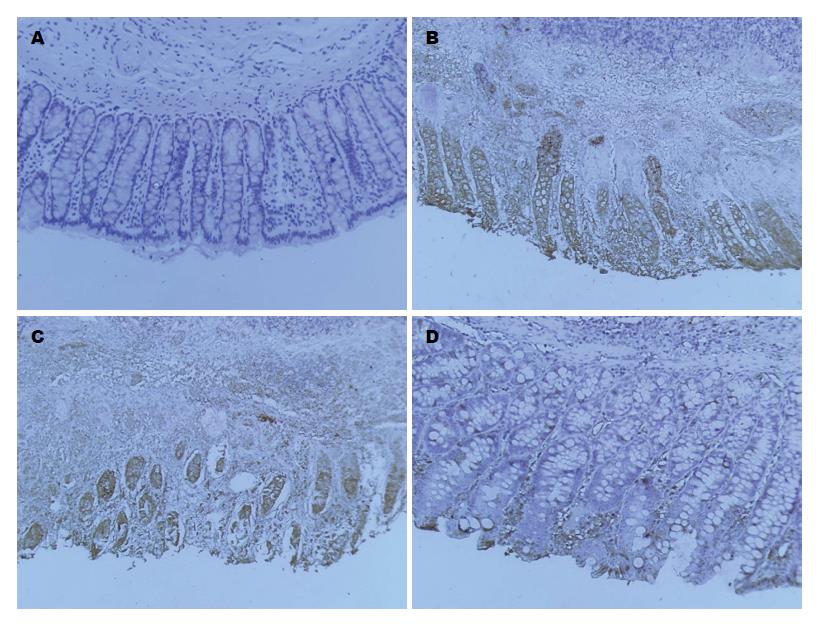
免疫组织化学分析表明, 在空白组结肠部位仅能发现少量甚至无法察觉到磷酸化STAT3蛋白着色. 相反的是, 在模型组中能够观察到大量的磷酸化STAT3蛋白表达, 并且主要集中于黏膜上皮层和固有层. 通过Ad-CXCE4-BMSCs治疗, 磷酸化STAT3蛋白表达则明显降低(图3). 这些数据证明STAT3活化可能参与了TNBS诱导的结肠炎病理过程.
目前普遍认为IBD的发生是遗传易感个体, 在环境因素及肠道菌丛的参与下, 启动肠道黏膜免疫及非免疫系统, 在抗原的持续刺激和免疫调节紊乱持续存在的情况下, 导致炎症级联的放大和局部炎症介质对组织的损伤. 其中, 黏膜免疫功能的失调是IBD发生并呈慢性持续状态的中心环节[14]. IBD发病时会产生大量的炎症细胞因子及介质的产生, 所产生的炎症分子进一步损伤肠道黏膜屏障功能, 加重黏膜的异常免疫反应, 如此形成恶性循环[4].
MSCs具有多向分化潜能, 在体内能参与损伤组织的修复[15], 同体或同种异体的MSCs在体内能归巢到炎症/损伤部位, 发挥抗炎作用[16], 并能通过直接细胞接触, 或分泌可溶性的免疫调节介质对多种适应性或固有免疫细胞(如T/B淋巴细胞、DC细胞、NK细胞等)均发挥调节作用[17,18]. 有研究[19,20]表明MSCs向炎症组织的归巢能力是决定MSCs疗效的关键, 我们前期的实验[13]证实: 与Ad-GFP-BMSCs组比较, 系统注射的Ad-CXCR4-BMSCs能够更有效的归巢于炎症结肠部位并显著地改善结肠炎大鼠的临床症状, 表明SDF-1α/CXCR4轴在BMSCs归巢于受损的结肠部位中发挥重要的作用. 在本研究中, 我们进一步研究了Ad-CXCR4-BMSCs治疗实验性结肠炎潜在的机制. IBD的致病机制之一是黏膜上皮细胞或巨噬细胞产生大量的炎症细胞因子损害了肠道功能. BMSCs是多功能细胞, 能够促进受损的组织再生, 包括IBD[21,22]. 有证据显示BMSCs能够聚集至炎症结肠, 分化成基质细胞或上皮细胞, 从而促进结肠黏膜修复[23]. 另外也有报道[24]指出BMSCs能够通过发挥免疫调节功能来治疗实验性结肠炎. 研究[25,26]证实多种促炎介质和高度活跃的炎症细胞(如中性粒细胞、树突状细胞和巨噬细胞)参与了IBD和TNBS诱导的结肠炎的病理过程. IL-6被发现大量存在于炎症结肠的固有层并可以抑制T细胞凋亡[27]. 在人类和动物实验模型中, IL-10都能够通过抑制T细胞、巨噬细胞和树突状细胞活化来发挥抗炎作用[24]. Ad-CXCR4-BMSCs能显著的下调促炎细胞因子和上调抗炎细胞因子表明BMSCs在TNBs诱导的结肠炎中具有明显的抗炎效果.
STAT3在多种生物学进程(如抗/促凋亡、细胞运动、调节细胞因子产物和抗菌)中发挥着关键作用[28,29]. STAT3活化是以其磷酸化并转移至细胞核为特征的, 该过程受多种细胞和生长因子(如IL-22、IL-6、IL-7、IL-11和INF家族)诱导[26]. 本研究[30]中, Western blot表明: STAT3在TNBS诱导的结肠炎中明显活化, 同样的结论出现在DSS诱导的结肠炎[11]和IBD患者中. STAT3活化是于IBD病理过程息息相关的. 一些研究[12,26]表明STAT3能够通过IL-6、IL-22和IL-24诱导活化来发挥功能. 阻断这些信号通路可能成为IBD治疗的靶点[11,31]. 本研究中我们进一步调查了磷酸化STAT3的分布区域, 并在结肠黏膜层, 特别是上皮层和固有层, 观察到了大量的免疫着色. 更有趣的是, 通过尾静脉注射Ad-CXCR4-BMSCs、STAT3和磷酸化STAT3表达显著降低. 这些结论表明Ad-CXCR4-BMSCs可能通归巢于受损结肠, 分化为上皮层或固有层细胞, 并最终通过抑制细胞因子和STAT3活化来治疗结肠炎.
总之, 我们的实验阐明了相对于正常BMSCs, 静脉注射Ad-CXCR4-BMSCs能够更有效的迁移至受损的结肠, 减轻和修复结肠损伤, 改善TNBS诱导的结肠炎症状. 另外, Ad-CXCR4-BMSCs可能通过发挥抗炎和免疫调节功能来治疗实验性结肠炎. 这些结论可能给SDF-1α/CXCR4轴在BMSCs的IBD治疗提供新的思路和理论依据.
炎症性肠病(inflammatory bowel disease, IBD)被世界卫生组织列为难治性疾病之一. 间充质干细胞(marrow-derived mesenchymal stem cells, MSCs)以其独特的性质及广泛的应用前景成为了当前IBD治疗研究的热点. 前期研究证实SDF-1α/CXCR4轴能够有效的促进BMSCs归巢于受损结肠部位, 本研究通过对结肠部位炎症因子及转录激活子(signal transducer and activator of transcription, STAT)3表达的检测, 探讨骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)在IBD实验模型的抗炎和免疫调节机制.
陈凤媛, 副教授, 复旦大学附属上海市第五人民医院消化科; 张涛, 副主任医师, 广西中医药大学附属瑞康医院消化内科
虽然已证实系统注射的Ad-CXCR4-BMSCs能够有效到达受损的结肠部位, 但其潜在的治疗机制尚不清楚, 本研究从抗炎和免疫调节角度探讨BMSCs的治疗机制.
大量研究证实干扰素-γ(Interferon-γ, IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-6、IL-10等炎症因子在IBD的发病机制中扮演着重要的作用, 而这些细胞因子通过STAT来发挥其生物学功能.
BMSCs治疗IBD的作用机制尚不清楚, 已知炎症因子及STAT在IBD的发病过程中发挥了重要作用, 本文首次通过检测受损结肠部位炎症因子及STAT变化来探讨BMSCs潜在的作用机制.
通过检测受损结肠部位炎症因子及STAT变化, 有助于更深入理解BMSCs在IBD体内的治疗机制.
本文从结肠黏膜免疫失衡角度, 讨论骨髓间充质干细胞治疗溃疡性结肠炎的研究, 研究路线清晰, 研究方法可靠.
编辑: 于明茜 电编: 闫晋利
| 1. | Molodecky NA, Soon IS, Rabi DM, Ghali WA, Ferris M, Chernoff G, Benchimol EI, Panaccione R, Ghosh S, Barkema HW. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012;142:46-54.e42; quiz e30. [PubMed] |
| 2. | Strober W, Fuss IJ. Proinflammatory cytokines in the pathogenesis of inflammatory bowel diseases. Gastroenterology. 2011;140:1756-1767. [PubMed] [DOI] |
| 3. | Castelo-Branco MT, Soares ID, Lopes DV, Buongusto F, Martinusso CA, do Rosario A, Souza SA, Gutfilen B, Fonseca LM, Elia C. Intraperitoneal but not intravenous cryopreserved mesenchymal stromal cells home to the inflamed colon and ameliorate experimental colitis. PLoS One. 2012;7:e33360. [PubMed] [DOI] |
| 4. | Andoh A, Bamba S, Fujiyama Y, Brittan M, Wright NA. Colonic subepithelial myofibroblasts in mucosal inflammation and repair: contribution of bone marrow-derived stem cells to the gut regenerative response. J Gastroenterol. 2005;40:1089-1099. [PubMed] [DOI] |
| 5. | Chen QQ, Yan L, Wang CZ, Wang WH, Shi H, Su BB, Zeng QH, Du HT, Wan J. Mesenchymal stem cells alleviate TNBS-induced colitis by modulating inflammatory and autoimmune responses. World J Gastroenterol. 2013;19:4702-4717. [PubMed] [DOI] |
| 6. | Nasef A, Mathieu N, Chapel A, Frick J, François S, Mazurier C, Boutarfa A, Bouchet S, Gorin NC, Thierry D. Immunosuppressive effects of mesenchymal stem cells: involvement of HLA-G. Transplantation. 2007;84:231-237. [PubMed] [DOI] |
| 7. | Voswinkel J, Francois S, Simon JM, Benderitter M, Gorin NC, Mohty M, Fouillard L, Chapel A. Use of mesenchymal stem cells (MSC) in chronic inflammatory fistulizing and fibrotic diseases: a comprehensive review. Clin Rev Allergy Immunol. 2013;45:180-192. [PubMed] [DOI] |
| 8. | Paiotti AP, Ribeiro DA, Silva RM, Marchi P, Oshima CT, Neto RA, Miszputen SJ, Franco M. Effect of COX-2 inhibitor lumiracoxib and the TNF-α antagonist etanercept on TNBS-induced colitis in Wistar rats. J Mol Histol. 2012;43:307-317. [PubMed] [DOI] |
| 9. | Sugimoto K. Role of STAT3 in inflammatory bowel disease. World J Gastroenterol. 2008;14:5110-5114. [PubMed] [DOI] |
| 10. | Polgar N, Csongei V, Szabo M, Zambo V, Melegh BI, Sumegi K, Nagy G, Tulassay Z, Melegh B. Investigation of JAK2, STAT3 and CCR6 polymorphisms and their gene-gene interactions in inflammatory bowel disease. Int J Immunogenet. 2012;39:247-252. [PubMed] [DOI] |
| 11. | Lee MJ, Lee JK, Choi JW, Lee CS, Sim JH, Cho CH, Lee KH, Cho IH, Chung MH, Kim HR. Interleukin-6 induces S100A9 expression in colonic epithelial cells through STAT3 activation in experimental ulcerative colitis. PLoS One. 2012;7:e38801. [PubMed] [DOI] |
| 12. | Mitsuyama K, Matsumoto S, Rose-John S, Suzuki A, Hara T, Tomiyasu N, Handa K, Tsuruta O, Funabashi H, Scheller J. STAT3 activation via interleukin 6 trans-signalling contributes to ileitis in SAMP1/Yit mice. Gut. 2006;55:1263-1269. [PubMed] [DOI] |
| 13. | 刘 星星, 范 恒, 段 雪云, 唐 庆, 寿 折星, 左 冬梅, 张 丽娟, 曹 丹, 邹 舟. SDF-1α/CXCR4轴促进间充质干细胞归巢于实验性结肠炎受损结肠. 世界华人消化杂志. 2013;21:3623-3630. [DOI] |
| 14. | Cho JH. The genetics and immunopathogenesis of inflammatory bowel disease. Nat Rev Immunol. 2008;8:458-466. [PubMed] [DOI] |
| 15. | Shi Y, Hu G, Su J, Li W, Chen Q, Shou P, Xu C, Chen X, Huang Y, Zhu Z. Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair. Cell Res. 2010;20:510-518. [PubMed] [DOI] |
| 16. | Prockop DJ, Oh JY. Mesenchymal stem/stromal cells (MSCs): role as guardians of inflammation. Mol Ther. 2012;20:14-20. [PubMed] [DOI] |
| 17. | Vasandan AB, Shankar SR, Prasad P, Sowmya Jahnavi V, Bhonde RR, Jyothi Prasanna S. Functional differences in mesenchymal stromal cells from human dental pulp and periodontal ligament. J Cell Mol Med. 2014;18:344-354. [PubMed] [DOI] |
| 18. | Jones BJ, McTaggart SJ. Immunosuppression by mesenchymal stromal cells: from culture to clinic. Exp Hematol. 2008;36:733-741. [PubMed] [DOI] |
| 19. | Karp JM, Leng Teo GS. Mesenchymal stem cell homing: the devil is in the details. Cell Stem Cell. 2009;4:206-216. [PubMed] [DOI] |
| 20. | Ko IK, Kim BG, Awadallah A, Mikulan J, Lin P, Letterio JJ, Dennis JE. Targeting improves MSC treatment of inflammatory bowel disease. Mol Ther. 2010;18:1365-1372. [PubMed] [DOI] |
| 21. | Ando Y, Inaba M, Sakaguchi Y, Tsuda M, Quan GK, Omae M, Okazaki K, Ikehara S. Subcutaneous adipose tissue-derived stem cells facilitate colonic mucosal recovery from 2,4,6-trinitrobenzene sulfonic acid (TNBS)-induced colitis in rats. Inflamm Bowel Dis. 2008;14:826-838. [PubMed] [DOI] |
| 22. | Andoh A, Shioya M, Nishida A, Bamba S, Tsujikawa T, Kim-Mitsuyama S, Fujiyama Y. Expression of IL-24, an activator of the JAK1/STAT3/SOCS3 cascade, is enhanced in inflammatory bowel disease. J Immunol. 2009;183:687-695. [PubMed] [DOI] |
| 23. | Valcz G, Krenács T, Sipos F, Leiszter K, Tóth K, Balogh Z, Csizmadia A, Muzes G, Molnár B, Tulassay Z. The role of the bone marrow derived mesenchymal stem cells in colonic epithelial regeneration. Pathol Oncol Res. 2011;17:11-16. [PubMed] [DOI] |
| 24. | Parekkadan B, Upadhyay R, Dunham J, Iwamoto Y, Mizoguchi E, Mizoguchi A, Weissleder R, Yarmush ML. Bone marrow stromal cell transplants prevent experimental enterocolitis and require host CD11b+ splenocytes. Gastroenterology. 2011;140:966-975. [PubMed] [DOI] |
| 25. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 26. | de Faria FM, Luiz-Ferreira A, Socca EA, de Almeida AC, Dunder RJ, Manzo LP, da Silva MA, Vilegas W, Rozza AL, Pellizzon CH. Effects of Rhizophora mangle on Experimental Colitis Induced by TNBS in Rats. Evid Based Complement Alternat Med. 2012;2012:753971. [PubMed] [DOI] |
| 27. | Neurath MF, Finotto S, Fuss I, Boirivant M, Galle PR, Strober W. Regulation of T-cell apoptosis in inflammatory bowel disease: to die or not to die, that is the mucosal question. Trends Immunol. 2001;22:21-26. [PubMed] [DOI] |
| 28. | Sugimoto K, Ogawa A, Mizoguchi E, Shimomura Y, Andoh A, Bhan AK, Blumberg RS, Xavier RJ, Mizoguchi A. IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis. J Clin Invest. 2008;118:534-544. [PubMed] [DOI] |
| 29. | Nguyen PM, Putoczki TL, Ernst M. STAT3-Activating Cytokines: A Therapeutic Opportunity for Inflammatory Bowel Disease? J Interferon Cytokine Res. 2015;35:340-350. [PubMed] [DOI] |
| 30. | Neufert C, Pickert G, Zheng Y, Wittkopf N, Warntjen M, Nikolaev A, Ouyang W, Neurath MF, Becker C. Activation of epithelial STAT3 regulates intestinal homeostasis. Cell Cycle. 2010;9:652-655. [PubMed] [DOI] |
| 31. | Garbers C, Aparicio-Siegmund S, Rose-John S. The IL-6/gp130/STAT3 signaling axis: recent advances towards specific inhibition. Curr Opin Immunol. 2015;34:75-82. [PubMed] [DOI] |