修回日期: 2015-08-18
接受日期: 2015-08-26
在线出版日期: 2015-09-18
目的: 探讨microRNA-133b(miR-133b)在食管鳞癌组织中表达及其与临床病理特征的关系.
方法: 应用实时定量聚合酶链式反应(real-time quantitative PCR)技术检测63例食管鳞癌及其癌旁正常组织中miR-133b的表达量, 并分析miR-133b在不同组织中的表达差异及其与食管鳞癌临床病理因素间的关系, 探讨miR-133b在食管鳞癌发生与进展中的重要作用.
结果: 食管鳞癌组织中miR-133b的相对表达量明显低于正常食管黏膜组织(P<0.05), 病理分级Ⅲ级和TNM分期Ⅲ期的食管鳞癌患者组织中miR-133b的表达水平明显低于Ⅰ-Ⅱ(P<0.001).
结论: miR-133b表达水平与食管鳞癌发生发展与恶性程度密切相关, 有望成为食管鳞癌诊断的新靶点.
核心提示: 微小RNA(microRNA, miRNA)是一类存在于真核细胞中的非编码小RNA, 在肿瘤的发生发展过程中起着癌基因或抑癌基因的作用. 对miR-133b在食管鳞癌中的表达及其与食管鳞癌病理特征的关系进行了深入研究之后发现,miR-133b有望成为食管鳞癌诊断的新靶点.
引文著录: 张志梅, 何晓燕, 施瑞华. miR-133b在食管鳞癌中的表达及其临床病理意义. 世界华人消化杂志 2015; 23(26): 4242-4246
Revised: August 18, 2015
Accepted: August 26, 2015
Published online: September 18, 2015
AIM: To investigate the clinicopathologic significance of microRNA-133b expression in esophageal squamous cell carcinoma (ESCC).
METHODS: Quantitative real-time PCR was used to quantify miR-133b expression in 63 pairs of ESCC tissues and matched normal esophageal tissues. The association of miR-133b expression with the clinicopathologic features was then evaluated.
RESULTS: The expression of miR-133b was significantly downregulated in ESCC tissue samples compared to matched normal tissues (P < 0.05). MiR-133b was highly expressed in ESCC with a low pathological grade (I-II) but markedly decreased in grade III tumors (P < 0.001). In addition, the expression of miR-133b between patients with TNM stages I-II and those with stage III ESCC was statistically significant (P < 0.001).
CONCLUSION: The expression of miR-133b is closely related to the development and progression of ESCC. MiR-133b may act as a prognostic marker for this widespread disease.
- Citation: Zhang ZM, He XY, Shi RH. Clinicopathologic significance of miR-133b expression in esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4242-4246
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4242.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4242
食管癌是常见的消化道恶性肿瘤之一, 在全球范围内发病率和死亡率分别位居恶性肿瘤第八位和第六位[1]. 因其早期发现率较低, 恶性程度较高, 目前食管癌患者的5年生存率仅15%至25%[2]. 在欧美国家, 食管癌以腺癌为主, 我国以食管鳞状细胞癌为主. 近年来微小RNA(microRNA, miRNA)与肿瘤的关系研究成为热点. miRNA是一类存在于真核细胞中长度为21-25 nt的非编码小RNA, 在肿瘤的发生发展过程中起着癌基因或抑癌基因的作用[3]. miRNA表达失调与食管癌的发生、发展密切相关. 本课题组前期采用miRNA表达谱芯片技术获得食管鳞癌表达谱, 发现多个miRNA表达下调[4], 其中miR-133b下调倍数最多, 为了进一步验证miR-133b在食管鳞癌中的表达及其与食管鳞癌病理特征的关系, 我们进行大样本实时定量PCR(real-time quantitative PCR, qRT-PCR)验证及相应的统计分析.
收集2013-01/2013-12南京医科大学第一附属医院63例食管鳞癌手术切除标本, 临床资料完整, 术后病理证实为食管鳞癌. 其中, 男性36例, 女性37例. 年龄43-75岁, 中位年龄60岁. TNM(tumor node metastasis)分期: Ⅰ期11例, Ⅱ期34例, Ⅲ期18例. 病理分级: Ⅰ级13例, Ⅱ级22例, Ⅲ级28例. 所有患者术前均未接受放化疗及其他食管手术. 每对样本都包括同一患者病变组织及正常食管黏膜组织(距病变部位5 cm以上), 标本收集后冻存于液氮. 本实验获得南京医科大学第一附属医院伦理委员会批准(2013-SR-158).
实时定量PCR检测: RNA提取试剂盒、RT-PCR试剂盒购于大连宝生生物工程有限公司. miR-133b引物由广州锐博生物科技有限公司合成. 液氮下研磨粉碎组织块, TRIzol法提取组织RNA. 逆转录反应体系为10 μL: 5×PrimerScript RT Master Mix 2 μL、total RNA 500 ng、RNase Free dH2O up to 10 μL; 反应条件: 37 ℃ 15 min; 85 ℃ 5 s; 4 ℃. qRT-PCR反应体系为10 μL: SYBR Premix Ex TaqⅡ(2×) 5 μL、PCR上游引物0.4 μL、PCR下游引物0.4 μL、cDNA 2 μL(300 ng)、RNase Free dH2O 2.2 μL; 反应条件为: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 共40循环×3次, 求平均Ct值作为实验结果. miR-133b的相对表达量以2-△Ct及2-△△Ct法计算[5]: 获取每个样本中miR-133b及内参U6的Ct值, 计算miR-133b在肿瘤组织与癌旁组织之间表达的差异.
统计学处理 采用SPSS17.0统计软件进行分析, 所有结果均以mean±SD表示, 两组间比较用独立样本t检验或配对t检验. P<0.05为差异有统计学意义.
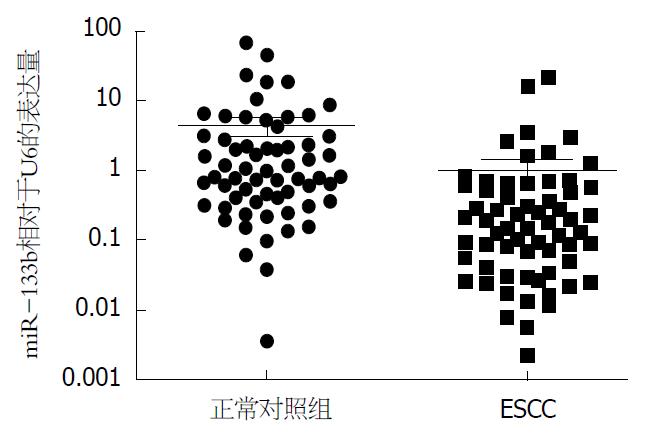
应用SYBR Green qRT-PCR方法检测63对食管鳞癌组织及其配对癌旁正常组织中miR-133b的相对表达量, 以内参U6进行数据标准化. 结果发现miR-133b在食管鳞癌组织中的表达量明显低于其配对正常对照组织(P<0.05, 图1).
miR-133b的表达水平在TNM分期Ⅲ期的食管鳞癌患者中均明显低于Ⅰ-Ⅱ期患者(P<0.001), 病理分级Ⅲ级的食管鳞癌患者miR-133b表达水平均明显低于Ⅰ-Ⅱ级患者(P<0.001). 而在年龄≤60岁与>60岁的食管鳞癌患者miR-133b的表达水平无统计学差异, 男性患者与女性患者miR-133b的表达水平也无统计学差异(表1).
| 特征 | n | miR-133b | P值 |
| 年龄 | 0.345 | ||
| >60 | 31 | -8.4902±1.82969 | |
| ≤60 | 32 | -8.92847±1.82229 | |
| 性别 | 0.764 | ||
| 男 | 18 | -8.6026±1.48797 | |
| 女 | 45 | -8.7569±1.95667 | |
| 病理分级 | <0.001 | ||
| Ⅰ-Ⅱ | 35 | -9.7848±1.47944 | |
| Ⅲ | 28 | -7.3728±1.23954 | |
| TNM分期 | <0.001 | ||
| Ⅰ-Ⅱ | 45 | -9.1818±1.66529 | |
| Ⅲ | 18 | -7.54035±1.71049 |
食管癌的发生与亚硝胺的慢性刺激、炎症与创伤、遗传因素及饮水饮食习惯等有关. 在食管癌的发生发展过程中存在着癌基因的过度表达或抑癌基因的缺失表达. 近来研究表明[6-9], miRNA在调节肿瘤相关基因表达的同时, 其本身也具有癌基因或抑癌基因的特点. 目前, 应用各种不同的技术, 很多研究小组都在致力于研究不同癌症的特异性miRNA表达谱[10,11], 为肿瘤的早期诊断和个性化治疗提供依据. 本课题组自2012年起对食管鳞癌miRNAs的表达谱及其发病机制进行了一系列的研究, 但由于食管鳞癌发病率的地域差异性, 目前国内外对于食管鳞癌miRNAs表达谱及其机制的研究相对于其他恶性肿瘤来说尚有限.
本课题组前期采用Agilent miRNA芯片技术初步筛选了在食管鳞癌组织中表达异常的 miRNAs, 共筛选出了 51个上调的 miRNAs, 17个下调的 miRNA. S. 该芯片筛选的食管鳞癌 miRNAs表达谱的结果与以往已报道[12-14]的研究结果有比较好的重叠性, 部分结果相符, 如miR-7、miR-21等miRNAs在食管鳞癌中均为表达上调. 前期研究中, 我们已对芯片结果中部分的miRNA(如miR-183[4]、miR-1290[7]、miR-195[15]、miR-224[16]、miR-130b[17]等)进行了大样本验证, 结果与芯片结果近重叠. 在17个下调的miRNA中, miR-133b下调倍数最多, 本研究对miR-133b在食管鳞癌的表达进行大样本临床验证研究.
miR-133b位于人 6 号染色体P12.1[18], 目前被视为肌肉组织特异性miRNAs, 其可能参与调控B细胞和骨骼肌发育分化过程子[19,20]. 早在2009年Crawford等[21]就报道了miR-133b在非小细胞肺癌中表达下调, 具有抑制肺癌细胞增殖及促进凋亡的作用, 随后有Patron等[22]报道miR-133b在前列腺癌组织中与配对的正常前列腺组织相比其表达显著下调, Li等[23]报道了通过体外细胞试验研究在前列腺癌细胞中过表达miR-133b促进细胞增殖和细胞周期的进展, 而抑制细胞凋亡. Duan等[24]研究结果表明miR-133b在结肠癌组织中呈低表达, 且能够负向调节其靶基因CXCR4. 从而推测miR-133b可能对结直肠癌的靶点治疗有重要意义. Chen等[25]通过qRT-PCR检测41例膀胱癌组织中miR-133b表达量, 结果较其配对正常组织明显下调, 且发现miR-133b低表达与膀胱癌临床病理分期明显相关. Zhang等[26]通过检测100例骨肉瘤患者血清miR-133b表达量与100名健康患者血清标本相比, 骨肉瘤患者血清miR-133b表达水平显著下降, 同时发现miR-133b表达水平越低, 患者总生存期越短, 推测miR-133b低表达可能促进骨肉瘤的发生发展. Yamamoto等[27]通过miRNA芯片技术检测19例胃肠道间质瘤中miRNAs的表达, 研究发现miR-133b在胃肠道间质瘤中呈低表达, 其靶基因Fascin-1呈高表达且与胃肠道间质瘤临床病理联系明显相关. Zhao等[28]通过qRT-PCR研究胃癌组织中miR-133b表达量明显下调且与肿瘤淋巴结转移明显有关. 由此可见, miR-133b在多种恶性肿瘤组织中均呈低表达, 起抑癌基因作用.
至今大样本研究验证miR-133b在食管鳞癌中的表达水平报道甚少, 于是, 我们收集了63对食管鳞癌组织, 对miR-133b在食管鳞癌中的表达及其与食管鳞癌病理特征的关系进行了深入研究. 结果显示miR-133b在食管鳞癌组织中表达量明显低于配对的癌旁正常组织, 结果与以往文献报道[29,30]一致, 提示miR-133b在食管鳞癌中可能通过调节某种原癌基因而起抑制肿瘤发生的作用. 我们进一步分析miR-133b表达与食管鳞癌临床病理因素间的关系, 发现miR-133b的表达水平与食管鳞癌的病理分级存在显著相关, 肿瘤TMN分期越高、病理分级越差, miR-133b表达越低. 上述结果说明, 原发性食管鳞癌的发生发展过程伴随着miR-133b表达的逐级下调. 就此我们推测, miR-133b在食管鳞癌的发生发展中起到重要作用.
食管癌的发生是一个多因素参与的多阶段性过程, 通过生物学软件预测miR-133b可以通过不同的靶基因调控食管癌的发生、发展以及转移. miR-133b有望作为一种新的肿瘤标志物对食管癌的诊断提供参考信息, 也有可能作为一个靶点为食管癌患者提供新的治疗策略. 仍需要大样本研究miR-133b在食管癌组织或者血清中的表达及临床意义, miR-133b调控的靶基因参与食管癌发生的机制以及基因治疗的有效性等有待进一步深入研究.
食管鳞癌(esophagcal squamous cell carcinoma, ESCC)发病率高, 5年生存率低, 加强其发病机制的研究有助于早期诊断和及时治疗. miRNAs参与调控细胞各项生物学功能, 在多种肿瘤的发生发展中具有重要的意义.
李苏宜, 教授, 主任医师, 安徽省肿瘤医院肿瘤营养与代谢治疗科(肿瘤内三科)
微小RNA-133b(miR-133b)是新近发现的一种miRNA, 已有相关研究报道在肺癌、结肠癌、前列腺癌等恶性肿瘤中表达上调, 目前miR-133b在ESCC中表达相关研究报道甚少.
Crawford等报道了miR-133b在肺癌细胞中具有抑制肺癌细胞增殖及促进肺癌细胞凋亡的作用.
本课题组采用miRNA芯片分析技术选出ESCC组织中异常表达的miRNAs, 本研究选取miR-133b进一步大样本临床验证并探讨其与食管鳞癌临床病理之间的关系.
本实验为ESCC发病机制研究提供了新的靶点, 为miR-133b应用于ESCC的早期诊断提供了初步的理论依据.
microRNAs: 是一类长约21-24个核苷酸的内源性非编码单链小RNA, 通过与靶基因信使 RNA(mRNA)的3'非编码区(3'-UTR)结合, 在转录后水平靶向抑制 mRNA的·译, 调节基因的表达, 参与细胞分化、增殖、凋亡、新陈代谢等生理过程.
本文验证和发现miR-133b在食管鳞癌组织表达量明显低于癌旁正常组织, miR-133b表达与食管鳞癌病理分级显著相关. 推测, miR-133b在食管鳞癌发生发展中起到重要作用. 该研究创新性特点较为突出, 课题设计合理性也十分明显, 是在前期研究发现基础上的针对性深入研究工作, 数据可信, 结论可靠.
编辑: 于明茜 电编: 闫晋利
| 1. | Enzinger PC, Mayer RJ. Esophageal cancer. N Engl J Med. 2003;349:2241-2252. [PubMed] [DOI] |
| 2. | Pennathur A, Gibson MK, Jobe BA, Luketich JD. Oesophageal carcinoma. Lancet. 2013;381:400-412. [PubMed] [DOI] |
| 3. | Esquela-Kerscher A, Slack FJ. Oncomirs - microRNAs with a role in cancer. Nat Rev Cancer. 2006;6:259-269. [PubMed] [DOI] |
| 4. | Ren LH, Chen WX, Li S, He XY, Zhang ZM, Li M, Cao RS, Hao B, Zhang HJ, Qiu HQ. MicroRNA-183 promotes proliferation and invasion in oesophageal squamous cell carcinoma by targeting programmed cell death 4. Br J Cancer. 2014;111:2003-2013. [PubMed] [DOI] |
| 5. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 6. | He FC, Meng WW, Qu YH, Zhou MX, He J, Lv P, Ming L. Expression of circulating microRNA-20a and let-7a in esophageal squamous cell carcinoma. World J Gastroenterol. 2015;21:4660-4665. [PubMed] [DOI] |
| 7. | Li M, He XY, Zhang ZM, Li S, Ren LH, Cao RS, Feng YD, Ji YL, Zhao Y, Shi RH. MicroRNA-1290 promotes esophageal squamous cell carcinoma cell proliferation and metastasis. World J Gastroenterol. 2015;21:3245-3255. [PubMed] [DOI] |
| 9. | Yu T, Cao R, Li S, Fu M, Ren L, Chen W, Zhu H, Zhan Q, Shi R. MiR-130b plays an oncogenic role by repressing PTEN expression in esophageal squamous cell carcinoma cells. BMC Cancer. 2015;15:29. [PubMed] [DOI] |
| 10. | Fu HL, Wu de P, Wang XF, Wang JG, Jiao F, Song LL, Xie H, Wen XY, Shan HS, Du YX. Altered miRNA expression is associated with differentiation, invasion, and metastasis of esophageal squamous cell carcinoma (ESCC) in patients from Huaian, China. Cell Biochem Biophys. 2013;67:657-668. [PubMed] [DOI] |
| 11. | Pinto R, De Summa S, Danza K, Popescu O, Paradiso A, Micale L, Merla G, Palumbo O, Carella M, Tommasi S. MicroRNA expression profiling in male and female familial breast cancer. Br J Cancer. 2014;111:2361-2368. [PubMed] [DOI] |
| 12. | Guo Y, Chen Z, Zhang L, Zhou F, Shi S, Feng X, Li B, Meng X, Ma X, Luo M. Distinctive microRNA profiles relating to patient survival in esophageal squamous cell carcinoma. Cancer Res. 2008;68:26-33. [PubMed] [DOI] |
| 13. | Hiyoshi Y, Kamohara H, Karashima R, Sato N, Imamura Y, Nagai Y, Yoshida N, Toyama E, Hayashi N, Watanabe M. MicroRNA-21 regulates the proliferation and invasion in esophageal squamous cell carcinoma. Clin Cancer Res. 2009;15:1915-1922. [PubMed] [DOI] |
| 14. | Kurashige J, Watanabe M, Iwatsuki M, Kinoshita K, Saito S, Hiyoshi Y, Kamohara H, Baba Y, Mimori K, Baba H. Overexpression of microRNA-223 regulates the ubiquitin ligase FBXW7 in oesophageal squamous cell carcinoma. Br J Cancer. 2012;106:182-188. [PubMed] [DOI] |
| 15. | Fu MG, Li S, Yu TT, Qian LJ, Cao RS, Zhu H, Xiao B, Jiao CH, Tang NN, Ma JJ. Differential expression of miR-195 in esophageal squamous cell carcinoma and miR-195 expression inhibits tumor cell proliferation and invasion by targeting of Cdc42. FEBS Lett. 2013;587:3471-3479. [PubMed] [DOI] |
| 16. | He X, Zhang Z, Li M, Li S, Ren L, Zhu H, Xiao B, Shi R. Expression and role of oncogenic miRNA-224 in esophageal squamous cell carcinoma. BMC Cancer. 2015;15:575. [PubMed] [DOI] |
| 17. | 郁 婷婷, 李 硕, 傅 敏根, 曹 日昇, 朱 宏, 施 瑞华. miR-130b在食管鳞癌中的表达及对食管鳞癌细胞增殖和迁移的影响. 世界华人消化杂志. 2013;21:1685-1692. [DOI] |
| 18. | Nohata N, Hanazawa T, Enokida H, Seki N. microRNA-1/133a and microRNA-206/133b clusters: dysregulation and functional roles in human cancers. Oncotarget. 2012;3:9-21. [PubMed] |
| 19. | Koutsoulidou A, Mastroyiannopoulos NP, Furling D, Uney JB, Phylactou LA. Expression of miR-1, miR-133a, miR-133b and miR-206 increases during development of human skeletal muscle. BMC Dev Biol. 2011;11:34. [PubMed] [DOI] |
| 20. | Boettger T, Wüst S, Nolte H, Braun T. The miR-206/133b cluster is dispensable for development, survival and regeneration of skeletal muscle. Skelet Muscle. 2014;4:23. [PubMed] [DOI] |
| 21. | Crawford M, Batte K, Yu L, Wu X, Nuovo GJ, Marsh CB, Otterson GA, Nana-Sinkam SP. MicroRNA 133B targets pro-survival molecules MCL-1 and BCL2L2 in lung cancer. Biochem Biophys Res Commun. 2009;388:483-489. [PubMed] [DOI] |
| 22. | Patron JP, Fendler A, Bild M, Jung U, Müller H, Arntzen MØ, Piso C, Stephan C, Thiede B, Mollenkopf HJ. MiR-133b targets antiapoptotic genes and enhances death receptor-induced apoptosis. PLoS One. 2012;7:e35345. [PubMed] [DOI] |
| 23. | Li X, Wan X, Chen H, Yang S, Liu Y, Mo W, Meng D, Du W, Huang Y, Wu H. Identification of miR-133b and RB1CC1 as independent predictors for biochemical recurrence and potential therapeutic targets for prostate cancer. Clin Cancer Res. 2014;20:2312-2325. [PubMed] [DOI] |
| 24. | Duan FT, Qian F, Fang K, Lin KY, Wang WT, Chen YQ. miR-133b, a muscle-specific microRNA, is a novel prognostic marker that participates in the progression of human colorectal cancer via regulation of CXCR4 expression. Mol Cancer. 2013;12:164. [PubMed] [DOI] |
| 25. | Chen XN, Wang KF, Xu ZQ, Li SJ, Liu Q, Fu DH, Wang X, Wu B. MiR-133b regulates bladder cancer cell proliferation and apoptosis by targeting Bcl-w and Akt1. Cancer Cell Int. 2014;14:70. [PubMed] [DOI] |
| 26. | Zhang C, Yao C, Li H, Wang G, He X. Serum levels of microRNA-133b and microRNA-206 expression predict prognosis in patients with osteosarcoma. Int J Clin Exp Pathol. 2014;7:4194-4203. [PubMed] |
| 27. | Yamamoto H, Kohashi K, Fujita A, Oda Y. Fascin-1 overexpression and miR-133b downregulation in the progression of gastrointestinal stromal tumor. Mod Pathol. 2013;26:563-571. [PubMed] [DOI] |
| 28. | Zhao Y, Huang J, Zhang L, Qu Y, Li J, Yu B, Yan M, Yu Y, Liu B, Zhu Z. MiR-133b is frequently decreased in gastric cancer and its overexpression reduces the metastatic potential of gastric cancer cells. BMC Cancer. 2014;14:34. [PubMed] [DOI] |
| 29. | Kano M, Seki N, Kikkawa N, Fujimura L, Hoshino I, Akutsu Y, Chiyomaru T, Enokida H, Nakagawa M, Matsubara H. miR-145, miR-133a and miR-133b: Tumor-suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma. Int J Cancer. 2010;127:2804-2814. [PubMed] [DOI] |