修回日期: 2015-05-24
接受日期: 2015-07-14
在线出版日期: 2015-09-18
目的: 探讨钙调蛋白(calmodulin, CaM)及肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)介导急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)心肌损害机制的研究.
方法: 36只SD大鼠随机分为假手术组(SO组)和ANP组, 每组18只. 应用胰胆管逆行注射牛磺胆酸钠的方法诱导ANP模型, 术后1、4和8 h分批处死大鼠(每个时间点6只), 用荧光控测法测定心脏组织内游离钙离子浓度, 实时荧光定量PCR检测心脏细胞中CaM及TNF-α mRNA的表达, 并进行胰腺和心脏组织病理检查.
结果: (1)ANP组胰腺及心脏组织均有病理损伤, 且1、4和8 h ANP组胰腺病理损伤呈进行性加重(P<0.05); (2)各时间点ANP组心脏组织内游离钙离子浓度较SO组明显降低, 且随ANP病情加重钙离子浓度逐渐降低(P<0.05); (3)与SO组相比, 心脏细胞中CaM及TNF-α mRNA的表达均明显升高, 并随ANP病情加重而表达增加, 且两者的表达量与细胞内钙离子浓度呈负相关.
结论: CaM及TNF-α通过抑制心肌细胞钙离子通道, 介导ANP心肌损伤.
核心提示: 本实验通过钙调蛋白(calmodulin, CaM)及肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)对急性坏死性胰腺炎(acute necrotizing pancreatitis)心肌损害机制的研究, 为将来临床通过抑制CaM及TNF-α的表达, 减少"胰心综合征"的发生提供了一个新的科学依据.
引文著录: 张浩, 潘达, 朱丽明, 黄春伟, 潘佳佳. 钙调蛋白及肿瘤坏死因子-α对介导急性坏死性胰腺炎心肌损害的作用. 世界华人消化杂志 2015; 23(26): 4162-4166
Revised: May 24, 2015
Accepted: July 14, 2015
Published online: September 18, 2015
AIM: To investigate the role of calmodulin (CaM) and tumor necrosis factor (TNF)-α in myocardial injury associated with acute necrotizing pancreatitis (ANP) in rats.
METHODS: Thirty-six male Sprague-Dawley (SD) rats were randomly divided into a sham-operation (SO) group and an ANP group. ANP was induced by retrograde injection of sodium taurocholate into the biliopancreatic duct. Rats were sacrificed at 1, 4 and 8 h after operation. HE staining was used to observe the pathological changes of pancreatic and myocardial tissues. Fluorescence monitoring method was used to determine the free Ca2+ concentration in rat myocardial cells. The expression of CaM and TNF-α in myocardial cells was analyzed by real-time PCR.
RESULTS: Rats in the ANP all had pathological damage in pancreatic and myocardial tissues, which was progressively exacerbated. Compared with the SO group, the free Ca2+ concentration in rat myocardial cells was significantly reduced in the ANP group, and the free Ca2+ concentration decreased as the severity of the disease increased (P < 0.05). Compared with the SO group, the expression of CaM and TNF-α in myocardial cells was markedly up-regulated in the ANP group. The expression of CaM and TNF-α was negatively correlated with the calcium ion concentration in myocardial cells.
CONCLUSION: CaM and TNF-α mediate myocardial damage in ANP through inhibiting calcium channels.
- Citation: Zhang H, Pan D, Zhu LM, Huang CW, Pan JJ. CaM and TNF-α mediate myocardial damage in acute necrotizing pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4162-4166
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4162.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4162
急性胰腺炎(acute pancreatitis, AP)是指多种病因引起胰酶激活, 继以胰腺局部炎性反应为主要特征, 伴或不伴有其他器官功能改变的疾病, 其中5%-10%的AP患者伴有胰腺实质或胰周组织坏死, 或二者兼有, 称之为急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)[1], 其临床经过凶险, 预后差, 死亡率高达15%-20%[2]. 其早期死亡的原因主要是全身炎症反应(systemic inflammatory response syndrome, SIRS)引起的多脏器功能衰竭(multiple organ failure function, MOF)[3]. 在诸多胰外器官损害中, 对心脏的损害研究较少, 但ANP时心血管失代偿是死亡率最高的并发症之一. 本实验通过建立大鼠ANP动物模型, 动态观察不同时间点ANP心肌细胞内Ca2+、钙调蛋白(calmodulin, CaM)及肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)含量的变化, 以探讨CaM及TNF-α介导ANP心肌损伤的作用机制.
36只健康♂SD大鼠, 质量200-250 g, 由温州医学院实验动物中心提供. 牛磺胆酸钠(Sigma公司); 胎牛血清(杭州四季青); Ⅰ型胶原酶(Sigma); 牛血清白蛋白(Solarbio); Fluo-2/AM(Biotium Inc); TritonX-100(捷瑞); EGTA(Solarbio); 岛京RF-5301单波荧光分光光度计; TRIzol(Invitrogen公司); First strand cDNA synthesis kit(MBI公司); SYBR Green PCR Master Mix(ABI公司); 实时定量PCR仪(ABI公司).
1.2.1 建模及分组: 大鼠造模前禁食12 h, 自由饮水. 36只SD大鼠随机分为假手术组(SO组)和急性坏死性胰腺炎组(ANP组), 每组18只. 水合氯醛0.3 mL/100 g腹腔注射麻醉, ANP模型诱导参照Aho法并略有改进. 经十二指肠乳头插入胆胰管注射4%牛黄胆酸钠(0.1 mL/100 g)制造ANP模型, 药物注射前动脉夹夹闭胰管入肝门端, 缓慢注射5 min, 注射完5 min后取下动脉夹, 假手术组仅打开腹腔, 翻动肠管. 术后每只大鼠给予生理盐水2.0 mL皮下注射以补充术中丢失液体, 分别于术后1、4、8 h处死大鼠, 留取胰腺及心脏组织待测.
1.2.2 胰腺、心脏组织病理学检查: 胰腺、心脏组织常规脱水、石蜡包埋、切片、HE染色. 镜下观察胰腺、心脏病理改变. 胰腺病理学评分参考改良Schmidt评价标准[4].
1.2.3 荧光控测法测定心肌细胞内钙离子浓度: 取新鲜心脏组织, 加入适量混合酶(0.25%胰酶+1%胶原酶等体积混合), 迅速剪碎, 置于水域恒温振荡器中培养16 min, 200目网过滤, 1000 r/min, 10 min, 弃上清, 加入含有胎牛血清的1640培养液终止消化, 反复吹打后1000 r/min, 10 min, 弃上清, 加入0.2%牛血清白蛋白负载稀释, 台盼蓝实验检测验证活细胞数>90%. 细胞消化分离后立即加入1 mol/L Fura-2/Am 10 μL, 在37 ℃水浴内孵育30 min, 然后将浓度稀释为106个细胞/mL. 然后采用岛京RF-5301单波荧光分光光度计分别检测激发波长(EX)为340和380 nm时的荧光强度, 加入18%Triton X-100 20 μL破坏其细胞膜, 测定Ca2+饱和状态下的荧光强度(Rmax), 最后加入0.6MEGTA 20 μL络合全部Ca2+, 测得其最小荧光强度(Rmin). 最后通过公式: [Ca2+]i = Kd(Sf2/Sb2)×(R-Rmin)/(Rmax-R)来计算心肌细胞内钙离子浓度. Sf2和Sb2分别代表380 nm条件下零钙和高钙状态下的荧光值. Kd值为常数224[5].
1.2.4 实时定量荧光PCR测定CaM及TNF-α的表达: 取40-50 mg组织, 以TRIzol试剂抽提总RNA, 逆转录为cDNA. 以cDNA为模板, SYBR GREEN为荧光标志物, 分别用CaM、TNF-α和β-actin引物进行反应. CaM基因上游引物为: 5'-GCCCTTCTGTCAGTTGCTTC-3', 下游引物为: 5'-CTTTGGGGACCAATCCCTAT-3'; TNF-α上游引物为: 5'-ACTCCCAGAAAAGCAAGCAA-3', 下游引物为: 5'-CGAGCAGGAATGAGAAGAGG-3'; β-actin上游引物为: 5'-AGACAGCCGCATCTTCTTGT-3', 下游引物为: 5'-CTTGCCGTGGGTAGAGTCAT-3'. 扩增体系反应条件: 95 ℃ 10 min变性, 95 ℃ 15 s、60 ℃ 30 s、72 ℃ 45 s, 循环40次. 体系扩增及结果分析在7500快速实时定量PCR系统中进行, 计算出Threshold Cycle(Ct值). 反应完成后再于95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s, 绘制熔解曲线. 根据Livak和Schmittgen设计的阈值法测定目的基因的相对表达水平, 目的基因量 = 2-△△Ct, △△Ct = (Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组.
统计学处理 以SPSS18.0统计学软件进行分析. 所有数据以mean±SD表示, 进行方差齐性检验, 根据样本的性质采用t检验、单因素方差分析、LSD-t检验和Dunnet T3检验. 以P<0.05为差异有统计学意义.
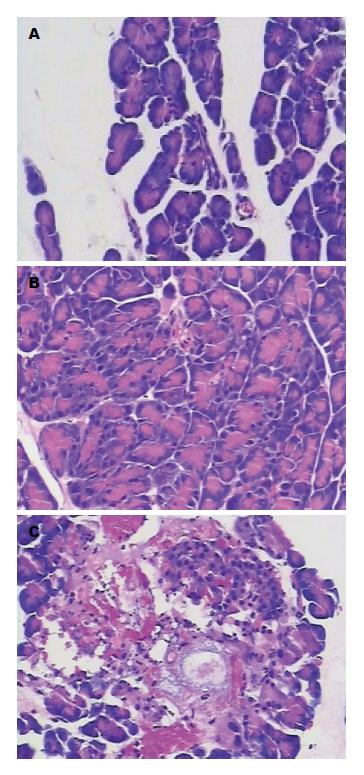
镜下, SO组: 1、4和8 h时间点的胰腺组织小叶清晰, 未见明显异常. ANP组1 h见胰腺间质水肿, 伴少量炎性细胞浸润; 4 h胰腺间质水肿、出血, 炎性细胞浸润明显增加; 8 h严重出血, 坏死区见大量中性粒细胞和单核细胞浸润(表1, 图1).
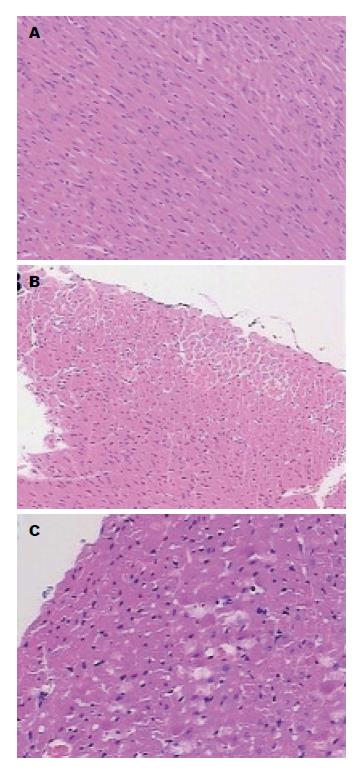
镜下, SO组1、4、8 h时间点的心脏组织结构清晰, 排列整齐, 未见明显其他异常. ANP组1 h见心肌细胞轻度排列紊乱; 4 h心肌细胞正常结构破坏, 排列明显紊乱, 可见炎性细胞浸润; 8 h部分心肌细胞溶解, 排列杂乱无章, 有大量炎性细胞浸润(图2).
与SO组比较, 1、4和8 h ANP心肌细胞内的[Ca2+]i浓度明显降低(P<0.01), 且随ANP病情加重细胞内钙离子浓度降低(表2).
管家基因β-actin及CaM分别在12-14、22-28循环进入指数扩增期. 管家基因β-actin及TNF-α分别在14-18、24-28循环进入指数扩增期. 在相同的扩增条件下, 内参β-actin与CaM及β-actin与TNF-α的熔解曲线均为单一主峰, 熔解温度分别为81 ℃、84 ℃及82 ℃、85 ℃, 说明扩增为特异性产物. ANP组的CaM和TNF-α mRNA表达以SO组为参照. ANP组各时点mRNA的表达较SO组明显升高, 并随ANP病情加重而表达增加, 且两者的表达量与细胞内钙离子浓度呈负相关(P<0.05或P<0.01)(表3).
ANP合并心肌损害又称"胰心综合征", 主要表现为心功能异常、心律失常、心源性休克、中毒性心肌炎、心包炎、心肌梗死、心包积液、心力衰竭, 甚至心脏骤停. 近年来, 随着ANP合并心肌损害病例的增多, 逐渐成为研究的热点[6]. ANP合并心肌损伤多被认为是各种细胞因子及炎症介质过度表达引起的SIRS所导致, 但关于心肌损伤时心肌细胞内钙离子平衡的破坏, 国内尚未见报道.
本实验研究表明, 各时间点ANP心肌细胞内钙离子浓度显著降低, 且随ANP病情加重钙离子浓度逐渐降低, 证实了Ca2+是心肌细胞内重要信号分子, 对心肌细胞正常细胞活动和细胞功能的病理改变起重要作用.
TNF-α是ANP时体内最重要的炎性介质之一, 在心脏组织中仅在心肌间质的单核巨噬细胞中表达, 适量释放对机体有保护作用, 当心肌缺血时表达可局部升高, 对心脏有毒性作用, 他可直接损害心肌, 引起心肌缩力降低[7]; 另外TNF-α还可刺激心肌细胞表达功能性的肿瘤坏死因子受体1(tumornecrosis factor receptor 1, TNFR1), 启动心肌细胞的凋亡[8].
CaM由148个氨基酸组成, 是心肌细胞内主要的钙结合蛋白, 静息状态下无活性[9], 和Ca2+结合后CaM结构发生变化而激活, 然后作用于各种靶蛋白调节细胞内Ca2+转运及离子通道活性, 通过调节心肌细胞内Ca2+浓度, 对心肌细胞产生各种损害[10].
本实验研究结果显示ANP组各时点CaM及TNF-α mRNA的表达较SO组明显升高, 并随ANP病情加重而表达增加, 且与钙离子浓度呈负相关. 这表明ANP时CaM及TNF-α可通过调节钙离子通道, 早期即对心脏功能起抑制作用. ANP时, TNF-α和TNFR1结合后, 可使神经鞘磷脂降解成饱和糖脂醇, 通过阻滞肌浆网(sarcoplasmic reticulum, SR)上钙释放通道受体Ryanodine受体(Ryanodine receptor, RyR), 使SR释放Ca2+减少, 从而降低细胞内Ca2+浓度[11]. 同时CaM可同时作用与α1c亚基上IQ基序及RyR, 抑制浆膜浆膜及SR上钙离子通道开放, 降低心肌细胞内Ca2+浓度[12]. 两者对钙通道的抑制起协同作用. 由于心肌细胞内Ca2+浓度降低, 峰值减少, 使心肌收缩力减退, 心脏泵血量减少, 再加上ANP炎症介质介导作用, 使微循环血管通透性增加, 二者共同导致有效循环血量急剧下降, 心血量减少, 终导致心肌损伤.
总之, 心肌细胞内钙离子平衡的破坏是导致ANP心肌损害的重要发病机制, 且CaM及TNF-α介导了心肌损伤的过程. 本实验通过CaM及TNF-α对ANP心肌损害机制的研究, 为将来临床通过抑制CaM及TNF-α的表达, 减少"胰心综合征"的发生提供了一个新的科学依据.
急性坏死性胰腺炎(acute necrotizing pancreatitis, ANP)临床经过凶险, 预后差, 死亡率高. 在ANP合并多脏器功能衰竭的研究过程中, 对心肌损伤的研究较少.
夏时海, 教授, 主任医师, 武警后勤学院附属医院肝胆胰脾科(中心)
心肌细胞内钙离子平衡失调是心肌损伤的重要机制, 本实验通过钙调蛋白(calmodulin, CaM)及肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)对ANP心肌损害机制的研究, 为将来临床通过抑制CaM及TNF-α的表达, 减少"胰心综合征"的发生提供了一个新的科学依据. 然炎症介质在CaM及TNF-α表达的过程中所起的作用目前还不完全清楚.
ANP相关性心肌损伤的研究目前逐渐成为热点, 随着分子生物学技术的发展, 相关蛋白和基因的表达已成为一个新的研究方向.
目前国内外均有ANP心肌损伤的相关报道, 然CaM及TNF-α对钙离子通道的调节导致心肌细胞内钙离子失衡的机制研究目前国内尚未见报道.
本文探讨CaM及TNF-α介导ANP心肌损害机制, 有一定的临床指导意义.
编辑: 韦元涛 电编: 闫晋利
| 1. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 2. | Berezina TL, Zaets SB, Mole DJ, Spolarics Z, Deitch EA, Machiedo GW. Mesenteric lymph duct ligation decreases red blood cell alterations caused by acute pancreatitis. Am J Surg. 2005;190:800-804. [PubMed] [DOI] |
| 3. | Sha H, Ma Q, Jha RK. Trypsin is the culprit of multiple organ injury with severe acute pancreatitis. Med Hypotheses. 2009;72:180-182. [PubMed] [DOI] |
| 4. | Surbatović M, Jovanović K, Radaković S, Filipović N. [Pathophysiological aspects of severe acute pancreatitis-associated lung injury]. Srp Arh Celok Lek. 2005;133:76-81. [PubMed] [DOI] |
| 5. | Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 1985;260:3440-3450. [PubMed] |
| 7. | Gao Q, Zhang SZ, Cao CM, Bruce IC, Xia Q. The mitochondrial permeability transition pore and the Ca2+-activated K+ channel contribute to the cardioprotection conferred by tumor necrosis factor-alpha. Cytokine. 2005;32:199-205. [PubMed] [DOI] |
| 10. | Tao J, Xu H, Yang C, Liu CN, Li S. Effect of urocortin on L-type calcium currents in adult rat ventricular myocytes. Pharmacol Res. 2004;50:471-476. [PubMed] |
| 11. | Shao JP, Chen X, Zhu BD, Zhao Y, Feng BH, Liu X, Hu R, Deng CD. Influence of Yihuo Qingyi decoction on myocardial cell injury of severe acute pancreatitis rat. Chin J Integr Trad West Med Dig. 2005;13:71-74. |
| 12. | 赵 鹏军, 孙 锟. 钙/钙调素依赖的蛋白激酶II对心肌细胞钙循环的影响. 国外医学•生理•病理科学与临床分册. 2004;24:357-359. |