修回日期: 2014-11-14
接受日期: 2014-11-25
在线出版日期: 2015-01-18
目的: 系统评价沙利度胺(thalidomide, TLD)联合肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗原发性肝癌(primary hepatic carcinomas, PHC)的疗效和安全性.
方法: 计算机检索Cochrane Library(2014年第3期)、Web of Science(1986/2014-03)、PubMed(1966/2014-03)、CNKI(1917/2014-03)、维普(1989/2014-03)、万方数据库(1998/2014-03), 收集所有TLD联合TACE治疗PHC的随机对照试验. 由两名评价员严格按照纳入标准选择文献, 提取资料, 并参照Cochrane系统评价的要求, 对选择纳入的随机对照试验进行方法学质量评估后, 采用Cochrane协作网提供的RevMan 5.2软件对总有效率、疾病控制率、生活质量KPS评分、不同年限生存率、甲胎蛋白的变化、血管内皮生长因子(vascular endothelial growth factor, VEGF)的变化及不良反应发生率进行Meta分析.
结果: 最终纳入22项随机对照试验, 包括1590例PHC患者, Meta分析结果显示, TLD联合TACE组治疗PHC的总有效率(RR合并 = 1.29, 95%CI: 1.15-1.44)、疾病控制率(RR合并 = 1.27, 95%CI: 1.16-1.39)、生活质量KPS评分(MD合并 = 9.23, 95%CI: 6.90-11.55)、半年生存率(RR合并 = 1.10, 95%CI: 1.01-1.20)、1年生存率(RR合并 = 1.25, 95%CI: 1.13-1.39)、2年生存率(RR合并 = 1.45, 95%CI: 1.18-1.78)、3年生存率(RR合并 = 1.70, 95%CI: 1.16-2.50)、VEGF水平的变化(MD合并 = -123.64, 95%CI: -143.72--103.55)优于单纯TACE组, 差异有统计学意义(均P<0.05); 不良反应发生率: 在药物性皮疹发生率方面, TLD联合TACE组明显高于单纯TACE组, 差异有统计学意义(RR = 4.50, 95%CI: 2.34-8.64, P<0.00001); 在减少消化系应发生率(RR = 1.08, 95%CI: 0.93-1.25)、降低骨髓抑制发生率(RR = 1.12, 95%CI: 0.82-1.52)、降低肝功能异常发生率方面(RR = 1.00, 95%CI: 0.72-1.39), TLD联合TACE组与单纯TACE组相近似, 差异无统计学意义(均P>0.05).
结论: 目前研究显示, 与单纯TACE疗法相比, TLD联合TACE治疗PHC在总有效率、疾病控制率、生活质量KPS评分、半年生存率、1、2、3年生存率、降低VEGF方面具有明显的优势, 但在安全性方面, TLD联合TACE组在药物性皮疹发生率方面明显高于单纯TACE组, 而在消化系反应、骨髓抑制率、肝功能异常方面与单纯TACE组相似.
核心提示: 原发性肝癌(primary hepatic carcinomas, PHC)属于多血管实体瘤, 肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是晚期肝癌的首选治疗方法, 但术后肝癌组织缺氧而促进新的血管生成, 从而降低治疗效果. 沙利度胺沙利度胺(thalidomide)是一种目前研究较为成熟的抗肿瘤血管生成药物, 能选择性抑制血管的新生, 与TACE联合应用可明显提高抑制癌肿的疗效, 使对PHC的治疗更为彻底.
引文著录: 陈子瑶, 梁健, 邓鑫. 沙利度胺联合TACE治疗原发性肝癌疗效与安全性的系统评价. 世界华人消化杂志 2015; 23(2): 291-307
Revised: November 14, 2014
Accepted: November 25, 2014
Published online: January 18, 2015
AIM: To evaluate the efficacy and safety of thalidomide (TLD) combined with transcatheter arterial chemoembolization (TACE) for primary hepatic carcinoma (PHC).
METHODS: We searched all randomized controlled trials (RCTs) about TLD combined with TACE for PHC from the Cochrane Library (2014, Issue 3), Web of Science (1986 to March 2014), PubMed (1966 to March 2014), CNKI (1917 to March 2014), VIP (1989 to March 2014) and WanFang Databases (1998 to March 2014). The retrieved articles were screened by two reviewers according to the inclusion criteria, and the data were then extracted. The quality of the included RCTs was evaluated with reference to the Cochrane systematic review. Meta-analysis of overall response rate (ORR), disease control rate (DCR), change of KPS score, survival rate, the change of VEGF and rate of adverse effects was conducted using RevMan 5.2 software.
RESULTS: A total of 22 RCTs involving 1590 patients were included. The meta-analysis showed that compared with TACE alone, TLD combined with TACE was superior in ORR [relative risk (RR) = 1.29, 95% confidence interval (CI): 1.15-1.44], DCR (RR = 1.27, 95%CI: 1.16-1.39), change of KPS score [mean difference (MD) = 9.23, 95%CI: 6.90-11.55], 6-month survival rate (RR = 1.10, 95%CI: 1.01-1.20), 1-year survival rate (RR = 1.25, 95%CI: 1.13-1.39), 2-year survival rate (RR = 1.45, 95%CI: 1.18-1.78), 3-year survival rate (RR = 1.70, 95%CI: 1.16-2.50), and change of VEGF score (MD = -123.64, 95%CI: -143.72--103.55) (P < 0.05). TLD combined with TACE was associated with a higher incidence of drug rash compared with TACE alone (RR = 4.50, 95%CI: 2.34-8.64, P < 0.00001), although the two groups had comparable incidence of gastrointestinal reactions (RR = 1.08, 95%CI: 0.93-1.25), myelosuppression (RR = 1.12, 95%CI: 0.82-1.52), and liver dysfunction (RR = 1.00, 95%CI: 0.72-1.39) (P > 0.05).
CONCLUSION: The current research shows that compared with TACE alone, TLD combined with TACE was associated with higher ORR, DCR, change of KPS score, 0.5-, 1-, 2- and 3-year survival rates, and change of VEGF score, as well as a higher incidence of drug rash, although the incidence of gastrointestinal reactions, myelosuppression, and liver dysfunction was similar between the two groups.
- Citation: Chen ZY, Liang J, Deng X. Efficacy and safety of thalidomide combined with transcatheter arterial chemoembolization for primary hepatic carcinoma: A systematic review. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 291-307
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/291.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.291
原发性肝癌(primary hepatic carcinomas, PHC)是全球范围内最常见的消化系恶性肿瘤之一, 据统计, 2008年, 全球范围内PHC新发病例达748300例; 因PHC死亡病例达695900例, 而这些新发病例和死亡病例约50%发生在中国, 分别位居我国恶性肿瘤的第2、3位[1,2], 严重危害着人们的生命和健康. 目前对于PHC的治疗, 局部手术切除仍是首选的治疗方法, 但由于肝癌发病隐匿, 进展迅猛, 临床上很多患者就诊时病情已属于不可切除的中晚期, 因此非手术治疗PHC成为临床各个学科积极研究的方向[3]. 肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)是已被公认了的非手术治疗肝癌的首选方法[4-7], 但由于PHC属于多血管实体肿瘤, 新生血管为其细胞提供了充分的营养, 促进其增殖、浸润和转移, 从而大大地影响了TACE治疗的整体疗效, 使TACE治疗后3年生存率仅约20%[8,9], 且TACE术后肝癌组织缺氧导致血管内皮生长因子(vascular endothelial growth factor, VEGF)的生成增加[10], 更加促进癌肿组织新的血管生成, 因此抗肿瘤血管生成在治疗PHC上显得尤为重要.
沙利度胺(thalidomide, TLD)是一种目前研究较为成熟的抗肿瘤血管生成分子靶向药物, 近年来, 许多学者不断尝试TLD联合TACE治疗PHC的研究, 表明, TLD可有效阻止VEGF诱导的Caveolin-1的下调, 从而选择性抑制VEGF的血管生成作用, 弥补TACE的不足, 巩固TACE治疗PHC的整体疗效[11]. 但目前大部分相关的临床对照研究规模都比较小, 数据零散, 样本量小, 说服力不足. 因此, 本文采用Cochrane系统评价方法, 搜集已发表的随机对照试验(randomized controlled trial, RCT)进行严格评价和分析, 以期为临床应用TLD联合TACE治疗PHC提供参考.
国内外所有关于TLD联合TACE治疗PHC的临床RCT, 无论是否采用盲法和分配隐藏, 语种不限. 符合2001年"原发性肝癌的临床诊断与分期标准"[12]的诊断标准, 确诊为PHC、不能手术切除、Karnofsky(简称KPS)评分>60分的中晚期患者, 不限性别、年龄、种族. 干预措施: (1)TLD+TACE术 vs 单纯TACE术; (2)TLD+TACE术+其他疗法 vs TACE术; (3)TLD+TACE术+其他疗法 vs TACE术+其他疗法. 两组若都采用了TACE术治疗, TACE术的操作和化疗方案均完全相同. 评价指标: (1)主要指标: 总有效率: 按世界卫生组织(World Health Organization, WHO)实体瘤近期疗效标准[13]进行评估, 总有效率 = (CR+PR)/总例数; (2)次要指标: 疾病控制率: 按WHO实体瘤近期疗效标准[13]进行评估, 疾病控制率 = (CR+PR+SD)/总例数. 生活质量KPS评分: 按Karnofsky评分标准[14], 治疗后提高10分者为改善. 不同年限生存率: 从试验治疗开始至死亡(注明原因)的病例数/总病例数. VEGF水平的变化: 试验治疗前后的对比. 不良反应发生率: 按WHO抗癌药物急性与亚急性不良反应分度标准[15]来评估, 包括药物性皮疹、消化系反应、骨髓抑制及肝功能异常. 检索策略: 按照Cochrane协作网工作手册的要求制定检索策略, 计算机检索Cochrane Library(2014年第3期)、Web of Science(1986-2014.3)、PubMed(1966-2014.3)、CNKI(1917-2014.3)、维普(1989-2014.3)、万方数据库(1998-2014.3), 收集所有TLD联合TACE治疗PHC的RCT. 中文检索式为(原发性肝癌、肝细胞癌 、沙利度胺或反应停、肝动脉化疗栓塞术), 英文检索式为(primary hepatic carcinoma, thalidomide, transcatheter arterial chemoembolization). 检索途径以"原发性肝癌"为主题, 在全文中搜索"沙利度胺"、"肝动脉化疗栓塞术", 对搜索结果进行相关文献筛选.
1.2.1 筛选文献: 由两位研究员独立筛选文献的摘要和题目, 剔除动物实验研究、病例报告、综述、临床经验总结、体会、非随机对照试验及重复的文献, 然后查看全文, 进一步确定是否符合上述纳入标准. 交叉核对纳入研究的结果, 如遇分歧, 由第3位研究员协助解决.
1.2.2 提取资料: 由两位研究员对符合纳入标准的文献进行数据提取, 填写预先设计好数据提取表, 包括: (1)一般信息, 包括标题、研究ID号、作者、作者ID号、作者联系方式、发表时间和文献来源; (2)受试者, 包括性别、年龄、诊断标准、参加的人数、描述退出或随访丢失的原因; (3)设计和实施, 包括设计类型、研究和随访时间、干预措施、测量指标; (4)结局指标, 包括总有效率、疾病控制率、生活质量KPS评分、不同年限生存率、VEGF水平的变化和不良反应发生率. 缺乏的资料通过电话方式与原始作者联系进行补充.
1.2.3 纳入研究的方法学质量评价: 纳入RCT的方法学质量采用Higgins等[16]Cochrane Reviewer Handbook 5.1.4的RCT质量评价标准进行评价: (1)随机分配方法, 即随机序列的产生方法; (2)分配隐藏的实施情况; (3)是否采用盲法, 包括研究实施过程和测量结果过程中是否采用了盲法; (4)纳入研究结果数据的完整性, 对失访情况的报道; (5)是否选择性报告研究结果; (6)是否有其他偏倚来源.
1.2.4 证据质量的评估: 按照Cochrane系统评价推荐使用的GRADE标准, 采用GRADE 3.6软件来评估证据质量, 影响GRADE证据质量的因素主要有: (1)研究设计和实施过程中的局限性; (2)证据的间接性; (3)结果间无法解释的异质性; (4)结果不精确; (5)发表偏倚的高度可能性.
统计学处理 采用Cochrane协作网提供的RevMan 5.2软件进行Meta分析. 各纳入研究结果间的异质性采用χ2检验. 当各研究结果间有统计学同质性(P>0.1, I2<50%)时, 采用固定效应模型进行Meta分析; 如各研究结果间存在统计学异质性(P<0.1, I2>50%), 分析其异质性原因, 根据可能导致异质性的因素进行亚组分析, 当亚组内各研究之间及亚组间有足够相似性(亚组P>0.1, I2<50%)时则用固定效应模型进行Meta分析, 若纳入研究各亚组之间存在统计学异质性而无临床异质性或临床差异无统计学意义时, 采用随机效应模型进行Meta分析. 若亚组中存在低质量研究时则采用敏感性分析检验结果的稳定性和强度.
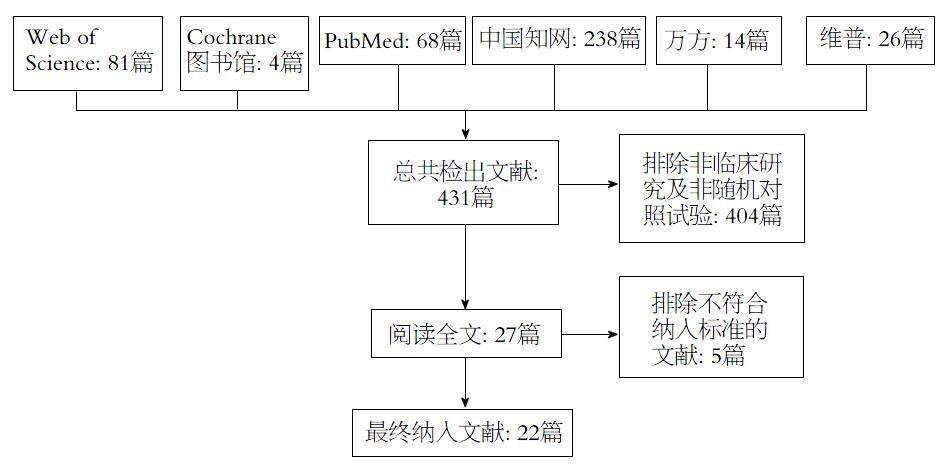
初检出相关文献431篇, 通过去重、阅读文题与摘要后, 初步纳入文献27篇, 阅读全文后排除5篇, 最终纳入22个RCT[11,17-37], 共1590例患者, 其中试验组783例, 对照组807例. 文献筛选流程及结果如图1.
纳入研究的基本特征如表1. 各项研究的试验组和对照组中患者的性别、年龄、临床分期、生活质量等差异无统计学意义, 具有良好的可比性.
| 纳入研究 | 病例人数(n) | 男/女 | 年龄(岁) | TNM分期(n) | 生活质量 | 干预措施 | 终点指标 | ||
| T组 | C组 | T组 | C组 | ||||||
| 冯龙等[17]2008 | 15 | 20 | 28/7 | 31-73 | NA | KPS | TACE+TLD | TACE | (1)、(4)、(5) |
| 刘秀芳等[18]2007 | 40 | 58 | 62/36 | 36-70 | Ⅱ(64) Ⅲ(34) | NA | TACE+TLD | TACE | (1)、(2)、(5)、(6)、(7)、(9) |
| 叶祯开等[19]2013 | 38 | 39 | 72/5 | 23-69 | Ⅱ(55) Ⅲ(22) | KPS | TACE+TLD+放疗 | TACE+放疗 | (1)、(4)、(5)、(6) |
| 姜海英等[20]2010 | 32 | 32 | 48/16 | 37-72 | Ⅱb-Ⅲ(49) Ⅳ(15) | KPS | TACE+TLD | TACE | (1)、(2)、(5)、(6)、(8)、(9) |
| 姜海英等[21]2011 | 50 | 50 | 77/23 | 30-60 | Ⅱb-Ⅲ(77) Ⅳ(23) | KPS | TACE+TLD | TACE | (1)、(2)、(5)、(6)、(8)、(9) |
| 尚岩等[22]2011 | 60 | 60 | 69/51 | 31-74 | Ⅱ(88) Ⅲ(32) | NA | TACE+TLD | TACE | (1)、(2)、(5)、(6)、(7) |
| 戚晓军等[23]2007 | 34 | 34 | 48/20 | 30-83 | Ⅱ(28) Ⅲ(22) Ⅳ(18) | NA | TACE+TLD | TACE | (8) |
| 李泽锋等[24]2009 | 20 | 23 | 36/7 | NA | Ⅱ(43) | KPS | TACE+TLD+热疗 | TACE+热疗 | (1)、(2)、(3)、(4)、(5) |
| 林海澜等[25]2007 | 32 | 31 | 53/10 | 22-75 | Ⅰ(6) Ⅱ(57) | NA | TACE+TLD | TACE | (8) |
| 林云笑等[26]2010 | 70 | 62 | 94/38 | 30-77 | Ⅱ(91) Ⅲ(41) | NA | TACE+TLD | TACE | (4)、(5)、(6) |
| 潘骥群等[27]2013 | 27 | 27 | 38/16 | 36-76 | NA | KPS | TACE+TLD | TACE | (1)、(2)、(8) |
| 王为民等[11]2009 | 21 | 26 | 30/17 | 25-75 | Ⅱ(15) Ⅲ(32) | KPS | TACE+TLD | TACE+纤维素片 | (1)、(2)、(9) |
| 王飞[28]2010 | 38 | 34 | 48/24 | 15-70 | NA | NA | TACE+TLD | TACE | (1)、(2)、(5)、(8) |
| 苏小琴等[29]2012 | 37 | 35 | NA | NA | NA | KPS | TACE+TLD | TACE | (3) |
| 袁孝兵等[30]2009 | 18 | 21 | 31/8 | 35-75 | Ⅱ(27) Ⅲ(12) | KPS | TACE+TLD | TACE+纤维素片 | (4)、(5) |
| 赵增虎等[31]2010 | 45 | 42 | 66/21 | 39-68 | Ⅱ(17) Ⅲ(70) | KPS | TACE+TLD+中药 | TACE+中药 | (1)、(8) |
| 郑伟生[32]2006 | 14 | 15 | 26/3 | 21-70 | NA | KPS | TACE+TLD | TACE | (1)、(3) |
| 郝明志等[33]2007 | 45 | 51 | 86/10 | 22-75 | Ⅰ(6) Ⅱ(76) Ⅲ(14) | KPS | TACE+TLD | TACE | (4)、(5)、(6) |
| 郭鹏等[34]2007 | 15 | 17 | 20/12 | 33-66 | NA | KPS | TACE+TLD | TACE | (1) |
| 陆向东等[35]2014 | 30 | 30 | 41/19 | 26-77 | NA | KPS | TACE+TLD | TACE | (1)、(8) |
| 陈昌南等[36]2008 | 40 | 40 | 58/22 | 32-79 | Ⅰ(13) Ⅱ(49) Ⅲ(18) | NA | TACE+TLD | TACE | (4)、(5)、(6) |
| 陈昌南等[37]2012 | 62 | 60 | 106/16 | 18-82 | Ⅰ(3) Ⅱ(26) Ⅲ(93) | NA | TACE+TLD+替吉奥 | TACE | (1)、(2)、(9) |
纳入RCT的方法学质量评价按照Cochrane协作网偏倚风险评价标准, 采用Cochrane评价员手册5.2推荐的偏倚风险评价工具进行评估. 所有纳入的研究均提及随机对照, 其中有6项研究[20,21,23,24,27,33]使用了随机数字表, 有1项研究[19]使用了信封法产生随机序列, 其余15项研究[11,17,18,22,25,26,28-32,34-37]未描述具体的随机方法. 所有研究均未提及方案分配隐藏. 有2项研究[11,30]也实施了盲法(双盲), 其余20项研究未描述盲法的使用情况. 全部研究的数据均完整. 1项研究[26]报告的结局指标与预先的指标不一致. 所有研究均因信息不全而不清楚是否存在其他偏倚来源(表2).
| 纳入研究 | 随机方法 | 分配隐藏 | 盲法实施 | 不完整报告资料 | 选择性报告结果 | 其他偏倚 |
| 冯龙等[17]2008 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 刘秀芳等[18]2007 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 叶祯开等[19]2013 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 姜海英等[20]2010 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 姜海英等[21]2011 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 尚岩等[22]2011 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 戚晓军等[23]2007 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 李泽锋等[24]2009 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 林海澜等[25]2007 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 林云笑等[26]2010 | 不清楚 | 不清楚 | 高风险 | 低风险 | 高风险 | 不清楚 |
| 潘骥群等[27]2013 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 王为民等[11]2009 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 | 不清楚 |
| 王飞[28]2010 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 苏小琴等[29]2012 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 袁孝兵等[30]2009 | 不清楚 | 不清楚 | 低风险 | 低风险 | 低风险 | 不清楚 |
| 赵增虎等[31]2010 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 郑伟生[32]2006 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 郝明志等[33]2007 | 低风险 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 郭鹏等[34]2007 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 陆向东等[35]2014 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 陈昌南等[36]2008 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
| 陈昌南等[37]2012 | 不清楚 | 不清楚 | 高风险 | 低风险 | 低风险 | 不清楚 |
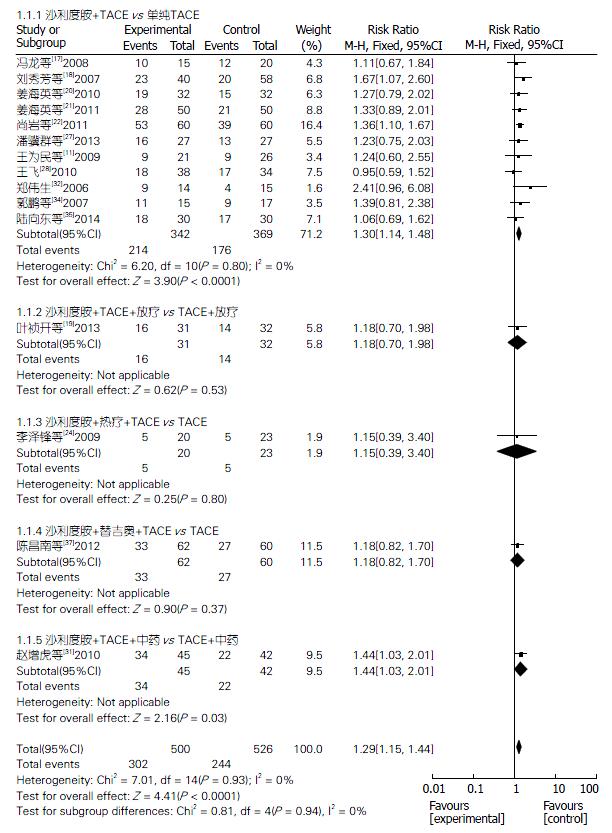
2.4.1 总有效率: 15项研究[11,17-22,24,27,28,31,32,34,35,37]报道了TLD联合TACE组与单纯TACE组治疗PHC的总有效率, 固定效应模型分析结果显示, 两组总有效率差异显著(Z = 4.41, P<0.0001); 合并效应值RR合并 = 1.29, 95%可信区间(95%CI): 1.15-1.44. 提示TLD联合TACE组的总有效率明显优于单纯TACE组, 差异有统计学意义(P<0.0001). 5个亚组有效率分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 3.90, P<0.0001), TLD+TACE+放疗 vs TACE+放疗(Z = 0.62, P = 0.53), TLD+TACE+热疗 vs 单纯TACE(Z = 0.25, P = 0.80), TLD + 替吉奥+TACE vs 单纯TACE(Z = 0.90, P = 0.37), TLD+TACE+中药 vs TACE+中药(Z = 2.16, P = 0.03). 敏感性分析结果提示, 不论剔除哪一项研究RR值和95%CI都不会发生很大改变(图2).
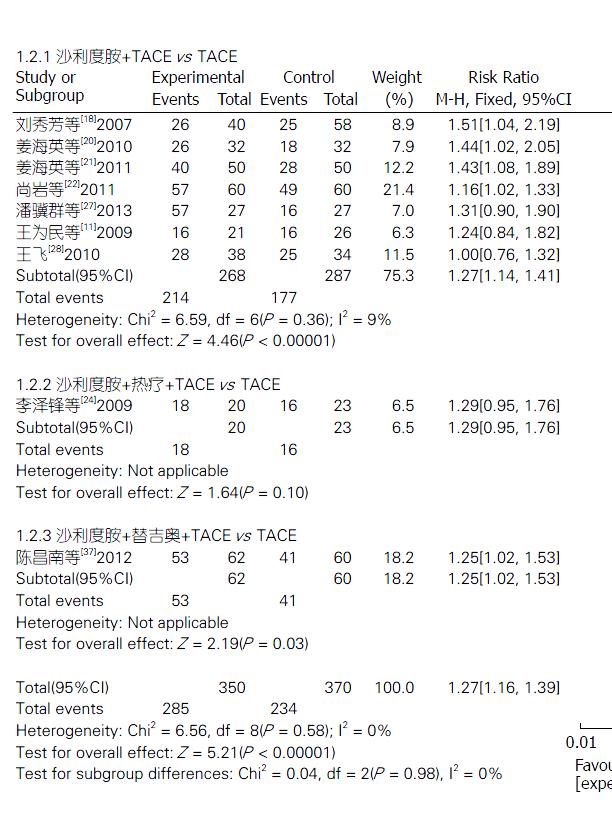
2.4.2 疾病控制率: 9项研究[11,18,20-22,24,27,28,37]报道了TLD联合TACE组与单纯TACE组治疗PHC的疾病控制率, 固定效应模型分析结果显示, 两组疾病控制率差异显著(Z = 5.21, P<0.00001); 合并效应值RR合并 = 1.27, 95%CI: 1.16-1.39. 提示TLD联合TACE组的疾病控制率明显优于单纯TACE组, 差异有统计学意义(P<0.00001). 3个亚组疾病控制率分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 4.46, P<0.00001), TLD+TACE+热疗 vs 单纯TACE(Z = 1.64, P = 0.10), TLD+替吉奥+TACE vs 单纯TACE(Z = 2.19, P = 0.03). 敏感性分析结果提示, 不论剔除哪一项研究RR值和95%CI都不会发生很大改变(图3).
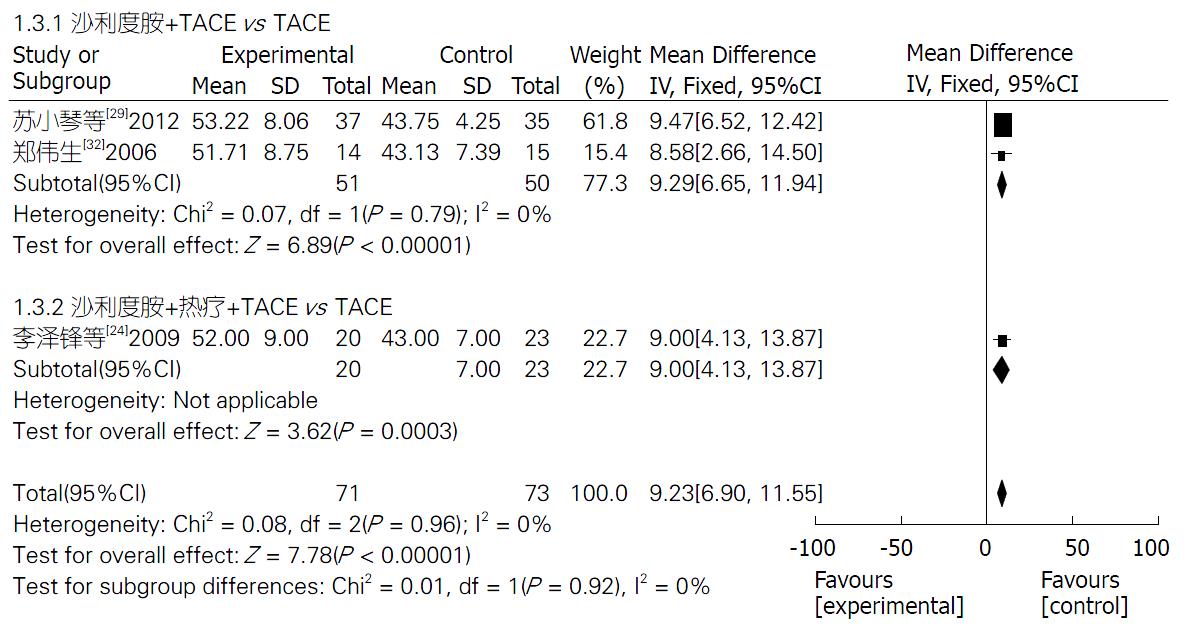
2.4.3 生活质量KPS评分: 3项研究[24,29,32]报道了TLD联合TACE组与单纯TACE组治疗PHC的生活质量KPS评分, 固定效应模型分析结果显示, 两组生活质量KPS评分差异显著(Z = 7.78, P<0.00001); 合并效应值MD合并 = 9.23, 95%CI: 6.90-11.55. 提示TLD联合TACE组的生活质量改善率明显优于单纯TACE组, 差异有统计学意义(P<0.00001). 2个亚组生活质量改善率分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 6.89, P<0.00001), TLD+TACE+热疗 vs 单纯TACE(Z = 3.62, P = 0.0003). 敏感性分析结果提示, 不论剔除哪一项研究MD值和95%CI都不会发生很大改变(图4).
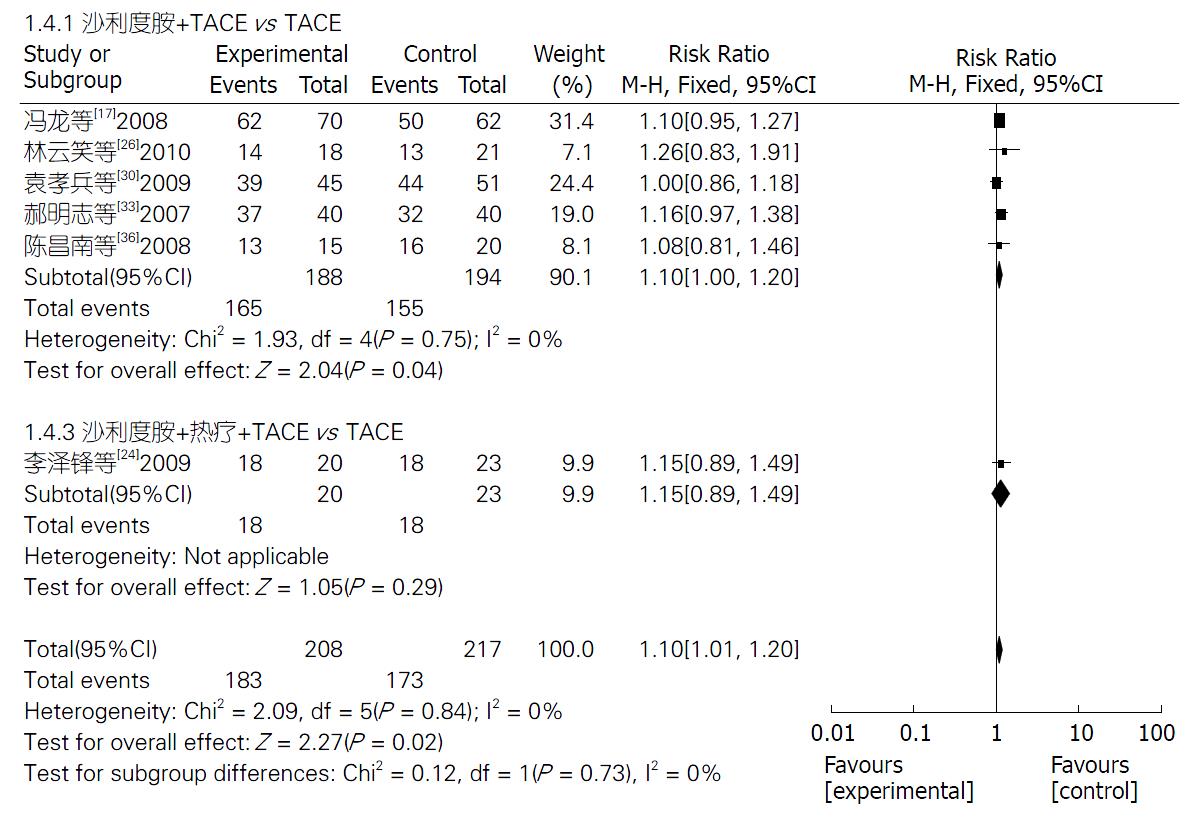
2.4.4 半年生存率: 7项研究[17,19,24,26,30,33,36]报道了TLD联合TACE组与单纯TACE组治疗PHC的半年生存率, 异质性检验结果显示, 7项研究间具有异质性(P<0.00001, I2 = 83%), 进行异质性分析和处理, 剔除研究[19]后显示6项研究具有同质性(P = 0.84, I2 = 0%). 固定效应模型分析结果显示, 两组生存率差异显著(Z = 2.27, P = 0.02); 合并效应值RR合并 = 1.10, 95%CI: 1.01-1.20. 提示TLD联合TACE组的半年生存率明显优于单纯TACE组, 差异有统计学意义(P = 0.02). 2个亚组半年生存率分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 2.04, P = 0.04), TLD+TACE+热疗 vs 单纯TACE(Z = 1.05, P = 0.29). 敏感性分析结果提示, 不论去除哪一项研究RR值和95%CI都不会发生很大改变(图5).
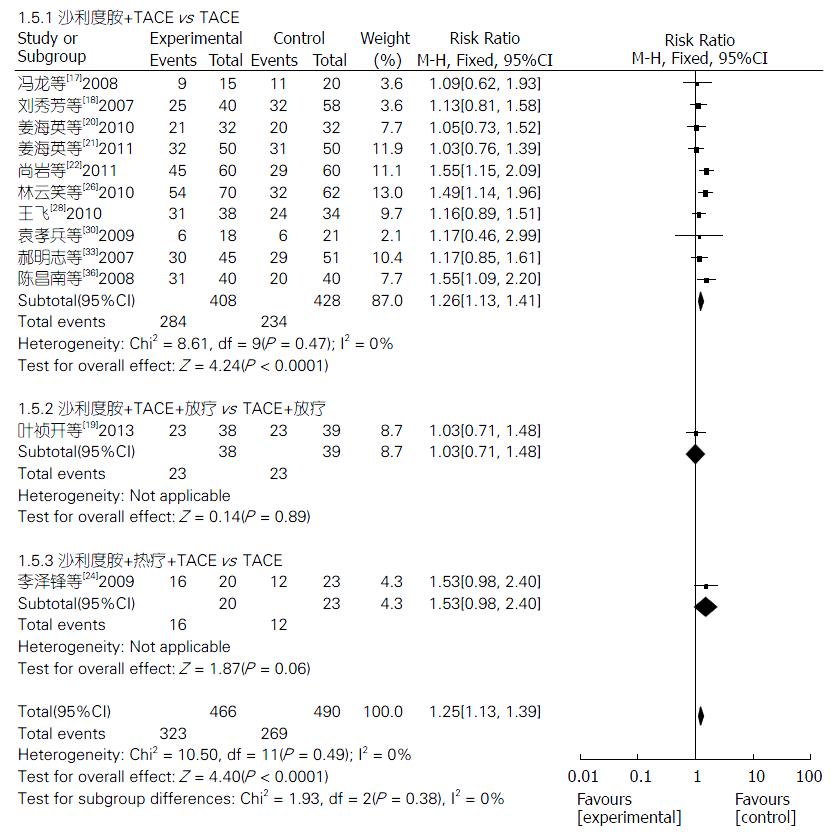
2.4.5 1年生存率: 12项研究[17-22,24,26,28,30,33,36]报道了TLD联合TACE组与单纯TACE组治疗PHC的1年生存率, 固定效应模型分析结果显示, 两组生存率差异显著(Z = 4.40, P<0.0001); 合并效应值RR合并 = 1.25, 95%CI: 1.13-1.39. 提示TLD联合TACE组的1年生存率明显优于单纯TACE组, 差异有统计学意义(P<0.0001). 3个亚组1年生存率分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 4.24, P<0.0001), TLD+TACE+放疗 vs TACE+放疗(Z = 0.14, P = 0.89), TLD+TACE+热疗 vs 单纯TACE(Z = 1.87, P = 0.06). 敏感性分析结果提示, 不论去除哪一项研究RR值和95%CI都不会发生很大改变(图6).
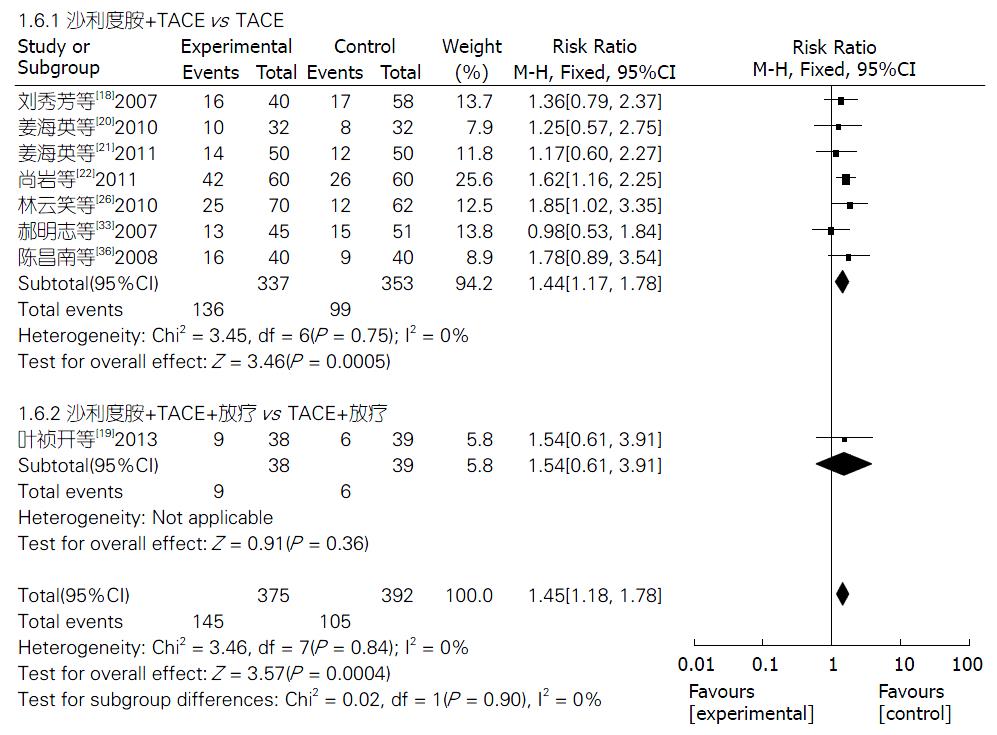
2.4.6 2年生存率: 8项研究[18-22,26,33,36]报道了TLD联合TACE组与单纯TACE组治疗PHC的2年生存率, 固定效应模型分析结果显示, 两组生存率差异显著(Z = 3.57, P = 0.0004); 合并效应值RR合并 = 1.45, 95%CI: 1.18-1.78. 提示TLD联合TACE组的2年生存率明显优于单纯TACE组, 差异有统计学意义(P = 0.0004). 2个亚组2年生存率分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 3.46, P = 0.0005), TLD+TACE+放疗 vs TACE+放疗(Z = 0.91, P = 0.36). 敏感性分析结果提示, 不论去除哪一项研究RR值和95%CI都不会发生很大改变(图7).
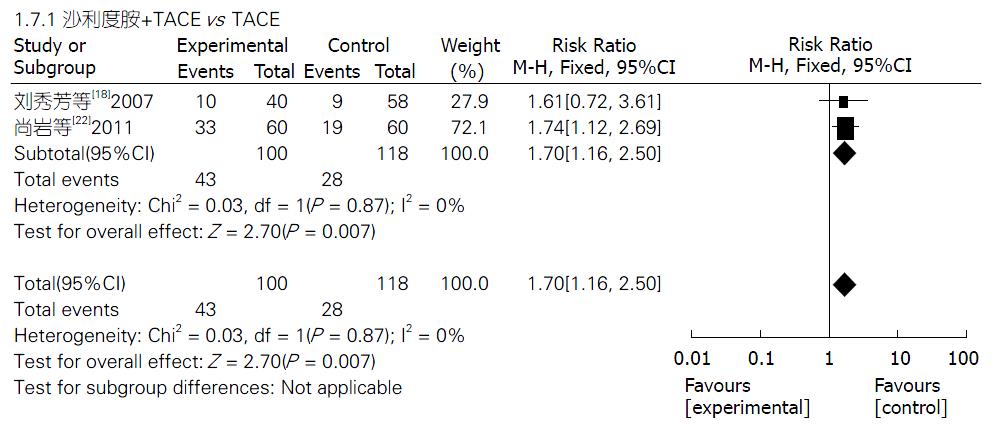
2.4.7 3年生存率: 2项研究[18,22]报道了TLD联合TACE组与单纯TACE组治疗PHC的3年生存率, 固定效应模型分析结果显示, 两组生存率差异显著(Z = 2.70, P = 0.007); 合并效应值RR合并 = 1.70, 95%CI: 1.16-2.50. 提示TLD联合TACE组的3年生存率明显优于单纯TACE组, 差异有统计学意义(P = 0.007)(图8).
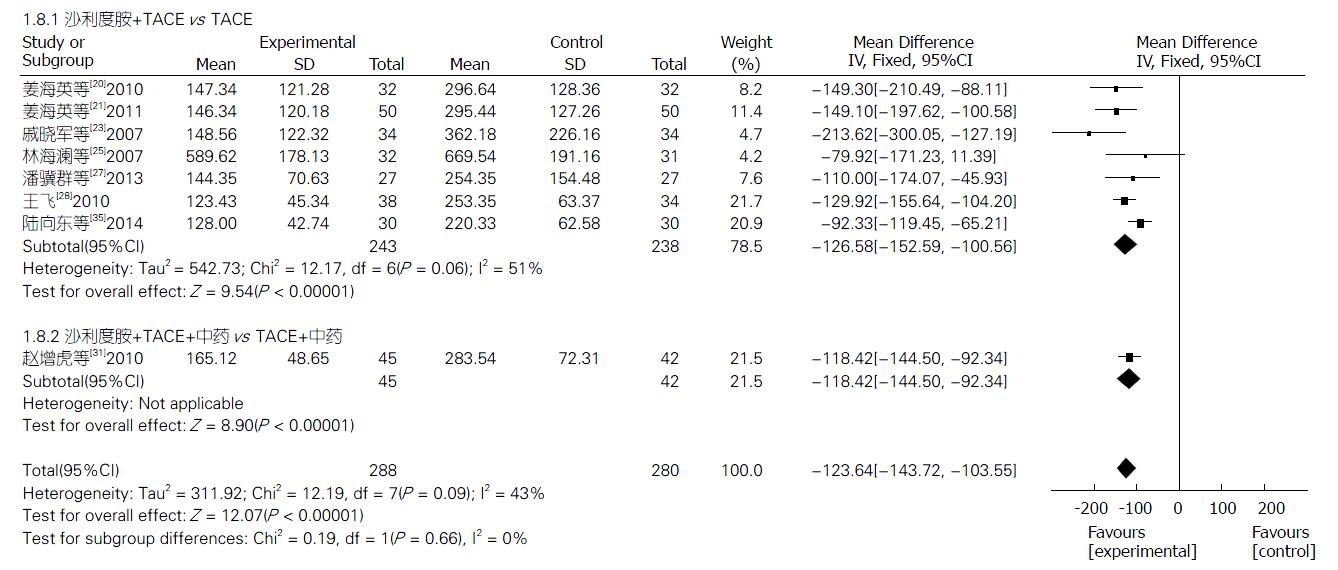
2.4.8 VEGF水平的变化: 8项研究[20,21,23,25,27,28,31,35]报道了TLD联合TACE组与单纯TACE组治疗PHC的VEGF水平的变化, 异质性检验结果显示, 8项研究间具有中度异质性(P = 0.09, I2 = 43%), 采用随机效应模型分析结果显示, 两组VEGF水平变化差异显著(Z = 12.07, P<0.00001); 合并效应值MD合并 = -123.64, 95%CI: -143.72--103.55. 提示TLD联合TACE组的VEGF水平变化明显优于单纯TACE组, 差异有统计学意义(P<0.00001). 2个亚组VEGF水平变化分析结果分别如下: TLD+TACE vs 单纯TACE(Z = 9.54, P<0.00001), TLD+TACE+中药 vs TACE+中药(Z = 8.90, P<0.00001). 敏感性分析结果提示, 不论剔除哪一项研究MD值和95%CI都不会发生很大改变(图9).
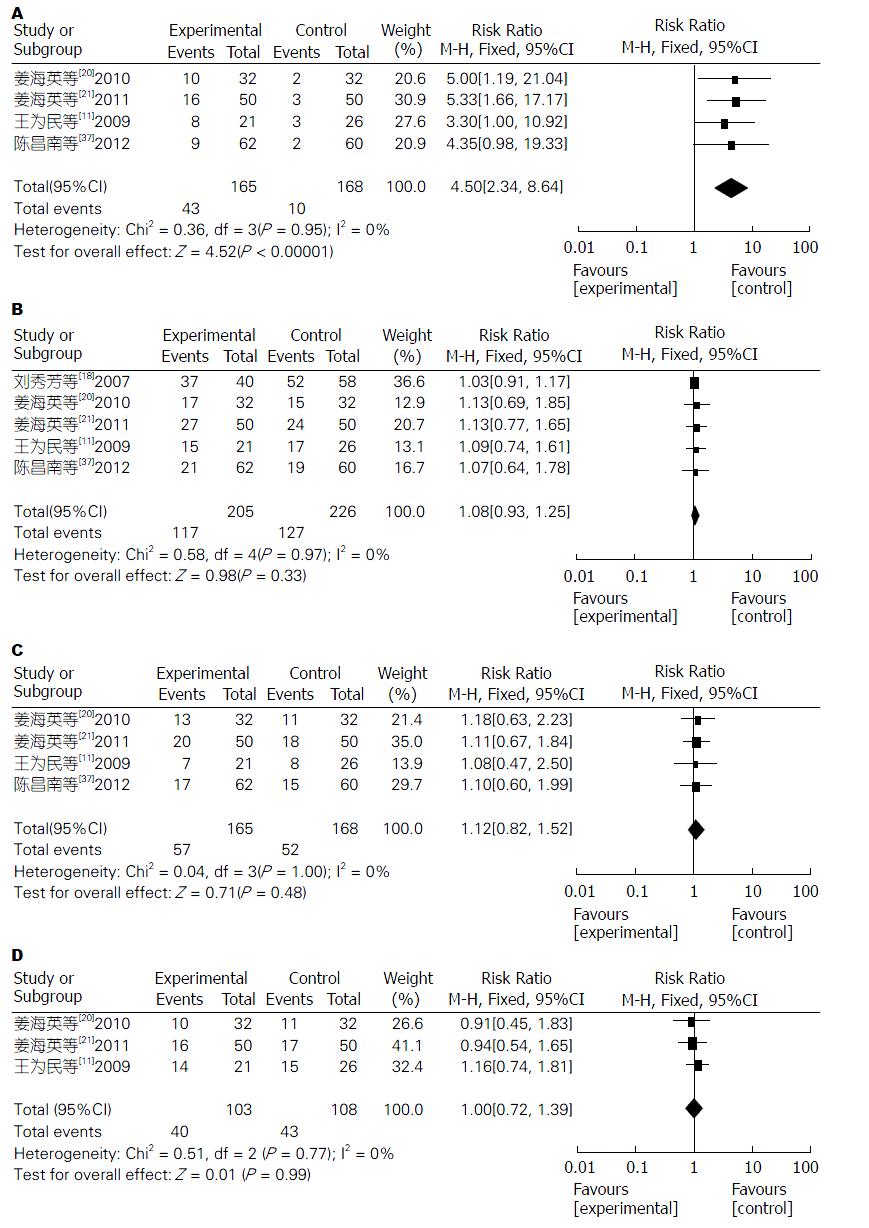
2.4.9 不良反应发生率: 4项研究[11,20,21,37]报道了TLD联合TACE组与单纯TACE组治疗PHC的药物性皮疹发生率, 固定效应模型分析结果显示, 两组药物性皮疹发生率差异显著(Z = 4.52, P<0.00001); 合并效应值RR = 4.50, 95%CI: 2.34-8.64. 提示TLD联合TACE组的药物性皮疹发生率明显高于单纯TACE组, 差异有统计学意义(P<0.00001)(图10).
5项研究[11,18,20,21,37]报道了TLD联合TACE组与单纯TACE组治疗PHC的消化系反应发生率, 固定效应模型分析结果显示, 两组消化系反应发生率无明显差异(Z = 0.98, P = 0.33); 合并效应值RR = 1.08, 95%CI: 0.93-1.25. 提示TLD联合TACE组的消化系反应发生率与单纯TACE组相近似, 差异无统计学意义(P = 0.33)(图10).
4项研究[11,20,21,37]报道了TLD联合TACE组与单纯TACE组治疗PHC的骨髓抑制发生率, 固定效应模型分析结果显示, 两组骨髓抑制发生率无明显差异(Z = 0.71, P = 0.48); 合并效应值RR = 1.12, 95%CI: 0.82-1.52. 提示TLD联合TACE组的骨髓抑制发生率与单纯TACE组相近似, 差异无统计学意义(P = 0.48)(图10).
3项研究[11,20,21]报道了TLD联合TACE组与单纯TACE组治疗PHC的肝功能异常发生率, 固定效应模型分析结果显示, 两组肝功能异常发生率无明显差异(Z = 0.01, P = 0.99); 合并效应值RR = 1.00, 95%CI: 0.72-1.39. 提示TLD联合TACE组的肝功能异常发生率与单纯TACE组相近似, 差异无统计学意义(P = 0.99)(图10).
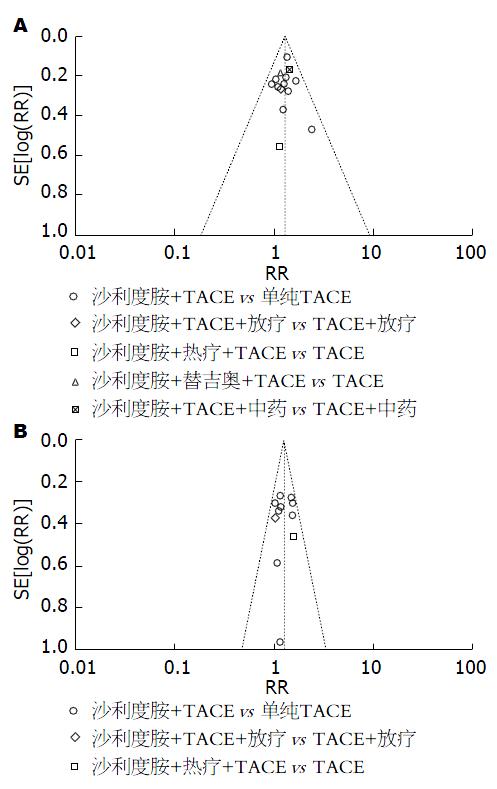
我们采用总有效率指标及1年生存率指标对纳入研究进行漏斗图分析. 漏斗图对称性良好, 提示结果受发表偏倚影响的可能性较小(图11).
根据GRADE标准质量分级原则把证据质量评级分为四级(高质量、中等质量、低质量、极低质量), 本研究中纳入研究的证据评级基本都是中等质量, 具体情况如表3 (GRADE分级证据质量评估表).
| 评价 指标 | 受试者 人数 | 效应值 [RR(95%CI)] | 证据 质量 |
| 总有效率 | 1026 | RR = 1.29, 95%CI: 1.15-1.44 | 中等质量 |
| 疾病控制率 | 720 | RR = 1.27, 95%CI: 1.16-1.39 | 中等质量 |
| 半年生存率 | 425 | RR = 1.10, 95%CI: 1.01-1.20 | 中等质量 |
| 1年生存率 | 956 | RR = 1.25, 95%CI: 1.13-1.39 | 中等质量 |
| 2年生存率 | 767 | RR = 1.45, 95%CI: 1.18-1.78 | 中等质量 |
| 3年生存率 | 218 | RR = 1.70, 95%CI: 1.16-2.50 | 中等质量 |
| VEGF值的变化 | 568 | MD = -123.64, 95%CI: -143.72--103.55 | 中等质量 |
本研究检索了2014-03以前国内外关于TLD联合TACE与单纯TACE治疗PHC疗效与安全性的临床研究, Meta分析结果证实, 在总有效率、疾病控制率、生活质量KPS的变化、不同年限生存率、VEGF的变化指标方面, TLD联合TACE组明显优于单纯TACE组. 关于安全性方面, TLD联合TACE组的药物性皮疹发生率明显高于单纯TACE组, 而TLD联合TACE组与单纯TACE组在消化系反应、骨髓抑制及肝功能损害三方面的发生率相近似.
PHC是全球死亡率极高的恶性肿瘤之一, 尤其是亚洲国家[1].目前对于PHC的治疗, 根治性切除术仍被认为是首选手段, 手术后的5年生存率高达23.8%-54.85%[38-41], 但PHC起病隐匿, 发展迅速, 很多患者就诊时因错失手术的机会而选择非手术治疗. TACE被推荐为不能手术治疗的PHC患者的首选的一线姑息治疗方法[42], 他的原理主要是基于PHC几乎完全是由肝动脉供养, 堵塞供养的肝动脉后能诱导肿瘤缺血坏死, 与化疗结合, 更能大大增加化疗药物的局部浓度, 从而提高治疗的效果. 研究显示, 与一般治疗相比, TACE明显促进了不能手术切除的PHC的肿瘤坏死和提高了患者的2年生存率[43-45]. 然而, 肝脏主要是通过门静脉系统供养, 肝癌结节的典型特征是动脉血管过度生成, 血管生成涉及到不同的细胞因子、生长分化因子和金属蛋白酶, 如VEGF就是被证明了的参与血管生成过程的关键因子之一[46], 肝组织缺氧会激活VEGF从而导致肝动脉血流灌注的增加[47,48]. 研究表明TACE会引起肝癌组织血氧不足, 激活VEGF, VEGF释放并进入血液中, 刺激肝癌组织新的血管生成, 导致肿瘤的继续发展[49]. 因此, 在TACE治疗PHC的同时抗血管生成显得尤为重要.
抗血管生成是20世纪70年代由Folkman等[50]发起的一个癌症治疗新理论. 肿瘤的增长依赖于血管生成, 血管生成抑制剂能阻止肿瘤的增长和治疗肿瘤, 尤其是血管化肿瘤. 近年来, 在学者们的不懈努力下, 研究出了许多抗血管生成药物, TLD就是其中之一. TLD是一种特异性的抗血管生成药物[51,52], 能明显地抑制癌症细胞的VEGF和BFGF等因子[53,54], 从而抑制血管生成. Ⅱ期研究[55,56]发现TLD适用于大多数PHC患者, 但仅仅应用TLD单药治疗取得的效应比较温和, 联合其他药物或者其他治疗方法可能会提高治疗的效果, 延长患者的生存期, 如联合TACE. 姜海英等[21]采用TLD联合TACE治疗PHC发现, 治疗后患者的近期疗效明显提高, 疾病控制率明显改善, 生存期明显延长, VEGF水平显著下降. 可见, TLD与TACE具有明显的优势互补作用, 两者联合应用可明显提高抑制癌肿的疗效, 使对PHC的治疗更为彻底.
对纳入的研究进行Meta分析时, 研究的偏倚风险不能被忽视, 本系统评价共纳入22项随机对照试验, 其中有7项随机对照试验均描述了具体的随机方法; 所有纳入的随机对照试验均未描述了分配方案隐藏, 因而有中度选择性偏倚的可能性. 有2项随机对照试验采用了双盲实施试验, 其余20个盲法实施情况不明, 因此存在中度测量性偏倚的可能性. 有4项随机对照试验报告了失访、脱落人数, 但失访及脱落而缺失的数据不足以对效应值产生影响, 其余18项随访率100%, 因此随访偏倚风险较小. 有1项随机对照试验未报告所有预先指定的主要结局指标, 其余21项有研究方案及报告研究方案所预定的所有结局指标, 因此报告偏倚风险较小. 我们采用总有效率指标及1年生存率指标对纳入研究进行漏斗图分析, 漏斗图对称性良好, 表明发表偏倚较小.
研究方法的局限性、研究结果不一致性、间接证据、结果不精确性、发表性偏倚的5个因素会使得证据的质量而相应降低, 本系统评价结果一致性、精确性较好, 不存在间接证据, 无发表偏倚, 但在研究设计、实施等方面存在一定的缺陷, 有一定的偏倚风险, 由此可能会夸大评价结果, 所以GRADE证据质量评级为中等质量证据, 产生偏倚的可能性为中度.
纳入研究总体质量不高, 存在中度选择性偏倚、实施偏倚及测量性偏倚, 所以在方法学上有一定的局限性. 所纳入的随机对照试验的样本含量均相对较小, 可能造成抽样误差增大, 影响抽样推断的可靠性. 多数测量指标纳入研究数量少, 使论证强度受到影响. 另外本系统评价中纳入的随机对照试验来自规模比较大型的三甲医院, 无国外及基层医院, 故在研究人群的选择上可能有选择偏倚. 此外, 所纳入的随机对照试验均未报告经济学指标, 故未能进行相关的经济学分析.
本系统研究地对TLD联合TACE疗法与单纯TACE疗法治疗PHC进行了近期疗效、疾病控制率、生活质量、生存率、甲胎蛋白与VEGF的变化、不良反应指标的比较, 结果显示: TLD联合TACE疗法在提高近期疗效、稳定瘤体、改善生活质量、延长生存期、降低复发转移方面优于单纯TACE疗法; 在安全性方面, TLD联合TACE疗法有明显药物性皮疹的不良反应, 但在消化系反应、骨髓抑制、肝功能损害反面相近似, 表明TLD联合TACE疗法更适用于不能行局部手术切除治疗的中晚期PHC患者, 且适合长期应用, 但对某些因药物引起的不良反应应作相关处理. 同时, 我们发现所纳入的22项随机对照试验中的样本量均不大, 进而提示TLD联合TACE治疗中晚期PHC疗效尚需要开展多中心、大样本的随机对照试验来验证. 总之, 今后在随机对照试验设计中, 应做到充分随机、充分实施方案隐藏和实施盲法, 注意数据不完整性的处理, 提高研究报告的质量, 重视阴性结果临床试验的报告. 建议严格按照临床试验注册制度[57]和临床随机对照试验报告统一规范(CONSORT)声明[58]规范PHC治疗的RCT, 为临床提供科学的依据.
本研究结果显示TLD联合TACE疗法治疗PHC疗效确切, 但其证据质量为中等质量证据, 进一步的研究有可能改变此种疗法的可信度. 因此, 我们需要更为严格的RCT去提高TLD联合TACE治疗PHC疗效的可信度.
原发性肝癌(primary hepatic carcinomas, PHC)是临床常见的消化系恶性肿瘤, 死亡率居我国恶性肿瘤的第3位, 很多患者就诊时已属于不可切除的中晚期而错失手术机会. 肝动脉化疗栓塞术(transcatheter arterial chemoe-
mbolization, TACE)是已被公认了的非手术治疗肝癌的首选方法, 但由于术后肝癌组织缺氧, 促进癌肿新的血管生成, 使术后3年生存率仅约20%. 近年来, 许多研究表明沙利度胺(thalidomide, TLD)可有效抑制血管生成, 巩固TACE治疗PHC的整体疗效.
庹必光, 教授, 遵义医学院附属医院消化科
近年来, 许多关于TLD联合TACE治疗PHC的研究报道了TLD可有效阻止血管内皮生长因子(vascular endothelial growth factor, VEGF)诱导的Caveolin-1的下调, 从而选择性抑制VEGF的血管生成作用, 弥补TACE的不足, 巩固TACE治疗PHC的整体疗效.
许多学者, 如叶祯开、姜海英、尚岩等通过研究发现TLD联合TACE治疗PHC有一定疗效, 在治疗有效率、疾病控制率、生存率等方面明显优于单纯TACE组, 值得进一步临床应用及观察.
对于错失手术切除的中晚期原发性肝癌患者的治疗仍较为棘手, 目前认为TACE可促进肝癌癌肿坏死, 提高患者的生存率. 但术后肝a组织缺氧, 刺激肝癌组织新的血管生成, 导致肿瘤的继续发展. TLD具有抑制血管生成作用, 与TACE联合治疗PHC可提高患者的生存率及近期有效率.
TACE联合抗血管生成是目前治疗中晚期肝癌比较有效的一种方法, 越来越受人关注. TACE联合TLD治疗中晚期肝癌的近期疗效较好, 能明显缓解患者的临床症状, 延长患者的生存期, 提高患者的生存质量, 值得进一步研究.
本文从整体上比较了TLD联合TACE治疗和单用TACE治疗的两种方法, 有重要的临床参考价值.
编辑:郭鹏 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 11. | 王 为民, 殷 世武, 孙 祥, 李 成发, 孟 曼, 袁 孝兵, 黄 孟芹, 姚 荣杰, 程 莹星. 中大剂量沙利度胺联合TACE治疗原发性肝癌临床研究. 安徽医学. 2009;30:1419-1422. |
| 14. | Burris HA, Moore MJ, Andersen J, Green MR, Rothenberg ML, Modiano MR, Cripps MC, Portenoy RK, Storniolo AM, Tarassoff P. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997;15:2403-2413. [PubMed] |
| 16. | Higgins J, Green S. Cochrane sandbook for systematic reviews of interventions version 5.1.0 [updated March 2011]. The Cochrane ColloBoration. 2011;. |
| 25. | 林 海澜, 郝 明志, 郑 伟生, 叶 韵斌, 陈 起忠, 陈 建彬, 郑 建雄. 沙利度胺对原发性肝癌介入栓塞术后血管生长因子的影响. 中国介入影像与治疗学. 2007;4:440-443. |
| 32. | 郑 伟生. 沙利度胺联合TACE治疗原发性肝癌. 福州: 福建医科大学 2006; . |
| 36. | 陈 昌南, 潘 歧作, 林 云笑, 苏 铭俊, 黄 活勋, 朱 家康, 钟 妙文, 杨 劲松. 沙利度胺联合TACE术对原发性肝癌复发和生存期的影响. 中国热带医学. 2008;8:406-408. |
| 37. | 陈 昌南, 潘 岐作, 张 呈, 苏 铭俊, 林 云笑, 方 伟达, 梁 文勇. 替吉奥与沙利度胺联合干预治疗肝癌切除术/ TACE术后肝内外转移. 现代肿瘤医学. 2012;20:2569-2571. |
| 38. | Katz SC, Shia J, Liau KH, Gonen M, Ruo L, Jarnagin WR, Fong Y, D'Angelica MI, Blumgart LH, Dematteo RP. Operative blood loss independently predicts recurrence and survival after resection of hepatocellular carcinoma. Ann Surg. 2009;249:617-623. [PubMed] [DOI] |
| 39. | Fan ST, Mau Lo C, Poon RT, Yeung C, Leung Liu C, Yuen WK, Ming Lam C, Ng KK, Ching Chan S. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 2011;253:745-758. [PubMed] [DOI] |
| 40. | Zhou Y, Sui C, Li B, Kan T, Yang J, Wu M. Safety and efficacy of trisectionectomy for hepatocellular carcinoma. ANZ J Surg. 2011;81:895-899. [PubMed] [DOI] |
| 41. | Shrager B, Jibara G, Schwartz M, Roayaie S. Resection of hepatocellular carcinoma without cirrhosis. Ann Surg. 2012;255:1135-1143. [PubMed] [DOI] |
| 42. | Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology. 2005;42:1208-1236. [PubMed] [DOI] |
| 43. | Adachi E, Matsumata T, Nishizaki T, Hashimoto H, Tsuneyoshi M, Sugimachi K. Effects of preoperative transcatheter hepatic arterial chemoembolization for hepatocellular carcinoma. The relationship between postoperative course and tumor necrosis. Cancer. 1993;72:3593-3598. [PubMed] [DOI] |
| 44. | Harada T, Matsuo K, Inoue T, Tamesue S, Inoue T, Nakamura H. Is preoperative hepatic arterial chemoembolization safe and effective for hepatocellular carcinoma? Ann Surg. 1996;224:4-9. [PubMed] [DOI] |
| 45. | Llovet JM, Bruix J. Systematic review of randomized trials for unresectable hepatocellular carcinoma: Chemoembolization improves survival. Hepatology. 2003;37:429-442. [PubMed] [DOI] |
| 46. | Fernández M, Semela D, Bruix J, Colle I, Pinzani M, Bosch J. Angiogenesis in liver disease. J Hepatol. 2009;50:604-620. [PubMed] [DOI] |
| 47. | Hoofring A, Boitnott J, Torbenson M. Three-dimensional reconstruction of hepatic bridging fibrosis in chronic hepatitis C viral infection. J Hepatol. 2003;39:738-741. [PubMed] [DOI] |
| 48. | Ross MA, Sander CM, Kleeb TB, Watkins SC, Stolz DB. Spatiotemporal expression of angiogenesis growth factor receptors during the revascularization of regenerating rat liver. Hepatology. 2001;34:1135-1148. [PubMed] [DOI] |
| 49. | Seki T, Tamai T, Ikeda K, Imamura M, Nishimura A, Yamashiki N, Nakagawa T, Inoue K. Rapid progression of hepatocellular carcinoma after transcatheter arterial chemoembolization and percutaneous radiofrequency ablation in the primary tumour region. Eur J Gastroenterol Hepatol. 2001;13:291-294. [PubMed] [DOI] |
| 50. | Folkman J, Watson K, Ingber D, Hanahan D. Induction of angiogenesis during the transition from hyperplasia to neoplasia. Nature. 1989;339:58-61. [PubMed] [DOI] |
| 51. | Bauer KS, Dixon SC, Figg WD. Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species-dependent. Biochem Pharmacol. 1998;55:1827-1834. [PubMed] [DOI] |
| 52. | D'Amato RJ, Loughnan MS, Flynn E, Folkman J. Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci U S A. 1994;91:4082-4085. [PubMed] |
| 53. | Kenyon BM, Browne F, D'Amato RJ. Effects of thalidomide and related metabolites in a mouse corneal model of neovascularization. Exp Eye Res. 1997;64:971-978. [PubMed] [DOI] |
| 54. | Peuckmann V, Fisch M, Bruera E. Potential novel uses of thalidomide: focus on palliative care. Drugs. 2000;60:273-292. [PubMed] [DOI] |
| 55. | Patt YZ, Hassan MM, Lozano RD, Nooka AK, Schnirer II, Zeldis JB, Abbruzzese JL, Brown TD. Thalidomide in the treatment of patients with hepatocellular carcinoma: a phase II trial. Cancer. 2005;103:749-755. [PubMed] [DOI] |
| 56. | Lin AY, Brophy N, Fisher GA, So S, Biggs C, Yock TI, Levitt L. Phase II study of thalidomide in patients with unresectable hepatocellular carcinoma. Cancer. 2005;103:119-125. [PubMed] [DOI] |
| 57. | De Angelis CD, Drazen JM, Frizelle FA, Haug C, Hoey J, Horton R, Kotzin S, Laine C, Marusic A, Overbeke AJ. Is this clinical trial fully registered?--A statement from the International Committee of Medical Journal Editors. N Engl J Med. 2005;352:2436-2438. [PubMed] [DOI] |