修回日期: 2014-03-01
接受日期: 2014-03-18
在线出版日期: 2014-04-28
目的: 探索阿魏酸钠对胆管结扎所致大鼠实验性肝纤维化的作用.
方法: 用胆管结扎方法制作肝纤维化大鼠模型. 将实验大鼠分为3组: 对照组、胆管结扎所致肝纤维化模型组、胆管结扎后阿魏酸钠治疗组. 检测、比较各组大鼠血清肝功能指标: 谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、白蛋白(albumin, ALB)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、γ-谷氨酰基转移酶(γ-glutamyl transferase, γ-GGT). 称取各组大鼠体质量、肝脏重量并计算肝指数. 阿魏酸钠治疗对肝脏纤维化程度的影响通过显微镜下观察肝脏HE染色切片、透射电镜观察肝脏超微结构改变, 以及免疫组织化学检测肝脏α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)表达积分吸光度值(integrated absorbance, IA)等综合评定.
结果: 用阿魏酸钠治疗后, 肝纤维化大鼠的肝功能较治疗前并无明显改善. 模型组大鼠的肝指数较对照组明显增加(7.83%±0.57% vs 4.05%±0.17%, P<0.01); 治疗组大鼠的肝指数与模型组比较有所减低(7.08%±0.68% vs 7.83%±0.57%, P<0.05). 病理观察提示, 治疗组大鼠肝脏纤维化程度及肝细胞破坏程度较模型组有所减低. 免疫组织化学检测提示模型组大鼠肝脏α-SMA表达量均高于对照组(113224.74±45518.79 vs 4197.80±1364.97, P<0.01); 经过阿魏酸钠处理后的治疗组大鼠肝脏α-SMA的表达量有所减低(46451.65±15600.56 vs 113224.74±45518.79, P<0.05).
结论: 阿魏酸钠对胆管结扎所致的实验性肝纤维化大鼠有抗肝纤维化作用.
核心提示: 肝硬化是一种弥漫性肝损害疾病, 防治肝纤维化的发展, 对于慢性肝病的预后意义重大. 本文以胆管结扎所致的肝纤维化大鼠为研究对象, 从血清学、病理学以及免疫组织化学等多个层面展开研究, 证实阿魏酸钠具有一定的抗肝纤维化作用.
引文著录: 杨娟, 徐胜南, 王敏, 彭丽萍, 周琦. 阿魏酸钠对大鼠肝纤维化的作用. 世界华人消化杂志 2014; 22(12): 1676-1681
Revised: March 1, 2014
Accepted: March 18, 2014
Published online: April 28, 2014
AIM: To assess the effects of sodium ferulate on liver fibrosis in rats with experimental cirrhosis induced by bile duct ligation.
METHODS: Liver cirrhosis was experimentally induced in rats by bile duct ligation. Rats were divided into three groups: a control group, a model group and a treatment group, which were treated by sham-operation, bile duct ligation, and sodium ferulate injection after bile duct ligation, respectively. Biochemical parameters were measured. Body weight, liver weight and liver index were compared between groups. Pathological characteristics of liver tissues were observed by optical microscopy and transmission electron microscopy, and the integrated absorbance of hepatic α-smooth muscle actin was determined by immunohistochemistry.
RESULTS: Biochemical parameters did not differ between the model group and treatment group. Liver index in the model group increased compared with control rats (7.83% ± 0.57% vs 4.05% ± 0.17%, P < 0.01); after treatment, the index decreased significantly (7.08% ± 0.68% vs 7.83% ± 0.57%, P < 0.05). Pathological observation revealed that the degree of fibrosis and severity of hepatocyte damage in the treatment group were lower than those in the model group. Hepatic α-SMA content in the model group was significantly higher than that in the control group (113224.74 ± 45518.79 vs 4197.80 ± 1364.97, P < 0.01). After treatment with sodium ferulate, hepatic α-SMA content decreased in the treatment group compared with the model group (46451.65 ± 15600.56 vs 113224.74 ± 45518.79, P < 0.05).
CONCLUSION: Sodium ferulate has a therapeutic effect on liver fibrosis in rats with experimental cirrhosis induced by bile duct ligation.
- Citation: Yang J, Xu SN, Wang M, Peng LP, Zhou Q. Effects of sodium ferulate on liver fibrosis in experimental cirrhotic rats. Shijie Huaren Xiaohua Zazhi 2014; 22(12): 1676-1681
- URL: https://www.wjgnet.com/1009-3079/full/v22/i12/1676.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i12.1676
肝硬化是一种以肝细胞坏死、肝脏纤维组织增生以及残留肝细胞结节状再生为病理特征的弥漫性肝损害疾病[1,2]. 肝脏纤维化可引起一系列严重并发症, 如门脉高压、腹水、肝性脑病、肝肾综合征等. 防治肝纤维化的发展, 对于慢性肝病的预后意义重大[3-9]. 有研究表明, 阿魏酸能抑制肾小管纤维化[10], 且具有护肝作用[11-15]. 我们以胆管结扎所致的实验性肝纤维化大鼠为研究对象, 观察、分析阿魏酸钠治疗后大鼠肝纤维化程度变化, 初步探索阿魏酸钠的抗肝纤维化作用, 以期为临床治疗提供新思路.
SPF级♂Wistar大鼠50只, 体质量180-200 g, 购自湖北省疾控中心. 阿魏酸钠由广东阳江制药厂有限公司生产. 小鼠单克隆α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体、DAB试剂盒、苏木素等由武汉博士德生物工程有限公司提供; SP三步法免疫组织化学检测试剂盒由北京中杉金桥生物技术有限公司提供.
1.2.1 动物模型的建立: 实验大鼠随机分为3组, 在麻醉条件下分别接受手术处理. 对照组大鼠(n = 10)经开腹手术但不作其余任何处理即关腹, 饲养4 wk; 模型组大鼠(n = 10)接受胆管结扎手术并继续饲养4 wk; 治疗组(n = 10)大鼠为在胆管结扎手术后第4 wk开始, 接受为期1 wk的经尾静脉注射阿魏酸钠治疗, 剂量为50 mg/kg[10,16].
1.2.2 血清肝功能的测定: 各组大鼠造模成功后, 在麻醉下开腹. 取5 mL注射器, 肝素浸润管壁后, 经下腔静脉抽取血液并转移至离心管, 置离心机于4 ℃恒温条件下以12000 r/min转速离心5 min, 取上清液分装于1.5 mL EP管中, 立即送武汉同济医院检验科检验肝功能指标: 谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、白蛋白(albumin, ALB)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、γ-谷氨酰基转移酶(γ-glutamyltransferase, γ-GGT).
1.2.3 大鼠肝指数: 肝指数(%) = 肝脏质量/体质量×100%[17,18].
1.2.4 病理分析: (1)大鼠取血后, 分离大鼠肝脏, 用剪刀剪取肝脏碎片, 立即投入4%多聚甲醛中固定. 取固定后的肝脏组织, 经梯度乙醇脱水、二甲苯透明、石蜡包埋等步骤制作成蜡块保存. 将蜡块切成厚度为4 μm切片, 经HE染色后, 在显微镜下观察比较不同组间大鼠肝脏组织的病理变化; (2)各组大鼠在麻醉处死后, 在1 min内用锋利刀片分别取下1条大小约1 mm×1 mm×5 mm的肝脏组织, 投入2.5%戊二醛预固定2 h. 之后经过锇酸固定、脱水、包埋、超薄切片等步骤, 将组织制作成电镜标本, 在常规透射电镜下观察比较不同组间大鼠肝脏组织的超微结构变化.
1.2.5 免疫组织化学检测α-SMA的表达: 将肝脏石蜡包埋标本切成厚度为4 μm切片, 常规脱蜡至水. 3%过氧化氢室温孵育15 min以灭活内源性过氧化物酶, PBS洗涤. 采用微波抗原修复, 经1-2 h自然冷却至室温, PBS洗涤3次. 向组织切片上滴加试剂盒中A液(山羊血清封闭液), 切片置湿盒中室温孵育15 min, 倾去, 勿洗. 将小鼠来源一抗α-SMA(稀释比例1:100)滴加到切片上, 置湿盒中于4 ℃冰箱中孵育过夜. 次日取出湿盒, 室温中静置1 h, PBS洗涤. 滴加试剂盒中试剂B(生物素标记二抗工作液), 室温孵育30 min, PBS洗涤. 滴加试剂盒中试剂C(HRP标记链霉卵白素工作液), 室温孵育30 min, PBS洗涤后用DAB试剂盒显色, 光镜下控制反应时间. 经苏木素复染、梯度乙醇脱水、二甲苯头透明等处理后, 待切片自然风干, 封片, 光镜下观察, α-SMA阳性产物呈棕黄色. 各实验组分别选取6张切片, 每张切片在高倍镜下随机选取至少5个完整而不重叠的视野, 用Image-Pro Plus 6.0软件测定每个视野下阳性反应的IA值[19-20].
统计学处理 计量资料用mean±SD表示. 用SPSS19.0软件统计数据, 采取单因素方差分析(数据满足方差齐性用Bonferroni检验; 不满足方差齐性用Dunn检验). P<0.05为差异有统计学意义.
模型组大鼠的肝功能各项指标(除ALB减低外)均明显高于对照组. 用阿魏酸钠治疗后, 肝纤维化大鼠的肝功能较治疗前并无明显改善(表1).
计算出各组大鼠的肝指数分别为: 对照组: 4.05%±0.17%, 模型组: 7.83%±0.57%, 治疗组: 7.08%±0.68%. 与对照组相比, 模型组的肝指数明显增加(P<0.01); 治疗组的肝指数与模型组比较有所减低(P<0.05).
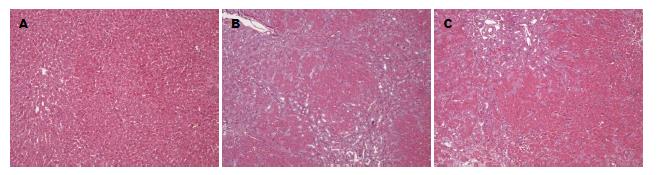
2.3.1 经光镜观察各组大鼠肝脏HE染色切片: 通过在镜下观察模型大鼠的肝脏HE染色切片, 我们发现, 对照组大鼠肝小叶结构正常, 肝细胞索排列整齐, 肝窦结构清晰, 未见水肿和坏死肝细胞(图1A). 模型组大鼠肝脏纤维组织增生, 部分区域有假小叶结构形成, 间质内弥漫性淋巴细胞浸润, 肝细胞有不同程度的水肿和坏死(图1B). 治疗组大鼠肝脏组织炎症反应、纤维组织增生程度及肝细胞水肿、坏死程度较模型组有所减轻(图1C).
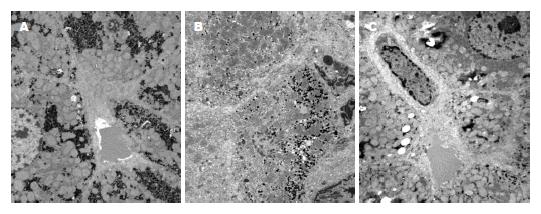
2.3.2 经透射电镜观察各组大鼠肝脏超微结构: 对照组大鼠肝脏组织细胞形态清晰, 结构完整, 胞浆粗面内质网、线粒体、核糖体丰富, 肝窦周间隙未见纤维沉积(图2A); 模型组肝细胞坏死明显, 结构紊乱, 细胞器大量破坏, 细胞间隙增宽, 窦周及细胞间隙均有大量胶原纤维沉积(图2B); 治疗组: 肝细胞坏死较轻, 部分肝细胞胞浆内出现肿胀空泡和脂滴, 窦周间隙偶见少量胶原纤维(图2C).
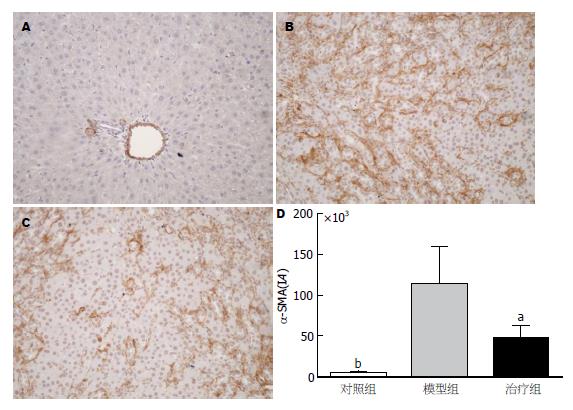
α-SMA在肝脏组织中的表现为胞浆中深浅不一的棕黄色. 在对照组正常大鼠肝脏中, α-SMA蛋白主要表达于血管壁, 统计IA值为4197.80±1364.97; 模型组大鼠肝脏α-SMA除血管壁有阳性表达以外, 汇管区、纤维间隔及邻近肝窦也有大量表达, IA值增加至113224.74±45518.79, 表达量明显增多(P<0.01 vs 对照组). 经过阿魏酸钠处理后, 治疗组大鼠肝脏α-SMA的阳性表达面积较模型组减少、阳性染色减轻, IA值减少为46451.65±15600.56(P<0.05 vs 模型组), (图3).
肝硬化是病毒性肝炎、酒精性肝炎、自身免疫性肝炎等各种慢性肝病发展的晚期阶段, 而肝纤维化是其形成的病理基础[1,21-23]. 抗肝纤维化是肝硬化的基础治疗措施, 可延缓肝硬化的进展, 改善肝硬化患者的预后. 目前对肝纤维化的治疗药物, 根据其作用机制, 主要包括抑制肝脏炎症和免疫反应、抗氧化损伤、抑制肝星状细胞激活、抑制细胞外基质(extracellular matrix, ECM)合成及加速ECM降解这几大类别[24-26].
阿魏酸是当归、川芎等中药材水溶性提取物中主要单体活性成分, 属于酚酸类化合物, 具有抗血小板聚集、抗炎、抗氧化等作用[27-29], 不良反应少, 临床多运用于肿瘤、肾脏及心血管等相关疾病的治疗[30-32], 而对肝脏疾病的临床应用较少见. Huang等[33]研究指出, 阿魏酸治疗后能显著降低肝硬化患者的门脉压力, 其具体机制尚未阐明. 前面我们提到, 阿魏酸具有保护肝细胞损伤的作用. 有研究指出, 在肝脏慢性损伤的过程中均伴有不同程度的氧化应激, 后者参与诱导枯否氏细胞及肝星状细胞活化, 促进肝细胞损伤, 在肝纤维化的发生过程中起着一定作用[34-36]. 既然阿魏酸具有抗氧化作用已为我们所熟知, 其或许对肝纤维化能起对应的抑制作用.
在本实验中, 我们用胆管结扎的方法制作大鼠肝纤维化模型. 实验表明, 阿魏酸钠治疗后, 肝纤维化大鼠肝功能指标有所改善, 但其统计学意义并不显著. 经阿魏酸钠治疗后的大鼠肝指数较模型组有所减低, 表明阿魏酸钠治疗能够改善肝脏充血肿大, 减轻肝损伤. 实验大鼠造模结束后, 对大鼠肝脏进行HE染色并观察, 可以了解胆管结扎手术是否成功, 更重要的是, 通过比较各组大鼠肝脏HE染色切片, 我们发现, 治疗组大鼠肝脏组织炎症反应、纤维组织增生程度较模型组有所减轻. 同时, 通过在透射电镜下观察各组大鼠肝脏超微结构的变化, 表明经过阿魏酸钠治疗后的大鼠肝细胞损害明显减轻, 窦周及细胞间隙的胶原纤维沉积量有所减少. 上述实验结果从形态学上表明阿魏酸钠具有保护肝细胞损伤的作用, 而且能够减轻肝脏纤维化程度. 本实验对α-SMA蛋白表达的研究表明, 经过阿魏酸钠治疗后, 大鼠肝脏α-SMA表达量明显减少. 肝脏纤维化形成的中心环节是门脉周围及窦周富α-SMA肌成纤维细胞的产生及增殖[37-39]. 因此, 我们推断, 阿魏酸作用可以使肝脏α-SMA蛋白表达下降, 从而使肝纤维化形成过程受阻.
总之, 本实验表明, 阿魏酸钠对胆管结扎所致的实验性肝纤维化化大鼠有抗肝纤维化作用. 其机制或许一方面源于阿魏酸的抗氧化作用, 使氧化应激引起的肝损伤及肝纤维化作用减弱; 另一方面, 阿魏酸使肝脏α-SMA表达减少, 纤维形成过程受阻. 阿魏酸作为一种安全、不良反应少的药物, 其对肝纤维化的具体作用机制尚需展开深入的基础试验及临床病例研究, 以使其在临床抗肝纤维化治疗方面发挥作用.
肝硬化是一种弥漫性肝损害疾病, 可引起一系列严重并发症, 防治肝纤维化的发展对于慢性肝病的预后意义重大.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
本文以胆管结扎所致的实验性肝纤维化大鼠为研究对象, 观察、分析阿魏酸钠治疗后大鼠肝纤维化程度变化, 初步探索阿魏酸钠的抗肝纤维化作用, 以期为临床治疗提供新思路.
国内外近年均未见关于阿魏酸钠对肝纤维化作用及其机制的详细报道. 国外研究表明, 阿魏酸能抑制肾小管纤维化, 且具有护肝作用. 国内有报道指出, 从肝脏显微结构的变化看来, 阿魏酸具有一定的抗纤维化作用; 阿魏酸治疗能显著降低肝硬化患者的门脉压力.
本文以胆管结扎所致的实验性肝纤维化大鼠为研究对象, 从血清学、病理学以及免疫组织化学等多个层面研究阿魏酸钠治疗后大鼠肝纤维化程度变化, 探索阿魏酸钠的抗肝纤维化作用.
本文从血清学、病理学以及免疫组织化学等多个层面研究阿魏酸钠治疗后大鼠肝纤维化程度变化, 以期为阿魏酸对肝硬化治疗作用的相关研究及临床治疗提供新的思路.
本文将阿魏酸钠引入肝纤维化的治疗, 是一种尝试. 通过胆管结扎方法制作肝纤维化大鼠模型, 研究阿魏酸钠对该模型大鼠的作用, 证实了阿魏酸钠对胆管结扎所致的实验性肝纤维化大鼠有抗肝纤维化作用. 本研究实验设计合理, 资料详细, 结果可信, 有一定参考价值.
编辑:郭鹏 电编:鲁亚静
| 2. | Brandão DF, Ramalho LN, Ramalho FS, Zucoloto S, Martinelli Ade L, Silva Ode C. Liver cirrhosis and hepatic stellate cells. Acta Cir Bras. 2006;21 Suppl 1:54-57. [PubMed] [DOI] |
| 3. | Prelipcean CC. [Portal hypertension in liver cirrhosis]. Rev Med Chir Soc Med Nat Iasi. 2001;105:63-68. [PubMed] |
| 4. | Schuster MJ. [Complications of liver cirrhosis: portal hypertension, gastroesophageal varices and ascites]. Praxis (Bern 1994). 2003;92:1427-1434. [PubMed] |
| 5. | Kuiper JJ, de Man RA, van Buuren HR. Review article: Management of ascites and associated complications in patients with cirrhosis. Aliment Pharmacol Ther. 2007;26 Suppl 2:183-193. [PubMed] [DOI] |
| 6. | Wong F. Management of ascites in cirrhosis. J Gastroenterol Hepatol. 2012;27:11-20. [PubMed] [DOI] |
| 7. | Moriwaki H, Shiraki M, Iwasa J, Terakura Y. Hepatic encephalopathy as a complication of liver cirrhosis: an Asian perspective. J Gastroenterol Hepatol. 2010;25:858-863. [PubMed] [DOI] |
| 8. | Carl DE, Sanyal A. The management of hepatorenal syndrome. Minerva Gastroenterol Dietol. 2009;55:207-226. [PubMed] |
| 9. | Aguillon D, Seguin P, Mallédant Y. [Hepatorenal syndrome: from physiopathology to treatment]. Ann Fr Anesth Reanim. 2003;22:30-38. [PubMed] [DOI] |
| 10. | Meng LQ, Tang JW, Wang Y, Zhao JR, Shang MY, Zhang M, Liu SY, Qu L, Cai SQ, Li XM. Astragaloside IV synergizes with ferulic acid to inhibit renal tubulointerstitial fibrosis in rats with obstructive nephropathy. Br J Pharmacol. 2011;162:1805-1818. [PubMed] [DOI] |
| 11. | Rukkumani R, Priyanka A, Sankar P, Menon VP. Ferulic acid influences hepatic expression pattern of matrix metalloproteinases during alcohol and PUFA induced toxicity. Eur Rev Med Pharmacol Sci. 2012;16:2147-2153. [PubMed] |
| 12. | Guo Y, Wu XQ, Zhang C, Liao ZX, Wu Y, Wang H. Protective effect of sodium ferulate on acetaldehyde-treated precision-cut rat liver slices. J Med Food. 2012;15:557-562. [PubMed] [DOI] |
| 13. | Kim HY, Park J, Lee KH, Lee DU, Kwak JH, Kim YS, Lee SM. Ferulic acid protects against carbon tetrachloride-induced liver injury in mice. Toxicology. 2011;282:104-111. [PubMed] [DOI] |
| 14. | Chotimarkorn C, Ushio H. The effect of trans-ferulic acid and gamma-oryzanol on ethanol-induced liver injury in C57BL mouse. Phytomedicine. 2008;15:951-958. [PubMed] [DOI] |
| 15. | Rukkumani R, Aruna K, Suresh Varma P, Padmanabhan Menon V. Hepatoprotective role of ferulic acid: a dose-dependent study. J Med Food. 2004;7:456-461. [PubMed] [DOI] |
| 16. | Alam MA, Sernia C, Brown L. Ferulic acid improves cardiovascular and kidney structure and function in hypertensive rats. J Cardiovasc Pharmacol. 2013;61:240-249. [PubMed] [DOI] |
| 17. | Yuan LP, Chen FH, Ling L, Bo H, Chen ZW, Li F, Zhong MM, Xia LJ. Protective effects of total flavonoids of Bidens bipinnata L. against carbon tetrachloride-induced liver fibrosis in rats. J Pharm Pharmacol. 2008;60:1393-1402. [PubMed] [DOI] |
| 19. | Xu Q, Liu X, Chen W, Zhang Z. Inhibiting adenoid cystic carcinoma cells growth and metastasis by blocking the expression of ADAM 10 using RNA interference. J Transl Med. 2010;8:136. [PubMed] [DOI] |
| 20. | Piao RL, Brigstock DR, Zhu J, Zhang ML, Gao RP. Clinical significance of connective tissue growth factor in hepatitis B virus-induced hepatic fibrosis. World J Gastroenterol. 2012;18:2280-2286. [PubMed] [DOI] |
| 21. | Ito K, Shiraki K, Sakai T, Yoshimura H, Nakano T. Portal hypertensive colopathy in patients with liver cirrhosis. World J Gastroenterol. 2005;11:3127-3130. [PubMed] |
| 27. | Srinivasan M, Sudheer AR, Menon VP. Ferulic Acid: therapeutic potential through its antioxidant property. J Clin Biochem Nutr. 2007;40:92-100. [PubMed] [DOI] |
| 31. | Yin H, Yan X, Yang KH. [Systematic review on sodium ferulate for treatment of diabetic nephropathy]. Zhongguo Zhongxiyi Jiehe Zazhi. 2009;29:970-974. [PubMed] |
| 32. | Wang BH, Ou-Yang JP. Pharmacological actions of sodium ferulate in cardiovascular system. Cardiovasc Drug Rev. 2005;23:161-172. [PubMed] [DOI] |
| 33. | Huang Z, Wei W, Zhong Q. [Effect of sodium ferulate on hemodynamics in hepatic cirrhosis patients with portal hypertension]. Zhongguo Zhongxiii Jiehe Zazhi. 2008;28:640-642. [PubMed] |
| 35. | Natarajan SK, Thomas S, Ramamoorthy P, Basivireddy J, Pulimood AB, Ramachandran A, Balasubramanian KA. Oxidative stress in the development of liver cirrhosis: a comparison of two different experimental models. J Gastroenterol Hepatol. 2006;21:947-957. [PubMed] [DOI] |
| 36. | Lv P, Luo HS, Zhou XP, Chireyath Paul S, Xiao YJ, Si XM, Liu SQ. Thalidomide prevents rat liver cirrhosis via inhibition of oxidative stress. Pathol Res Pract. 2006;202:777-788. [PubMed] [DOI] |
| 37. | Elsharkawy AM, Oakley F, Mann DA. The role and regulation of hepatic stellate cell apoptosis in reversal of liver fibrosis. Apoptosis. 2005;10:927-939. [PubMed] [DOI] |
| 38. | Atzori L, Poli G, Perra A. Hepatic stellate cell: a star cell in the liver. Int J Biochem Cell Biol. 2009;41:1639-1642. [PubMed] [DOI] |
| 39. | Senoo H, Yoshikawa K, Morii M, Miura M, Imai K, Mezaki Y. Hepatic stellate cell (vitamin A-storing cell) and its relative--past, present and future. Cell Biol Int. 2010;34:1247-1272. [PubMed] [DOI] |