修回日期: 2014-01-22
接受日期: 2014-02-18
在线出版日期: 2014-04-08
目的: 观察胃转流术(gastric bypass, GBP)对2型糖尿病(type 2 diabetes mellitus, T2DM)大鼠胰腺的胰岛素抵抗的影响.
方法: 将24只T2DM SD大鼠随机分为手术组(O组)、饮食控制组(F组)、对照组(C组)每组8只. 术前及术后第1、2、4、8周分别测各组空腹血糖(fasting plasma insulin, FPG)、空腹胰岛素(fasting plasma insulin, FINS); 计算各组术前及术后第8周胰岛素敏感指数(quantitative insulin sensitivity check index, QUICKI); Western blot检测各组术后第8周胰腺组织胰岛素受体底物-1/-2(insulin receptor substrate-1/-2, IRS-1/-2)蛋白的表达.
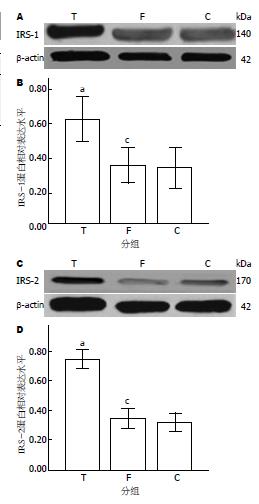
结果: 与术前相比, T组FPG由GBP后第1周开始降低, 至第8周时FPG降至5.79 mmol/L±1.83 mmol/L(P<0.05); T组FINS在GBP后第1周时稍有上升, 之后开始下降, 至第8周降至7.69 mU/L±1.73 mU/L(P<0.05), 即术后糖尿病手术组空腹胰岛素经历了先升后降的过程; 术后8 wk T组QUICKI由术前的0.44±0.05升至0.61±0.05(P<0.05); Western blot检测结果显示: T组与C组相比术后8 wk胰腺组织IRS-1、2的蛋白表达分别增加了35%和38%(P<0.05).
结论: GBP可上调T2DM大鼠胰腺组织胰岛素信号传导通路中IRS-1、2的表达水平, 提高胰腺组织的胰岛素敏感性.
核心提示: 本实验通过高糖高脂加链脲佐菌素(streptozotocin, STZ)诱导2型糖尿病(type 2 diabetes mellitus, T2DM)的模型, 发现胃转流术(gastric bypass)可以通过改善胰岛β细胞胰腺组织胰岛素受体底物-1/-2(insulin receptor substrate-1/-2, IRS-1/-2)/PI3K和MAPK胰岛素信号传导通路, 改善胰岛自身的胰岛素抵抗, 从而使胰岛β细胞功能恢复正常, 最终使T2DM患者糖尿病得到治愈.
引文著录: 温雨晴, 谭迎春, 吕墩涛, 张蓬波, 任泽强. 胃转流术对2型糖尿病大鼠胰腺胰岛素抵抗的影响. 世界华人消化杂志 2014; 22(10): 1431-1435
Revised: January 22, 2014
Accepted: February 18, 2014
Published online: April 8, 2014
AIM: To observe the influence of gastric bypass on pancreatic insulin resistance in type 2 diabetic rats.
METHODS: Twenty-four type 2 diabetic SD rats were randomly and equally divided into three groups: a gastric bypass group (T group), a food control group (F group), and a type 2 diabetes control group (C group). Plasma levels of glucose, insulin, quantitative insulin sensitivity check index and protein expression of pancreatic insulin receptor substrates-1 and -2 (IRS-1,2) were measured preoperatively and at weeks 1, 2, 4 and 8 postoperatively.
RESULTS: Fasting blood glucose in the T group decreased from week 1 after gastric bypass and reached 5.79 mmol/L ± 1.83 mmol/L at week 8 (P < 0.05). Fasting plasma insulin (FINS) in the T group slightly increased at week 1 after surgery, then decreased and reached 7.69 mU/L ± 1.73 mU/L at week 8 (P < 0.05). In contrast, fasting blood glucose and FINS showed no significant changes after surgery in the F and C groups (P > 0.05 for all). QUICKI had a dramatic increase in the T group, from 0.44 ± 0.05 preoperatively to 0.61 ± 0.05 (P < 0.05) 8 weeks post operation, while the F and C groups showed no significant changes after operation (P > 0.05 for both). Compared with the C group, a significant increase in the expression of IRS-1, 2 proteins was observed in the T group 8 weeks postoperatively (P < 0.05), although no significant difference was observed in the F and C groups (P > 0.05).
CONCLUSION: GBP can improve the expression of hepatic IRS-1, 2 and thus increase pancreatic insulin sensitivity in rats with type 2 diabetes mellitus.
- Citation: Wen YQ, Tan YC, Lv DT, Zhang PB, Ren ZQ. Influence of gastric bypass on pancreatic insulin resistance in type 2 diabetic rats. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1431-1435
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1431.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1431
胃转流术(gastric bypass, GBP)对2型糖尿病(type 2 diabetes mellitus, T2DM)有确切的治疗作用[1,2], 其排除了胃远端、十二指肠和近端空肠, 从而使未消化或未完全消化的食物提前到达回肠, 十二指肠与部分空肠从肠-胰岛轴中被排除, 这就提示GBP改变了胃肠道激素的分泌, 从而导致胰岛素抵抗的降低, 糖代谢的改善[3].
研究证实, T2DM最主要的发病机制是胰岛β细胞功能减退和胰岛素抵抗[4,5]. 胰岛β细胞功能减退包括胰岛素分泌不足和胰岛β细胞数量减少; 胰岛素抵抗是胰岛β细胞功能减退的始动因素和主要原因, 包括外周胰岛素抵抗(肝脏、骨骼肌和脂肪)和胰岛细胞的胰岛素抵抗; 而胰岛细胞的胰岛素抵抗成为近年来研究的热点[6]. 我们通过观察GBP对T2DM大鼠胰腺的胰岛素抵抗的影响, 探索胃转流术改善胰腺组织胰岛素抵抗机制, 为胃转流术治疗T2DM患者提供实验依据.
健康♂Sprague-Dawley(SD)大鼠30只, 体质量250-300 g, 购自徐州医学院实验动物中心, 实验动物的合格证号: SYXK(苏)2012-0032. 高糖高脂饲料: 猪油18%+蔗糖20%+蛋黄3%+基础饲料59%. 主要实验试剂和仪器: 链脲佐菌素(streptozotocin, STZ)(美国Sigma公司); Insulin一抗(武汉博士德生物技术有限公司); BCA蛋白浓度测定试剂盒(碧云天公司); 胰腺组织胰岛素受体底物1(insulin receptor substrate-1, IRS-1)一抗、IRS-2一抗(Santa Cruz公司); 稳步血糖仪(美国强生公司); DYY-8C型电泳仪(北京六一仪器厂); Centrifuge 5810R冷冻高速离心机(德国Eppendorf公司); Centrifuge 5810R冷冻高速离心机(德国Eppendorf公司).
1.2.1 动物制模: SD大鼠经高糖高脂饲料喂养2 mo后腹腔内注射STZ(30 mg/kg)建立2型糖尿病模型, 72 h和1 wk后快速血糖仪测随机血糖, 两次均≥16.7 mmol/L为成功模型[7], 成模大鼠均独笼饲养.
1.2.2 动物分组: 成模大鼠随机分为手术组(gastric bypass operation group, T组)、饮食控制组(food control group, F组)、糖尿病对照组(type 2 diabetes-control group, C组), 每组8只, 其余大鼠备用.
1.2.3 GBP手术: 为了避免胃部分切除造成的摄食减少, T组行保留全胃的GBP手术, 大鼠术前禁食12-14 h, 不限饮水, 3%戊巴比妥钠(1 mL/kg)腹腔内注射麻醉, 腹部脱毛剂脱毛, 固定于手术台, 碘伏消毒3遍后铺无菌巾, 上腹部正中切口长约3 cm进腹, 切口周围无菌纱布保护, 切断幽门, 闭合十二指肠残端, 距Treitz韧带约8 cm切断空肠, 远端空肠与幽门行端端吻合, 近端空肠与距此吻合口远端12 cm行空肠端侧吻合, 均用0/6号丝线缝合, 术后用庆大霉素(80万U/L)2 mL冲洗腹腔后关腹. 术后1 d进糖盐水, 3 d后进普通饲料, 保证充足饮水. F组进食量控制在15 g/(只·d)[8].
1.2.4 检测指标: 术前各组大鼠体质量(body mass, BM)、空腹血糖(fasting plasma insulin, FPG)、空腹血清胰岛素(fasting plasma insulin, Fins)和胰岛素敏感指数(quantitative insulin sensitivity check index, QUICKI)之间均无显著差异(表1).
| 指标 | BM(g) | FPG(mmol/L) | Fins(mU/L) | QUICKI |
| T组 | 376.4±31.2 | 18.98±2.05 | 11.09±1.88 | 0.44±0.05 |
| F组 | 374.9±26.4 | 20.09±1.81 | 10.94±2.12 | 0.43±0.03 |
| C组 | 373.5±29.2 | 19.47±2.07 | 10.67±1.90 | 0.47±0.06 |
术前及术后第1、2、4、8周分别测各组FPG、FINS; 计算各组术前及术后第8周QUICKI, QUICKI = 1/(logFINS+logFPG); 应用blot技术检测各组术后第8周IRS-1、2的表达. 眼眶取血法取血约1 mL, 离心后取血清放入-80 ℃冰箱保存, 统一检测FINS. 术后第8周取胰腺组织用于Western blot分析IRS-1、2蛋白含量.
统计学处理 数据使用SPSS16.0统计软件处理, 多组间数据比较采用单因素方差分析(One-way ANOVA), 计量资料以mean±SD表示, 两组间比较采用t检验, P<0.05为差异有统计学意义.
T组GBP后第1周开始下降, 至术后第2周FPG值降至14.06 mmol/L±1.78 mmol/L(P<0.05), 至第4、8周分别降至10.96 mmol/L±2.01 mmol/L、5.79 mmol/L±1.83 mmol/L(P<0.05). T组自术后第2周开始FPG明显低于F组、C组各时间点(P<0.05). F组、C组手术前后变化差异无统计学意义(P>0.05)(表2).
与术前相比, T组FINS在GBP后第1周开始升至14.40 mU/L±1.92 mU/L(P<0.05), 自第2周有下降趋势, 至第8周降至7.69 mU/L±1.73 mU/L, 即术后糖尿病手术组空腹胰岛素经历了先升后降的过程. F组、C组手术前后变化差异无统计学意义(P>0.05)(表3).
与术前相比, 术后8 wk T组QUICKI由术前的0.44±0.05升至0.61±0.05(P<0.05). F组、C组手术前后变化差异无统计学意义(P>0.05)(表4).
T组与C组相比术后8周胰腺组织IRS-1、2的蛋白表达分别增加了35%和38%, 差异有统计学意义(P<0.05); 内参照β-actin蛋白表达没有差异. F组、C组手术前后相比蛋白表达差异无统计学意义(P>0.05)(图1).
GBP治疗T2DM的具体机制尚未完全阐明[9]. 起初在肥胖症患者中发现此现象时被认为是术后肥胖症患者饮食减少和体质量下降的结果[10], 亦有学者提出"肠-胰岛轴"、"脂肪-胰岛轴"、"生长激素-胰岛素样生长因子1轴"等机制[11].
目前, 从T2DM的发病机制来看, 在胰岛素敏感性降低的情况下, 随着胰岛素的增加患者糖尿病症状并没有得到改善, 而胰岛β细胞的"压力"却增加了, 致使其功能受损, 甚至衰竭、β细胞凋亡, 从而加速了T2DM的发展. 本实验T组FINS在GBP术后第1周由术前的11.09 mU/L±1.88 mU/L(P<0.05)升至14.40 mU/L±1.92 mU/L(P<0.05), 而以后并没有继续增加或保持高水平不变, 至术后8 wk降至7.69 mU/L±1.73 mU/L(P<0.05)与正常FINS接近. 而胰岛素敏感性T组由术前0.44±0.05升高到术后8 wk的0.61±0.05(P<0.05). 另有文献报道[12], 在肥胖或伴T2DM患者中伴随着胰岛素敏感性提高, FINS分泌量也有所减少, 尤其在GBP术后这种变化更明显. 可见GBP可以通过改善胰岛素敏感性来实现T2DM血糖恢复正常.
近来研究显示, 胰岛β细胞在血糖的调控中扮演着主体和客体的"双重角色", 他既可以产生胰岛素, 反过来又接受胰岛素的反馈机制或前馈机制的调控[13]. 胰岛β细胞存在胰岛素受体(insulin receptor, Ins-R)和IRS, 同时存在胰岛素信号转导通路各组分如Ins-R、IRS家族、磷脂酰肌醇3激酶(phosphatidyl inositol 3-kinase, PI3K)及其下游的蛋白激酶B(proteinkinase B, PKB)、Ras、Raf及丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)等的表达, 其胰岛素信号转导通路主要包括PI3K和MAPK两条途径[14], 任何一个或多个环节障碍, 均会在β细胞水平发生胰岛素抵抗, 导致β细胞功能降低, 导致糖尿病, 尤其是T2DM. 已有学者通过免疫组织化学证明, Ins-R及IRS-1、IRS-2主要集中于胰岛, 而胰腺外分泌部分含量甚少[15]. 因此, 本试验中直接采用整个胰腺来代替胰岛用于Western blot检测.
本实验通过高糖高脂加STZ诱导T2DM的模型, 术后发现T组胰腺组织IRS-1、2蛋白表达水平显著上调, T组与C组相比术后8 wk IRS-1、2的蛋白表达分别增加了35%和38%, 差异有统计学意义(P<0.05). 可见GBP可以通过改善胰岛β细胞IRS-1(-2)/PI3K和MAPK胰岛素信号传导通路, 改善胰岛自身的胰岛素抵抗, 从而使胰岛β细胞功能恢复正常, 最终使T2DM患者糖尿病得到治愈.
糖尿病的发病率逐年增高, 到2030年全球患者数预计达到3.66亿, 而我国则为世界糖尿病第2大国. 其中85%-90%为2型糖尿病(type 2 diabetes mellitus, T2DM). 目前 T2DM的治疗以内科为主, 但治疗效果不理想. Pories等报道胃转流术(gastric bypass, GBP)治疗病态肥胖症时偶然发现合并有T2DM的患者, 术后血糖快速恢复了正常, 且不再需要采取任何措施维持. 后来国内外大量的临床实践证实GBP对正常体质量的T2DM的也有较好的疗效.
于珮, 主任医师, 天津医科大学代谢病医院
外科手术的应用, 打破了传统内科治疗的思路, 但目前GBP治疗T2DM的具体机制尚不清楚. 国内外通过多项实验研究, 提出了许多理论假说, 主要有: 前肠学说; 后肠学说; 脂肪-胰岛轴学说.
早期, 人们对胰岛素抵抗的研究都是针对经典的胰岛素靶组织骨骼肌、脂肪等外周组织和肝脏组织, 即外周胰岛素抵抗和肝胰岛素抵抗; 目前胰岛β细胞表面存在的胰岛素受体被发现,且胰岛素对胰岛β细胞有反馈调节作用, 所以胰岛本身也是胰岛素作用的靶器官. 本实验研究的是胃转流术对T2DM大鼠胰腺的胰岛素抵抗影响.
2型糖尿病的传统内科治疗包括饮食控制、体育运动、口服降糖药及胰岛素的使用等, 虽能控制血糖, 但很少能使患者的血糖完全恢复正常, 且患者依从性差, 效果不理想. 与传统内科治疗相比, 手术治疗T2DM起效后, 患者可不必长期控制饮食, 也减少了终生治疗的费用, 肥胖型T2DM患者行GBP后血糖得到长期稳定的控制已得到多数学者的认可, 并得到临床病例回顾性研究的肯定, 对于体质量正常的患者, 亦有明显疗效.
本文对2型糖尿病的研究有一定的参考价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Buchwald H, Avidor Y, Braunwald E, Jensen MD, Pories W, Fahrbach K, Schoelles K. Bariatric surgery: a systematic review and meta-analysis. JAMA. 2004;292:1724-1737. [PubMed] [DOI] |
| 2. | Rubino F. Is type 2 diabetes an operable intestinal disease? A provocative yet reasonable hypothesis. Diabetes Care. 2008;31 Suppl 2:S290-S296. [PubMed] [DOI] |
| 3. | Ukkola O. Gastric bypass and glucose metabolism. Intern Med J. 2009;39:502-505. [PubMed] [DOI] |
| 4. | Stern SE, Williams K, Ferrannini E, DeFronzo RA, Bogardus C, Stern MP. Identification of individuals with insulin resistance using routine clinical measurements. Diabetes. 2005;54:333-339. [PubMed] [DOI] |
| 5. | Valverde AM, Kahn CR, Benito M. Insulin signaling in insulin receptor substrate (IRS)-1-deficient brown adipocytes: requirement of IRS-1 for lipid synthesis. Diabetes. 1999;48:2122-2131. [PubMed] [DOI] |
| 6. | Alexandrides TK, Skroubis G, Kalfarentzos F. Resolution of diabetes mellitus and metabolic syndrome following Roux-en-Y gastric bypass and a variant of biliopancreatic diversion in patients with morbid obesity. Obes Surg. 2007;17:176-184. [PubMed] [DOI] |
| 9. | John S, Hoegerl C. Nutritional deficiencies after gastric bypass surgery. J Am Osteopath Assoc. 2009;109:601-604. [PubMed] |
| 10. | Greenway SE, Greenway FL, Klein S. Effects of obesity surgery on non-insulin-dependent diabetes mellitus. Arch Surg. 2002;137:1109-1117. [PubMed] [DOI] |
| 12. | Ferrannini E, Natali A, Camastra S, Nannipieri M, Mari A, Adam KP, Milburn MV, Kastenmüller G, Adamski J, Tuomi T. Early metabolic markers of the development of dysglycemia and type 2 diabetes and their physiological significance. Diabetes. 2013;62:1730-1737. [PubMed] |
| 13. | Assmann A, Ueki K, Winnay JN, Kadowaki T, Kulkarni RN. Glucose effects on beta-cell growth and survival require activation of insulin receptors and insulin receptor substrate 2. Mol Cell Biol. 2009;29:3219-3228. [PubMed] [DOI] |
| 14. | Aulinger B, D'Alessio D. Glucagon-like peptide 1: continued advances, new targets and expanding promise as a model therapeutic. Curr Opin Endocrinol Diabetes Obes. 2007;14:68-73. [PubMed] [DOI] |