修回日期: 2014-02-06
接受日期: 2014-02-19
在线出版日期: 2014-04-08
目的: 观察改良胆胰转流术(new biliopancreatic diversion, NBPD)和十二指肠改道术(duodenal-jejunal bypass, DJB)对GK(Goto-Kakizaki)大鼠血糖、血脂等的影响, 探讨手术治疗2型糖尿病的可能机制.
方法: 将30只12周龄♂SPF级GK大鼠随机分为3组, 每组10只, 分别行假手术、NBPD、DJB. 检测各组术前及术后体质量、随机血糖(random plasma glucose)、空腹血糖(fasting plasma glucose, FPG)、血脂及胰岛素水平.
结果: 术后1 wk, NBPD组、DJB组大鼠随机血糖分别从17.088 mmol/L±3.708 mmol/L、17.180 mmol/L±3.383 mmol/L降至9.200 mmol/L±1.000 mmol/L、9.620 mmol/L±0.794 mmol/L, 明显低于假手术组, 差异均有统计学意义(P<0.05); 术后4 wk, DJB组、NBPD组空腹胆固醇分别从3.220 mmol/L±0.185 mmol/L和3.200 mmol/L±0.278 mmol/L降至3.100 mmol/L±0.424 mmol/L和2.550 mmol/L±0.691 mmol/L, 差异有统计学意义.
结论: DJB和NBPD术式可以降低GK大鼠血糖、血脂, 其原因可能是术后胆胰液的转流造成食物尤其是脂类的消化吸收不完全, 改善了脂代谢, 进而降低血糖.
核心提示: 本文研究表明胆胰液的转流可能才是外科手术后血糖降低的关键. 其机制可能是胆胰液的转流造成食物尤其是脂类的消化吸收不完全, 改善了脂代谢, 降低了血糖.
引文著录: 林春忠, 徐常国, 冯苏, 张斌, 翁山耕. 改良胆胰转流术对GK大鼠血糖和血脂的影响. 世界华人消化杂志 2014; 22(10): 1417-1422
Revised: February 6, 2014
Accepted: February 19, 2014
Published online: April 8, 2014
AIM: To observe the effects of a new biliopancreatic diversion (NBPD) surgery and duodenal-jejunal bypass (DJB) surgery on plasm glucose and lipids in Goto-Kakizaki (GK) rats and investigate the possibility of surgical treatment of diabetes.
METHODS: Thirty rats were randomly and equally divided into a sham operation group, a NBPD group or a DJB group. The NBPD group and the DJB group underwent NBPD and DJB, respectively, and the sham operation group underwent a sham operation. Body weight, random plasma glucose, OGTT and blood lipids were measured before and after surgery.
RESULTS: One week after surgery, random plasma glucose levels decreased from 17.088 mmol/L ± 3.708 mmol/L to 9.200 mmol/L ± 1.000 mmol/L in the NBPD group and from 17.180 mmol/L ± 3.383 mmol/L to 9.620 mmol/L ± 0.794 mmol/L in the DJB group, respectively, and both were significantly lower than those in the sham operation group. Four weeks postoperatively, fasting cholesterol decreased from 3.220 mmol/L ± 0.185 mmol/L to 3.100 mmol/L ± 0.424 mmol/L in the DJB group and from 3.100 mmol/L ± 0.424 mmol/L to 2.550 mmol/L ± 0.691 mmol/L in the NBPD group.
CONCLUSION: DJB and NBPD decrease plasma glucose and lipids in GK rats possibly via mechanisms associated with diversion of biliopancreatic juice that results in incomplete food digestion and absorption and improves lipid metabolism and plasma glucose.
- Citation: Lin CZ, Xu CG, Feng S, Zhang B, Weng SG. A new biliopancreatic diversion surgery decreases plasma glucose and lipids in Goto-Kakizaki rats. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1417-1422
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1417.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1417
胃旁路手术(roux-en-Y gastric bypass, RYGB)可以治疗2型糖尿病, 这已经得到了国际糖尿病联盟、美国糖尿病协会的认可[1], 然而现有的研究结果并不能解释其机制.
在我们先前的研究中发现, 不减少胃容量, 不改变消化途径, 仅推迟食物与胆汁和胰液混合的时间及部位同样可以改善GK(Goto-Kakizaki)大鼠的糖耐量[2], 现在被大多数学者认可的肠道假说似乎不能完全的解释这一结果[3,4]. 因此我们认为外科手术术后, 血糖降低的主要因素可能是胆胰液的转流. 所以我们设计这一课题, 对GK大鼠行改良胆胰转流术(new biliopancreatic diversion, NBPD)及十二指肠改道术(duodenal-jejunal bypass, DJB), 观察手术前后大鼠血糖、血脂及胰岛素的变化, 探讨外科手术治疗2型糖尿病的可能机制.
10周龄♂GK大鼠30只, 上海斯莱克实验动物有限公司提供, 实验动物证号[SCXK(沪)2007-0005]. 体质量290-320 g, 饲养于福建医科大学实验动物中心屏障系统. 大鼠胰岛素(insulin)ELISA试剂盒(美国Alpco公司). 大鼠肠抑胃肽(gastric inhibitory polypeptide, GIP)ELISA试剂盒(德国DRG公司), 大鼠胰高血糖样肽-1(glucagon-like peptide-1, GLP-1)ELISA试剂盒(德国DRG公司), 七氟醚(福建医科大学附属第一医院麻醉科提供).
1.2.1 分组: 动物自由进水, 喂食5%脂肪饲料, 每天20-25 g. 2 wk后, 随机分为DJB手术组、NBPD手术组、假手术组, 每组10只.
1.2.2 手术: 各组大鼠均在12 wk龄时行手术, 术前1 d禁食, 不禁饮. 使用七氟醚吸入麻醉. DJB手术组, 于幽门下0.5 cm处切断十二指肠, 远端封闭; 在距Treitz韧带10 cm处切断空肠, 远端空肠与近端十二指肠做端端吻合, 近端空肠在距Treitz韧带以远20 cm处与空肠做端侧吻合[5]; NBPD手术组, 在胆肠汇合点处肠管的近端0.5 cm处横断十二指肠, 远端封闭; 胆肠汇合点远端0.5 cm处横断十二指肠, 将近端十二指肠与远端十二指肠吻合, 并将胆肠汇合点1 cm肠管与距Treitz韧带20 cm处肠管行端侧吻合[6]; 假手术组, 在幽门下0.5 cm处切断十二指肠后原位缝合.
1.2.3 体质量测量: 使用电子体质量测量仪, 测量术前1 wk及术后12 wk各组大鼠的体质量, 测量选择清晨空腹时.
1.2.4 空腹血糖测量: 使用罗氏活力型一键式微量血糖仪. 取大鼠尾静脉血, 测量术前1 wk及术后12 wk禁食12 h后清晨空腹血糖.
1.2.5 随机血糖测量: 使用罗氏活力型一键式微量血糖仪. 取大鼠尾静脉血, 测量术前1 wk及术后第1、12周非禁食状态下的血糖.
1.2.6 血脂检测: 分别于术前2 wk及术后4 wk大鼠禁食12 h后清晨空腹、术前1 wk及术后12 wk正常饮食状态下, 取眶静脉血, 生化管收集血液, 离心收集上清液, 送福建医科大学附属第一医院检验科检测血清甘油三酯、胆固醇、游离脂肪酸含量.
1.2.7 血浆胰岛素的测量: 术前2 wk及术后6 wk, 禁食12 h后, 眶静脉取血, 3000 r/min在4 ℃离心10 min, 分离后的血浆保存在-80 ℃冰箱中待测量. 测量使用大鼠胰岛素试剂盒.
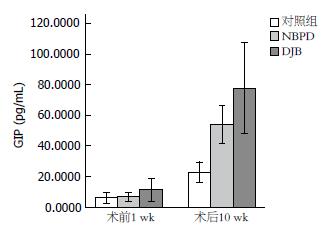
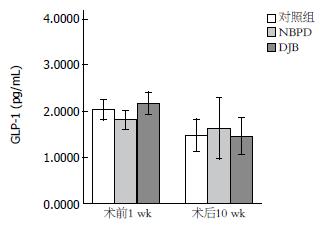
1.2.8 血浆GIP、GLP-1的测量: 术前1 wk及术后10 wk, 非禁食状态下,眶静脉取血, 3000 r/min在4 ℃离心10 min, 分离后的血浆保存在-80 ℃冰箱中待测量. 测量使用大鼠GIP试剂盒及大鼠GLP-1试剂盒.
统计学处理 用SPSS17.0软件行统计学分析, 数据以mean±SD表示. P<0.05为差异有统计学意义.
术后12 wk, 各组大鼠无死亡.
术后12 wk, 假手术组、NBPD组大鼠体质量与术前相比, 均有增多, 且均高于DJB组; DJB组大鼠体质量与术前相比无明显增多(表1).
术后12 wk, 3组大鼠空腹血糖与术前对比差别无统计学意义, 3组间相互比较差别无统计学意义(表1).
术后1 wk, DJB组和NBPD组大鼠的随机血糖明显低于假手术组, 差别有统计学意义. 术后12 wk, DJB组与NBPD组大鼠随机血糖仍低于假手术组, 差别有统计学意义. 假手术组手术前后随机血糖差别无统计学意义(表2).
术后4 wk, DJB组与NBPD组大鼠空腹胆固醇与术前相比降低, 差别有统计学意义. 假手术组大鼠空腹胆固醇手术前后差别无统计学意义(表3).
| 指标 | DJB组 | NBPD组 | 假手术组 | |||
| 术前2wk | 术后4wk | 术前2wk | 术后4wk | 术前2wk | 术后4wk | |
| 胆固醇(mmol/L) | 3.220± 0.185 | 2.450± 0.424ac | 3.200± 0.278 | 2.550± 0.691ac | 3.415± 0.291 | 3.125± 0.267 |
| 甘油三酯(mmol/L) | 0.660± 0.049 | 1.569± 0.612ac | 0.737± 0.200 | 1.329± 0.716ac | 0.792± 0.077 | 0.754± 0.236 |
| 游离脂肪 酸(mEq/L) | 630.000± 66.216 | 670.333± 129.421c | 762.167± 214.440 | 697.667± 103.774c | 627.052± 371.840 | 994.667± 257.817 |
术后4 wk, DJB组与NBPD组大鼠空腹甘油三酯与术前相比上升, 差别有统计学意义. 假手术组大鼠空腹甘油三酯手术前后差别无统计学意义(表3).
术后4 wk, DJB组与NBPD组大鼠血清游离脂肪酸与假手术组相比降低, 差别有统计学意义. 假手术组大鼠血清游离脂肪酸手术前后差别无统计学意义(表3).
术后12 wk, DJB组与NBPD组大鼠餐后胆固醇为与假手术组相比降低, 差别有统计学意义; 假手术组大鼠餐后胆固醇手术前后差别无统计学意义(表4).
| 指标 | DJB组 | NBPD组 | 手术组 | |||
| 术前1 wk | 术后12 wk | 术前1 wk | 术后12 wk | 术前1 wk | 术后12 wk | |
| 胆固醇(mmol/L) | 2.960± 0.546 | 1.808± 0.274ac | 3.045± 0.450 | 2.242± 0.249ac | 3.077± 0.406 | 2.797± 0.199 |
| 甘油三酯(mmol/L) | 1.335± 0.512 | 0.692± 0.151ac | 1.268± 0.472 | 0.548± 0.105ac | 1.412± 0.548 | 1.135± 0.594 |
| 游离脂肪 酸(mEq/L) | 221.000± 29.766 | 233.167± 70.652 | 224.500± 54.265 | 225.000± 72.807 | 253.833± 55.683 | 279.000± 92.326 |
术后12 wk, DJB组与NBPD组餐后甘油三酯与假手术组相比降低, 差别有统计学意义; 假手术组大鼠手术前后餐后甘油三酯差别无统计学意义(表4).
术后12 wk, 3组大鼠餐后游离脂肪酸值术前相比, 差别无统计学意义(表4).
术后6 wk, DJB组与NBPD组大鼠空腹血浆胰岛素低于假手术组, 差别有统计学意义; 假手术组大鼠空腹血清胰岛素与术前相比升高, 差别有统计学意义(表5).
近年来, RYGB等减肥手术治疗2型糖尿病的效果已被大量临床及基础实验证实[4,7-11]. 然而对其机制目前尚无明确定论.
我们先前的实验已证实了仅转流胆胰液不改变消化系途径就能改善GK大鼠的糖耐量[2]. 本实验对GK大鼠检测的血糖值结果显示, 术后1 wk NBPD组及DJB组大鼠随机血糖明显降低, 同样证实了仅胆胰液的转流就能够改善GK大鼠的随机血糖.
2型糖尿病常常合并脂代谢异常, 脂代谢异常为糖尿病及其并发症的原发病理生理改变. DJB和NBPD术式都有胆胰液的转流, 胆胰液是重要的消化液, 这必然影响食物尤其是脂类的消化吸收, 术后脂代谢异常可能得到改善.
胆固醇的吸收主要来源于胆汁[12], 其消化吸收受胆胰液的影响较大. 本实验对胆固醇检测的数据显示, DJB组和NBPD组术后, 空腹及餐后血清胆固醇较术前降低, 并明显低于假手术组. 这可能是由于术后胆胰液的转流影响了餐后胆固醇的吸收, 长期的胆固醇吸收减少, 体内的胆固醇水平也相应地下降, 相应的空腹状态下胆固醇水平也下降.
游离脂肪酸(free fatty acid, FFA)是血脂中的重要成分, 他与2型糖尿病的发生发展密切相关, 有研究表明2型糖尿病患者的FFA再酯化减弱[13]. 由于FFA对胰岛细胞有毒害作用, 并会增加胰岛素抵抗, 因此降低FFA浓度被认为是治疗2型糖尿病的一个关键[14]. 空腹状态下, FFA由TG分解产生, 受胰岛素的调控参与供能, 而餐后供能主要是葡萄糖, FFA生成减少, 因此空腹FFA的影响更为突出[15]. 本实验结果显示, 术后4 wk, DJB组和NBPD组空腹FFA水平小于假手术组. 这可能与TG分解减少及FFA再酯化增加有关, 而TG的分解减少及FFA再酯化增加都与胰岛素敏感性增高有关.
TG餐后作为一种能源储备, 空腹时又被分解参与供能, 同样也是反映血脂的重要指标. 本实验结果显示, 术后6 wk起, DJB组和NBPD组餐后TG较术前降低, 并明显小于假手术组, 但两组之间无差异. 这可能是由于胆胰液与食物相作用的时间减少及肠道缩短, 引起TG消化产物(FFA+甘油三酯)吸收减少, 进而导致餐后TG合成储存就减少. 而DJB组在降低餐后TG方面并不优于NBPD组, 那么上段肠道的旷置可能不是降低餐后TG的主要因素, 而胆胰液的转流才是关键. 然而, 令人不解的是, 本实验结果中NPBD组及DJB组大鼠术后空腹TG水平明显高于假手术组, 且高于餐后TG水平. 对此我们推测可能是由于术后胰岛素敏感性增加, 空腹TG分解减少及FFA再酯化增加, 从而导致血中的TG水平升高.
总之, DJB组和NBPD组术后, 空腹FFA、餐后TG及胆固醇都降低, 脂代谢紊乱可能得到改善, 从而改善胰岛素抵抗, 增强胰岛素的敏感性. 胰岛素敏感性增强可以减少空腹状态下TG分解生成FFA, 降低的游FFA又可以减弱对胰岛细胞的损害, 从而改善胰岛素的敏感性, 形成一种良性的循环[16]. 胰岛素的敏感性的增强, 可以增强体内的糖利用, 进而可以降低血糖. 因此, RYGB等减肥术后, 胆胰液的转流可能才是血糖降低的关键. 其机制可能是胆胰液的转流造成食物尤其是脂类的消化吸收不完全, 改善了脂代谢, 降低了血糖.
此外, 本实验结果显示DJB组及NBPD组大鼠术后, 餐后GIP水平升高, DJB组大鼠餐后GLP-1水平降低, 这与Speck等[17]的研究不同. 目前多数学者都认为GIP能够促进胰岛素分泌, 但有研究表明这一功能在2型的患者身上减弱[18]. 而GIP能够抑制胃排空这一功能被多数人忽略, 有研究表明, 糖尿病大鼠的胃排空加快[19], GIP有抑制胃排空的作用, 餐后GIP水平升高导致GK大鼠术后胃排空减慢, 这可能造成餐后血糖的降低. GLP-1的分泌主要来源于食物对肠道的刺激[20], 由于胃排空的减慢, 食物进入末段回肠的时间延后, 可能导致餐后GLP-1的分泌减少.
2型糖尿病的发病机制尚不明确, 目前内科药物治疗尚无法治愈. 近年来外科手术治疗2型糖尿病的研究风靡全球, 但其机制争论颇多.
陈积圣, 教授, 中山大学孙逸仙纪念医院肝胆外科
在我们先前的研究中发现, 仅推迟食物与胆汁和胰液混合的时间及部位同样可以改善GK(Goto-Kakizaki)大鼠的糖耐量, 因此我们认为外科手术术后, 血糖降低的主要因素可能是胆胰液的转流.
胃旁路术治疗2型糖尿病已得到美国糖尿病协会的认可, Madeleine Speck的文章指出胃旁路术后血糖恢复的原因可能与GLP-1升高有关.
分别对GK大鼠行不同的术式, 观察血糖、血脂、胃肠道激素等的变化情况, 探讨外科手术治疗2型糖尿病的可能机制.
本文在前期研究基础上, 设计改良胆胰转流术, 比较术前后血糖、血脂、胰岛素改变, 以探讨根治2型糖尿病的机制, 有重要参考意义.
编辑 田滢 电编 鲁亚静
| 1. | American Diabetes Association. Standards of medical care in diabetes--2010. Diabetes Care. 2010;33 Suppl 1:S11-S61. [PubMed] [DOI] |
| 2. | Weng SG, Zhang B, Feng S, Xu CG, Lin CZ. Effects of modified biliopancreatic diversion on glucose tolerance of GK rats. Obes Surg. 2013;23:522-530. [PubMed] [DOI] |
| 3. | Mason EE. Ileal [correction of ilial] transposition and enteroglucagon/GLP-1 in obesity (and diabetic?) surgery. Obes Surg. 1999;9:223-228. [PubMed] [DOI] |
| 4. | Patriti A, Aisa MC, Annetti C, Sidoni A, Galli F, Ferri I, Gullà N, Donini A. How the hindgut can cure type 2 diabetes. Ileal transposition improves glucose metabolism and beta-cell function in Goto-kakizaki rats through an enhanced Proglucagon gene expression and L-cell number. Surgery. 2007;142:74-85. [PubMed] [DOI] |
| 5. | Rubino F, Marescaux J. Effect of duodenal-jejunal exclusion in a non-obese animal model of type 2 diabetes: a new perspective for an old disease. Ann Surg. 2004;239:1-11. [PubMed] [DOI] |
| 6. | Weng SG. Modified biliopancreatic diversion for GK rats: a proposal for a simpler technique and mechanism research. Obes Surg. 2012;22:997-998. [PubMed] [DOI] |
| 7. | Buchwald H, Estok R, Fahrbach K, Banel D, Jensen MD, Pories WJ, Bantle JP, Sledge I. Weight and type 2 diabetes after bariatric surgery: systematic review and meta-analysis. Am J Med. 2009;122:248-256.e5. [PubMed] |
| 8. | Pories WJ, Swanson MS, MacDonald KG, Long SB, Morris PG, Brown BM, Barakat HA, deRamon RA, Israel G, Dolezal JM. Who would have thought it? An operation proves to be the most effective therapy for adult-onset diabetes mellitus. Ann Surg. 1995;222:339-350; discussion 350-352. [PubMed] [DOI] |
| 9. | Buchwald H, Oien DM. Metabolic/bariatric surgery Worldwide 2008. Obes Surg. 2009;19:1605-1611. [PubMed] [DOI] |
| 10. | Buchwald H, Avidor Y, Braunwald E, Jensen MD, Pories W, Fahrbach K, Schoelles K. Bariatric surgery: a systematic review and meta-analysis. JAMA. 2004;292:1724-1737. [PubMed] [DOI] |
| 11. | Sjöström L, Lindroos AK, Peltonen M, Torgerson J, Bouchard C, Carlsson B, Dahlgren S, Larsson B, Narbro K, Sjöström CD. Lifestyle, diabetes, and cardiovascular risk factors 10 years after bariatric surgery. N Engl J Med. 2004;351:2683-2693. [PubMed] [DOI] |
| 12. | Pakarinen M, Miettinen TA, Lauronen J, Kuusanmäki P, Raivio P, Kivistö T, Halttunen J. Adaptation of cholesterol absorption after proximal resection of porcine small intestine. J Lipid Res. 1996;37:1766-1775. [PubMed] |
| 13. | Taskinen MR, Bogardus C, Kennedy A, Howard BV. Multiple disturbances of free fatty acid metabolism in noninsulin-dependent diabetes. Effect of oral hypoglycemic therapy. J Clin Invest. 1985;76:637-644. [PubMed] [DOI] |
| 14. | Deng YT, Chang TW, Lee MS, Lin JK. Suppression of free fatty acid-induced insulin resistance by phytopolyphenols in C2C12 mouse skeletal muscle cells. J Agric Food Chem. 2012;60:1059-1066. [PubMed] [DOI] |
| 15. | Frayn KN. Non-esterified fatty acid metabolism and postprandial lipaemia. Atherosclerosis. 1998;141 Suppl 1:S41-S46. [PubMed] [DOI] |
| 16. | Boden G. Does inhibition of β-cell proliferation by free fatty acid in mice explain the progressive failure of insulin secretion in type 2 diabetes. Diabetes. 2012;61:560-561. [PubMed] [DOI] |
| 17. | Speck M, Cho YM, Asadi A, Rubino F, Kieffer TJ. Duodenal-jejunal bypass protects GK rats from {beta}-cell loss and aggravation of hyperglycemia and increases enteroendocrine cells coexpressing GIP and GLP-1. Am J Physiol Endocrinol Metab. 2011;300:E923-E932. [PubMed] [DOI] |
| 18. | Nauck MA, Heimesaat MM, Orskov C, Holst JJ, Ebert R, Creutzfeldt W. Preserved incretin activity of glucagon-like peptide 1 [7-36 amide] but not of synthetic human gastric inhibitory polypeptide in patients with type-2 diabetes mellitus. J Clin Invest. 1993;91:301-307. [PubMed] [DOI] |
| 19. | Young AA, Gedulin B, Vine W, Percy A, Rink TJ. Gastric emptying is accelerated in diabetic BB rats and is slowed by subcutaneous injections of amylin. Diabetologia. 1995;38:642-648. [PubMed] [DOI] |
| 20. | Brubaker PL. The glucagon-like peptides: pleiotropic regulators of nutrient homeostasis. Ann N Y Acad Sci. 2006;1070:10-26. [PubMed] [DOI] |