修回日期: 2013-01-10
接受日期: 2013-01-18
在线出版日期: 2013-02-08
目的: 分离、培养和鉴定枯否细胞, 并探讨LPS刺激对细胞肿瘤坏死因子(tumor necrosis factor-α, TNF-α)表达和分泌的影响.
方法: 采用在体原位灌注、密度梯度离心和早期细胞换液等方法分离纯化大鼠肝枯否细胞(kupffer cell, KC), 并采用墨汁吞噬和ED2染色试验对分离培养的细胞进行鉴定. TNF-α表达和分泌采用RT-PCR和酶联免疫技术(enzyme-linked immunosorbent, ELISA)检测.
结果: 成功分离和纯化大鼠肝KC, 并经墨汁吞噬和ED2染色试验鉴定证实; LPS刺激KC细胞内TNF-α mRNA的表达较非刺激细胞(PBS处理细胞)显著升高(1.10±0.02 vs 0.09±0.01, P<0.001). 另外, LPS刺激较非刺激KC培养上清液TNF-α蛋白的水平也显著升高(487.10 pg/mL±5.56 pg/mL vs 39.41 pg/mL±15.30 pg/mL, P<0.001).
结论: 原位灌注和密度梯度离心法能有效分离纯化大鼠KC, LPS刺激可诱导其表达和分泌大量TNF-α.
引文著录: 叶长根, 梁冬雨, 赵亮, 于芳苹, 孙水林, 张吉翔, 刘亮明. 大鼠枯否细胞的分离、鉴定以及LPS刺激诱导TNF-α的表达. 世界华人消化杂志 2013; 21(4): 307-312
Revised: January 10, 2013
Accepted: January 18, 2013
Published online: February 8, 2013
AIM: To isolate, culture and identify rat Kupffer cells, and to investigate the effect of LPS on TNF-α expression and secretion in rat Kupffer cells.
METHODS: Rat liver Kupffer cells (KCs) were isolated and purified by means of in situ perfusion, density gradient centrifugation and early medium change. Isolated cells were identified by ink phagocytosis and ED2 staining test. The expression and secretion of TNF-α was detected by RT-PCR and enzyme-linked immunosorbent assay (ELISA).
RESULTS: Rat liver KCs were successfully isolated, purified, and confirmed by ink phagocytosis and ED2 staining test. Compared with non-stimulated KCs, LPS-stimulated cells had a significantly higher level of TNF-α mRNA expression (1.10 ± 0.02 vs 0.09 ± 0.01, P < 0.001). TNF-α protein levels in cell supernatants were also significantly increased in LPS-stimulated cells than in non-stimulated cells (487.10 pg/mL± 5.56 pg/mL vs 39.41 pg/mL ± 15.30 pg/mL, P < 0.001).
CONCLUSION: Rat KCs have been successfully isolated and purified by means of in situ perfusion and density gradient centrifugation, and LPS can stimulate the expression and secretion of TNF-α.
- Citation: Ye CG, Liang DY, Zhao L, Yu FP, Sun SL, Zhang JX, Liu LM. Rat Kupffer cells: Isolation, identification and LPS-stimulated TNF-α expression and secretion. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 307-312
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/307.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.307
枯否细胞(kupffer cell, KC)是一种非实质性肝细胞, 其数量约占肝细胞总数的15%和体内组织驻留巨噬细胞总数的80%-90%[1]. KC被覆于肝窦内壁, 在稳定或生理情况下, 可作为"专业化"的吞噬细胞[2], 以清除衰老的红细胞、免疫复合物和来自门脉循环的肠源性细菌产物[1]. 在功能上, KC可作为抗原呈递细胞, 参与肝移植免疫, 并通过可溶性介质的表达和分泌, 在固有免疫和宿主防御反应方面起重要作用[3]. 近年的研究表明, KC参与了各种炎症性肝病[4-8]及缺血再灌注肝损伤[9]的发病过程. 并在胆汁淤积性肝损伤中调节炎性单核吞噬细胞的流入和活化[10]. 已证实, KC可通过分泌多种前炎细胞因子, 在肝免疫炎症性损伤性疾病(包括急性肝衰竭)的发生发展中起关键作用[11]. 因此, 本项目拟进行原代大鼠KC的分离、培养和鉴定, 并拟采用LPS刺激, 以观察该细胞对TNF-α的表达和分泌情况, 以期为将来进行急性肝衰竭等肝免疫炎症损伤疾病的病理生理机制研究提供实验和物质基础.
健康♂SD大鼠由上海交通大学附属第一人民医院动物中心提供, 鼠龄5 wk, 体质量180-200 g. 动物合格证号: SYXK(沪)2009-0086, 清洁级饲养. 脂多糖(lipopolysaccharide, LPS)、链霉蛋白酶E和DNaseⅠ酶购自美国Sigma公司; IV型胶原酶购自美国Invitrogen公司; RPMI 1640培养基和胎牛血清均购自美国Gibco公司; 青链霉素混合液、HBSS液(无Ca2+, Mg2+)购自德国Hyclone公司; Percoll细胞分离液购自瑞典Pharmacia公司; 抗CD163 mAb(又名ED2)购自国Santa cruz公司; PCR反应试剂盒购自北京天根公司; Elisa试剂盒购自上海欣博盛公司; 细胞免疫化学试剂盒购自武汉博士德公司.
1.2.1 动物饲养方法: 实验前, 大鼠置清洁级动物房饲养1 wk, 饲养方法参考文献[12]. 动物自由进食和饮水, 每12 h开灯或关灯. 环境温度: 20 ℃-23 ℃, 湿度: 40%-80%. 设施内换气次数为8-15次, 噪声<50 dB, 滤过后空气洁净度10000级. 实验动物的使用符合国家动物保护法. 实验前12 h禁食.
1.2.2 原代枯否细胞分离: 采用文献[13,14]分离培养大鼠肝枯否细胞并稍加改进. 简要操作方法如下: 大鼠采用腹腔内注射戊巴比妥钠(40 mg/kg)麻醉, 同时腹腔注入肝素1 mL. 750 mL/L乙醇浸泡消毒, 开腹并显露门静脉. 结扎肝上下腔静脉后, 室温下经门静脉缓慢注入D-Hanks'液, 并剪破肝下下腔静脉, 让血液和灌注液自行流出. 待肝脏体积膨大各部位颜色逐渐变白后, 改用5%Ⅳ型胶原酶消化液(采用HBSS配制)继续灌注消化肝组织. 剪取肝脏, 置Ⅳ型胶原酶消化液(含0.1%链霉蛋白酶E、0.005%DNaseⅠ)中, 小心撕碎肝组织, 200目筛网过滤. 滤液离心后, 沉淀用不连续Percoll密度梯度离心. 小心吸取30%Percoll与60%Percoll液界面间的膜状细胞层. 细胞用HBSS液洗涤后, 加入RPMI 1640培养液(含胎牛血清、青霉素和链霉素)重悬. 培养1-2 h后, 洗去未贴壁细胞, 即可获得纯化KC.
1.2.3 细胞鉴定(墨汁吞噬试验): 在细胞培养液中加入数滴灭菌后的碳素墨水, 6-12 h观察细胞吞噬墨汁的情况[13].
1.2.4 细胞免疫化学染色: 按试剂盒操作说明书进行. 简要步骤如下: 细胞经福尔马林固定后, 加冰乙酸灭活内源性酶. 采用BSA封闭非特异性结合位点. 随后, 滴加特异性CD163抗体, 室温孵育1-2 h. TBS洗细胞3次后, 加入生物素化的IgG, 继续室温孵育20 min. 细胞经TBS清洗后, 采用BCIP/NBT工作液显色.
1.2.5 细胞LPS刺激方法: 参考文献[12,15]并稍加以改进. 分离纯化的枯否细胞培养4 h后, 洗去未贴壁细胞, 并重新接种于6孔板, 每孔细胞数为4×106. 24 h后, 用磷酸盐缓冲盐水(phosphate buffered saline, PBS)洗细胞3次, 每孔各加入500 μL无血清培养液, 并按文献[16]的方法, 在各孔细胞中随机加入LPS(终浓度20 μg/mL, 以PBS配制)或PBS液10 μL. 每种处置方法各3孔细胞. 处理6 h后分别收集培养上清液及细胞.
1.2.5 细胞LPS刺激方法: 参考文献[12,15]并稍加以改进. 分离纯化的枯否细胞培养4 h后, 洗去未贴壁细胞, 并重新接种于6孔板, 每孔细胞数为4×106. 24 h后, 用磷酸盐缓冲盐水(phosphate buffered saline, PBS)洗细胞3次, 每孔各加入500 μL无血清培养液, 并按文献[16]的方法, 在各孔细胞中随机加入LPS(终浓度20 μg/mL, 以PBS配制)或PBS液10 μL. 每种处置方法各3孔细胞. 处理6 h后分别收集培养上清液及细胞.
1.2.6 RT-PCR分析方法: 用TRIzol处理培养的KC, 以抽提细胞总RNA. 抽提方法按说明书进行. 2 mg总RNA作为模板用于第一链cDNA的合成. 引物设计借助Primer Premier 6.0软件设计, 基因检测引物序列和产物长度见表1. 引物由上海生工生物公司合成. TNF-α基因的反应条件为: 94 ℃预变性5 min; 94 ℃ 1 min, 51 ℃ 45 s, 72 ℃ 45 s, 共32个循环; 72 ℃延伸10 min. 所得PCR产物经1.5%的琼脂糖凝胶电泳, β-actin作为内参照. 电泳结果经BIO-RAD Quantity-One 4.7成像分析软件检测并计算待测基因灰度相对相应β-actin的表达量.
| 基因 | 引物序列5'-3' | 产物长度(bp) |
| TNF-α | 上游: GGCGTGGAGCTGAGAGATAAC | 92 |
| 下游: GGTGTGGGTGAGGAGCACAT | ||
| β-actin | 上游: TGTTACAGGAAGTCCCTTGCC | 101 |
| 下游: AATGCTATCACCTCCCCTGTG |
1.2.7 酶联免疫技术: 细胞培养上清液TNF-α测定采用双抗体夹心酶联免疫技术, 按照试剂盒说明书操作进行. 简单操作如下: (1)加入样本或标准品(100 μL/孔), 36 ℃孵育90 min; (2)洗板5次, 加入生物素化抗体工作液(100 μL/孔), 36 ℃孵育60min; (3)洗板5次, 加入酶结合物工作液(100 μL/孔), 36 ℃避光孵育30 min; (4)洗板5次, 加入显色底物(100 μL/孔), 36 ℃避光孵育15 min; (5)加入终止液(100 μL/孔), 混匀后测A450值. LPS或PBS处理各取3复孔, 结果取三者均值.
统计学处理 结果用mean±SD表示, 组间比较采用独立样本t检验, 以P<0.05为具有统计学差异.
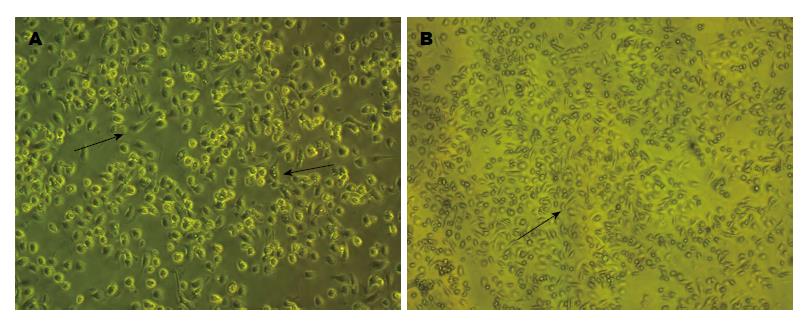
原代分离培养的KC形态可随培养时间延长, 出现明显变化. 这一点与原代肝实质细胞有明显不同. 初分离的KC镜下呈折光性很强的圆球形, 培养30 min后即逐渐贴壁, 呈扁圆形(图1). 培养4 h的KC已牢固贴壁, 并呈不规则形状, 部分已伸出伪足. 随着培养时间的延长, 细胞伸出的伪足会逐渐增多. 24 h后, 细胞形态将完全舒展, 大小基本一致, 但形态不规则, 多呈星形、多角形或十字型等.
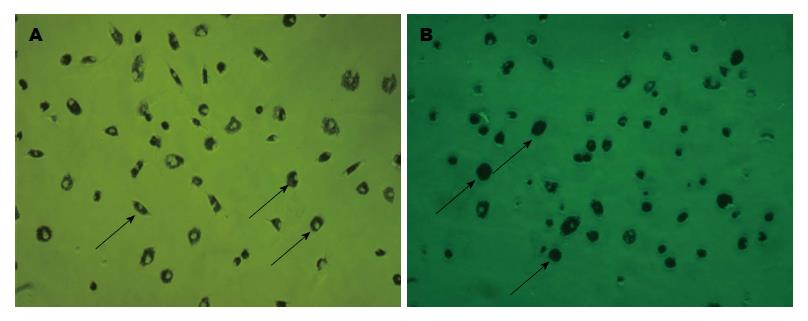
由图2可见KC吞噬墨汁后的情况. 图中可见细胞胞浆中含有大量被吞噬的墨汁, 将细胞核衬托得更加清晰. 这表明我们分离的KC存在正常的吞噬能力.
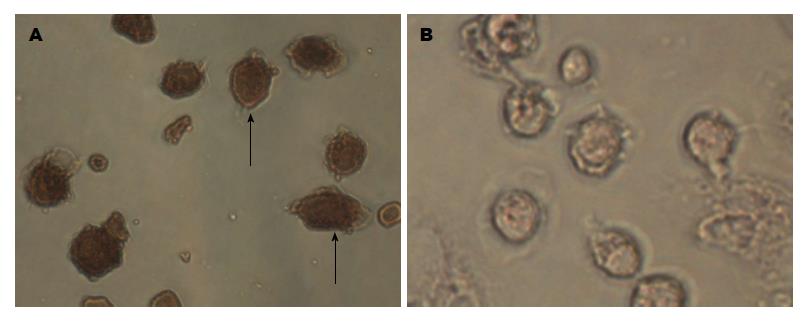
图3为KC免疫细胞化学染色结果. 图中可见许多细胞被染成了黄褐色. 由于大部分KC表达CD163, 经ED2染色后, 细胞可被染成黄褐色. 通过该项染色方法, 可十分准确地将KC鉴定出来. 该结果提示我们已成功分离出了原代KC. 通过本染色技术, 也可对KC的纯度进行准确评估. 在本项实验中, 我们分离的KC纯度均超过90%. 这表明, 采用原位灌注加密度梯度离心的方法, 不仅简便而且十分高效的KC分离方法.
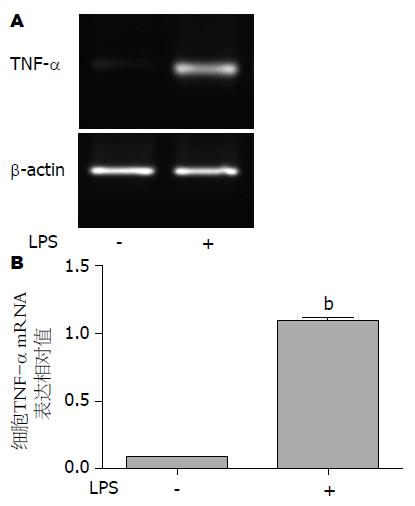
大鼠枯否细胞前炎细胞因子TNF-α mRNA表达结果如图4. LPS刺激后, 枯否细胞TNF-α mRNA的表达显著增高. 加入LPS或PBS后, 枯否细胞TNF-α mRNA的相对表达量分别为1.10±0.02和0.09±0.01. 经统计学处理, 两组间存在显著统计学差异(P<0.001). 这说明, LPS可以诱导枯否细胞TNF-α mRNA表达.
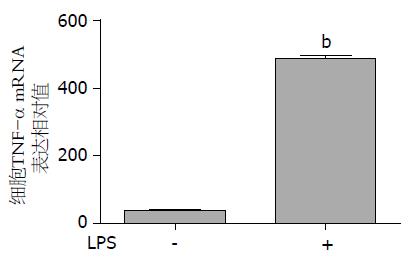
大鼠KC细胞培养上清液中TNF-α蛋白分泌水平如图5. LPS或PBS刺激细胞后, 其TNF-α蛋白的分泌水平分别为487.10 pg/mL±5.56 pg/mL和39.41 pg/mL±15.30 pg/mL. 经统计学处理, 两组间存在显著性差异(P<0.001). 这表明, LPS可刺激KC表达和分泌TNF-α.
枯否细胞是机体固有免疫的重要组成部分, 对枯否细胞功能研究显得极其重要. 但枯否细胞的提取和培养是一大难题, 提取分离得到高纯度的KC更加困难. 目前国内外主要有密度梯度离心法[17,18]、离心淘析法[19]及流式细胞术[20,21]来提取枯否细胞, 但使用得最多的是密度梯度离心法. 该方法操作简单、经济实用, 对器械要求也不高.
在本实验中, 我们采用了肝脏在体原位灌注消化法分离KC. 该方法需经门静脉插管. 在此基础上, 采用PBS反复冲洗肝脏, 以使肝内血液冲净. 因为肝脏内如残留较多血液, 将影响后面的离心纯化, 并可能影响KC贴壁和吞噬作用的发挥. 用Ⅳ型胶原酶灌注时, 速度宜偏慢, 以使Ⅳ型胶原酶充分消化肝组织. 将松散的肝组织撕碎后, 可移入培养瓶中振荡消化, 但时间不宜过长, 一般10 min左右即可. 时间过长, 可能造成KC消化损毁. DNA酶Ⅰ的加入, 主要是防止肝细胞破坏后释放大量DNA, 以免形成黏连、聚集的絮状物, 影响细胞的分离效率和产率. 在密度梯度离心的过程中, 可采用多种浓度的Percoll细胞分离液, 但以30%和60%两种浓度较佳. 密度梯度离心后, 需要十分小心地吸取KC细胞层. 培养过程中, KC在30 min内即开始贴壁, 1 h后KC已贴壁牢靠, 而其他细胞贴壁时间相对较长. 利用该特点, 可以通过换液, 将其他细胞特别是肝细胞去除, 以获得较高纯度的KC. 当然, 在整个过程中, 无菌操作也是十分重要的.
在进行下一步实验之前, 需要对所提取的细胞进行鉴定. 我们采用了两种方法对KC进行鉴定, 包括墨汁吞噬试验和ED2染色试验[22]. ED2染色对KC的鉴别具有特异性. ED2(又称CD163)是单核吞噬细胞系统细胞膜上的一种跨膜糖蛋白, 其在细胞内的阳性表达是巨噬细胞活化的重要标志[23], 而肝内其他实质和非实质细胞均不表达CD163分子. 因此, ED2染色后, KC呈现阳性反应, 而其他细胞均呈阴性反应, 从而能十分有效地将KC与肝内其他细胞区分出来. 墨汁吞噬试验主要反映的是KC的吞噬功能. KC是机体内重要的吞噬细胞, 具有吞噬多种异物包括墨汁中的炭素的能力. 上述两项试验证实, 我们已获得了高纯度且有良好吞噬功能的KC, 这为下一步细胞学研究提供了实验物质基础.
KC是机体固有免疫的重要组成部分, 炎症或损伤性刺激, 特别是来自肠道内的细菌代谢产物LPS, 可激活KC并使其分泌大量生物活性分子[24-26]. 在本项研究中, 我们发现, LPS可刺激KC表达和分泌TNF-α. 已知, TNF-α是KC激活后产生并分泌的最重要的前炎细胞因子之一[3]. TNF-α可诱导肝细胞凋亡和坏死, 并促进PMNs等炎症细胞在炎症损伤部位聚集. 在肝损伤动物模型中, TNF-α升高水平与肝损伤程度呈密切正相关关系[27-29]. KC清除后, TNF-α释放明显减少, 肝细胞损伤显著减轻[30,31]. 因此, KC在免疫炎症性肝损伤的发病中起着关键作用. 以原代KC作为研究对象, 有望能够更加深入地阐明急性肝损伤或肝衰竭的病理生理机制. 我们下一阶段将进一步借助原代KC, 研究LPS对TNF-α产生和分泌的细胞分子通路的影响, 以期最终达到抑制肝内级联性炎性反应和阻断急性肝损伤发生发展的目的.
枯否细胞(KC)是肝脏最重要的非实质细胞之一, 是机体固有免疫的重要组成部分, 在肝脏炎性反应、缺血再灌注损伤、胆汁淤汁性肝损伤等方面发挥着重要作用. 分离及培养高纯度的KC可为免疫炎症肝损伤病理生理机制的研究提供实验和物质基础.
潘兴华, 副主任医师, 中国人民解放军成都军区昆明总医院干细胞与组织器官工程研究中心
Kitani等报道, 采用密度梯度离心法可获得较高纯度的KC.
采用在体灌注, 一次消化和不连续密度梯度离心方法, 分离获得高纯度的KC; 在此基础上, 进行了LPS刺激实验, 对KC的TNF-α表达水平进行了检测.
可应用于肝组织免疫炎症损伤及肝纤维化机制的研究等方面.
固有免疫: 又称非特异性免疫或天然免疫, 是生物体在长期种系进化过程中形成的一系列防御机制. 固有免疫在个体出生时就具备, 可产生非特异抗感染免疫和清除体内损伤衰老或畸变的细胞, 并对特异性免疫应答过程也起重要作用; 枯否细胞(KC): 固定于肝血窦内的一群巨噬细胞, 在肝固有免疫应答中起关键作用.
本文对研究肝脏免疫及肝纤维化等有一定技术参考意义.
编辑: 田滢 电编: 闫晋利
| 1. | Vollmar B, Menger MD. The hepatic microcirculation: mechanistic contributions and therapeutic targets in liver injury and repair. Physiol Rev. 2009;89:1269-1339. [PubMed] [DOI] |
| 2. | Movita D, Kreefft K, Biesta P, van Oudenaren A, Leenen PJ, Janssen HL, Boonstra A. Kupffer cells express a unique combination of phenotypic and functional characteristics compared with splenic and peritoneal macrophages. J Leukoc Biol. 2012;92:723-733. [PubMed] [DOI] |
| 3. | Huang HF, Zeng Z, Chen MQ. Roles of Kupffer cells in liver transplantation. Hepatogastroenterology. 2012;59:1251-1257. [PubMed] |
| 4. | Kolios G, Valatas V, Kouroumalis E. Role of Kupffer cells in the pathogenesis of liver disease. World J Gastroenterol. 2006;12:7413-7420. [PubMed] |
| 5. | Roberts RA, Ganey PE, Ju C, Kamendulis LM, Rusyn I, Klaunig JE. Role of the Kupffer cell in mediating hepatic toxicity and carcinogenesis. Toxicol Sci. 2007;96:2-15. [PubMed] [DOI] |
| 6. | Jaeschke H, Gores GJ, Cederbaum AI, Hinson JA, Pessayre D, Lemasters JJ. Mechanisms of hepatotoxicity. Toxicol Sci. 2002;65:166-176. [PubMed] [DOI] |
| 7. | Duwaerts CC, Gehring S, Cheng CW, van Rooijen N, Gregory SH. Contrasting responses of Kupffer cells and inflammatory mononuclear phagocytes to biliary obstruction in a mouse model of cholestatic liver injury. Liver Int. 2013;33:255-265. [PubMed] [DOI] |
| 8. | Chatterjee S, Ganini D, Tokar EJ, Kumar A, Das S, Corbett J, Kadiiska MB, Waalkes MP, Diehl AM, Mason RP. Leptin is key to peroxynitrite-mediated oxidative stress and Kupffer cell activation in experimental non-alcoholic steatohepatitis. J Hepatol. 2012; Dec 1. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Kitagawa T, Yokoyama Y, Kokuryo T, Nagino M. Protective effects of branched-chain amino acids on hepatic ischemia-reperfusion-induced liver injury in rats: a direct attenuation of Kupffer cell activation. Am J Physiol Gastrointest Liver Physiol. 2012; Dec 28. [Epub ahead of print]. [PubMed] [DOI] |
| 10. | Lotowska JM, Sobaniec-Lotowska ME, Lebensztejn DM. The role of Kupffer cells in the morphogenesis of nonalcoholic steatohepatitis - ultrastructural findings. The first report in pediatric patients. Scand J Gastroenterol. 2012; Dec 27. [Epub ahead of print]. [PubMed] [DOI] |
| 11. | Yang Q, Shi Y, He J, Chen Z. The evolving story of macrophages in acute liver failure. Immunol Lett. 2012;147:1-9. [PubMed] [DOI] |
| 12. | Liu C, Tao Q, Sun M, Wu JZ, Yang W, Jian P, Peng J, Hu Y, Liu C, Liu P. Kupffer cells are associated with apoptosis, inflammation and fibrotic effects in hepatic fibrosis in rats. Lab Invest. 2010;90:1805-1816. [PubMed] [DOI] |
| 14. | Kitani H, Takenouchi T, Sato M, Yoshioka M, Yamanaka N. A simple and efficient method to isolate macrophages from mixed primary cultures of adult liver cells. J Vis Exp. 2011;24; 2757. [PubMed] |
| 17. | Liu H, Cao H, Wu ZY. Isolation of Kupffer cells and their suppressive effects on T lymphocyte growth in rat orthotopic liver transplantation. World J Gastroenterol. 2007;13:3133-3136. [PubMed] |
| 18. | Hirsch J, Hansen KC, Choi S, Noh J, Hirose R, Roberts JP, Matthay MA, Burlingame AL, Maher JJ, Niemann CU. Warm ischemia-induced alterations in oxidative and inflammatory proteins in hepatic Kupffer cells in rats. Mol Cell Proteomics. 2006;5:979-986. [PubMed] [DOI] |
| 19. | Murthi P, Kalionis B, Ghabrial H, Dunlop ME, Smallwood RA, Sewell RB. Kupffer cell function during the erythocytic stage of malaria. J Gastroenterol Hepatol. 2006;21:313-318. [PubMed] [DOI] |
| 20. | Tomiyama K, Ikeda A, Ueki S, Nakao A, Stolz DB, Koike Y, Afrazi A, Gandhi C, Tokita D, Geller DA. Inhibition of Kupffer cell-mediated early proinflammatory response with carbon monoxide in transplant-induced hepatic ischemia/reperfusion injury in rats. Hepatology. 2008;48:1608-1620. [PubMed] [DOI] |
| 21. | You Q, Cheng L, Kedl RM, Ju C. Mechanism of T cell tolerance induction by murine hepatic Kupffer cells. Hepatology. 2008;48:978-990. [PubMed] [DOI] |
| 22. | Polfliet MM, Fabriek BO, Daniëls WP, Dijkstra CD, van den Berg TK. The rat macrophage scavenger receptor CD163: expression, regulation and role in inflammatory mediator production. Immunobiology. 2006;211:419-425. [PubMed] [DOI] |
| 24. | Wu J, Meng Z, Jiang M, Zhang E, Trippler M, Broering R, Bucchi A, Krux F, Dittmer U, Yang D. Toll-like receptor-induced innate immune responses in non-parenchymal liver cells are cell type-specific. Immunology. 2010;129:363-374. [PubMed] [DOI] |
| 25. | Seki E, Tsutsui H, Nakano H, Tsuji N, Hoshino K, Adachi O, Adachi K, Futatsugi S, Kuida K, Takeuchi O. Lipopolysaccharide-induced IL-18 secretion from murine Kupffer cells independently of myeloid differentiation factor 88 that is critically involved in induction of production of IL-12 and IL-1beta. J Immunol. 2001;166:2651-2657. [PubMed] |
| 26. | Kinoshita M, Uchida T, Sato A, Nakashima M, Nakashima H, Shono S, Habu Y, Miyazaki H, Hiroi S, Seki S. Characterization of two F4/80-positive Kupffer cell subsets by their function and phenotype in mice. J Hepatol. 2010;53:903-910. [PubMed] [DOI] |
| 27. | Cazanave S, Vadrot N, Tinel M, Berson A, Lettéron P, Larosche I, Descatoire V, Feldmann G, Robin MA, Pessayre D. Ibuprofen administration attenuates serum TNF-alpha levels, hepatic glutathione depletion, hepatic apoptosis and mouse mortality after Fas stimulation. Toxicol Appl Pharmacol. 2008;231:336-343. [PubMed] [DOI] |
| 28. | Eipel C, Kidess E, Abshagen K, Leminh K, Menger MD, Burkhardt H, Vollmar B. Antileukoproteinase protects against hepatic inflammation, but not apoptosis in the response of D-galactosamine-sensitized mice to lipopolysaccharide. Br J Pharmacol. 2007;151:406-413. [PubMed] [DOI] |
| 29. | Langdale LA, Hoagland V, Benz W, Riehle KJ, Campbell JS, Liggitt DH, Fausto N. Suppressor of cytokine signaling expression with increasing severity of murine hepatic ischemia-reperfusion injury. J Hepatol. 2008;49:198-206. [PubMed] [DOI] |
| 30. | Shibuya H, Ohkohchi N, Tsukamoto S, Satomi S. Tumor necrosis factor-induced, superoxide-mediated neutrophil accumulation in cold ischemic/reperfused rat liver. Hepatology. 1997;26:113-120. [PubMed] [DOI] |
| 31. | Owumi SE, Corthals SM, Uwaifo AO, Kamendulis LM, Klaunig JE. Depletion of Kupffer cells modulates ethanol-induced hepatocyte DNA synthesis in C57Bl/6 mice. Environ Toxicol. 2012; Sep 20. [Epub ahead of print]. [PubMed] |