修回日期: 2013-04-15
接受日期: 2013-04-18
在线出版日期: 2013-05-18
目的: 评价非甾体类抗炎药吲哚美辛预防经内镜逆行胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)后胰腺炎(post-endoscopic retrograde cholangiopancreato-graphy pancreatitis, PEP)的有效性.
方法: 计算机检索PubMed、Embase、中国生物医学文献数据库、清华同方数据库、万方数据库、维普数据库, 全面收集吲哚美辛预防ERCP术后胰腺炎的随机对照试验, 由两人独立进行数据提取和文献评价. 应用Review Manager 5.0进行统计分析.
结果: 共纳入11项随机对照试验(randomized controlled trials,RCTs), 共计2718例行ERCP患者. Meta分析结果显示: 应用吲哚美辛可降低PEP的发生率(OR = 0.39, 95%CI: 0.30-0.52, P<0.00001)及高淀粉酶血症的发生率(OR = 0.50, 95%CI: 0.37-0.67, P<0.00001). 11个纳入研究均未报告药物相关不良反应.
结论: 吲哚美辛可以有效降低ERCP术后胰腺炎及术后高淀粉酶血症的发生率.
核心提示: 内镜逆行胰胆管造影术经内镜逆行胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)后胰腺炎(post-endoscopic retrograde cholangiopancreatography pancreatitis, PEP)是ERCP术后最常见且严重的并发症, 其发生可能与磷脂酶A2(phospholipase A2)及环氧酶有关. 本研究采用Meta分析的方法对非甾体类抗炎药(nonsteroidal antiinflammatory drugs)吲哚美辛预防PEP的有效性进行评价, 结果表明该药物可以降低ERCP术后胰腺炎及术后高淀粉酶血症的发生率.
引文著录: 姜丹, 赖铭裕, 陈家庄, 韦春回. 吲哚美辛预防ERCP术后胰腺炎的Meta分析. 世界华人消化杂志 2013; 21(14): 1343-1350
Revised: April 15, 2013
Accepted: April 18, 2013
Published online: May 18, 2013
AIM: To assess the effectiveness and safety of indomethacin in preventing post-endoscopic retrograde cholangiopancreatography pancreatitis (PEP).
METHODS: Electronic searches were conducted to retrieve randomized controlled trials (RCTs) comparing indomethacin to placebo in the prevention of PEP from the PubMed, Embase, CBM, CNKI, WANFANG and VIP databases. Data collection and literature evaluation were performed by two reviewers independently. Review Manager 5.0 was used for statistical analysis.
RESULTS: A total of 11 RCTs involving 2718 patients were included. The meta-analysis showed that indomethacin could reduce the incidence of PEP (OR = 0.39, 95%CI: 0.30-0.52, P < 0.00001) and hyperamylasemia (OR = 0.50, 95%CI: 0.37-0.67, P < 0.00001).
CONCLUSION: Indomethacin is safe and effective in reducing the incidence of PEP and hyperamylasemia.
- Citation: Jiang D, Lai MY, Chen JZ, Wei CH. Indomethacin for preventing post-endoscopic retrograde cholangiopancreatography pancreatitis: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2013; 21(14): 1343-1350
- URL: https://www.wjgnet.com/1009-3079/full/v21/i14/1343.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i14.1343
经内镜逆行胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)自20世纪60年代开始应用于临床以来, 已成为胆胰系统疾病的常规诊疗术式. 随着技术条件的日益成熟, ERCP的术后并发症有所下降, 但ERCP术后胰腺炎(post-endoscopic retrograde cholangiopancreatography pancreatitis, PEP)仍为ERCP术后最常见的严重并发症之一. 有研究表明, 急性胰腺炎的发生与磷脂酶A2(phospholipase A2, PLA2)及环氧酶有关, 而非甾体类抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs)作为有效的PLA2及环氧酶抑制剂, 有可能降低PEP及术后高淀粉酶血症的发生率. 本研究采用Cochrane系统评价中Meta分析的方法, 对非甾体类抗炎药吲哚美辛(indomethacin)预防PEP的有效性进行评价, 以期为临床合理用药提供证据.
计算机检索PubMed、Embase、中国生物医学文献数据库、清华同方数据库、万方数据库及维普数据库. 检索时限均为建库至2012-11. 英文检索词包括"ERCP*", "Endoscopic Retrograde Cholangiopancreatography*", "Pancreatitis*", "PEP*", "Post-ERCP Pancreatitis*", "Post-Endoscopic Retrograde Cholangiopancreatography*", "NSAIDs", "nonsteroidal anti-inflammatory drugs", "anti-inflammatory agents, non-steroidal", "indomethacin", "Prophylaxis"及"Prevention". 中文检索词包括: "经内镜逆行胰胆管造影术"、"ERCP术后胰腺炎"、"胰腺炎"、"非甾体类抗炎药"、"吲哚美辛"及"消炎痛".
1.2.1 材料纳入与排除标准: (1)研究类型: 吲哚美辛预防ERCP术后胰腺炎与安慰剂/空白对照比较的随机对照试验; 公开杂志发表, 无论是否采用盲法及分配隐藏, 不限语种; (2)研究对象: 拟行ERCP术的患者, 排除胰腺炎急性发作、怀孕或哺乳、急性细菌感染的患者, 其性别、年龄、人种及国籍等不限; (3)干预措施: 试验组采用吲哚美辛(indomethacin), 对照组采用安慰剂或空白对照; (4)疗效判定指标: 采用下列一项或多项疗效判定指标的原始研究文献均被纳入: PEP发病率、重度PEP发病率、PEP患者病死率及药物不良反应发生率. 参照Cotton等[1]制定的关于ERCP术后并发症的建议和形成的共识将PEP定义为ERCP后出现腹痛或者腹痛加重持续时间超过24 h, 造成门诊患者住院超过一晚或延迟住院患者的住院时间, 并且血清淀粉酶水平在ERCP后18 h内增加至少超过正常值上限的3倍; (5)排除标准: 研究中出现下列情况之一者均予以排除: 采用除吲哚美辛外其他预防PEP的措施; 研究中仅限于药物防治ERCP术后高淀粉酶血症的试验; 试验尚未完成或仅有初步结果者; 试验报告无法获取全文者.
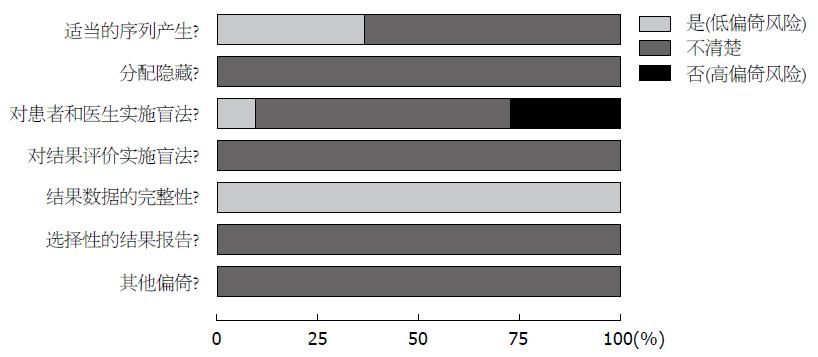
1.2.2 偏倚风险评估: 由两名评价员共同按照Cochrane系统评价员手册(5.1.0版)中随机对照试验(randomized controlled trials,RCTs)的偏倚风险评价标准对所纳入研究进行方法学质量评价, 若分歧则通过讨论或征求第三方意见解决. 评价内容包括: (1)随机分配的产生; (2)隐藏分组; (3)对患者和医生实施盲法; (4)对结果评价实施盲法; (5)结果数据的完整性; (6)选择性的结果报告; (7)其他偏倚. 针对上述7条评价内容, 回答"是"表示"低偏倚风险"; "否"表示"高偏倚风险" "不清楚"则表示"缺乏相关信息或偏倚情况不确定".
1.2.3 资料提取: 由两名评价员独立提取纳入研究资料, 交叉核对后, 通过讨论或征求第三方意见处理不一致结果. 资料提取内容包括: 方法学质量、干预方案、疗程判效指标及结果. 缺乏的资料试通过电话或邮件与作者联系进行补充. 在涉及含有多组研究的RCT时, 提取与本研究相关的试验组与对照组.
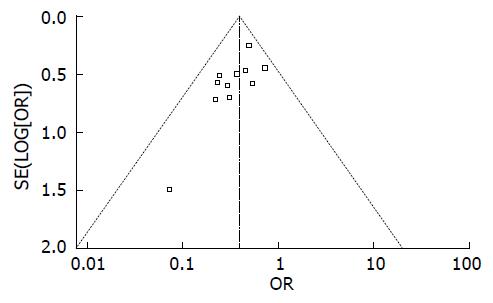
统计学处理 采用Cochrane协作网所提供的RevMan5.0软件进行统计分析. Meta分析之前, 先进行异质性检验. 若P>0.1, I2<50%, 表明异质性不明显, 选用固定效应模型估计合并效应量; 若P<0.1, I2>50%, 表明异质性明显, 可采用随机效应模型估计合并效应量, 若异质性过于明显, 则需进一步分析异质性原因和来源, 必要时进行亚组分析、敏感性分析, 乃至最终放弃Meta分析. 计数资料的效应量表达采用OR及其95%CI, P<0.05表示有统计学意义. 若纳入研究数在11篇及以上, 则绘制漏斗图, 用以分析发表偏倚.
检索数据库获得相关文献112篇, 剔除重复后获得文献84篇. 阅读文题及摘要后, 因题目或摘要不符合要求及非随机对照实验进行初筛剩余文献12篇. 在阅读全文后, 按照纳入标准, 排除不符合纳入标准的文献1篇. 最终纳入11个RCT, 共2718例行ERCP术患者.
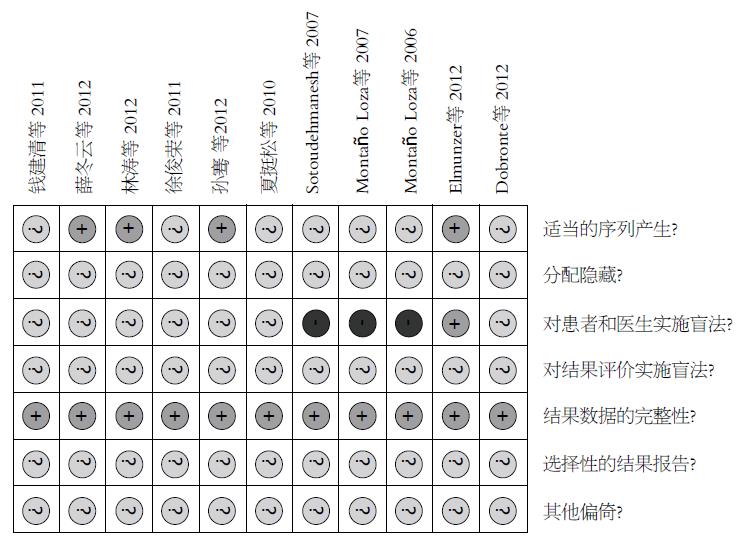
纳入的11个RCT[2-12]均以全文形式发表. 研究对象在年龄、性别、ERCP术前病史因素等方面基线一致. 2718例拟行ERCP术的患者中, 试验组1385例, 采用吲哚美辛直肠给药; 对照组1333例, 给予安慰剂或空白对照. 所有纳入试验均设置了明确的纳入标准, 其中7个试验设置了排除标准, 有4个RCT[3,5,6,11]未描述排除标准. 其中有4篇[9-12]文献写明随机化分配方案, 另外7篇则未提及. 有3个RCT[2-4]采用单盲, 1个RCT[9]采用双盲, 其余未提及盲法(表1).
| 文献作者 | 发表时间 | 研究n | 干预组 | 对照组 | 随机分配方式是否提及 | 盲法实施 | ||||
| n | 干预措施(吲哚美辛100mg) | 平均年龄(岁) | n | 干预措施(给药时间同前) | 平均年龄(岁) | |||||
| Montaño Loza等[2] | 2006 | 117 | 61 | 术前2 h | 54.2±18.8 | 56 | 甘油 | 50.1±18.1 | 否 | 单盲 |
| Montaño Loza等[3] | 2007 | 150 | 75 | 术前2 h | 55.37±18.0 | 75 | 甘油 | 51.1±17.0 | 否 | 单盲 |
| Sotoudehmanesh等[4] | 2007 | 442 | 221 | 术前 | 58.4±17.1 | 221 | 安慰剂 | 58.1±16.8 | 否 | 单盲 |
| 夏挺松等[5] | 2010 | 60 | 30 | 术前0.5 h | 68.7 | 30 | 空白对照 | 68.7 | 否 | 未提及 |
| 钱建清等[6] | 2011 | 348 | 182 | 术前0.5 h | 50.1±7.1 | 166 | 安慰剂 | 51.9±6.4 | 否 | 未提及 |
| 徐俊荣等[7] | 2011 | 168 | 83 | 术前0.5 h | 60.354±1.275 | 85 | 安慰剂 | 60.354±1.275 | 否 | 未提及 |
| Döbrönte等[8] | 2012 | 228 | 130 | 术前0 min | 66.8±16.4 | 98 | 安慰剂 | 66.8±16.4 | 否 | 未提及 |
| Elmunzer等[9] | 2012 | 602 | 295 | 术后立即 | 44.4±13.5 | 307 | 安慰剂 | 46.0±13.1 | 是 | 双盲 |
| 薛冬云等[10] | 2012 | 90 | 48 | 术后立即 | 67.2 | 42 | 安慰剂 | 69 | 是 | 未提及 |
| 孙骞等[11] | 2012 | 113 | 60 | 术前1 h | 59 | 53 | 空白对照 | 59 | 是 | 未提及 |
| 林涛等[12] | 2012 | 400 | 200 | 术前0.5 h | 63 | 200 | 空白对照 | 63 | 是 | 未提及 |
11个RCT纳入的病例均基线可比. 其中4篇文献[9-12]对随机分配方案的产生描述完整, 其他9篇只提到随机化分配而未进行具体描述. 所以文献均未对分配隐藏进行完整描述. 仅有1个RCT[9]研究过程中实施双盲, 另外有3个RCT[2-4]在研究过程中实施单盲. 有1个RCT[5]存在退出病例, 并详细描述了退出原因. 因未获得11个RCT的计划书, 故无法判断其是否存在选择性报告结果. 所有纳入研究的其他偏倚情况不清楚(图1, 2).
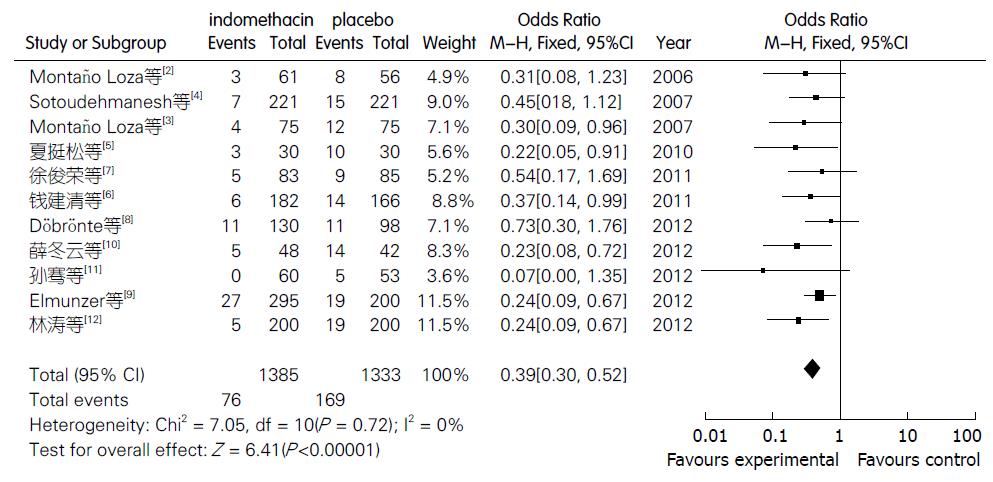
2.4.1 对PEP发病率的影响: 纳入11个RCT研究, 对照组均为空白对照或安慰剂. 对11个RCT进行Meta分析的结果提示, 11个试验间不存在明显的异质性(P = 0.72, I2 = 0%). 采用固定效应模型合并后结果显示, 试验组PEP发病率为5.487%, 对照组发病率为12.68%, 两组间发病率差异有统计学意义(OR = 0.39, 95%CI: 0.30-0.52, P<0.00001)(图3).
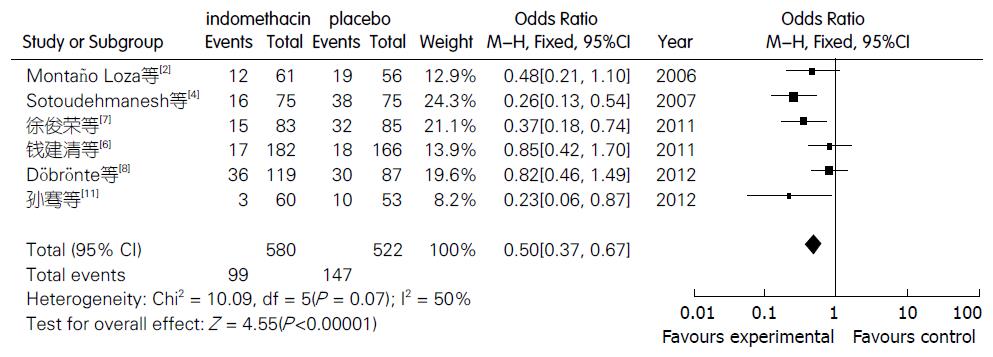
2.4.2 对高淀粉酶血症发生率的影响: 有6个试验[2,3,6,7,8,11]报告了吲哚美辛对高淀粉酶血症发生率影响的结果, 共包括580例试验者和522例对照者. 将Montaño Loza等[3]的试验进行亚组间异质性检验, 采用固定效应模型合并后结果显示, 干预组高淀粉酶血症发生率为17.07%, 对照组发生率为28.16%, 两组间发病率差异有统计学意义(OR = 0.50, 95%CI: 0.37-0.67, P<0.00001)(图4).
ERCP是肝胆胰疾病的重要诊治手段之一, 因其创伤小、恢复快及不良反应少而广泛应用于临床实践. 急性胰腺炎是其最常见的并发症, ERCP术后PEP的发生率为1%-10%[1,13-16], 在某些高风险的患者中其发病率可超过25%, 术后无症状性高淀粉酶血症发生率可达70%以上[17]. 在一项涉及16885例接受ERCP诊断和治疗, 归纳其并发症的研究中, PEP也被发现是发生最频繁的, 发生率约3.47%. 其中轻度占45%, 中度为44%, 重度约11%, 死亡率为3%[18]. PEP作为ERCP术后最常见且严重的并发症, 如何预防其发生一直是困扰临床医生的一个难题.
导致ERCP术后胰腺炎的原因很多, 包括操作直接引起或热电传导引起乳头和胰管损伤, 从导致胰液排除受限, 以及注射造影剂等损伤胰腺组织, 引起蛋白水解酶的过早激活, 发生胰腺自身消化和受损[19]. 虽然PEP的发病机制尚未明确, 但细胞因子所介导的炎症级联反应发挥了重要的作用, 并由此产生了炎症放大效应导致全身炎症反应综合征和器官功能障碍综合征的发生以及促抗炎因子的失衡导致代偿性抗炎反应综合征, 二次打击的出现[20]. ERCP术后胰腺炎预防的目的, 是中断这种级联反应点之一.
在ERCP术后胰腺炎损伤的机制中, PLA2、环氧酶、中性粒细胞及内皮细胞相互作用在胰腺炎的发生机制中被认为起到重要的作用. 早在1989年Funakoshi等[21]研究经内镜逆行胰腺造影后立即测血清PLA2水平升高显著, 并在24 h后恢复到基础水平, 结果表明阶段测量血清PLA2有助于胰腺炎的诊断和监测. 且有研究表明PEP的发生发展还与PLA2的过早激活和过度释放有关[22]. PLA2是一种重要的中心炎症因子, 广泛分布于细胞质膜、细胞器膜, 活化的PLA2催化、水解细胞膜的甘油磷脂产生一系列的炎症介质(如肿瘤坏死因子、白介素、白三烯等)[23]. 这些炎症介质直接或间接引起并加剧了胰腺的损伤, PLA2可以直接分解细胞膜磷脂, 破坏膜结构, 增加细胞膜的通透性, 直接破坏细胞. PLA2引起大量炎症介质的释放, 这些炎症介质又通过"扳机样作用"触发下游炎症介质的"瀑布样级联反应", 并能通过自分泌和旁分泌等调节作用而起到级联放大作用, 从而进一步增加炎症介质的生物合成, 使胰腺组织损伤进一步加重. 此外PLA2还通过产生氧自由基、抑制氧化应激诱导的细胞凋亡等途径加重胰腺组织的坏死, 使胰腺炎趋向于重症化[24].
很多非甾体类抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs), 包括吲哚美辛, 是强效PLA2及环氧酶抑制剂, 能阻止嗜中性粒细胞到达组织, 从而阻断这一炎症反应的关键步骤[25]. Mäkelä等[26]研究发现NSAIDs能有效抑制重症胰腺炎患者血清的PLA2的活性及中性粒细胞/内皮细胞的附着, 减少中性粒细胞在损伤组织的积聚. 也有研究显示NSAIDs可抑制伴随中性粒细胞活化的一系列现象, 包括环磷酸腺苷的合成、过氧化物阴离子的产生、溶酶体酶的释放等, 从而减轻炎症反应[27].
近年来关于NSAIDs预防PEP的有效性逐渐被人重视. Elmunzer等[25]针对直肠给予NSAIDs预防PEP做了荟萃分析, 共搜集截止到2008年的4个随机对照试验, 共包括912例患者, 该研究表明NSAIDs可以有效预防PEP的发生相对危险(relative risk, RR)为0.36, 95%CI: 0.22-0.60, 无药物不良事件报告. 与此同时, 我国学者Zheng等[28]则将以上ERCP病例按其手术操作难度分为高危和低危人群, 按照Cotton标准将PEP分为轻、中、重度, 进行分层统计分析后提示: 直肠给予NSAIDs可显著降低轻度PEP的发生(RR = 0.40), 可降低中度及重度PEP的发生(RR = 0.13), 无药物不良反应及死亡病例, 提示直肠给予NSAIDs是安全有效的. 2010年欧洲胃肠内镜协会在ERCP术后胰腺炎的预防指南中指出: 使用NSAIDs双氯芬酸或吲哚美辛100 mg已被证明可以有效预防并降低PEP的发病率(证据水平1++), 并建议ERCP术前或术后常规直肠给药双氯芬酸或吲哚美辛100 mg(建议A级)[29]. 然而2012年我国赖薇等[30]针对双氯芬酸预防PEP疗效与安全性的系统评价显示: 应用双氯芬酸可降低PEP发病率(OR = 0.41, 95%CI: 0.18-0.95, P = 0.04), OR值在界值附近, 敏感性分析提示结果稳定性较差; 双氯芬酸不能显著降低重度PEP发病率(OR = 0.40, 95%CI: 0.08-2.06, P = 0.27).
另外, 目前相关研究比较多且临床上较常用于预防PEP的药物还有生长抑素及其长效类似物奥曲肽. 国外最近一项纳入了17个RCT包含3818名参与者的Meta分析[31]提示: 生长抑素和高剂量奥曲肽有可能预防ERCP术后胰腺炎, 生长抑素在行胰管内注射、胆道括约肌切开术的患者中及高剂量维持超过12 h或单剂注射的使用方法中可获得显著的预防效果. 国内的汤学文等[32]对奥曲肽预防PEP的疗效进行系统评价, 其中纳入17个RCT共5092例患者, 得出的结论为奥曲肽能降低PEP(P<0.00001, OR = 0.47, 95%CI: 0.35-0.63)和ERCP术后高淀粉酶血症(P = 0.0001, OR = 0.58, 95%CI: 0.44-0.77)的发病率, 但不能降低SPEP和ERCP术后腹痛的发病率. 在蛋白酶抑制剂的相关研究中表明加贝酯和乌司他丁对降低PEP的发生率及减少ERCP术后高淀粉酶血症的发生可能有效, 但疗效不显著, 且只有在足够的剂量时才能有效[33,34]. 通过上述研究, 虽然该类药物在可以起到预防PEP的作用, 但其价格昂贵, 意味着需要更多的医疗资源和费用. 而硝酸甘油、糖皮质激素等对PEP的预防作用不甚理想, 不推荐临床应用[35-37]. 目前多数研究对低分子肝素、乙酰半胱氨酸、硝苯地平、β-胡萝卜素等的预防PEP作用持否定观点, 而中药适时干预的效果也尚需进一步研究.
本研究采用Meta分析的方法对非甾体类抗炎药吲哚美辛预防PEP的有效性进行评价. 严格按照纳入及排除标准, 共纳入11个RCT研究, 各样本量从60例到602例, 共纳入2718例. 入选研究对象在年龄、性别等方面基线平行良好. 对11篇有关吲哚美辛预防PEP的文献数据进行分析. 其中, 吲哚美辛对PEP发生率的合并分析结果为(OR = 0.39, 95%CI: 0.30-0.52, P<0.00001), 表明干预组的PEP发生率低于对照组, 且差异有统计学意义, 吲哚美辛对高淀粉酶血症发生率的合并分析结果为(OR = 0.50, 95%CI: 0.37-0.67, P<0.00001), 表明干预组的高淀粉酶血症发生率低于对照组, 且差异有统计学意义. 通过本研究可进一步表明吲哚美辛作为一种NSAIDs可以降低ERCP术后胰腺炎及术后高淀粉酶血症的发生率. 此外, 经直肠给药的药物浓度于30-90 min达峰浓度, 其生物利用度为100%, 而经口途径药物达峰值约2 h, 生物利用度仅为直肠给药的50%-60%[38], 且投入-效益比明显(美国平均治疗每个PEP病例需多花费5700美元, 而预防性使用消炎痛仅需2美元)[25]. 为此, 拟行ERCP的患者术前常规禁饮禁食, 而直肠给药具有起效快、减少NSAIDs对胃肠道的不良反应、经济低廉等优点, 选择该药物对PEP进行预防, 有望达到减少PEP的发生率、提高ERCP的诊疗水平及安全性、缩短患者的住院时间、减轻患者的精神心理和经济负担及减少医疗资源的耗费等预期目的.
目前经内镜逆行胰胆管造影术(endoscopic retrograde cholangio-pancreatography, ERCP)术后胰腺炎(post-endoscopic retrograde cholangiopancreatography pancreatitis, PEP)的发生仍为ERCP术后最常见的严重并发症之一, 其发生与磷脂酶A2(phospholipase A2, PLA2)及环氧酶有关. 吲哚美辛是一种具有抑制PLA2及环氧酶作用的非甾体类抗炎药非甾体类抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs), 有可能降低PEP及术后高淀粉酶血症的发生率.
郭晓钟,教授, 中国人民解放军沈阳军区总医院消化内科
PLA2、环氧酶、中性粒细胞及内皮细胞相互作用在胰腺炎的发生机制中被认为起到重要的作用. NSAIDs是强效PLA2及环氧酶抑制剂, 其中吲哚美辛在多项临床对照试验中显示可降低PEP及术后高淀粉酶血症的发生率.
欧洲胃肠内镜协会在ERCP术后胰腺炎的预防指南中指出: 使用NSAIDs双氯芬酸或吲哚美辛100 mg已被证明可以有效预防并降低PEP的发病率(证据水平1++), 并建议ERCP术前或术后常规直肠给药双氯芬酸或吲哚美辛100 mg(建议A级).
本文采用Meta分析的方法对非甾体类抗炎药吲哚美辛预防经内镜逆行胰胆管造影PEP的有效性进行评价, 共纳入11个随机对照试验研究, 涉及2718例病例, 针对该药物预防PEP的效果进行统计学分析, 并对术后高淀粉酶血症的发生率进行亚组分析.
吲哚美辛经直肠给药具有起效快、生物利用度高、胃肠道不良反应少、经济低廉等优点, 有望达到减少PEP的发生率、提高ERCP的诊疗水平及安全性、缩短患者的住院时间、减轻患者的精神心理和经济负担及减少医疗资源的耗费等预期目的.
磷脂酶A2: 一种能催化磷脂甘油分子上二位酰基的水解酶, 亦是花生四烯酸、前列腺素及血小板活化因子等生物活性物质生成的限速酶, 所产生的脂质介质在炎症和组织损伤时膜通道的活化、信息传递、血流动力学及病理生理过程中, 以及在调节细胞内外代谢中起关键性作用.
本文采取Meta分析的方法对吲哚美辛的预防作用给出了肯定的结论, 是一种简单、经济、给药途径方便的预防方法, 值得在临床上推广应用.
编辑: 田滢 电编: 闫晋利
| 1. | Cotton PB, Lehman G, Vennes J, Geenen JE, Russell RC, Meyers WC, Liguory C, Nickl N. Endoscopic sphincterotomy complications and their management: an attempt at consensus. Gastrointest Endosc. 1991;37:383-393. [PubMed] |
| 2. | Montaño Loza A, García Correa J, González Ojeda A, Fuentes Orozco C, Dávalos Cobián C, Rodríguez Lomelí X. [Prevention of hyperamilasemia and pancreatitis after endoscopic retrograde cholangiopancreatography with rectal administration of indomethacin]. Rev Gastroenterol Mex. 2006;71:262-268. [PubMed] |
| 3. | Montaño Loza A, Rodríguez Lomelí X, García Correa JE, Dávalos Cobián C, Cervantes Guevara G, Medrano Muñoz F, Fuentes Orozco C, González Ojeda A. [Effect of the administration of rectal indomethacin on amylase serum levels after endoscopic retrograde cholangiopancreatography, and its impact on the development of secondary pancreatitis episodes]. Rev Esp Enferm Dig. 2007;99:330-336. [PubMed] |
| 4. | Sotoudehmanesh R, Khatibian M, Kolahdoozan S, Ainechi S, Malboosbaf R, Nouraie M. Indomethacin may reduce the incidence and severity of acute pancreatitis after ERCP. Am J Gastroenterol. 2007;102:978-983. [PubMed] [DOI] |
| 7. | 徐 俊荣, 楚 有良, 韩 坤, 宋 瑛, 张 宁霞, 方 雅丽. 吲哚美辛在预防ERCP术后胰腺炎中作用的研究. 胃肠病学和肝病学杂志. 2011;20:858-860. |
| 8. | Döbrönte Z, Toldy E, Márk L, Sarang K, Lakner L. [Effects of rectal indomethacin in the prevention of post-ERCP acute pancreatitis]. Orv Hetil. 2012;153:990-996. [PubMed] [DOI] |
| 9. | Elmunzer BJ, Scheiman JM, Lehman GA, Chak A, Mosler P, Higgins PD, Hayward RA, Romagnuolo J, Elta GH, Sherman S. A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis. N Engl J Med. 2012;366:1414-1422. [PubMed] [DOI] |
| 10. | 薛 冬云, 赵 治香, 曲 少贤. 非甾体类抗炎药对内镜下逆行性胰胆管造影术后急性胰腺炎的预防作用. 中国中西医结合消化杂志. 2012;20:347-348. |
| 12. | 林 涛, 周 毅, 王 均, 姚 茹, 姜 莉, 方 如塘, 王 苏丽, 谢 艳. 吲哚美辛预防经内镜逆行胰胆管造影术后胰腺炎和高淀粉酶血症的临床研究. 中华消化内镜杂志. 2012;29:185-187. |
| 13. | Freeman ML, DiSario JA, Nelson DB, Fennerty MB, Lee JG, Bjorkman DJ, Overby CS, Aas J, Ryan ME, Bochna GS. Risk factors for post-ERCP pancreatitis: a prospective, multicenter study. Gastrointest Endosc. 2001;54:425-434. [PubMed] |
| 14. | Frank CD, Adler DG. Post-ERCP pancreatitis and its prevention. Nat Clin Pract Gastroenterol Hepatol. 2006;3:680-688. [PubMed] [DOI] |
| 15. | Cooper ST, Slivka A. Incidence, risk factors, and prevention of post-ERCP pancreatitis. Gastroenterol Clin North Am. 2007;36:259-276, vii-viii. [PubMed] [DOI] |
| 16. | Cheng CL, Sherman S, Watkins JL, Barnett J, Freeman M, Geenen J, Ryan M, Parker H, Frakes JT, Fogel EL. Risk factors for post-ERCP pancreatitis: a prospective multicenter study. Am J Gastroenterol. 2006;101:139-147. [PubMed] [DOI] |
| 17. | Gottlieb K, Sherman S. ERCP and biliary endoscopic sphincterotomy-induced pancreatitis. Gastrointest Endosc Clin N Am. 1998;8:87-114. [PubMed] |
| 18. | Andriulli A, Loperfido S, Napolitano G, Niro G, Valvano MR, Spirito F, Pilotto A, Forlano R. Incidence rates of post-ERCP complications: a systematic survey of prospective studies. Am J Gastroenterol. 2007;102:1781-1788. [PubMed] [DOI] |
| 19. | Donnellan F, Byrne MF. Prevention of Post-ERCP Pancreatitis. Gastroenterol Res Pract. 2012;2012:796751. [PubMed] |
| 21. | Funakoshi A, Furukawa M, Yamada Y, Wakasugi H, Abe M, Oogami Y, Shinozaki H. [Clinical studies of serum phospholipase A2 immunoreactivity]. Nihon Shokakibyo Gakkai Zasshi. 1989;86:1136-1140. [PubMed] |
| 22. | Yamamoto K, Shinomura Y, Tojo H, Okamoto M, Tarui S. Serum pancreatic phospholipase A2 and prophospholipase A2 in acute pancreatitis and after endoscopic retrograde pancreatography. Gastroenterol Jpn. 1993;28:679-686. [PubMed] |
| 23. | Kudo I, Murakami M. Phospholipase A2 enzymes. Prostaglandins Other Lipid Mediat. 2002;68-69:3-58. [PubMed] |
| 24. | Seleznev K, Zhao C, Zhang XH, Song K, Ma ZA. Calcium-independent phospholipase A2 localizes in and protects mitochondria during apoptotic induction by staurosporine. J Biol Chem. 2006;281:22275-22288. [PubMed] [DOI] |
| 25. | Elmunzer BJ, Waljee AK, Elta GH, Taylor JR, Fehmi SM, Higgins PD. A meta-analysis of rectal NSAIDs in the prevention of post-ERCP pancreatitis. Gut. 2008;57:1262-1267. [PubMed] [DOI] |
| 26. | Mäkelä A, Kuusi T, Schröder T. Inhibition of serum phospholipase-A2 in acute pancreatitis by pharmacological agents in vitro. Scand J Clin Lab Invest. 1997;57:401-407. [PubMed] [DOI] |
| 27. | Slater D, Kunnathil S, McBride J, Koppala R. Pharmacology of nonsteroidal antiinflammatory drugs and opioids. Semin Intervent Radiol. 2010;27:400-411. [PubMed] [DOI] |
| 28. | Zheng MH, Xia HH, Chen YP. Rectal administration of NSAIDs in the prevention of post-ERCP pancreatitis: a complementary meta-analysis. Gut. 2008;57:1632-1633. [PubMed] |
| 29. | Dumonceau JM, Andriulli A, Deviere J, Mariani A, Rigaux J, Baron TH, Testoni PA. European Society of Gastrointestinal Endoscopy (ESGE) Guideline: prophylaxis of post-ERCP pancreatitis. Endoscopy. 2010;42:503-515. [PubMed] [DOI] |
| 31. | Omata F, Deshpande G, Tokuda Y, Takahashi O, Ohde S, Carr-Locke DL, Jacobs JL, Mine T, Fukui T. Meta-analysis: somatostatin or its long-acting analogue, octreotide, for prophylaxis against post-ERCP pancreatitis. J Gastroenterol. 2010;45:885-895. [PubMed] [DOI] |
| 33. | 张 俊, 李 非. 加贝酯预防ERCP术后胰腺炎的Meta分析. 中国普外基础与临床杂志. 2012;19:48-57. |
| 34. | Zhang ZF, Yang N, Zhao G, Zhu L, Zhu Y, Wang LX. Preventive effect of ulinastatin and gabexate mesylate on post-endoscopic retrograde cholangiopancreatography pancreatitis. Chin Med J (Engl). 2010;123:2600-2606. [PubMed] |
| 35. | Chen B, Fan T, Wang CH. A meta-analysis for the effect of prophylactic GTN on the incidence of post-ERCP pancreatitis and on the successful rate of cannulation of bile ducts. BMC Gastroenterol. 2010;10:85. [PubMed] [DOI] |
| 36. | Shao LM, Chen QY, Chen MY, Cai JT. Nitroglycerin in the prevention of post-ERCP pancreatitis: a meta-analysis. Dig Dis Sci. 2010;55:1-7. [PubMed] [DOI] |
| 37. | Bai Y, Gao J, Shi X, Zou D, Li Z. Prophylactic corticosteroids do not prevent post-ERCP pancreatitis: a meta-analysis of randomized controlled trials. Pancreatology. 2008;8:504-509. [PubMed] [DOI] |
| 38. | Dai HF, Wang XW, Zhao K. Role of nonsteroidal anti-inflammatory drugs in the prevention of post-ERCP pancreatitis: a meta-analysis. Hepatobiliary Pancreat Dis Int. 2009;8:11-16. [PubMed] |