修回日期: 2010-10-18
接受日期: 2010-10-26
在线出版日期: 2010-12-28
靶向EGFR的单克隆抗体西妥昔单抗和帕尼单抗的问世大大拓宽了转移性结直肠肿瘤疗效, 而当人们意识到使用免疫组织化学技术检测EGFR蛋白表达阳性与应用EGFR单抗治疗的疗效并没有相关性, 便致力于可能的疗效预测标志物的研究. EGFR信号转导系统下游的例如K-ras、BRAF、PIK3CA的基因突变, 以及肿瘤抑制基因PTEN的失活都成了研究的热点. 在结直肠癌中, K-ras基因突变率为35%-45%, 已成为EGFR单克隆抗体治疗转移性结直肠癌的主要疗效预测标志物. 另外, 在K-ras野生型基因的患者中, BRAF、PIK3CA基因突变以及PTEN的缺失表达, 都可能与EGFR单克隆抗体的耐药有关, 但在这些可能的疗效预测标志物被运用到临床实践中前, 还需进一步地研究以明确他们的价值, 以期在选择适合接受EGFR单克隆抗体的患者中起到更大的作用. 而K-ras基因突变被作为治疗前的疗效预测标志物, 则是开创了转移性结直肠癌个体化治疗的第一步.
引文著录: 施敏, 张俊, 朱正纲. EGFR单抗治疗晚期结直肠癌的疗效预测标志物的研究进展. 世界华人消化杂志 2010; 18(36): 3831-3837
Revised: October 18, 2010
Accepted: October 26, 2010
Published online: December 28, 2010
The emergence of monoclonal antibodies targeting the epidermal growth factor receptor (EGFR), such as panitumumab and cetuximab, has expanded the range of treatment options for metastatic colorectal cancer. The realization that detection of positive EGFR expression by immunostaining does not reliably predict clinical outcome of EGFR-targeted treatment has led to an intense search for alternative predictive biomarkers. Oncogenic activation of signaling pathways downstream of the EGFR, such as K-ras, BRAF or PIK3CA mutations, or inactivation of the PTEN tumor suppressor gene is central to the progression of colorectal cancer. Tumor K-ras mutations, which may be present in 35%-45% of patients with colorectal cancer, have emerged as an important predictive marker of resistance to panitumumab or cetuximab treatment. In addition, among colorectal tumors carrying wild-type K-ras, mutation of BRAF or PIK3CA or loss of PTEN expression may be associated with resistance to EGFR-targeted monoclonal antibody treatment, although these additional biomarkers require further validation before incorporation into clinical practice. Additional knowledge of the molecular basis for sensitivity or resistance to EGFR-targeted monoclonal antibodies will allow the development of new treatment algorithms to identify patients who are most likely to respond to treatment and could also provide rationale for combining therapies to overcome primary resistance. The use of K-ras mutations as a selection biomarker for anti-EGFR monoclonal antibody (eg, panitumumab or cetuximab) treatment is the first major step toward individualized treatment for patients with metastatic colorectal cancer.
- Citation: Shi M, Zhang J, Zhu ZG. Biomarkers predicting clinical response to EGFR-targeted monoclonal antibody therapy in patients with metastatic colorectal cancer. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3831-3837
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3831.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3831
我国结直肠癌(colorectal cancer, CRC)发病率不断上升, 尽管对其病因学研究和以手术切除、放射治疗和化学药物治疗为主的多学科综合治疗取得一定进展, 但进一步的疗效提高仍面临巨大挑战. 最近, 个体差异与药物治疗疗效的关系日益受到重视. 随着循证医学和转化型研究地不断发展, 个体化治疗日益成为CRC临床治疗及基础研究的重点, 其中尤以基于肿瘤发生发展机制的分子靶向治疗发展最快.
表皮生长因子受体(epidermal growth factor receptor, EGFR)是实体瘤分子靶向治疗的重要靶点之一. EGFR是具有配体依赖性的酪氨酸激酶活性的跨膜糖蛋白家族, 存在于除造血干细胞外的大多数细胞中, 在CRC、乳腺癌、胰腺癌、前列腺癌和非小细胞肺癌等多种肿瘤中均呈过度表达. EGFR过度激活可促使恶性肿瘤细胞增殖、抑制凋亡、促进肿瘤血管生成和转移.
目前, 已有西妥昔单抗和帕尼单抗2种EGFR单抗获准用于CRC的临床治疗. 前者为人鼠嵌合性IgG1型抗体, 较天然配体亲和力高100倍以上, 通过与受体胞外区结合, 导致受体内化、降解、抑制EGFR信号转导, 并通过抗体依赖的细胞毒(antibody dependent cytotoxicity, ADCC)效应杀伤肿瘤细胞. 在早期开展的EGFR单抗多项临床研究中, 均将肿瘤组织EGFR免疫组织化学染色阳性作为入组标准. 最近发现, EGFR蛋白表达与EGFR单抗疗效间并无相关性[1]. 这一发现促使人们致力于研究可能的疗效预测分子, 以便确定哪类患者能从EGFR单抗治疗中获益. 本文就EGFR单抗治疗晚期CRC的疗效预测标志物的研究进展综述如下.
目前使用较多的分子标志物大致可分为疗效预测标志物(predictive marker)和预后判断标志物(prognostic marker)2种. 前者是预测某一个特定治疗药物疗效的标志物, 为临床选用何种药物及何种组合治疗提供信息; 而预后判断标志物则是判断患者预后的指标, 有助于指导临床是否需要及何时开始治疗. 就EGFR单抗治疗领域而言, 目前公认的疗效预测标志物为皮疹和K-ras基因突变状态.
西妥昔单抗的注册研究-BOND-1研究比较了含伊立替康方案一线化疗失败的转移性结直肠肿瘤患者, 二线使用伊立替康或伊立替康联合西妥昔单抗的疗效. 结果发现, 皮疹严重程度与临床疗效明显相关; 皮疹越多, 疗效越好[2], 嗣后的多个研究均重复了这一现象. 为进一步验证皮疹程度与疗效的关系, 发起了EVEREST研究[3], 共计入组166例伊立替康治疗失败的患者, 先接受标准剂量的西妥昔单抗联合伊立替康治疗, 其中89例0-1度皮疹者在第22天时随机再分为西妥昔单抗标准剂量组和剂量递增组, 后者逐步增加西妥昔单抗剂量, 直至患者耐受性良好且皮疹程度升至2级, 最大剂量为500 mg/m2. 结果显示, 剂量递增组3-4级皮肤毒性发生率明显升高, 有效率亦明显高于标准剂量组(30% vs 13%, P<0.05).
特征性的"痤疮样"皮疹是一个较理想的临床疗效预测指标. 但鉴于皮疹的发生只有在用药后方能观察到, 与其说这是疗效预测指标, 倒不如说是提示药物有效性的临床征兆更为恰当.
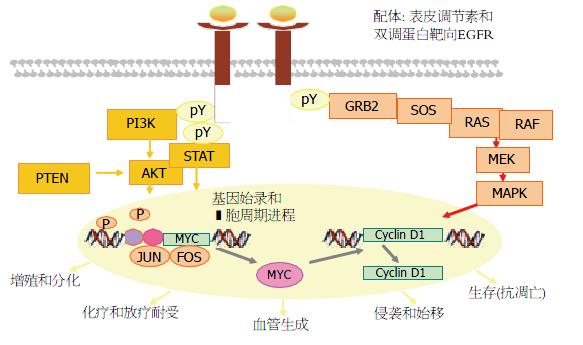
K-ras基因是实体瘤中突变频率较高的癌基因, 属ras癌基因家族, 10%-20%的肿瘤发生与K-ras异常有关. 有丝分裂活化蛋白激酶(mitogen-activated protein kinase, RAS-RAF-MARK)和磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)信号通路所传递的细胞信号经不同接头蛋白磷酸化后, 通过转录因子调控细胞生长、分化和凋亡, 并在肿瘤发生及发展中起重要作用(图1)[4].
Andreyev等[5,6]开展RASCAL和RASCALⅡ研究, 旨在评价K-ras突变状态作为CRC预后判断标志物的意义. 结果显示, CRC中K-ras突变率为37.3%, 其中80.8%发生在12密码子. K-ras突变者治疗失败(复发或死亡)的风险升高25%(HR = 1.25; P<0.001), 死亡风险升高22%(HR = 1.22; P = 0.004). K-ras基因不同密码子突变的预后意义亦各有不同, 如密码子12甘氨酸突变为缬氨酸的突变率为8.6%, 是独立不良预后因素. 突变者的治疗失败风险升高30%(HR = 1.3, P = 0.004), 死亡风险升高23%(HR = 1.23, P= 0.008). 缬氨酸突变只是Duke's C期患者的不良预后因素, 而对Duke's B无影响. 治疗失败风险升高50%(HR = 1.5, P = 0.0076), 死亡风险升高45%(HR = 1.45, P = 0.02).
K-ras基因突变后, 可自主激活EGFR信号转导途径的下游通路, 而无需胞外EGF信号刺激. 故一旦K-ras基因突变, 即可导致肿瘤对EGFR单抗耐药. 其他可能的相关机制还包括: K-ras基因突变可上调VEGF表达、激活肿瘤干细胞、上调DNA甲基化、抑制抑癌基因及促凋亡基因表达, 上调DNA修复基因等[7-9].
CRYSTAL研究是一项纳入1 000余例患者的3期临床研究, 证实了西妥昔单抗联合FOLFIRI方案一线治疗转移性结直肠癌(metastatic colorectal cancer, mCRC)疗效明显优于FOLFIRI方案. 分层分析显示, K-ras野生型者可从西妥昔单抗中获益显著, 而突变者则否[10](表1). 无独有偶, 另一项联合FOLFOX方案一线治疗mCRC的2期临床研究(OUPS)亦获类似结果; 甚者, K-ras突变者在化疗基础上加用西妥昔单抗非但不能获益, 反而降低疗效[11]. 包括帕尼单抗在内的其他抗EGFR单抗3期临床研究中, 均观察到疗效与K-ras突变状态的相关性[12,13].
| CRYSTAL K-ras wt | OPUS K-ras wt | |||
| FOLFIRI(n = 350) | Cetuximab+FOLFIRI(n = 316) | FOLFOX4(n = 97) | Cetuximab+FOLFOX4(n = 82) | |
| ORR(%) | 39.7 | 57.3 | 34.0 | 57.3 |
| P值 | <0.0001 | 0.0027 | ||
| mPFS(mo) | 8.4 | 9.9 | 7.2 | 8.3 |
| HR | 0.696 | 0.567 | ||
| P值 | 0.0012 | 0.0064 | ||
| OS(mo) | 20.0 | 23.5 | 18.5 | 22.8 |
| HR | 0.796 | 0.855 | ||
| P值 | 0.0094 | 0.3854 | ||
EVERSET研究发现, 在伊立替康耐药的mCRC患者中, K-ras野生型者可从西妥昔单抗治疗中显著获益; 对突变型患者, 即使西妥昔单抗剂量增加, 也不能提高客观缓解率[6].
总之, 无论是单药应用还是联合化疗, K-ras均是预测EGFR单抗疗效的独立分子标志物. 就检测技术而言, 基于DNA水平的基因突变分析, 较基于蛋白质水平的免疫组织化学检测更为合理[1]. 原因包括: (1)与蛋白质在标本处理过程中受固定剂、脱水剂、包埋试剂和储存条件等诸多因素影响不同, DNA在石蜡包埋组织中的结构相对保持稳定; (2)基因突变检测只有野生型和突变型2种结果, 清晰明了, 而免疫组织化学染色强度和染色比例的评判结果则受较多人为因素的影响; (3)鉴于约40%的结肠直肠肿瘤患者可发生K-ras基因突变. 且为结肠直肠肿瘤发生、发展过程中出现较早期的事件, 故在原发灶和转移灶中均可检测到基因突变[3,14], 标本选择余地较大. Santini等[15]检测了99例结肠直肠肿瘤原发灶和转移灶中的K-ras突变情况, 发现仅有4例(4%)表达不一致; (4)绝大多数的K-ras基因突变位点仅限于12、13、61这3个密码子, 用PCR技术即可检出, 无需进行繁杂的多个外显子测序, 从技术操作上也较为简便.
K-ras突变现已被公认为EGFR单抗的疗效预测标志物. 但即便是K-ras野生型者, 其总体反应率亦不足70%. 因此, 如何找到K-ras野生型患者的耐药标志物, 成为下一步的主要研究任务.
Di Nicolantonio等[16]回顾性分析了113例接受帕尼单抗或西妥昔单抗作为二线或三线治疗的mCRC患者资料, 并检测了其中79例的BRAF V600E突变情况. 发现BRAF V600E突变型者(n = 11), 无一对帕尼单抗或西妥昔单抗治疗有效. 而BRAF V600E野生型者(n = 68), 其对帕尼单抗或西妥昔单抗治疗的总体反应率为32%(P = 0.029). 且BRAF V600E突变性者的无进展生存时间(progression free survival, PFS)与总生存时间(overall survival, OS)均劣于BRAF野生型者(P<0.001)[16]. Loupakis等[17]报道了87例K-ras野生型mCRC患者接受西妥昔单抗联合伊立替康治疗, 回顾性分析BRAF基因状态与疗效之间的关系, 其中13例为BRAF V600E突变型者, 结果发现无1例有效, 与此相对的是, 74例BRAF V600E野生型者中, 有24例对治疗有效(P = 0.016).
同样, 2009年ASCO会议报道了对CRYSTAL研究入组患者BRAF基因状态的回顾性研究[18], 共检测了625例患者的BRAF基因突变状态, 其中59例(9%)为突变型, 未发现K-ras与BRAF双突变者. 回顾性分析显示, 在K-ras/BRAF均为野生型的患者中, 西妥昔单抗联合FOLFIRI组与单用FOLFIRI组相比, 前者PFS、客观反应率(objective response rate, ORR)均有显著提高, OS有延长趋势. 而在BRAF为突变型的患者中, 两组的疗效(OS、PFS、ORR)均差于BRAF野生型患者(表2). 因此, 2010年NCCN结直肠癌临床实践指南也做出了修改, 认为尽管目前的研究数据还不一致, 但存在BRAF V600E突变的患者似乎不太可能从抗EGFR单抗中获益.
| K-ras wt/BRAF wt(n = 566) | K-ras wt/BRAF mt(n = 59) | |||
| FOLFIRI(n = 289) | Cetuximab+FOLFIRI(n = 277) | FOLFOX4(n = 33) | Cetuximab+FOLFOX4(n = 26) | |
| ORR(%) | 42.6 | 61.0 | 15.2 | 19.2 |
| P值 | <0.0001 | 0.9136 | ||
| mPFS(mo) | 8.8 | 10.9 | 5.6 | 8.0 |
| HR | 0.679 | 0.934 | ||
| P值 | 0.0016 | 0.8656 | ||
| OS(mo) | 21.6 | 25.1 | 10.3 | 14.1 |
| HR | 0.830 | 0.908 | ||
| P值 | 0.0549 | 0.7440 | ||
10号染色体同源丢失性磷酸酶与张力蛋白(phosphatase and tensin homology deleted on chromosome ten, PTEN)基因是被发现的人类第一个有磷酸酶活性的抑癌基因, 可使PI3K信号途径中的主要信号分子磷脂酰肌醇3, 4, 5-三磷酸(phosphatidylinositol 3, 4, 5-triphosphate, PIP3)等磷脂酰肌醇去磷酸化, 是负向调节肿瘤的关键分子. 对PI3K家族全部16个成员的激酶结构域外显子编码区域进行序列分析显示, PIK3CA是唯一可发生体细胞突变而致癌的基因, 在CRC中突变率高达32%[19].
体外研究发现, 呈PIK3CA基因突变或PTEN失表达状态的结直肠肿瘤细胞系对西妥昔单抗耐药[20]. 在临床观察中, 也发现PIK3CA突变伴PTEN失表达(P = 0.02)或仅为PTEN失表达(P<0.001)者, 接受西妥昔单抗治疗疗效较差[21,22]. Frattini等[22]报道了11例PTEN失表达的mCRC患者中, 无一对西妥昔单抗治疗有反应. 相反, 在16例完整表达PTEN者中, 西妥昔单抗反应率高达63%(10/16). Sartore-Bianchi等[23]观察了110例接受EGFR单抗治疗的mCRC患者, 发现无论PTEN是否表达, PIK3CA突变均与PFS呈负相关(P = 0.035), PIK3CA基因突变伴PTEN失表达者OS显著缩短(P = 0.005). 该研究还提示, K-ras基因突变, 同时合并PIK3CA基因突变或PTEN失表达, 对EGFR靶向治疗无反应者高达70%[23]. 因此PIK3CA基因突变或PTEN失表达或许可成为潜在的EGFR单抗疗效预测标志物, 需通过大样本临床研究验证.
部分结直肠肿瘤表现为EGFR基因扩增, 由此导致EGFR蛋白高表达, 通过荧光原位杂交(fluorescence in situhybridization, FISH)或显色原位杂交(chromogenic in situ hybridization)技术, 可检测EGFR基因拷贝数[24]. Moroni等[25]用FISH技术检测31例mCRC组织, 发现在抗EGFR单抗治疗有反应的9例中, 8例呈EGFR拷贝数增加; 而在治疗无效的21例患者中, 仅1例为EGFR高度扩增.
但EGFR扩增状态作为疗效预测标志物的价值尚未获得共识. Italiano等[26]检测了39例接受西妥昔单抗治疗的mCRC组织, 发现EGFR基因拷贝数与临床有效率、PFS及OS均无明显相关. Lenz等[27]用RT-PCR法检测346例mCRC组织的结果也显示, EGFR基因拷贝数与临床有效率及PFS无关, 但与OS相关(P = 0.03). 基于FISH检测结果, 每个细胞核中<3个EGFR基因拷贝的患者, 对EGFR单抗治疗疗效不佳. 一项3期临床研究分析显示, 平均每个细胞核中<2.47个基因拷贝的患者, 帕尼单抗治疗无一有效; 而20例>2.47个基因拷贝数者中, 有效率则高达30%(6/20). 平均每个细胞核中<2.5个基因拷贝者. PFS和OS均明显缩短(P = 0.039, 0.015), 提示该指标作为预后判断标志物的价值[28].
就EGFR基因拷贝数检测技术而言, 有必要统一EGFR基因扩增的检测方法, 并开展大样本研究, 以进一步验证该指标作为EGFR单抗治疗疗效预测标志物的价值.
表皮调节素(epiregulin)和双调蛋白(amphiregulin)是天然的EGFR配体, 通过自分泌形式促进肿瘤生长. 表皮调节素或双调蛋白mRNA高表达与西妥昔单抗疗效相关[29]. 接受EGFR单抗治疗后, 表皮调节素高表达组与低表达组的中位PFS分别为103.5和57 d(P<0.001), 双调蛋白高表达组和低表达组的中位PFS分别为115.5和57 d(P<0.001)[29]. 在接受西妥昔单抗治疗的K-ras野生型患者中, 表皮调节素或双调蛋白高表达者的疾病控制率明显高于突变型者(P = 0.0003)[29]. Khambata-Ford等[29]认为表皮调节素和双调蛋白的表达水平, 有望成为继K-ras突变状态后, 另一个有价值的疗效预测标志物.
K-ras基因突变已是公认的EGFR单抗疗效预测标志物, NCCN和欧洲成人用药委员会(committee for medicinal products for human use of the European medicines agency, CHMP)指南均建议, 在确诊mCRC时就应该检测K-ras基因状态, 并据此选择相应的靶向治疗方案. BRAF基因状态有望成为EGFR单抗的另一疗效预测标志物. PTEN失表达、PI3K突变、EGFR扩增、EGFR配体过表达等其他指标, 都是潜在的疗效预测标志物, 应予深入研究. 以治疗目的为出发点的优化治疗方案选择除基于大样本的循证医学证据外, 基于各种相关标志物(包括疗效预测标志物与预后判断标志物)检测的个体化治疗, 有望成为将来的发展方向.
我国结直肠癌(CRC)发病率不断上升, 尽管对其病因学研究和以手术切除、放射治疗和化学药物治疗为主的多学科综合治疗取得一定进展, 但进一步的疗效提高仍面临巨大挑战. 最近, 个体差异与药物治疗疗效的关系日益受到重视.
房林, 副教授, 同济大学附属上海市第十人民医院普外科
随着循证医学和转化型研究地不断发展, 个体化治疗日益成为结直肠癌临床治疗及基础研究的重点, 其中尤以基于肿瘤发生发展机制的分子靶向治疗发展最快. EGFR信号转导系统下游, 如K-ras、BRAF、PIK3CA的基因突变, 以及肿瘤抑制基因PTEN的失活都成了研究的热点.
Santini等检测了99例结肠直肠肿瘤原发灶和转移灶中的K-ras突变情况, 发现仅有4例(4%)表达不一致.
BRAF基因状态有望成为EGFR单抗的另一疗效预测标志物. PTEN失表达、PI3K突变、EGFR扩增、EGFR配体过表达等其他指标, 都是潜在的疗效预测标志物, 基于各种相关标志物检测的个体化治疗, 有望成为将来的发展方向.
本文新颖性较好, 对了解EGFR单抗治疗方面的临床及基础研究有一定的参考价值.
编辑:李薇 电编:何基才
| 1. | Messersmith WA, Ahnen DJ. Targeting EGFR in colorectal cancer. N Engl J Med. 2008;359:1834-1836. [PubMed] [DOI] |
| 2. | Cunningham D, Humblet Y, Siena S, Khayat D, Bleiberg H, Santoro A, Bets D, Mueser M, Harstrick A, Verslype C. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004;351:337-345. [PubMed] [DOI] |
| 3. | Meyerhardt JA, Mayer RJ. Systemic therapy for colorectal cancer. N Engl J Med. 2005;352:476-487. [PubMed] [DOI] |
| 4. | Andreyev HJ, Norman AR, Cunningham D, Oates JR, Clarke PA. Kirsten ras mutations in patients with colorectal cancer: the multicenter "RASCAL]study. J Natl Cancer Inst. 1998;90:675-684. [PubMed] [DOI] |
| 5. | Andreyev HJ, Norman AR, Cunningham D, Oates J, Dix BR, Iacopetta BJ, Young J, Walsh T, Ward R, Hawkins N. Kirsten ras mutations in patients with colorectal cancer: the 'RASCAL II' study. Br J Cancer. 2001;85:692-696. [PubMed] [DOI] |
| 6. | Zachary I, Gliki G. Signaling transduction mechanisms mediating biological actions of the vascular endothelial growth factor family. Cardiovasc Res. 2001;49:568-581. [PubMed] [DOI] |
| 7. | Haigis KM, Kendall KR, Wang Y, Cheung A, Haigis MC, Glickman JN, Niwa-Kawakita M, Sweet-Cordero A, Sebolt-Leopold J, Shannon KM. Differential effects of oncogenic K-Ras and N-Ras on proliferation, differentiation and tumor progression in the colon. Nat Genet. 2008;40:600-608. [PubMed] [DOI] |
| 8. | Patra SK. Ras regulation of DNA-methylation and cancer. Exp Cell Res. 2008;314:1193-1201. [PubMed] [DOI] |
| 9. | Van Cutsem E, Köhne CH, Hitre E, Zaluski J, Chang Chien CR, Makhson A, D'Haens G, Pintér T, Lim R, Bodoky G. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360:1408-1417. [PubMed] [DOI] |
| 10. | Bokemeyer C, Bondarenko I, Makhson A, Hartmann JT, Aparicio J, de Braud F, Donea S, Ludwig H, Schuch G, Stroh C. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol. 2009;27:663-671. [PubMed] [DOI] |
| 11. | Karapetis CS, Khambata-Ford S, Jonker DJ, O'Callaghan CJ, Tu D, Tebbutt NC, Simes RJ, Chalchal H, Shapiro JD, Robitaille S. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med. 2008;359:1757-1765. [PubMed] [DOI] |
| 12. | Amado RG, Wolf M, Peeters M, Van Cutsem E, Siena S, Freeman DJ, Juan T, Sikorski R, Suggs S, Radinsky R. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:1626-1634. [PubMed] [DOI] |
| 13. | Fearon ER, Vogelstein B. A genetic model for colorectal tumorigenesis. Cell. 1990;61:759-767. [PubMed] |
| 14. | Santini D, Loupakis F, Vincenzi B, Floriani I, Stasi I, Canestrari E, Rulli E, Maltese PE, Andreoni F, Masi G. High concordance of KRAS status between primary colorectal tumors and related metastatic sites: implications for clinical practice. Oncologist. 2008;13:1270-1275. [PubMed] [DOI] |
| 15. | Di Nicolantonio F, Martini M, Molinari F, Sartore-Bianchi A, Arena S, Saletti P, De Dosso S, Mazzucchelli L, Frattini M, Siena S. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol. 2008;26:5705-5712. [PubMed] [DOI] |
| 16. | Loupakis F, Ruzzo A, Cremolini C, Vincenzi B, Salvatore L, Santini D, Masi G, Stasi I, Canestrari E, Rulli E. KRAS codon 61, 146 and BRAF mutations predict resistance to cetuximab plus irinotecan in KRAS codon 12 and 13 wild-type metastatic colorectal cancer. Br J Cancer. 2009;101:715-721. [PubMed] [DOI] |
| 17. | Samuels Y, Wang Z, Bardelli A, Silliman N, Ptak J, Szabo S, Yan H, Gazdar A, Powell SM, Riggins GJ. High frequency of mutations of the PIK3CA gene in human cancers. Science. 2004;304:554. [PubMed] [DOI] |
| 18. | Jhawer M, Goel S, Wilson AJ, Montagna C, Ling YH, Byun DS, Nasser S, Arango D, Shin J, Klampfer L. PIK3CA mutation/PTEN expression status predicts response of colon cancer cells to the epidermal growth factor receptor inhibitor cetuximab. Cancer Res. 2008;68:1953-1961. [PubMed] [DOI] |
| 19. | Perrone F, Lampis A, Orsenigo M, Di Bartolomeo M, Gevorgyan A, Losa M, Frattini M, Riva C, Andreola S, Bajetta E. PI3KCA/PTEN deregulation contributes to impaired responses to cetuximab in metastatic colorectal cancer patients. Ann Oncol. 2009;20:84-90. [PubMed] [DOI] |
| 20. | Frattini M, Saletti P, Romagnani E, Martin V, Molinari F, Ghisletta M, Camponovo A, Etienne LL, Cavalli F, Mazzucchelli L. PTEN loss of expression predicts cetuximab efficacy in metastatic colorectal cancer patients. Br J Cancer. 2007;97:1139-1145. [PubMed] [DOI] |
| 21. | Sartore-Bianchi A, Martini M, Molinari F, Veronese S, Nichelatti M, Artale S, Di Nicolantonio F, Saletti P, De Dosso S, Mazzucchelli L. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFR-targeted monoclonal antibodies. Cancer Res. 2009;69:1851-1857. [PubMed] [DOI] |
| 22. | Ooi A, Takehana T, Li X, Suzuki S, Kunitomo K, Iino H, Fujii H, Takeda Y, Dobashi Y. Protein overexpression and gene amplification of HER-2 and EGFR in colorectal cancers: an immunohistochemical and fluorescent in situ hybridization study. Mod Pathol. 2004;17:895-904. [PubMed] [DOI] |
| 23. | Moroni M, Veronese S, Benvenuti S, Marrapese G, Sartore-Bianchi A, Di Nicolantonio F, Gambacorta M, Siena S, Bardelli A. Gene copy number for epidermal growth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol. 2005;6:279-286. [PubMed] [DOI] |
| 24. | Italiano A, Follana P, Caroli FX, Badetti JL, Benchimol D, Garnier G, Gugenheim J, Haudebourg J, Keslair F, Lesbats G. Cetuximab shows activity in colorectal cancer patients with tumors for which FISH analysis does not detect an increase in EGFR gene copy number. Ann Surg Oncol. 2008;15:649-654. [PubMed] [DOI] |
| 25. | Lenz HJ, Van Cutsem E, Khambata-Ford S, Mayer RJ, Gold P, Stella P, Mirtsching B, Cohn AL, Pippas AW, Azarnia N. Multicenter phase II and translational study of cetuximab in metastatic colorectal carcinoma refractory to irinotecan, oxaliplatin, and fluoropyrimidines. J Clin Oncol. 2006;24:4914-4921. [PubMed] [DOI] |
| 26. | Sartore-Bianchi A, Moroni M, Veronese S, Carnaghi C, Bajetta E, Luppi G, Sobrero A, Barone C, Cascinu S, Colucci G. Epidermal growth factor receptor gene copy number and clinical outcome of metastatic colorectal cancer treated with panitumumab. J Clin Oncol. 2007;25:3238-3245. [PubMed] [DOI] |
| 27. | Khambata-Ford S, Garrett CR, Meropol NJ, Basik M, Harbison CT, Wu S, Wong TW, Huang X, Takimoto CH, Godwin AK. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab. J Clin Oncol. 2007;25:3230-3237. [PubMed] [DOI] |
| 28. | Bianco R, Rosa R, Damiano V, Daniele G, Gelardi T, Garofalo S, Tarallo V, De Falco S, Melisi D, Benelli R. Vascular endothelial growth factor receptor-1 contributes to resistance to anti-epidermal growth factor receptor drugs in human cancer cells. Clin Cancer Res. 2008;14:5069-5080. [PubMed] [DOI] |
| 29. | Lurje G, Nagashima F, Zhang W, Yang D, Chang HM, Gordon MA, El-Khoueiry A, Husain H, Wilson PM, Ladner RD. Polymorphisms in cyclooxygenase-2 and epidermal growth factor receptor are associated with progression-free survival independent of K-ras in metastatic colorectal cancer patients treated with single-agent cetuximab. Clin Cancer Res. 2008;14:7884-7895. [PubMed] [DOI] |