修回日期: 2010-08-10
接受日期: 2010-08-17
在线出版日期: 2010-09-18
目的: 探讨MAPK/ERK1/2细胞信号通路在胰腺癌演化中的作用和机制.
方法: 用不同浓度PD98059处理Panc-1细胞及裸鼠, 采用MTT法观察其对胰腺癌细胞增殖的影响, 利用流式细胞仪检测胰腺癌细胞周期以及细胞凋亡的变化, 使用Hoechst33258染色观察凋亡细胞的形态, 应用Western blot检测裸鼠荷瘤MAPK/ERK1/2通路P-ERK1/2蛋白的表达变化.
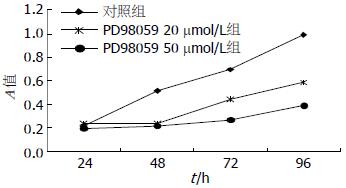
结果: 不同浓度的PD98059均可显著抑制胰腺癌Panc-1细胞的增殖(均P<0.05), 且随着处理时间的延长, PD98059浓度的增加, 其抑制能力逐渐增强. 96 h 50 μmol/L的PD98059抑制Panc-1细胞增殖的能力最强, 其A490与对照相比具有统计学差异(0.391±0.029 vs 0.994±0.057, P<0.05). 此时Panc-1细胞的凋亡率较对照组明显增加(11.77%±1.33% vs 1.13%±0.19%, P<0.05), 而20 μmol/L的PD98059处理后, 细胞凋亡率与对照组无明显增加. PD98059同时可以降低裸鼠荷瘤P-ERK1/2蛋白的表达, 其完全抑制浓度(50 μmol/L)具有最强的抑制能力.
结论: MAPK/ERK1/2信号通路是调控胰腺癌细胞重要的因素之一, 其作用机制与磷酸化的ERK1/2蛋白有关.
引文著录: 胡益群, 司丽娟, 叶震世, 林振和, 柯细松. PD98059对胰腺癌Panc-1细胞株及裸鼠荷瘤增殖、凋亡的影响. 世界华人消化杂志 2010; 18(26): 2756-2761
Revised: August 10, 2010
Accepted: August 17, 2010
Published online: September 18, 2010
AIM: To investigate the effect of PD98059, a specific inhibitor of the mitogen-activated protein kinase (MAPK)/extracellular signal-regulated kinase 1/2 (ERK1/2) signaling pathway, on the apoptosis and proliferation of pancreatic cancer Panc-1 cells and tumor growth in Panc-1-xenografted nude mice.
METHODS: After Panc-1 cells were treated with different doses of PD98059, cell proliferation was measured by MTT assay, cell cycle and apoptosis were detected by flow cytometry, and apoptotic cells were examined by Hoechst 33258 staining. The expression of phosphorylated ERK1/2 in tumors in Panc-1-xenografted nude mice was detected by Western blot.
RESULTS: PD98059 suppressed the proliferation of pancreatic cancer Panc-1 cells in a concentration- and time-dependent manner (P < 0.05). Compared with control cells, the absorbance at 490 nm (A490) was significantly lower (0.391 ± 0.029 vs 0.994 ± 0.057, P < 0.05) and the apoptosis rate was significantly higher (11.77% ± 1.33% vs 1.13% ± 0.19%, P < 0.05) in Panc-1 cells treated with 50 μmol/L PD98059 for 96 h. However, no significant difference was noted in the apoptosis rate between Panc-1 cells treated with 20 μmol/L PD98059 and control cells. PD98059 could restrain the expression of P-ERK1/2 proteins in tumors in Panc-1-xenografted nude mice, and the maximum inhibition was achieved with 50 μmol/L PD98059.
CONCLUSION: The MAPK/ERK1/2 signaling pathway may play an important role in regulating the proliferation and apoptosis of pancreatic cancer cells.
- Citation: Hu YQ, Si LJ, Ye ZS, Lin ZH, Ke XS. Effect of PD98059 on the proliferation and apoptosis of pancreatic cancer Panc-1 cells and tumor growth in Panc-1-xenografted nude mice. Shijie Huaren Xiaohua Zazhi 2010; 18(26): 2756-2761
- URL: https://www.wjgnet.com/1009-3079/full/v18/i26/2756.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i26.2756
流行病学调查资料显示近年来全球范围胰腺癌发病率、死亡率均在上升, 西方国家高于发展中国家[1]. 胰腺癌恶性程度高, 病程隐匿, 早期诊断对治疗、预后极为重要, 目前胰腺癌发病机制仍然不明确, 这给其早期的诊断以及治疗带来很大的困难.
许多学者认为肿瘤发生进展归根到底是由细胞调控机制紊乱造成的[2]. 丝裂原活化蛋白激酶(mitogen activited protein kinase, MAPK)信号通路介导细胞生长、发育、分裂、分化、死亡等过程, 细胞外信号调节激酶(extracellular signal-regulated kinase 1 and 2, ERK1/2)信号通路是MAPK通路的重要组成部分, 调控其转录活性[3]. 一些研究发现肿瘤演化中存在ERK1/2信号通路的活化及过度表达, 但其在胰腺癌中表达及其作用方面的研究甚少, PD98059是MAPK/ERK1/2信号通路特异性抑制剂, 我们通过不同浓度PD98059处理胰腺癌细胞, 探讨胰腺癌细胞中MAPK/ERK1/2信号通路的作用机制, 并为肿瘤早期诊断治疗寻找新的靶点.
PD98059、MTT、抑肽酶(aprotinin)、苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)、Hoechst33258均购自美国Sigma公司. P-ERK1/2、ERK1/2及相应二抗均为Santa Cruz公司产品, 预染Marker、Super ECL Plus Western blot超敏发光液购自北京普利莱基因技术有限公司. PD98059(50 mmol/L储液): 将PD98059黄色粉末5 mg溶于373 μL DMSO, 分装, 避光, -20 ℃冰箱保存. MTT(5 g/L): 称取250 mg MTT, 加50 mL PBS缓冲液, 搅拌30 min, 0.22 μm滤膜过滤, 分装, 4 ℃冰箱保存.
1.2.1 细胞培养: 人胰腺癌Panc-1细胞株由北京协和医院消化内科实验室提供, 细胞培养于10% FBS RPMI 1640培养基, 含两种抗生素: 青霉素和链霉素(浓度均为100 μ/mL), 放置于37 ℃、50 mL/L CO2饱和湿度环境, 每2-3 d换用新鲜培养液, 取对数生长期细胞用于实验.
1.2.2 分组: 对照组为空白对照, 实验组分为PD98059 20 μmol/L组(ERK1/2蛋白半数抑制浓度IC50), PD98059 50 μmol/L组(ERK1/2蛋白完全抑制浓度).
1.2.3 细胞增殖检测: (1)细胞准备: 取对数生长期细胞, 胰酶消化后用完全培养基配成单细胞悬液, 接种于96孔板, 接种细胞密度5×103/孔, 每孔接种体积为200 μL. 每组设4个平行孔. (2)增殖检测(MTT法): 无血清预处理细胞12 h后置CO2细胞培养箱, 继续培养24 h, 实验时每天更换RPMI 1640完全培养基, 分别加入浓度为20 μmol/L、50 μmol/L PD98059, 结束前4 h加入20 μL MTT(5 mg/mL), 37 ℃继续孵育4 h, 终止培养, 吸弃培养液, 每孔加入150 μL DMSO, 振荡10 min, 待甲臢完全溶解后, 在ELISA仪上于490 nm波长读取吸光度. 实验重复3次, 以平均值做剂量时间曲线. (3)凋亡细胞形态: Hoechst 33258染色法观察细胞凋亡. Panc-1细胞爬片, 50 μmol/L PD98059处理细胞, 参照细胞增殖检测结果, 以120 h时段为观察窗, 加入40 g/L多聚甲醛2 mL固定20 min, PBS洗1遍, 加入Hoechst 33258, 室温染色30 min, 将抗荧光衰减封片剂滴到载玻片上, 取出盖玻片倒扣在载玻片上, 封片. 荧光显微镜下观察凋亡细胞形态. 蓝色荧光波长465 nm, 正常细胞核大淡染, 凋亡细胞见核固缩、碎裂及凋亡小体. (4)流式细胞仪PI法检测细胞凋亡百分率、细胞周期各期比率. 根据细胞增殖结果, 选择凋亡检测最佳时间点, 胰酶消化细胞成单一细胞悬液, 转速1 000 r/min, 离心10 min, PBS洗3遍, 加入700 mL/L乙醇5 mL 4 ℃固定过夜, PBS洗2遍, 1 g/L RNAse 37 ℃, 20 mL PI 4 ℃孵育1 h. 实验重复3次, 取平均值.
1.2.4 动物实验: (1)实验动物: 裸鼠品系, BALB/c nu/nu, 5 wk龄, 体质量: 17-21 g. 中国医学科学院北京协和医院动物房提供, SPF级. (2)动物实验器械、用品及试剂: 手术剪, 止血钳, 组织剪, 组织分离镊, 手术刀片. 用品: 培养皿, 吸管, 1 mL注射器, 游标卡尺, 细胞计数板, 1.5 mL离心管. (3)裸鼠胰腺癌荷瘤模型的建立: 12只裸鼠随机分成两组: 对照组和PD98059处理组, 给每只裸鼠编号. 选取对数生长期、状态良好胰腺癌Panc-1细胞, 细胞80%-90%融合时胰酶消化. 无血清培养基清洗2次, 计数板计数细胞, 调整细胞密度至(1-2)×106/0.2 mL. 750 mL/L酒精消毒裸鼠背部, 细胞株混悬液注射入背部皮下. 每3-4 d观察1次, 称量体质量, 2 wk后裸鼠荷瘤长出后, 固定时间测量、记录荷瘤直径、横径和高度. (4)PD98059处理荷瘤模型: 实验组每日在瘤周和瘤体注射PD98059(50 μmol/L), 对照组注射等体积生理盐水. 每日注射前测量、记录瘤体长(a)、短(b)、高径(c). 10 d左右断髓处死裸鼠, 切取肿瘤放于冰袋中. (5)Western blot法检测MAPK/ERK1/2细胞信号通路蛋白. 使用细胞裂解液于冰上裂解PD98059处理和生理盐水处理的荷瘤组织, 收集上清液, 采用福林酚法测定蛋白含量. 上样孔中加入蛋白、上样缓冲液及预染Marker, 5%积层胶电泳8 V/cm, 12%分离胶15 V/cm, PVDF转膜、洗涤, 5% BSA封闭, P-ERK1/2、ERK1/2抗体用TBST稀释(1:1 000), 转移膜及一抗放置50 mL离心管中, 于4 ℃冷室摇床过夜, 加入0.1% TBST洗涤3遍. 每次10 min, 将PVDF置于TBST稀释的二抗(1:5 000)中, 室温振摇60 min. Super ECL Plus Western blot超敏发光液淋洗1-2 min, 在暗室中下曝光, 拍照记录.
统计学处理 每组实验至少重复3次, 实验数据以mean±SD表示, 应用SPSS10.0统计软件进行单因素方差(ANOVA)、组间t检验, P<0.05表示有显著性差异.
与对照组相比, 实验组PD98059 20 μmol/L组、50 μmol/L组Panc-1细胞增殖能力明显降低(P<0.05), 其中以50 μmol/L PD98059增殖抑制作用最强, 其作用具有明显的时间依赖性, 随时间延长增殖抑制作用逐渐增强(图1, 表1).
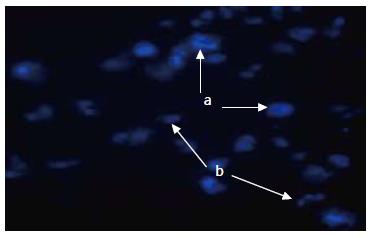
2.2.1 凋亡细胞的形态: 结合细胞增殖结果, 接种Panc-1细胞, 予以PD98059 50 μmol/L处理96 h, 固定后Hoechst 33258染色, 荧光显微镜下观察, 凋亡中晚期细胞核固缩, 核内染色质在局部区域凝集, 致密浓染, 核碎裂出现凋亡小体, 对照组细胞核呈均质状, 淡染(图2).
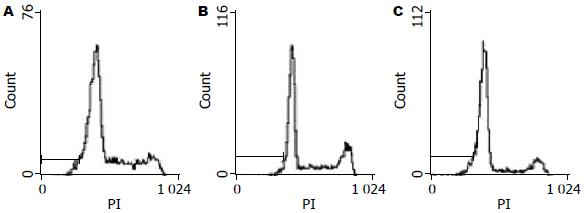
2.2.2 流式细胞仪技术(PI染色)检测Panc-1细胞的凋亡: PD98059 50 μmol/L组细胞凋亡百分率为11.77%±1.33%, 与对照组(1.13%±0.19%)比较差异显著(P<0.05), 而PD98059 20 μmol/L组细胞凋亡百分率为6.63%±1.26%, 虽较对照组有所增加, 但统计学结果显示二者无显著性差异(图3).
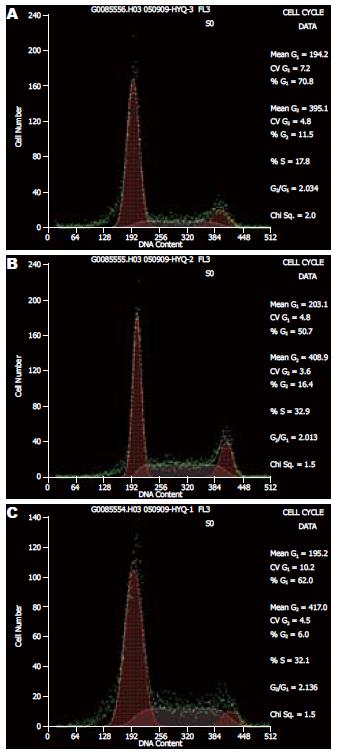
2.2.3 流式细胞仪检测细胞周期的变化: 不同浓度PD98059处理, 均可致Panc-1 G1期细胞百分率增加, DNA S期细胞百分率降低; Panc-1细胞虽然有上述趋势, 但统计学上与对照组相比无显著性差异(图4, 表2).
| 细胞周期 | 对照组 | 20 μmol/L组 | 50 μmol/L组 | P值 |
| G1 | 55.23±6.99 | 53.10±6.61 | - | 0.90 |
| 55.23±6.99 | - | 70.01±0.40 | 0.07 | |
| S | 25.17±7.90 | 30.87±6.06 | - | 0.59 |
| 25.07±7.90 | - | 20.07±3.63 | 0.11 |
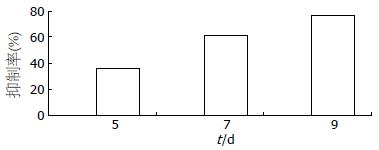
2.3.1 PD98059对胰腺癌Panc-1细胞荷瘤抑瘤率: PD98059(50 μmol/L)处理胰腺癌荷瘤裸鼠, 第3天开始测量瘤体体积, 第9天实验结束, 比较PD98059处理组和对照组荷瘤体积差异, 进行统计学分析, 计算抑瘤率, 结果可见PD98059处理可使肿瘤瘤体缩小, 第7天开始两组出现明显差异, 抑瘤率逐渐升高(图5, 表3).
2.3.2 PD98059对荷瘤的MAPK/ERK1/2信号通路的影响: PD98059(50 μmol/L)处理胰腺癌荷瘤模型第9天, 处死裸鼠, 切取荷瘤组织, 提取总蛋白, Western blot检测实验组及对照组胰腺癌荷瘤MAPK/ERK1/2细胞信号通路功能蛋白的表达情况, 结果发现实验组荷瘤P-ERK1/2蛋白表达明显受到抑制, 而对照组未受影响(图6), 提示MAPK/ERK1/2信号通路与胰腺癌进展相关, 其中P-ERK1/2蛋白可能在其中发挥重要作用.
近年来, 尽管随着外科技术水平的提高、化疗药物的推陈出新以及治疗理念、方式的转变, 胰腺癌治疗较前已有了长足的进步, 但胰腺癌治疗的远期效果仍不令人满意, 基于细胞信号转导通路特定靶点的靶向治疗成为研究热点, 目前正在从基础研究转向临床研究, 并取得了一定的治疗效果, 而MAPK/ERK1/2信号通路是其中最为重要的研究对象和治疗方向[4].
PD98059是MAPK/ERK1/2信号通路特异性抑制剂, MAPK信号通路有促进细胞增殖, 调节基因转录的作用, 是许多肿瘤发生的重要因素[5], 而ERK1/2信号通路是MAPK通路的重要组成部分, 与其他恶性肿瘤类似[6,7], 本实验通过对ERK1/2及其功能成分P-ERK1/2的研究证实, 在胰腺癌Panc-1细胞中存在ERK1/2及功能蛋白P-ERK1/2的活化及过度表达, 同时通过50 μmol/L PD98059下调MAPK/ERK1/2信号通路的表达, 从而使胰腺癌Panc-1细胞增殖明显受到抑制, 提示MAPK/ERK1/2信号通路在胰腺癌进展中发挥着重要作用, 而PD98059作用位点可以成为胰腺癌治疗的靶点. 从组织学上可证明PD98059对裸鼠荷瘤的抑瘤率. 切断MAPK/ERK1/2信号通路可以控制裸鼠胰腺癌荷瘤的快速增殖, 这与一些临床实验研究的结果相近[8,9], P-ERK1/2蛋白作为MAPK/ERK1/2信号通路的功能蛋白, 参与、调节胰腺癌Panc-1细胞的恶性增殖作用, 控制P-ERK1/2蛋白在胰腺癌细胞中的表达, 抑制其磷酸化. 这或许可以成为以MAPK/ERK1/2信号通路为目标的靶向治疗的核心与关键.
细胞凋亡是维持生物体平衡的重要环节, 与细胞生长、分裂和增殖联系紧密. 最近的一项研究也表明, 索拉非尼联合维生素K可通过调控磷酸化ERK1/2及Bcl-2基因表达水平来促进胰腺癌细胞凋亡[10], 提示磷酸化ERK1/2可能与胰腺癌细胞凋亡密切相关, 其可作为联系细胞凋亡与其他肿瘤调控因子或基因的中间环节而存在. 目前的肿瘤实验研究中, 多侧重于ERK1/2通路中ERK1/2蛋白的增殖、转化、分化作用[11,12], 对于ERK1/2蛋白与胰腺癌凋亡确切联系机制, 以及ERK1/2蛋白是否通过改变肿瘤细胞周期来促进细胞凋亡尚不明确. 本实验通过PD98059处理细胞, 检测细胞凋亡百分率、肿瘤细胞周期变化, 观察细胞凋亡大体形态, 结果证实其可阻断或部分阻断MAPK/ERK1/2细胞信号通路, 胰腺癌细胞出现了一定程度的凋亡. 通过Hoechst 33258染色, 荧光显微镜下可以观察到凋亡细胞形态的改变, 同时我们发现经过PD98059处理胰腺癌细胞, 凋亡百分率可以达到10%-15%, 与对照组有明显差异. 这也证明MAPK/ERK1/2细胞信号通路紊乱是胰腺癌发生进展的特定表现[13]. 不过从实验中我们还可以看到, 与其他研究略有不同的是, 即使PD98059最大浓度阻断MAPK/ERK1/2细胞信号通路, 细胞凋亡率还是比较低. 因此我们推测, 在细胞凋亡调节的环节上存在多个因素或多个节点的调控, MAPK/ERK1/2细胞信号通路只是参与了细胞凋亡的调节, 而不是全部调节功能均由其完成, 也就是说以MAPK/ERK1/2细胞信号通路的靶向治疗还不足以完成胰腺癌细胞凋亡或促进其表型的逆转.
细胞周期的调控是一个复杂的过程, 癌基因、抑癌基因均参与其调节, 他们通过其下游的细胞信号通路来发挥作用. 本实验中, 通过对细胞周期的检测, 我们注意到PD98059处理对MAPK细胞信号通路的阻滞作用, 可以促使细胞周期由S期向G1期转化, 而且不论PD98059浓度是否改变均有此趋势, 但作用效果并不显著, 与我们所做的细胞增殖的测定结果不甚一致. 一些抗胰腺癌细胞的体外研究也显示, 单一细胞信号通路靶点的阻滞对胰腺癌细胞并不能达到最佳治疗效果, 如果对多条细胞信号通路的节点联合治疗却能取得的良好疗效[14]. 因此我们设想, 胰腺癌细胞中细胞周期的调控存在多条信号通路, 他们之间相互联系, 共同参与细胞增殖过程调控, 对其中任何一条信号通路的阻断而得到的肿瘤控制作用有限, 为了解其中的机制, 在今后的实验中, 我们应采用多种信号通路抑制剂联合应用, 才能进一步明确胰腺癌细胞周期调控与细胞增殖的内在联系.
通过既往二十余年的研究, 人们不但克隆和鉴定了众多与肿瘤发生密切相关的癌基因和抑癌基因, 使人们对肿瘤的发生有了更深入的认识, 同时确立了细胞信号通路在肿瘤发生、发展、转化中的地位, 而且在分子水平为肿瘤治疗提供了新的方向, 进而有可能使肿瘤的治疗手段发生根本的变革. 目前很多研究者都将注意力转向肿瘤的病因学与病理过程中起作用的特异的分子及生物靶点. 通过对肿瘤细胞信号传导机制研究, 选择性阻断肿瘤细胞自分泌或旁分泌的信号传导通路, 破坏其自控性生长调节, 促进肿瘤细胞的分化, 恢复正常的生长调节机制, 已成为肿瘤治疗的研究热点. 这些作用均可通过选择性地调节肿瘤细胞信号传导系统的不同成分而达到. 但同时我们看到, 以肿瘤细胞信号传导系统为靶点的靶向治疗也具有一定的局限性, 单一的细胞信号通路的阻滞并不能完全控制恶性肿瘤的增殖、浸润和转移, 不能完全逆转其恶性表形. 恶性肿瘤细胞内信号通路相互关联、相互作用, 形成一个巨大而又复杂的网络, 只有真正了解其机制, 才能使靶向治疗成为肿瘤治疗的有力手段.
胰腺癌恶性程度高, 预后差, 症状隐匿, 近些年来全球范围胰腺癌发病率、死亡率均在上升. 胰腺癌发病机制仍然不明确, 这给早期诊断以及进一步治疗带来很大的困难. 只有真正揭示胰腺癌发病的内在机制, 才能寻找到有效的早期诊断及治疗方法.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科
近年来, 尽管随着外科技术水平的提高、化疗药物的推陈出新以及治疗理念、方式的转变, 胰腺癌治疗较前已有了长足的进步, 但胰腺癌治疗的远期效果仍不令人满意, 基于细胞信号转导通路特定靶点的靶向治疗成为研究热点, 目前正在从基础研究转向临床研究, 并取得了一定的治疗效果, 而MAPK/ERK1/2信号通路是其中最为重要的研究对象和治疗方向.
最近一项研究表明, 索拉非尼联合维生素K可通过调控磷酸化ERK1/2及Bcl-2基因表达水平来促进胰腺癌细胞凋亡. 一些胰腺癌细胞体外研究也显示, 单一细胞信号通路靶点的阻滞对胰腺癌细胞并不能达到最佳治疗效果. 这都证明MAPK/ERK1/2细胞信号通路紊乱是胰腺癌发生进展的特定表现.
PD98059是MAPK/ERK1/2信号通路特异性抑制剂, 本实验通过不同浓度PD98059处理胰腺癌细胞, 探讨胰腺癌细胞中MAPK/ERK1/2信号通路的作用机制, 并为肿瘤早期诊断治疗寻找新的靶点.
MAPK信号通路有促进细胞增殖, 调节基因转录的作用, 是许多肿瘤发生的重要因素, 而ERK1/2信号通路是MAPK通路的重要组成部分. MAPK/ERK1/2信号通路在胰腺癌进展中发挥着重要作用. PD98059是MAPK/ERK1/2信号通路特异性抑制剂, PD98059的作用位点可以成为胰腺癌治疗的靶点.
本文具有一定的先进性和科学性, 为进一步的临床研究奠定基础.
编辑: 李军亮 电编:何基才
| 1. | Lowenfels AB, Maisonneuve P. Epidemiology and prevention of pancreatic cancer. Jpn J Clin Oncol. 2004;34:238-244. [PubMed] [DOI] |
| 2. | Egan SE, Weinberg RA. The pathway to signal achievement. Nature. 1993;365:781-783. [PubMed] [DOI] |
| 3. | Nichols A, Camps M, Gillieron C, Chabert C, Brunet A, Wilsbacher J, Cobb M, Pouyssegur J, Shaw JP, Arkinstall S. Substrate recognition domains within extracellular signal-regulated kinase mediate binding and catalytic activation of mitogen-activated protein kinase phosphatase-3. J Biol Chem. 2000;275:24613-24621. [PubMed] [DOI] |
| 4. | Osada S, Yoshida K. A novel strategy for advanced pancreatic cancer - progression of molecular targeting therapy. Anticancer Agents Med Chem. 2009;9:877-881. [PubMed] |
| 5. | Lejeune D, Dumoutier L, Constantinescu S, Kruijer W, Schuringa JJ, Renauld JC. Interleukin-22 (IL-22) activates the JAK/STAT, ERK, JNK, and p38 MAP kinase pathways in a rat hepatoma cell line. Pathways that are shared with and distinct from IL-10. J Biol Chem. 2002;277:33676-33682. [PubMed] [DOI] |
| 6. | Greenberg AK, Hu J, Basu S, Hay J, Reibman J, Yie TA, Tchou-Wong KM, Rom WN, Lee TC. Glucocorticoids inhibit lung cancer cell growth through both the extracellular signal-related kinase pathway and cell cycle regulators. Am J Respir Cell Mol Biol. 2002;27:320-328. [PubMed] |
| 7. | English J, Pearson G, Wilsbacher J, Swantek J, Karandikar M, Xu S, Cobb MH. New insights into the control of MAP kinase pathways. Exp Cell Res. 1999;253:255-270. [PubMed] [DOI] |
| 8. | Cescato R, Loesch KA, Waser B, Mäcke HR, Rivier JE, Reubi JC, Schonbrunn A. Agonist-biased signaling at the sst2A receptor: the multi-somatostatin analogs KE108 and SOM230 activate and antagonize distinct signaling pathways. Mol Endocrinol. 2010;24:240-249. [PubMed] [DOI] |
| 9. | Ishiwata T, Yamamoto T, Kawahara K, Kawamoto Y, Matsuda Y, Ishiwata S, Naito Z. Enhanced expression of lumican inhibited the attachment and growth of human embryonic kidney 293 cells. Exp Mol Pathol. 2010;88:363-370. [PubMed] [DOI] |
| 10. | Wei G, Wang M, Carr BI. Sorafenib combined vitamin K induces apoptosis in human pancreatic cancer cell lines through RAF/MEK/ERK and c-Jun NH2-terminal kinase pathways. J Cell Physiol. 2010;224:112-119. [PubMed] |
| 11. | Yang MD, Lai KC, Lai TY, Hsu SC, Kuo CL, Yu CS, Lin ML, Yang JS, Kuo HM, Wu SH. Phenethyl isothiocyanate inhibits migration and invasion of human gastric cancer AGS cells through suppressing MAPK and NF-kappaB signal pathways. Anticancer Res. 2010;30:2135-2143. [PubMed] |
| 12. | Li H, He C, Feng J, Zhang Y, Tang Q, Bian Z, Bai X, Zhou H, Jiang H, Heximer SP. Regulator of G protein signaling 5 protects against cardiac hypertrophy and fibrosis during biomechanical stress of pressure overload. Proc Natl Acad Sci U S A. 2010;107:13818-13823. [PubMed] [DOI] |
| 13. | Zhao Y, Wu K, Yu Y, Li G. [Roles of ERK1/2 MAPK in vitamin E succinate-induced apoptosis in human gastric cancer SGC-7901 cells]. Weisheng Yanjiu. 2003;32:573-575. [PubMed] |
| 14. | Chang Q, Chen E, Hedley DW. Effects of combined inhibition of MEK and mTOR on downstream signaling and tumor growth in pancreatic cancer xenograft models. Cancer Biol Ther. 2009;8:1893-1901. [PubMed] [DOI] |