修回日期: 2009-08-24
接受日期: 2009-08-24
在线出版日期: 2009-09-28
目的: 探讨重症急性胰腺炎(SAP)大鼠胰腺组织中内皮素-1(ET-1)、内皮型一氧化氮合酶(eNOS)及诱生型一氧化氮合酶(iNOS)基因的表达与胰腺组织损伤的关系以及中药丹红注射液对其基因表达的影响.
方法: 96只SD雄性大鼠分为对照组(A组)、SAP模型组(B组)及丹红治疗组(C组); 用RT-PCR分别检测不同时间点各组大鼠胰腺组织中ET-1、eNOS及iNOS基因的表达; 分别用放射免疫法、硝酸还原酶法测不同时间点各组大鼠测血液中ET-1、NO浓度; 观察各组不同时间点的胰腺组织病理变化, 并对胰腺组织损伤进行评分.
结果: 与B组比较, C组可明显降低胰腺组织各时间点ET-1、iNOS基因的表达(ET-1: 4 h: 0.31±0.15 vs 0.58±0.17, 8 h: 0.45±0.16 vs 0.72±0.31, 12 h: 0.73±0.19 vs 1.19±0.28, 24 h: 0.64±0.26 vs 0.92±0.36; iNOS: 4 h: 0.32±0.10 vs 0.65±0.11, 8 h: 0.36±0.14 vs 0.73±0.08, 12 h: 0.43±0.07 vs 0.87±0.15, 24 h: 0.32±0.06 vs0.82±0.16, 均P<0.05), 上调eNOS基因的表达(4 h: 0.55±0.12 vs 0.25±0.11, 8 h: 0.53±0.10 vs 0.27±0.12, 12 h: 0.60±0.12 vs 0.24±0.10, 24 h: 0.56±0.13 vs 0.28±0.16, 均P<0.05). 且可明显降低C组大鼠12、24 h时间点胰腺病理评分(12 h: 4.73±1.29 vs 7.19±1.28, 24 h: 5.64±1.26 vs 8.92±2.16, 均P<0.05).
结论: 丹红注射液可下调重症急性胰腺炎大鼠胰腺组织中ET-1与iNOS基因的表达, 上调eNOS基因的表达, 改善胰腺组织病理
损伤.
引文著录: 范辉, 胡雅兵, 王小红, 沈云志. 丹红注射液对重症急性胰腺炎大鼠胰腺组织ET-1、eNOS和iNOS基因表达的影响. 世界华人消化杂志 2009; 17(27): 2784-2790
Revised: August 24, 2009
Accepted: August 24, 2009
Published online: September 28, 2009
AIM: To investigate the effects of Danhong Injection on pancreatic injury and the expression of endothelin-1 (ET-1), endothelial nitric oxide synthase (eNOS) and inducible nitric oxide synthase (iNOS) mRNAs in the pancreas in rats with severe acute pancreatitis (SAP).
METHODS: Ninety-six male Sprague-Dawley rats were randomly divided into normal control group(n = 32), SAP model group (n = 32) and Danhong Injection treatment group (n =32). The expression of eNOS, iNOS and ET-1 mRNAs in the pancreas was determined by reverse transcription-polymerase chain reaction (RT-PCR). The contents of ET-1 and nitric oxide (NO) in the blood were detected by radioimmunoassay (RIA) and nitrate reductase method (NRM), respectively. Pancreatic pathological changes were observed and scored.
RESULTS: Compared with the SAP model group, the expression levels of ET-1 and iNOS mRNAs decreased significantly (ET-1: 4 h: 0.31 ± 0.15 vs 0.58 ± 0.17, 8 h: 0.45 ± 0.16 vs 0.72 ± 0.31, 12 h: 0.73 ± 0.19 vs 1.19 ± 0.28, 24 h: 0.64 ± 0.26 vs 0.92 ± 0.36; iNOS: 4 h: 0.32 ± 0.10 vs 0.65 ± 0.11, 8 h: 0.36 ± 0.14 vs 0.73 ± 0.08, 12 h: 0.43 ± 0.07 vs 0.87 ± 0.15, 24 h: 0.32 ± 0.06 vs 0.82 ± 0.16, all P < 0.05), the expression levels of eNOS mRNA increased significantly (4 h: 0.55 ± 0.12 vs 0.25 ± 0.11, 8 h: 0.53 ± 0.10 vs 0.27 ± 0.12, 12 h: 0.60 ± 0.12 vs 0.24 ± 0.10, 24 h: 0.56 ± 0.13 vs 0.28 ± 0.16, all P < 0.05), and pancreatic pathological scores decreased significantly (12 h: 4.73 ± 1.29 vs 7.19 ± 1.28, 24 h: 5.64 ± 1.26 vs 8.92 ± 2.16, both P < 0.05) in the Danhong Injection treatment group.
CONCLUSION: Danhong Injection could decrease the expression of iNOS and ET-1 genes, increase the expression of eNOS gene in the pancreas, and alleviate pancreatic injury in rats with severe acute pancreatitis.
- Citation: Fan H, Hu YB, Wang XH, Shen YZ. Effects of Danhong Injection on the expression of endothelin-1, endothelial nitric oxide synthase and inducible nitric oxide synthase mRNAs in the pancreas in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2784-2790
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2784.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2784
重症急性胰腺炎(severe acute pancreatitis, SAP)是消化内科急腹症, 在SAP病程中、以及由SAP并发的全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)及多器官衰竭(multiple organs failure, MOF)过程中, 胰腺和其他脏器的微循环障碍起了重要作用. 引起微循环障碍血管活性介质包括缩血管介质和舒血管介质, 前者主要以内皮素(endothelin, ET-1)为代表, 后者主要有一氧化氮(nitric oxide, NO)、缓激肽等. ET-1使胰腺微血管痉挛, 减少胰腺血流, ET-1还与胰腺腺泡ET-1受体结合, 使腺泡细胞内钙超载, 损伤胰腺细胞, 引起腺泡坏死. 在生理状态下, NO由内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)合成, 此时NO具有松弛血管平滑肌细胞, 抑制白细胞黏附和血小板凝聚, 对脏器有保护作用. 在病理状态下, 由诱生型一氧化氮合酶(inducible nitric oxide synthase, iNOS)合成的NO占血液中NO的绝大多数, 过量NO的使脏器毛细血管过度扩张, 微循环淤血, 毛细血管通透性增高, 血管平滑肌对缩血管物质的反应性降低等, 引起严重的低血压和循环衰竭. 本研究旨在探讨不同时间点SAP大鼠胰腺组织ET-1、eNOS、iNOS基因表达、血清ET-1、NO浓度与胰腺组织损伤之间的关系, 以及应用中药丹红注射液对SAP大鼠胰腺组织ET-1、eNOS、iNOS基因表达和血清ET-1、NO浓度的影响以及对胰腺损伤的防治作用.
♂健康SD大鼠96只, 体质量250-300 g, 由南通大学实验动物中心提供. L-精氨酸(250 g/L)购自上海第一生化制药厂产品(国药准字H31020517). 丹红注射液采用济南步长制药有限公司生产的制剂(国药准字Z20026866). 丹红注射液是由丹参和红花2味药物组成, 其中含丹参素为8.3 g/L, 原儿茶醛为1.3 g/L, 丹参酚酸B为6.4 g/L, 总黄酮5.0 g/L.
1.2.1 造模及给药方法: 将96只清洁级SD大鼠随机分为3组, 即正常对照组(A组), SAP组(B组)和治疗组(C组), 实验前禁食12 h, 自由饮水. B、C组造模按照文献介绍方法给予腹腔注射25 g/L浓度L-精氨酸(剂量3.2 g/kg质量)2次, 间隔1 h[1-2], B组于第2次注射L-精氨酸后1 h按照文献[3]报道予以肌注丹红注射液1.6 mL/(kg·d), 分2次, 间隔3 h. 对照组动物肌注等量的生理盐水. 每组于注射L-精氨酸诱导SAP模型后术后4, 8, 12, 24 h 4个时间点采用断颈法各处死动物8只, 开腹腔提取胰腺组织.
1.2.2 光镜检查: 取胰腺头部组织于40 g/L多聚甲醛固定, 石蜡包埋、切片及HE染色, 由病理科医师按照Rongione[4]评分法对胰腺组织病理进行双盲评分: (1)水肿: 0 = 缺少; 1 = 于叶间隔部水肿; 2 = 小叶间间隔部水肿; 3 = 腺泡间隔部水肿; 4 = 细胞间间隔部水肿; (2)炎症浸润: 0 = 缺少; 1 = 位于导管边缘; 2 = 于小叶实质内(<50%); 3 = 于小叶实质内(51%-75%); 4 = 于小叶实质内(>75%); (3)空泡形成; 0 = 缺少; 1 = 导管周围(<5%); 2 = 灶发性(5%-20%); 3 = 扩散性(21%-50%); 4 = 广泛严重性(>50%); (4)坏死: 0 = 缺少; 1 =1-4/HPF; 2 = 5-10/HPF ; 3 = 11-15/HPF; 4 ≥16/HPF. 每只大鼠的胰腺组织病理评分为以上4 项评分相加后的分值.
1.2.3 血清ET-1、NO检测: 血清ET-1浓度采用放射免疫法(radioimmunoassay, RIA)测定, 仪器为CAP-16型放免仪, 放免试剂盒由北京北方生物技术研究所提供, NO采用硝酸还原酶法(nitrate reductase method, NRM)测定, 试剂盒由南京建成生物工程研究所提供, 按照说明书的方法测定NO.
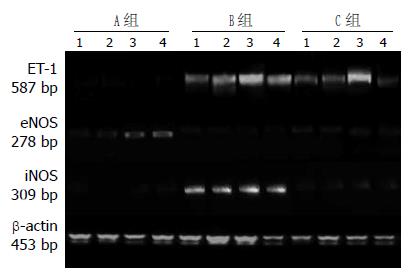
1.2.4 RT-PCR检测: 胰腺组织内ET-1、eNOS和iNOS-mRNA表达的检测采用RT-PCR(reverse transcription-PCR)法检测. 引物序列见表1. 引物由百奥生物技术(南通)有限公司实验室合成. 采用两步法RT-PCR, 取5 μL PCR产物跑1.0%琼脂糖电泳利用凝胶分析软件(Image J), 计算检测基因与β-actin的积分吸光度(A)比值来表示目的基因的表达量.
| 分组 | 引物序列 | 基因 | NCBI库号 | 长度 (bp) |
| eNOS-F' | AAGACCGATTACACGACATTG | eNOS | NM_021838 | 278 |
| eNOS-R' | AGTGACATCACCGCAGACA | |||
| iNOS-F' | CAGTTCTGTGCCTTTGCTCA | iNOS | NM_012611 | 309 |
| iNOS-R' | CATGGTGAACACGTTCTTGG | |||
| ET1-F' | TTCTCTCTGCTGTTTGTGG | ET1 | NM_012548 | 587 |
| ET1-R' | CAATGTGCTCGGTTGTG | |||
| Rn-actin-F' | GAGAGGGAAATCGTGCGTGAC | β-actin | NM_031144 | 453 |
| Rn-actin-R' | CATCTGCTGGAAGGTGGACA |
统计学处理 应用SAS V8.0统计软件包进行数据处理, 所有数据均用mean±SD来表示, 经Levene方差齐性分析, 若方差齐, 采用完全随机设计多组均数比较的方差分析(analysis of variance), 两两比较行S-N-K检验, 取P<0.05为差异有统计学意义.
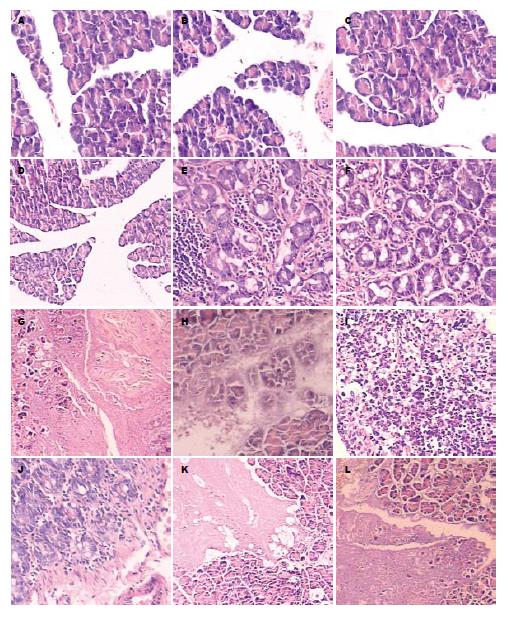
A组大鼠胰腺组织未见明显异常病变; B组大鼠胰腺出现出血坏死, 多为凝固性坏死, 残留腺泡呈孤立性分布, 腺管坏死; C组病理改变明显减轻, 胰腺细胞轻度变性水肿, 问质血管扩张、充血、小叶间隔增宽, 少许炎症细胞浸润(表2, 图1).
| 分组 | 4 h | 8 h | 12 h | 24 h |
| A组 | 0.38±0.18 | 0.35±0.12 | 0.34±0.16 | 0.40±0.15 |
| B组 | 3.58±0.47a | 4.72±1.41a | 7.19±1.28a | 8.92±2.16a |
| C组 | 3.31±0.15 | 4.25±1.16 | 4.73±1.29c | 5.64±1.26 |
B组ET-1 mRNA在SAP诱发后4 h即明显表达, 病程8, 12 h继续升高并且到达顶点, 至24 h有所降低, 但是仍高于相同时间点A组ET-1 mRNA的表达(P<0.05). 和B相比, C组大鼠的胰腺病理改变明显减轻, 胰腺各时间点ET-1 mRNA表达明显下调(P<0.05), 与A组比较, B组eNOS mRNA表达明显降低(P<0.05), 而B组iNOS mRNA的表达则随病程延长逐渐上调, 至12 h达高峰, 但24 h有所下降, 但仍明显高于对照组(P<0.05), 经治疗后, C组各时间点iNOS mRNA较B组下调, 差异有统计学意义(P<0.05, 表3, 图2).
| 分组 | 基因表达水平 | |||
| 4 h | 8 h | 12 h | 24 h | |
| ET-1/β-actin | ||||
| A组 | 0.18±0.08 | 0.21±0.09 | 0.20±0.06 | 0.20±0.05 |
| B组 | 0.58±0.17a | 0.72±0.31a | 1.19±0.28a | 0.92±0.36a |
| C组 | 0.31±0.15c | 0.45±0.16c | 0.73±0.19c | 0.64±0.26c |
| eNOS/β-actin | ||||
| A组 | 0.67±0.16 | 0.68±0.13 | 0.71±0.18 | 0.70±0.21 |
| B组 | 0.25±0.11a | 0.27±0.12a | 0.24±0.10a | 0.28±0.16a |
| C组 | 0.55±0.12c | 0.53±0.10c | 0.60±0.12c | 0.56±0.13c |
| iNOS/β-actin | ||||
| A组 | 0.17±0.07 | 0.12±0.08 | 0.16±0.11 | 0.20±0.09 |
| B组 | 0.65±0.11a | 0.73±0.08a | 0.87±0.15a | 0.82±0.16a |
| C组 | 0.32±0.10c | 0.36±0.14c | 0.43±0.07c | 0.32±0.06c |
在SAP的病因和发病机制中, 目前还有很多不明原因, 确切机制还不完全清楚[5]. 包括细胞凋亡、微循环障碍、凝血机制障碍等多种机制参与了SAP的病程[6], 并且容易导致SIRS和MOF的发生[7-8]. SAP微循环发生障碍时, 缩血管介质和舒血管介质两类血管活性物质起了主导作用. 缩血管介质主要以ET-1为代表, 舒血管介质主要有NO、缓激肽等. ET-1是由内皮细胞合成的缩血管介质, 是反映内皮功能的有效指标. ET-1参与了AP微循环障碍的发生, 其作用机制包括血管收缩、缺血-再灌注损伤、毛细血管通透性增加、血液流变学改变、影响白细胞-内皮细胞相互作用等多个方面. 首先ET-1作用于血管平滑肌上的受体, 通过信号传导使细胞内Ca2+浓度升高, 引起血管收缩减少微循环灌注. 其次, ET-1可使胰腺毛细血管通透性增加, 毛细血管渗漏增多. 一方面使血液浓缩、红细胞比积增大、血液黏度升高造成血液流变学变化, 使血小板容易发生聚集, 形成微血栓, 造成微循环血液淤滞[9]. 另一方面使组织水肿, 毛细血管数目相对减少而造成功能性毛细血管密度降低、组织供氧不足[10]. 针对微循环障碍的治疗目前有不同的观点[11]. 晚近有人主张使用血小板活化因子(platelet-activating factor, PAF)拮抗剂改善脏器灌注, 并认为PAF拮抗剂能够有效减轻全身和局部炎症反应, 改善患者预后[12-13], 但是确切疗效还有待进一步验证. 动物实验[14-16]和临床研究[17]表明, 使用活血化淤的中药制剂可以改善急性胰腺炎动物模型和患者血清ET-1浓度, 改善患者临床症状和预后. 本研究结果表明, SAP组大鼠胰腺组织ET-1 mRNA在SAP诱发后4 h即明显表达, 病程8, 12 h ET-1 mRNA表达继续升高并且到达顶点, 至病程24 h ET-1 mRNA的表达有所降低, 但是仍高于同一时间点正常对照组ET-1 mRNA的表达(P<0.05), 血清ET-1浓度也呈现类似改变. 和SAP组相比, 治疗组大鼠的胰腺病理改变明显减轻, 胰腺各时间点ET-1 mRNA表达明显水平下调、血清ET-1浓度降低(P<0.05), 表明丹红注射液对SAP大鼠胰腺组织有一定治疗作用, 其发挥作用的可能机制之一在于通过下调ET-1 mRNA表达, 减少ET-1的大量生成而发挥其保护作用.
NO是目前公认的一种信息传递分子, 在生理状态下和各类急、慢性疾病中的作用日益受到人们的关注. NOS有3种亚型: 神经型NOS(neuronal NOS, nNOS)、iNOS、eNOS. eNOS为Ca2+依赖型, 主要位于内皮细胞eNOS; iNOS为非Ca2+依赖型, 主要位于巨噬细胞、嗜中性白细胞、内皮细胞及上皮细胞[18]. 各种组织中的iNOS在生理状态下很少表达, 甚至不可用生物技术和免疫组织化学方法检测出来. 在iNOS基因的启动子或增强子区域有NF-κB的特异性结合位点. 脂多糖、内毒素、细胞因子、炎症介质、损伤、缺血、紫外线等因素可将NF-κB激活, NF-κB在转录水平参与iNOS表达的调控, 使iNOS mRNA迅速表达合成大量的iNOS[19]. iNOS编码基因被激活后可长时间内表达iNOS mRNA, 产生的NO是eNOS产生的100-1000倍. 在病理状态下, NO的大量生成可引起毛细血管过度扩张, 微循环淤血, 毛细血管通透性增高, 血管平滑肌对缩血管物质的反应性降低等, 引起严重的低血压和循环衰竭. 另外, NO是自由基, 当形成OO-NO-时具有严重的细胞毒性作用. 本实验的研究结果显示, SAP组大鼠胰腺组织各时间点eNOS mRNA均低表达, 与正常对照组同时间点eNOS mRNA的表达比较差异有统计学意义(P<0.05). 与SAP组相比, 治疗组大鼠的胰腺各时间点eNOS mRNA表达明显上调(P<0.05), SAP时胰腺组织iNOS mRNA表达随时间变化明显上调, 12 h达高峰, 在24 h均处于较高表达水平, 明显高于对照组(P<0.05), 且与血清NO浓度、胰腺组织损害程度评分呈正相关, 表明SAP时过量NO细胞毒性作用可能加剧了胰腺组织损害. 由此提示, 由iNOS诱导产生过量NO可能是造成急性坏死性胰腺炎的重要因素之一. 本实验的研究结果还发现, 与SAP组相比, 治疗组的胰腺组织各时间点iNOS mRNA的表达明显下调(P<0.05). 丹红注射液的活性成分具有多种生物作用, 除了改善微循环、减少病变部位的缺血缺氧状态外, 还具有很强的抗氧化活性和抗自由基活性, 其保护作用可能与下调SAP大鼠胰腺组织NF-κB的表达进而抑iNOS mRNA的表达有关[20]. 丹红注射液对L-精氨酸诱导的SAP大鼠胰腺组织具有较好的防治作用.
在重症急性胰腺炎(SAP)的发生过程中, 微循环障碍是重要的作用机制之一. 而在舒缩血管的活性介质中, 以ET-1为代表的缩血管介质和NO、PGI2代表的舒血管介质起着不同的调节作用. 传统观点认为, 在脏器微循环障碍的发生过程中由于早期缩血管物质作用过强、舒血管介质不足加重了微循环的损害.
姜慧卿, 教授, 河北医科大学第二医院消化科; 唐文富, 副教授, 四川大学华西医院中西医结合科.
在SAP的发生、发展过程中, 血清中ET-1和NO的浓度如何随病程发展而变化, 其基因表达与血清浓度、病理损害之间关系如何? 目前尚无系统的研究, 探索各个途径的作用及其相互关系是SAP微循环损害的热点、重点问题和难点问题之一.
Chen et al使用血小板活化因子(PAF)拮抗剂改善脏器灌注, 并认为PAF拮抗剂能够有效减轻全身和局部炎症反应, 改善患者预后. Jung et al使用活血化淤的中药制剂可以改善急性胰腺炎动物模型和患者血清ET-1浓度, 改善患者临床症状和预后.
本研究从SAP时大鼠胰腺组织不同时间点的形态学、血清生化指标与血管活性介质基因的表达等方面探讨了胰腺组织损害程度与血管活性介质基因表达之间的关联性, 证实使用丹红注射液治疗SAP时的抗氧化、改善微循环与对包括胰腺在内多脏器的保护作用, 为SAP的临床治疗提供了指导.
丹红注射液可下调重症急性胰腺炎大鼠胰腺组织中ET-1与iNOS基因的表达, 上调eNOS基因的表达, 改善胰腺组织病理损伤.
本文研究丹红注射液对SAP大鼠胰腺组织ET-1、eNOS和iNOS基因的表达影响, 有一定意义.
编辑:李军亮 电编:吴鹏朕
| 1. | Rakonczay Z Jr, Hegyi P, Dósa S, Iványi B, Jármay K, Biczó G, Hracskó Z, Varga IS, Karg E, Kaszaki J, Varró A, Lonovics J, Boros I, Gukovsky I, Gukovskaya AS, Pandol SJ, Takács T. A new severe acute necrotizing pancreatitis model induced by L-ornithine in rats. Crit Care Med. 2008;36:2117-2127. [PubMed] [DOI] |
| 2. | Szabolcs A, Reiter RJ, Letoha T, Hegyi P, Papai G, Varga I, Jarmay K, Kaszaki J, Sari R, Rakonczay Z Jr, Lonovics J, Takacs T. Effect of melatonin on the severity of L-arginine-induced experimental acute pancreatitis in rats. World J Gastroenterol. 2006;12:251-258. [PubMed] |
| 4. | Rongione AJ, Kusske AM, Kwan K, Ashley SW, Reber HA, McFadden DW. Interleukin 10 reduces the severity of acute pancreatitis in rats. Gastroenterology. 1997;112:960-967. [PubMed] [DOI] |
| 5. | Papachristou GI. Prediction of severe acute pancreatitis: current knowledge and novel insights. World J Gastroenterol. 2008;14:6273-6275. [PubMed] [DOI] |
| 6. | Wang GJ, Gao CF, Wei D, Wang C, Ding SQ. Acute pancreatitis: etiology and common pathogenesis. World J Gastroenterol. 2009;15:1427-1430. [PubMed] [DOI] |
| 9. | Plusczyk T, Bersal B, Menger MD, Feifel G. Differential effects of ET-1, ET-2, and ET-3 on pancreatic microcirculation, tissue integrity, and inflammation. Dig Dis Sci. 2001;46:1343-1351. [PubMed] [DOI] |
| 10. | Plusczyk T, Witzel B, Menger MD, Schilling M. ETA and ETB receptor function in pancreatitis-associated microcirculatory failure, inflammation, and parenchymal injury. Am J Physiol Gastrointest Liver Physiol. 2003;285:G145-G153. [PubMed] |
| 11. | Eibl G, Buhr HJ, Foitzik T. Therapy of microcirculatory disorders in severe acute pancreatitis: what mediators should we block? Intensive Care Med. 2002;28:139-146. [PubMed] [DOI] |
| 12. | Chen C, Xia SH, Chen H, Li XH. Therapy for acute pancreatitis with platelet-activating factor receptor antagonists. World J Gastroenterol. 2008;14:4735-4738. [PubMed] [DOI] |
| 13. | Bedirli A, Gokahmetoglu S, Sakrak O, Soyuer I, Ince O, Sozuer E. Beneficial effects of recombinant platelet-activating factor acetylhydrolase and BN 52021 on bacterial translocation in cerulein-induced pancreatitis. Eur Surg Res. 2004;36:136-141. [PubMed] [DOI] |
| 16. | Jung WS, Chae YS, Kim DY, Seo SW, Park HJ, Bae GS, Kim TH, Oh HJ, Yun KJ, Park RK. Gardenia jasminoides protects against cerulein-induced acute pancreatitis. World J Gastroenterol. 2008;14:6188-6194. [PubMed] [DOI] |
| 19. | Cooke CL, Davidge ST. Peroxynitrite increases iNOS through NF-kappaB and decreases prostacyclin synthase in endothelial cells. Am J Physiol Cell Physiol. 2002;282:C395-C402. [PubMed] |