修回日期: 2009-05-15
接受日期: 2009-05-21
在线出版日期: 2009-06-18
目的: 克隆幽门螺杆菌(H pylori)γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)基因, 实现GGT基因在大肠杆菌中的表达.
方法: 从胃癌患者胃黏膜组织中分离培养获得H pylori, 提取其基因组DNA, 对GGT基因进行PCR扩增, 克隆进pMD18-T载体, 酶切和测序验证, 构建原核表达载体 pET-28a(+)-GGT, 转化大肠杆菌BL21, 经IPTG诱导表达重组融合蛋白, SDS-PAGE及Western blot分析检测表达产物.
结果: 成功克隆了GGT基因, 经酶切和测序验证正确, 成功构建了pET-28a(+)-GGT质粒, 高效表达出了68 kDa的融合蛋白.
结论: 在大肠杆菌中成功表达了GGT重组融合蛋白, 为进一步研究GGT与线粒体介导的细胞凋亡之间的关系奠定了基础.
引文著录: 张尤历, 唐炜, 王文兵, 陈慧娟, 周武松. 幽门螺杆菌GGT基因的克隆及其在大肠杆菌中的表达. 世界华人消化杂志 2009; 17(17): 1768-1771
Revised: May 15, 2009
Accepted: May 21, 2009
Published online: June 18, 2009
AIM: To clone and express H pylori γ-glutamyl transpeptidase in Escherchia coli.
METHODS: The strains of H pylori were isolated from human gastric mucosa with gastric cancer. The GGT amplified by PCR from H pylori DNA was cloned into apMD18-T vectors. The recombinant plasmids were confirmed by enzyme digestion and were sequenced. The prokaryotic expression vector pET-28a (+)-GGT was constructed and GGT gene was expressed in E.coli BL21 strain. The fusion protein was produced by IPTG induction and analyzed by SDS-PAGE and Western blot.
RESULTS: The GGT gene was obtained and its sequence was proved to be correct. The prokaryotic expression vector pET-28a (+)-GGT was constructed. The fusion protein with relative molecule mass of 68 kDa was highly expressed.
CONCLUSION: The GGT is successfully expressed in E.coli, which is of importance to research of the relationship between the GGT and mitochondria-mediated apoptosis.
- Citation: Zhang YL, Tang W, Wang WB, Chen HJ, Zhou WS. Cloning of Helicobacter pylori γ-glutamyl transpeptidase gene and its expression in E.coli. Shijie Huaren Xiaohua Zazhi 2009; 17(17): 1768-1771
- URL: https://www.wjgnet.com/1009-3079/full/v17/i17/1768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i17.1768
自从1983年Warren和Mashall首次分离获得幽门螺杆菌(H pylori)以来, H pylori感染与慢性胃炎(chronic gastritis, CG)、胃溃疡(gastric ulcer, GU)、十二指肠溃疡(duodenal ulcer, DU)和胃癌(gastric cancer, GC)等疾病的关系逐步被认识[1]. H pylori γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)在分泌和成熟后通过离子键与细胞膜结合, 将细菌和宿主细胞直接连接起来[2]. GGT在H pylori诱导的线粒体介导的程序性细胞死亡中, 主要是通过诱导线粒体释放细胞色素C进入细胞质[3]和激活Caspase家族成员[4]起作用, 其可能是一个较好的抗肿瘤因子[5]. 但程序性细胞死亡的持续发生, 破坏了新细胞生成和细胞消亡之间的平衡产生病理作用, 凋亡调节基因的转变和突变频繁的发生, 反而增加了胃癌发生的危险性[6]. 有关GGT的生物学机制和在体内的效应还需要进一步研究. 为研究GGT蛋白在胃癌细胞中的表达, 进一步研究该蛋白的功能以及与线粒体之间的作用机制, 我们将从胃癌患者胃黏膜组织分离培养获得H pylori菌株, 提取其基因组DNA, 克隆GGT基因, 并对其原核表达进行研究.
H pylori从本院内镜室活检标本(距幽门5 cm内)分离培养获得, 尿素酶试验阳性, 行常规病理检查明确为GC. 大肠埃希菌E.coli DH5α、BL21受体菌株和原核表达质粒pET-28a(+)质粒均由江苏大学生命科学院实验室提供. Kanamycin购自上海华舜公司; His单抗购自Sigma公司; 羊抗鼠IgG和荧光剂购自Pierce公司; H pylori基础培养基、微需氧环境发生袋、选择性抗生素及厌氧培养罐购自德国Merck公司; 改良布氏肉汤培养基由上海腹泻疾病控制中心提供; 无菌羊全血购自金坛欣迪公司; pMD18-T质粒、试验中所用的限制性内切酶和配套的缓冲液、T4 DNA ligase、Taq酶、dNTPs、DL2000标准分子质量核酸、λ-HindⅢ标准分子量核酸、质粒抽提试剂盒为TaKaRa公司产品; TRIzol购自Invitrogen公司; X-gal、IPTG为Gibco公司产品; 酵母提取物、蛋白胨为Oxoid公司产品. 其他常规试剂为市售分析纯.
1.2.1 H pylori培养: 将活检新鲜组织用接种环均匀涂于固体琼脂培养基, 在微需氧环境, 37 ℃培养, 约 96 h后收集细菌.
1.2.2 H pylori基因组DNA提取: 刮取菌落, 提取其基因组DNA, 保存于-20 ℃备用.
1.2.3 引物设计与合成: 根据GenBank中H pylori 26695标准株(GenBank登录号: NC_000915)的GGT全序列, 设计PCR引物: 上游引物P1: 5'-CCGGAATTCATGAGACGGAGTTTTTTGAA-3'; 下游引物P2: 5'-CCGCTCGAGTTAAAATTCTTTCCTTGGAT-3'. 在上游引物5'端加EcoRⅠ酶切位点; 在下游引物5'端加XhoⅠ酶切位点. 引物由上海生工生物工程技术服务有限公司合成.
1.2.4 PCR扩增: 以获得的H pylori基因组DNA为模板, P1和P2为引物, 用LA-Taq聚合酶进行PCR扩增. 反应条件为: 94 ℃ 5 min; 94 ℃ 1 min, 59 ℃ 45 s, 72 ℃ 3 min; 35个循环, 最后72 ℃延伸10 min. PCR产物经10 g/L琼脂糖凝胶电泳鉴定.
1.2.5 TA克隆及鉴定: 将PCR产物与pMD18-T载体连接, 转化DH5α感受态菌. 采取蓝白斑筛选试验筛选阳性克隆, 提取质粒, 用XhoⅠ和EcoRⅠ双酶切分析鉴定转化重组质粒. 阳性克隆的DNA序列由上海英骏生物技术有限公司完成.
1.2.6 表达载体的构建及鉴定: 用XhoⅠ和EcoRⅠ酶切阳性质粒pMD18-T-GGT后, 回收GGT片段, 并将GGT片段与pET-28a(+)载体连接, 转化 DH5α感受态菌, 接种于含卡那霉素的LB培养基中, 酶切鉴定重组质粒.
1.2.7 诱导表达: 选取构建正确的重组质粒, 转化BL21感受态菌, 挑取单菌落过夜培养后取1/10体积接种于含卡那霉素的LB培养基中, 振摇至吸光度值(A600)为0.6-1.0后, 加入IPTG至终浓度为1 mmol/L, 28 ℃继续振摇2-6 h诱导表达目的蛋白.
1.2.8 分析检测表达产物: 分别取诱导表达2、4、6 h的菌液1 mL, 离心后收集菌体, 进行SDS-PAGE凝胶电泳分析及Western blot检测.
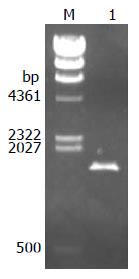
PCR产物经琼脂糖凝胶电泳分析, 可见1条清晰、单一、大小约1700 bp的特异性扩增条带(图1), 其大小与预计的相吻合, 序列测定正确.
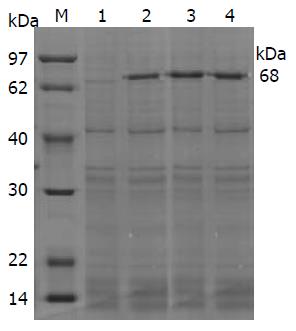
经诱导后, 在约68 kDa处有特异蛋白条带(图2), 其大小与理论推算的融合蛋白相对分子质量相符合.
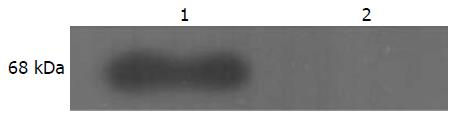
为了进一步验证表达产物, 采用Western blot进行检测, 结果在约68 kDa处有明显条带(图3), 与SDS-PAGE的结果一致, 说明插入的GGT基因已经成功在大肠杆菌中表达.
GGT广泛存在于原核和真核细胞中[7], 在动物体内主要存在于肾、肝、胰等脏器, 在谷胱苷肽的新陈代谢中起到了重要的作用[8]. GGT是谷氨酰循环中的关键酶, 可特异性催化γ-谷氨酰基的转移反应, H pylori GGT被发现也具有相似的特点, 但是H pylori GGT的成熟过程仍然不十分清楚.
与其他病原体相比, H pylori的感染是终生的, 目前持续感染的原因还不清楚. 有研究表明, CD4+ T细胞对于H pylori的清除有作用, 但是GGT作为一个新发现的免疫抑制剂通过诱导细胞周期停滞在G1时相抑制了T细胞的增殖, 对H pylori的定植有一定的作用[9].
正常胃黏膜的结构功能依赖于黏膜上皮细胞增殖和凋亡之间的动态平衡, H pylori感染能够引起细胞增生与凋亡之间的平衡失调, 从而导致病变的发生, 增加胃癌发生的风险. 目前, 已经对H pylori的凋亡诱导因素做了一些研究[10-12]. 有报道GGT具有诱导细胞凋亡的活性, 目前被广泛接受的观点是线粒体在凋亡的调节中起到了关键的作用[13]. 细胞凋亡的线粒体通路由含BH3结构域的Bcl-2家族成员Bid、Bad、Bim、Harikari、Noxa等在接受到胞内的死亡信号后激活. 这些含BH3结构域的Bcl-2家族成员与另外的Bcl-2家族成员(Bax亚家族成员Bax、Bak等, 主要松散的结合在线粒体外膜面或存在于胞质)作用, 导致后者的寡聚并插入线粒体膜, 引起线粒体膜通透性改变, 跨膜电位丢失, 释放细胞色素C和其他蛋白. 细胞色素C的释放是线粒体凋亡路径的主要步骤[14]. 在 ATP/dATP存在的情况下, 细胞色素C与凋亡蛋白酶活化因子(apoptotic protease-activating factor, Apaf-1)形成多聚复合体, 通过Apaf-1氨基端的Caspase募集结构域(caspase recruitment domain, CARD)募集胞质中的Caspase-9前体, 并使其自我剪切活化并启动Caspase级联反应, 激活下游的Caspase-3 和Caspase-7[15], 完成其相应底物的剪切, 引起细胞凋亡. GGT在胃癌细胞中能够诱导线粒体释放细胞色素C进入细胞质, 激活Caspase-9和 Caspase-3, 引起Bax的上调以及Bcl-2和Bcl-xL的下调[16], 引起凋亡级联反应, 最终导致程序性细胞死亡. 诱导的细胞凋亡在致胃癌过程中可能起到了重要作用[17]. 相反, GGT缺陷的突变体不能诱导细胞凋亡. 这些结果显示H pylori GGT参与了线粒体介导的程序性细胞死亡.
为了进一步弄清H pylori GGT在线粒体介导的细胞凋亡中的作用及临床上如何根治H pylori. 我们成功克隆了来源于胃癌菌株的H pylori GGT基因, 利用大肠杆菌高密度生长的优势和易于表达蛋白、纯化简单等特点, 进行了H pylori GGT基因在原核系统的表达, 为后续的功能研究、蛋白制备及其抗体研制提供了良好的实验材料.
H pylori是一种革兰染色阴性的微需氧菌, 世界范围内约有50%的人群感染有H pylori, 其感染是消化性溃疡的主要病因之一, 也是胃癌的主要危险因素. GGT是一种催化肽基转移作用的酶, 在H pylori诱导的线粒体介导的程序性细胞死亡中, 主要是通过诱导线粒体释放细胞色素C进入细胞质和激活 Caspase家族成员起作用.
倪润洲, 教授, 南通大学附属医院消化内科
H pylori被发现以来, 其感染与消化系疾病密切相关, 其致病机制一直是研究的焦点, 尤其是与胃癌的相关性. GGT已经被证实与细胞凋亡途径有关, 但是其具体作用机制还有待进一步研究.
Kim et al已经证实GGT参与H pylori诱导的线粒体介导的程序性细胞死亡. GGT作用时间越长, Caspase-3 和Caspase-9的活性越大, Bax的活性上调而抗凋亡的Bcl-2和Bcl-xL的活性下调. 凋亡信号引起线粒体的改变, 细胞色素C释放进入细胞质中. 相反, GGT缺陷的突变体不能诱导凋亡. 这些结果显示H pylori GGT通过线粒体介导的通路诱导细胞凋亡.
本研究方法正确, 结果可靠, 具有较好的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Kraft C, Suerbaum S. Mutation and recombination in Helicobacter pylori: mechanisms and role in generating strain diversity. Int J Med Microbiol. 2005;295:299-305. [PubMed] [DOI] |
| 2. | Shibayama K, Doi Y, Shibata N, Yagi T, Nada T, Iinuma Y, Arakawa Y. Apoptotic signaling pathway activated by Helicobacter pylori infection and increase of apoptosis-inducing activity under serum-starved conditions. Infect Immun. 2001;69:3181-3189. [PubMed] [DOI] |
| 3. | Gogvadze V, Orrenius S, Zhivotovsky B. Multiple pathways of cytochrome c release from mitochondria in apoptosis. Biochim Biophys Acta. 2006;1757:639-647. [PubMed] |
| 4. | Sung JJ, Leung WK, Go MY, To KF, Cheng AS, Ng EK, Chan FK. Cyclooxygenase-2 expression in Helicobacter pylori-associated premalignant and malignant gastric lesions. Am J Pathol. 2000;157:729-735. [PubMed] [DOI] |
| 5. | Kim KM, Lee SG, Park MG, Song JY, Kang HL, Lee WK, Cho MJ, Rhee KH, Youn HS, Baik SC. Gamma-glutamyltranspeptidase of Helicobacter pylori induces mitochondria-mediated apoptosis in AGS cells. Biochem Biophys Res Commun. 2007;355:562-567. [PubMed] [DOI] |
| 6. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] [DOI] |
| 7. | Barnes IH, Bagnall MC, Browning DD, Thompson SA, Manning G, Newell DG. Gamma-glutamyl transpeptidase has a role in the persistent colonization of the avian gut by Campylobacter jejuni. Microb Pathog. 2007;43:198-207. [PubMed] [DOI] |
| 8. | Zhang H, Forman HJ, Choi J. Gamma-glutamyl transpeptidase in glutathione biosynthesis. Methods Enzymol. 2005;401:468-483. [PubMed] [DOI] |
| 9. | Schmees C, Prinz C, Treptau T, Rad R, Hengst L, Voland P, Bauer S, Brenner L, Schmid RM, Gerhard M. Inhibition of T-cell proliferation by Helicobacter pylori gamma-glutamyl transpeptidase. Gastroenterology. 2007;132:1820-1833. [PubMed] [DOI] |
| 10. | Kuck D, Kolmerer B, Iking-Konert C, Krammer PH, Stremmel W, Rudi J. Vacuolating cytotoxin of Helicobacter pylori induces apoptosis in the human gastric epithelial cell line AGS. Infect Immun. 2001;69:5080-5087. [PubMed] [DOI] |
| 11. | Le'Negrate G, Ricci V, Hofman V, Mograbi B, Hofman P, Rossi B. Epithelial intestinal cell apoptosis induced by Helicobacter pylori depends on expression of the cag pathogenicity island phenotype. Infect Immun. 2001;69:5001-5009. [PubMed] [DOI] |
| 12. | Pompella A, De Tata V, Paolicchi A, Zunino F. Expression of gamma-glutamyltransferase in cancer cells and its significance in drug resistance. Biochem Pharmacol. 2006;71:231-238. [PubMed] [DOI] |
| 13. | Orrenius S. Mitochondrial regulation of apoptotic cell death. Toxicol Lett. 2004;149:19-23. |
| 14. | Borner C. The Bcl-2 protein family: sensors and checkpoints for life-or-death decisions. Mol Immunol. 2003;39:615-647. [PubMed] [DOI] |
| 15. | Robertson JD, Orrenius S, Zhivotovsky B. Review: nuclear events in apoptosis. J Struct Biol. 2000;129:346-358. [PubMed] [DOI] |
| 16. | Choi IJ, Kim JS, Kim JM, Jung HC, Song IS. Effect of inhibition of extracellular signal-regulated kinase 1 and 2 pathway on apoptosis and bcl-2 expression in Helicobacter pylori-infected AGS cells. Infect Immun. 2003;71:830-837. [PubMed] [DOI] |
| 17. | Shibayama K, Kamachi K, Nagata N, Yagi T, Nada T, Doi Y, Shibata N, Yokoyama K, Yamane K, Kato H. A novel apoptosis-inducing protein from Helicobacter pylori. Mol Microbiol. 2003;47:443-451. [PubMed] [DOI] |