修回日期: 2008-04-23
接受日期: 2008-05-14
在线出版日期: 2008-06-28
目的: 研究转染HBV的HepG2.2.15细胞株在体外促进肝星状细胞中Ⅰ、Ⅲ型胶原的表达, 进而探讨HBV促肝细胞纤维化的机制.
方法: 将HepG2和HepG2.2.15细胞株分别在体外与肝星状细胞共培养, 以单独培养的肝星状细胞为对照组. 取培养后24、48、72 h 3个时间点, 以RT-PCR定量检测肝星状细胞中Ⅰ、Ⅲ型胶原mRNA的表达; 以Western blot定量检测肝星状细胞中Ⅰ、Ⅲ型胶原蛋白的表达.
结果: 与对照组和与HepG2共培养的肝星状细胞比较, 与HepG2.2.15共培养的肝星状细胞中Ⅰ、Ⅲ型胶原mRNA的表达明显增高, 以72 h差异最为显著(P<0.01); 与HepG2.2.15共培养的肝星状细胞中Ⅰ、Ⅲ型胶原蛋白的表达也明显增高, 以48 h差异最为显著(P<0.01).
结论: 与HepG2.2.15细胞株共培养后, 肝星状细胞中肝纤维化相关因子的表达明显增强, HBV具有诱导肝细胞纤维化的重要作用.
引文著录: 哈明昊, 饶慧瑛, 刘峰, 潘孝本, 封波, 陈红松, 魏来. 乙型肝炎病毒促进Ⅰ型胶原和Ⅲ型胶原在肝星状细胞中的表达. 世界华人消化杂志 2008; 16(18): 2031-2035
Revised: April 23, 2008
Accepted: May 14, 2008
Published online: June 28, 2008
AIM: To investigate whether HepG2.2.15 could induce expression of fibrosis-related factors in hepatic stellate cells in vitro and further to explore the mechanism of HBV inducing fibrogenesis.
METHODS: The hepatic stellate cells were co-cultured with HepG2 or HepG2.2.15 in vitro and the hepatic stellate cells cultured alone were used as control. For differentiation mRNA expression of Collagen I and III in hepatic stellate cells, real-time PCR was performed; for differentiation protein expression of Collagen I and III in hepatic stellate cells, Western blot analysis was performed.
RESULTS: Compared with the control and the hepatic stellate cells co-cultured with HepG2, mRNA expression of Collagen I and III were significantly higher in the hepatic stellate cells co-cultured with HepG2.2.15 and the most prominent effect was found at 72 h (P < 0.01); the protein expression of Collagen I and III were higher significantly in the hepatic stellate cells co-cultured with HepG2.2.15 and the most prominent effect was found at 48 h compared with control and the hepatic stellate cells co-cultured with HepG2 (P < 0.01).
CONCLUSION: The expression of fibrosis-related factors in hepatic stellate cells are increased greatly after being co-cultured with HepG2.2.15. HBV is capable of inducing fibrogenesis in vitro.
- Citation: Ha MH, Rao HY, Liu F, Pan XB, Feng B, Chen HS, Wei L. Increased expression of Collagen I and Collagen III induced by HBV in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2008; 16(18): 2031-2035
- URL: https://www.wjgnet.com/1009-3079/full/v16/i18/2031.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i18.2031
乙型肝炎病毒(hepatitis B virus, HBV)感染呈世界性流行, 但不同地区HBV感染的流行强度差异很大. 全世界有3.5亿慢性HBV感染者, 每年约有50-120万人死于HBV感染相关的并发症[1-4]. HBV的感染导致肝细胞的损伤和炎症, 与肝纤维化和肝细胞癌的发生呈强相关性[5-8]. 肝纤维化的发生是由于细胞外基质(extracellular matrix, ECM)的过多积聚, 构成ECM的主要成分是胶原纤维Ⅰ(CollagenⅠ, ColⅠ)和胶原纤维Ⅲ(Collagen Ⅲ, Col Ⅲ)[9-14]. 激活的肝星状细胞(hepatic stellate cell, HSC)是合成ECM的主要效应细胞[15-17]. 转染了HBV的HepG2.2.15细胞株的上清中含有HBV的各相关病毒蛋白及HBV复制中间体; 目前, HepG2.2.15细胞株是研究HBV活性公认的体外模型[18-20]. 虽然研究表明HBV与肝细胞纤维化、肝硬化呈强相关性; 但是HBV致肝细胞纤维化的机制仍未阐明. 目前缺乏HBV直接感染肝星状细胞的证据. 感染HBV的肝细胞是否促进肝细胞纤维化以及其机制、调控通路是什么? 本研究利用体外细胞共培养技术对这一课题进行研究.
DMEM高糖培养基以及胎牛血清(FBS)购自美国Hyclone公司; RNA反转录试剂盒、荧光定量PCR反应扩增仪TaKaRa Ex Taq R-PCR Version.2.1购自TaKaRa公司; 人肝星状细胞系LX-2, 由Friedman SL教授和徐列明教授(上海中医药大学肝病研究所)惠赠; HepG2和HepG2.2.15细胞系为本所保存细胞系; Transwell细胞共培养系统购自Corning公司; 小鼠抗人ColⅠ和Col Ⅲ一抗购自R&D公司; PBS由北京大学人民医院生产. BCATM蛋白定量试剂盒和ECL Western印染发光试剂购自Pierce公司; 硝酸纤维素膜购自Gelman公司.
1.2.1 细胞共培养: 以含100 mL/L FBS DMEM养基分别培养LX-2、HepG2和HepG2.2.15细胞, 选取生长状态良好的细胞, 按照HepG2和HepG2.2.15细胞与LX-2细胞比例分别为4:1接种于Transwell细胞共培养系统中. HepG2和HepG2.2.15细胞接种于可渗透性滤膜上层; LX-2细胞接种于可渗透性滤膜下层. LX-2细胞接种密度为5×107个/L, HepG2和HepG2.2.15细胞接种密度为2×108个/L. 对照组LX-2细胞按照5×107个/L密度接种于普通6孔板, 无其他细胞与其共培养. 等待细胞生长至50%融合度时以PBS漂洗三遍, 加入含2 mL/L FBS DMEM培养基培养至72 h.
1.2.2 引物设计: 利用Bioedit软件设计引物. ColⅠ上游引物序列: ACCTCCGGCTCCT GCTCCTC, ColⅠ下游引物序列: GGCTC GGGTTTCCACACGTCTC, ColⅢ上游引物序列: TGGCTACTTCTCGCTCTGCTTC, ColⅢ下游引物序列: ACGGATCCTGAG TCACAGACAC.
1.2.3 RNA逆转录: 逆转录体系为: TOTAL RNA 1.5 μg, MgCl2 2 μL, 10×RT Buffer 1 μL, dNTP 1 μL, RNase Inhibitor 0.25 μL, AMV Rverse Transcriptase 0.5 μL, Oligo dT primer 0.5 μL, RNase free ddH2O 3.75 μL. 反应按照以下过程进行: 30℃ 10 min, 42℃ 50 min, 95℃ 5 min, 4℃ 5 min.
1.2.4 RT-PCR: 反应体系为: TaKaRa Ex Taq 0.25 μL, PCR Forward Primer 0.5 μL, PCR Reverse Primer 0.5 μL, dNTP Mixture 0.75 μL, 模板 1 μL, Mg2+ Solution 0.5 μL, 5×Real time PCR Buffer(Mg2+ Free) 5 μL, Even green 2.5 μL, 加ddH2O至总体系25 μL. PCR反应条件: 95℃ 120 s, 95℃ 15 s, 60℃ 20 s, 72℃ 20 s. 将预实验的PCR产物按照测吸光度值(A值)后以10倍浓度梯度进行稀释, 选择1/1000, 1/10 000, 1/100 000, 1/1 000 000浓度的稀释产物作为标准品模版, 进行荧光定量PCR反应并同时在荧光定量PCR仪中输入以上4个浓度梯度的浓度数值. 通过这4个标准品生成的反应数据, 软件Rotor-Gene 6.0根据反应的荧光实时监控数据和标准品的浓度关系, 生成标准曲线. 通过此标准曲线来计算在标准曲线所划定的CT值时的样品的浓度. 通过所得到的浓度可计算出样品在此刻的拷贝数.
1.2.5 Western blot: 参照Bio-Rad公司提供的配胶方案配制120 g/L分离胶和50 g/L积层胶. 积层胶聚合时, 蛋白样品与2×上样缓冲液等体积混合, 100℃煮沸5 min使蛋白变性. 用微量移液器按预定顺序加样, 每孔上样50 μg总蛋白. 上样后, 200 V稳压条件下进行电泳, 直至溴酚兰到达分离胶底部(约45 min), 关闭电源结束电泳. 转膜后, 把硝酸纤维素膜转移到杂交袋中室温下摇床预杂交3 h按0.1 mL/cm2膜面积加入5% Blotto预杂交液及分别加入1:200至1:1000稀释度的小鼠抗ColⅠ和Col Ⅲ抗体, 4℃摇床过夜. 5% Blotto预杂交液漂洗三次, 每次15 min. 按0.1 mL/cm2膜面积加入5% Blotto预杂交液及分别加入1:1000稀释度的辣根过氧化物酶标记的抗鼠IgG抗体, 室温下摇床杂交45 min. 5% Blotto预杂交液漂洗1次, 15 min, 0.05% TBS-T漂洗2次, 每次10 min, 1×TBS漂洗一次, 10 min. ECL显影, 用Umax2100XL扫描仪以及Quantity One图像分析软件测定条带的A值, 以Col Ⅰ和Col Ⅲ的A值/β-actin的A值代表Col Ⅰ和Col Ⅲ蛋白的相对表达量.
统计学处理 数据均以mean±SD表示, 用SPSS11.0统计软件, 组间差异采用单因素方差分析.
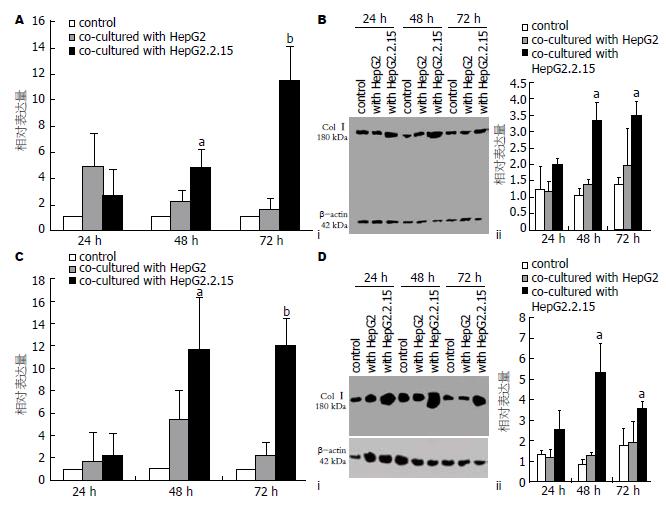
各实验组均取同样条件下培养的3份标本进行检测, 取其平均值. 将单独培养组LX-2细胞中Col Ⅰ及Col Ⅲ mRNA的表达量设定为1倍, 他们在共培养实验组的表达量与其分别比较发现, 与HepG2细胞共培养实验组在24、48、72 h时间点分别增高约4.1、2.2、1.7倍和1.8、5.7、2.2倍(均P<0.05); 与HepG2.2.15细胞共培养实验组在24、48、72 h时间点分别增高约2.4、4.2、11.7倍和2.1、11.7、11.9倍(均P<0.01). 其中以72 h与HepG2.2.15共培养组表达差异最为显著(图1).
各实验组均取同样条件下培养的3份标本进行检测, 取其平均值. 发现与单独培养组LX-2细胞中Col Ⅰ及Col Ⅲ蛋白的表达量相比, 与HepG2细胞共培养实验组在24、48、72 h时间点分别增高约1.0、1.1、1.2倍和0.9、1.3、1.1倍(均P<0.05); 与HepG2.2.15细胞共培养实验组在24、48、72 h时间点分别增高约1.7、2.2、1.9倍和2.2、7.3、2.1倍(均P<0.01). 其中以48 h与HepG2.2.15共培养组表达差异最为显著(图1).
多种研究表明, 抑制HSC的表达明显减少肝纤维化基质的沉积[21-25]. 目前为止, 尚未有研究表明HBV能够感染HSC, 也未有感染HBV的HSC细胞建系成功. 缺乏HBV直接感染HSC的证据, 对于研究HBV致肝细胞纤维化的机制提出新的难题. 转染了HBV的HepG2.2.15细胞上清中含有HBV的各种蛋白及HBV的复制中间体[26-32], 是目前研究HBV的有效模型. 我们对HepG2.2.15细胞与HSC培养后能否促进肝星状细胞纤维化表达增强进行了研究.
在实验中我们利用细胞共培养技术, 其优点是: 利用聚碳酸酯膜将两种细胞分隔开, 避免了两种细胞的直接作用, 而直径小的多的细胞因子可以自由通过膜, 在细胞间发挥调控作用.
本文对与HepG2和HepG2.2.15细胞共培养后的LX-2细胞中Col Ⅰ和Col Ⅲ的表达, 从基因水平和蛋白水平进行检测发现, 与对照组相比, 与HepG2和HepG2.2.15细胞共培养后的LX-2细胞中Col Ⅰ和Col Ⅲ的表达水平均有明显升高, 与HepG2.2.15细胞共培养后效应更为显著. 其中与HepG2.2.15细胞共培养后Col Ⅰ和Col Ⅲ mRNA的表达在72 h升高最为明显; Col Ⅰ和Col Ⅲ蛋白的表达量在48 h亦有明显升高.
本研究证明了与HepG2细胞相比, HepG2.2.15细胞能明显促进肝星状细胞中Col Ⅰ和Col Ⅲ的表达. HBV可能通过促进肝星状细胞中肝纤维化蛋白的表达, 发挥重要的致肝细胞纤维化的作用.
乙型肝炎病毒(HBV)感染呈世界性流行, HBV的感染导致肝细胞的损伤和炎症, 与肝纤维化和肝细胞癌的发生呈强相关性. 肝纤维化的发生是由于细胞外基质(ECM)的过多积聚, 构成ECM的主要成分是胶原纤维Ⅰ(Col Ⅰ)和胶原纤维Ⅲ(ColⅢ). 激活的肝星状细胞(HSC)是合成ECM的主要效应细胞. 转染了HBV的HepG2.2.15细胞株的上清中含有HBV的各相关病毒蛋白及HBV复制中间体; 目前, HepG2.2.15细胞株是研究HBV活性公认的体外模型.
吴君, 主任医师, 贵州省贵阳市贵阳医学院附属医院感染科; 刘正稳, 教授, 西安交通大学医学院第一附属医院内科.
本领域中研究的热点和重点是与肝纤维化发生相关的细胞因子的表达.
本研究以体外共培养试验证明, HBV通过感染肝细胞释放促肝纤维化因子诱导肝纤维化的形成.
本研究证明了HBV感染后致肝纤维化的调控途径, 明确了HBV促进释放的重要促纤维化因子, 为临床治疗HBV感染后肝纤维化指明了靶点.
细胞共培养技术: 以Transwell细胞共培养系统, 利用聚碳酸酯膜将两种细胞分隔开, 避免了两种细胞的直接作用, 而直径小的多的细胞因子可以自由通过膜, 在细胞间发挥调控作用.
本文选题有一定的新颖性和实际应用价值, 实验设计方案较合理, 结果客观, 但讨论部分深度略显不够.
编辑:李军亮 电编:吴鹏朕
| 1. | Lavanchy D. Hepatitis B virus epidemiology, disease burden, treatment, and current and emerging prevention and control measures. J Viral Hepat. 2004;11:97-107. [PubMed] [DOI] |
| 2. | Steffen M, Cornberg M, Buggisch P. Treatment of chronic hepatitis C with consensus interferon in relapsers and non- responders to interferon-based therapy. Hepatogastroenterology. 2007;54:2368-2372. [PubMed] |
| 3. | Oyama T, Sadamori H, Matsukawa H, Murata H, Umeda Y, Watanabe Y, Ozaki M, Iwagaki H, Tanaka N, Yagi T. Small liver graft regenerates through immediate increase of HGF and IL-6--possible involvement of sinusoidal tensile/shear stress in small liver graft. Hepatogastroenterology. 2007;54:2078-2083. [PubMed] |
| 4. | Delgado JS. Evolving trends in nonalcoholic fatty liver disease. Eur J Intern Med. 2008;19:75-82. [PubMed] [DOI] |
| 5. | Santambrogio R, Costa M, Barabino M, Opocher E. Laparoscopic radiofrequency of hepatocellular carcinoma using ultrasound-guided selective intrahepatic vascular occlusion. Surg Endosc. 2008; Feb 5. [Epub ahead of print]. [PubMed] |
| 6. | Raoul JL. Natural history of hepatocellular carcinoma and current treatment options. Semin Nucl Med. 2008;38:S13-S18. [PubMed] [DOI] |
| 7. | Chen YB, Sun YA, Gong JP. Effects of rapamycin in liver transplantation. Hepatobiliary Pancreat Dis Int. 2008;7:25-28. [PubMed] |
| 8. | Kishor S, Turner ML, Borg BB, Kleiner DE, Cowen EW. Cutaneous sarcoidosis and primary biliary cirrhosis: A chance association or related diseases? J Am Acad Dermatol. 2008;58:326-335. [PubMed] [DOI] |
| 9. | Lau JY, Wright TL. Molecular virology and pathogenesis of hepatitis B. Lancet. 1993;342:1335-1340. [PubMed] [DOI] |
| 10. | Hopfner M, Schuppan D, Scherubl H. Growth factor receptors and related signalling pathways as targets for novel treatment strategies of hepatocellular cancer. World J Gastroenterol. 2008;14:1-14. [PubMed] [DOI] |
| 11. | Andersson KL, Chung RT. Hepatic schistosomiasis. Curr Treat Options. Gastroenterol. 2007;10:504-512. [PubMed] [DOI] |
| 12. | McCrudden R, Iredale JP. Liver fibrosis, the hepatic stellate cell and tissue inhibitors of metalloproteinases. Histol Histopathol. 2000;15:1159-1168. [PubMed] |
| 13. | Knittel T, Kobold D, Saile B, Grundmann A, Neubauer K, Piscaglia F, Ramadori G. Rat liver myofibroblasts and hepatic stellate cells: different cell populations of the fibroblast lineage with fibrogenic potential. Gastroenterology. 1999;117:1205-1221. [PubMed] [DOI] |
| 14. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 15. | Fonseca JC. Natural history of chronic hepatitis B. Rev Soc Bras Med Trop. 2007;40:672-677. [PubMed] [DOI] |
| 16. | Bissell DM. Chronic liver injury, TGF-beta, and cancer. Exp Mol Med. 2001;33:179-190. [PubMed] |
| 17. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 18. | Zhang LJ, Yu JP, Li D, Huang YH, Chen ZX, Wang XZ. Effects of cytokines on carbon tetrachloride-induced hepatic fibrogenesis in rats. World J Gastroenterol. 2004;10:77-81. [PubMed] |
| 19. | Paradis V, Perlemuter G, Bonvoust F, Dargere D, Parfait B, Vidaud M, Conti M, Huet S, Ba N, Buffet C. High glucose and hyperinsulinemia stimulate connective tissue growth factor expression: a potential mechanism involved in progression to fibrosis in nonalcoholic steatohepatitis. Hepatology. 2001;34:738-744. [PubMed] [DOI] |
| 20. | Terziyski K, Andonov V, Marinov B, Kostianev S. Exercise performance and ventilatory efficiency in patients with mild and moderate liver cirrhosis. Clin Exp Pharmacol Physiol. 2008;35:135-140. [PubMed] |
| 21. | Chan HL, Tse CH, Mo F, Koh J, Wong VW, Wong GL, Lam Chan S, Yeo W, Sung JJ, Mok TS. High viral load and hepatitis B virus subgenotype ce are associated with increased risk of hepatocellular carcinoma. J Clin Oncol. 2008;26:177-182. [PubMed] [DOI] |
| 22. | Nagase H. Activation mechanisms of matrix metalloproteinases. Biol Chem. 1997;378:151-160. [PubMed] |
| 23. | Sato H, Seiki M. Membrane-type matrix metalloproteinases (MT-MMPs) in tumor metastasis. J Biochem. 1996;119:209-215. [PubMed] |
| 24. | Sebastiani G, Vario A, Guido M, Alberti A. Performance of noninvasive markers for liver fibrosis is reduced in chronic hepatitis C with normal transaminases. J Viral Hepat. 2008;15:212-218. [PubMed] [DOI] |
| 25. | La Villa G, Gentilini P. Hemodynamic alterations in liver cirrhosis. Mol Aspects Med. 2008;29:112-118. [PubMed] [DOI] |
| 26. | Roingeard P, Lu SL, Sureau C, Freschlin M, Arbeille B, Essex M, Romet-Lemonne JL. Immunocytochemical and electron microscopic study of hepatitis B virus antigen and complete particle production in hepatitis B virus DNA transfected HepG2 cells. Hepatology. 1990;11:277-285. [PubMed] [DOI] |
| 27. | Meda F, Zuin M, Invernizzi P, Vergani D, Selmi C. Serum autoantibodies: a road map for the clinical hepatologist. Autoimmunity. 2008;41:27-34. [PubMed] [DOI] |
| 28. | Crawford SE, Stellmach V, Murphy-Ullrich JE, Ribeiro SM, Lawler J, Hynes RO, Boivin GP, Bouck N. Thrombospondin-1 is a major activator of TGF-beta1 in vivo. Cell. 1998;93:1159-1170. [PubMed] [DOI] |
| 29. | Kuiper JJ, de Man RA, van Buuren HR. Review article: Management of ascites and associated complications in patients with cirrhosis. Aliment Pharmacol Ther. 2007;26 Suppl 2:183-193. [PubMed] |
| 30. | Gao B, Jeong WI, Tian Z. Liver: An organ with predominant innate immunity. Hepatology. 2008;47:729-736. [PubMed] [DOI] |
| 31. | Arteel GE. Silencing a killer among us: ethanol impairs immune surveillance of activated stellate cells by natural killer cells. Gastroenterology. 2008;134:351-353. [PubMed] [DOI] |