修回日期: 2008-03-17
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 认识肝细胞肝癌中含IQ模体的GTP酶活化蛋白2(IQ motif containing GTPase activating protein 2, IQGAP2)的亚细胞定位和表达, 及其在肝细胞肝癌(hepatocellular carcinoma, HCC)中的作用.
方法: 分别通过Western blot、免疫荧光和免疫组织化学染色分析IQGAP2在7种人肝癌细胞与正常肝细胞系中的表达、定位, 及其在HCC组织样本中的表达与分布.
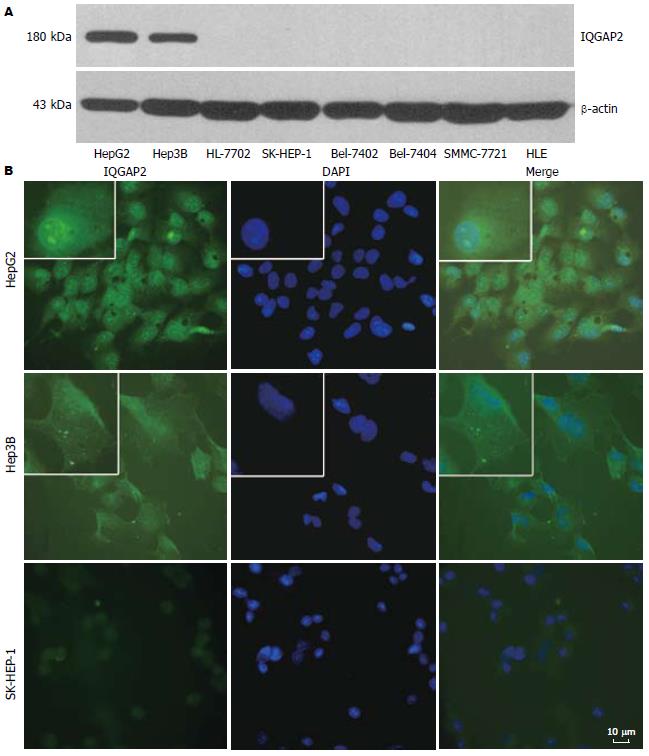
结果: IQGAP2在Bel-7402、Bel-7404、SMMC-7721、SK-HEP-1、HLE和HL-7702等肝癌和正常成人肝细胞系中不表达, 仅在HepG2和Hep3B等2种甲胎蛋白(AFP)表达阳性的人肝癌细胞系中表达. IQGAP2主要分布于细胞质, 此外, 在HepG2细胞中还具有明显的核膜和核仁定位. IQGAP2在HCC组织中表达降低(56.9%, 29/51). 其中, 19例配对HCC组织的IQGAP2表达与肿瘤大小, AJCC分期和血清AFP水平相关(P = 0.020, P = 0.017, P = 0.002); 38例配对组织IQGAP2在肿瘤和癌旁正常肝组织中主要定位于胞质, 部分细胞伴有胞核和胞膜定位. 但是, IQGAP2的表达与肿瘤大小、分化程度、AJCC分期以及血清AFP表达水平无相关性.
结论: IQGAP2蛋白可能参与细胞黏附、信号转导等过程, 在肝癌的发生发展中发挥重要作用, 是一种潜在的抑癌基因.
引文著录: 孙玉琳, 刘芳, 鲁海珍, 吕宁, 周兰萍, 蔡建强, 刘尚梅, 赵晓航. IQGAP2在肝细胞肝癌中的表达及其临床意义. 世界华人消化杂志 2008; 16(12): 1309-1316
Revised: March 17, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To investigate the expression of IQ motif containing GTPase activating protein 2 (IQGAP2) and its correlation with the clinicopathological parameters in hepatocellular carcinoma (HCC), and to reveal the potential mechanisms of IQGAP2 underlying human hepatocarcinogenesis.
METHODS: Western blot, immunofluorescence staining and immunohistochemical staining (IHC) were used to detect the expression and subcellular localization of IQGAP2 in 7 liver cancer and normal liver cell lines, as well as in 51 HCC tissue specimens. Meanwhile, the corresponding clinical data were analyzed retrospectively.
RESULTS: Only two liver cancer cell lines, HepG2 and Hep3B, expressed IQGAP2 at the protein level. In addition, immunofluorescence results revealed that IQGAP2 was localized in cytoplasm and nuclei. Apparent nucleolus and karyotheca staining was observed in HepG2 cells. Furthermore, histological validation of clinical samples showed that IQGAP2 expression was significantly down-regulated in tumor tissues (56.9%, 29/51). Meanwhile, the expression of IQGAP2 was associated with tumor size, AJCC staging and alpha-fetoprotein (AFP) expression level (P = 0.020; P = 0.017; P = 0.002). The immunohistochemical staining results from 38 HCC specimens showed that IQGAP2 was mainly localized at cytoplasm in the tumor and adjacent normal liver cells. In addition, partial cells had cell membrane and nuclear localization. However, definite association was not observed between IQGAP2 levels and tumor size, histological degree, AJCC staging or AFP expression status.
CONCLUSION: IQGAP2 expression is down-regulated in tumor tissues of HCC cases, and IQGAP2 may be a potential marker and tumor suppressor gene involved in HCC. These novel findings may provide a basis for the determination of mechanism(s) underlying human hepatocarcinogenesis.
- Citation: Sun YL, Liu F, Lu HZ, Lv N, Zhou LP, Cai JQ, Liu SM, Zhao XH. Expression of IQGAP2 and its clinical significance in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1309-1316
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1309.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1309
肝癌是一种严重危害人类健康的恶性肿瘤, 2000年全世界新发病例约564 000人, 位居所有恶性肿瘤第5位. 由于其恶性程度高、预后不良, 5年生存率不足10%. 中国是肝癌的高发区, 集中了全世界约54%的新发病例, 其中肝细胞肝癌(hepatocellular carcinomas, HCC)占原发性肝癌的90%以上[1-2]. 据1991-2000年169 871人口的死因抽样调查显示, HCC死亡率排在全部恶性肿瘤的第2位, 年死亡率为54.7/100 000(男81.2, 女29.0)[3]. 由于他具有很多生物学和化学性致癌因素, 因此他的分子癌变进展通路并不像结肠癌、胰腺癌、乳腺癌、肺癌等肿瘤那样明确. 甲胎蛋白(alpha-fetoprotein, AFP)是目前公认的HCC血清标志, 约60%-70%的HCC患者伴随血清AFP水平升高. 但是, 大约20%的慢性肝炎、20%-60%的肝炎肝硬化和某些胚胎性肿瘤时血清AFP水平也会升高[4-5]. 更重要的是, 大约20%-30%的HCC患者血清AFP水平不高, 而使AFP在辅助HCC诊断中的作用受限. 因此, 发现新的HCC相关肿瘤标志分子, 与AFP联用提高HCC诊断准确率以及揭示肝癌的分子癌变机制十分必要.
本实验室在前期工作中, 利用细胞培养的稳定同位素标记技术(stable isotope labeling with amino acid in cell culture, SILAC)结合高精度nanoLTQ-FT-MS/MS, 分析了肝癌细胞系HepG2和SK-HEP-1与正常成人肝细胞系HL-7702之间的差异蛋白表达谱, 发现含IQ模体的GTP酶活化蛋白2(IQ motif containing GTPase activating protein 2, IQGAP2)在肝癌细胞中表达水平明显改变. IQGAP2是Ras GTPase超家族成员, 分子质量约180 ku, 是一种肝脏特异表达蛋白, 近年发现IQGAP2还可以在活化血小板的丝状伪足和胃腺细胞canalicular membranes处表达[6-8]. 目前, 尚无IQGAP2在人类肝癌组织中表达情况的相关报道. 本研究通过观察IQGAP2在多个肝癌细胞系和51例临床标本中的表达状况, 初步探讨了IQGAP2在HCC发生发展中的潜在作用.
选取中国医学科学院肿瘤医院腹部外科2003-10/2006-11接受手术治疗的HCC新鲜组织标本19例和石蜡包埋标本(两者有6例重合病例)38例. 新鲜组织标本中包括18例男性和1例女性(均为HBV阳性), 年龄范围32-69(平均年龄52, 中位年龄50)岁. 其中AFP阳性(≥20 μg/L)12例, AFP正常或表达阴性(<20 μg/L)7例. 组织学Edmondson分级为Ⅰ-Ⅱ级3例、Ⅱ级10例、Ⅱ-Ⅲ级4例和Ⅲ级2例. 石蜡包埋样本38例, 含34例男性和4例女性, 除1例以外, 均为HBV感染阳性, 2例为HBV和HCV双重感染. 患者年龄30-71(平均年龄52, 中位年龄51)岁. 其中, 血清AFP阳性18例、AFP正常20例. Edmondson分级Ⅰ级2例、Ⅰ-Ⅱ级4例、Ⅱ级21例、Ⅱ-Ⅲ级6例和Ⅲ级4例、不明1例. 所有病例取材得到知情同意, 术前未行放化疗. 人肝癌细胞系HepG2、Hep3B和SK-HEP-1购自美国细胞中心(american type culture collection, ATCC, Rockville, MD). 培养于100 mL/L胎牛血清、1 mmol/L丙酮酸钠和2 mmol/L-谷氨酰氨的MEM培养基中. Bel-7402、Bel-7404、SMMC-7721和正常成人肝细胞系HL-7702购自中国科学院上海生物化学和细胞生物学研究所细胞库, 培养于含100 mL/L胎牛血清的RPMI 1640培养基中. HLE细胞购自日本科学研究资源库(Human Science Research Resources Bank, Osaka, Japan), 培养于含100 mL/L胎牛血清的DMEM培养基中. 以上细胞均在37℃、50 mL/L CO2条件下培养. MEM、RPMI 1640和DMEM培养基购自美国GIBCO/BRL公司; 胎牛血清购自PAA公司; 丙酮酸钠、L-谷氨酰氨、1 g/L(w/v)的poly-L-lysine原液, DAPI和蛋白酶抑制剂AEBSF、Leupeptin, β-actin mAb购自Sigma-Aldrich公司, Aprotinin购自Roche公司; Coomassie Plus Protein Assay蛋白定量试剂盒购自Pierce公司; 预染Bench Mark购自Invitrogen公司; 聚偏氟乙烯(PVDF)膜购自Amersham Pharmacia Biotech公司; ECL试剂购自Santa Cruz公司; 免疫组织化学S-P试剂盒购自福州迈新公司; DAB试剂盒购自北京中杉生物技术有限公司. IQGAP2 mAb购自Upstates公司.
新鲜组织标本一经分离, 迅速去除坏死的组织以及血管、系膜等结缔组织, 分别切取癌和远端切缘的正常肝组织, 放入预冷的生理盐水内, 洗3-4次. 称质量, 分装, 放入液氮速冻后转入-80℃冰箱保存. 用于免疫组化分析的标本经40 g/L甲醛固定.
1.2.1 蛋白提取和Western blot分析: 配对的肝癌和癌旁正常肝组织样品, 各取100 mg, 砸碎后于液氮中研磨成粉末状, 收集于Eppendorf管后, 置于冰上. 加入蛋白裂解液(50 mmol/L Tris-HCl(pH7.4), 150 mmol/L NaCl, 10 g/L NP-40, 10 g/L SDS, 1 mmol/L AEBSF, 20 mg/L aprotinin, 20 mg/L leupeptin, 1 mmol/L EDTA), 并用pellet motor(Sigma-Aldrich公司)匀浆, 冰上放置30 min, 使蛋白充分溶解. 冰上超声后, 4℃, 12 000 g, 离心15 min, 收集上清并分装, 保存于-80℃. 蛋白浓度经由Coomassie Plus Protein Assay试剂盒测定.
培养的正常肝及肝癌细胞待长到80%-90%融合时, 用4℃预冷的PBS洗3次后, 加入适量蛋白裂解液, 用细胞刮子将细胞刮下, 收集于Eppendorf管中, 蛋白获取方法同前述.
蛋白上样量为15 μg, 样品经100 g/L的SDS-PAGE分离以后, 湿转法转印至PVDF膜上. 50 g/L的脱脂牛奶室温封闭3 h后, 与鼠抗人IQGAP2(1:1000稀释)或β-actin(1:5000稀释)mAb室温反应3 h, 用含1 g/L Tween-20的TBS(TBST)溶液洗膜, 3 min×5次, 与辣根过氧化物酶标记的山羊抗小鼠IgG抗体(1:3000), 室温孵育1 h. 再次经TBST溶液洗膜, 3 min×8次后, ECL化学发光检测. 结果经ChampGel 3000(Sage Creation公司)灰度扫描后, 进行半定量分析.
1.2.2 间接免疫荧光分析: 首先用0.1 g/L的poly-L-lysine处理灭菌盖玻片的细胞接触面30 min, 而后弃去溶液, 将其置于6孔板中. 将3×105的HepG2、Hep3B和SK-HEP-1细胞接种于6孔板中, 37℃培养, 至细胞融合达60%-70%. 弃去培养基, 用4℃预冷的PBS洗3次, 吸干液体, 用甲醇室温固定30 min, PBS洗涤3 min×3次, 浸入30 mL/L的H2O2中10 min, PBS洗涤3 min×3次, 0.06% Triton-X 100处理10 min后, PBS洗3 min×3次. 山羊非免疫血清室温封闭10 min, 加入1:50稀释的IQGAP2单抗, 4℃孵育过夜. 采用PBS作为阴性对照. PBS洗涤3 min×3次以后, 加入FITC标记的二抗室温避光孵育30 min, PBS洗涤3 min×3次, 1:1000 DAPI染核, 500 mL/L甘油-PBS封片, Nikon E400荧光显微镜观察并照相.
1.2.3 免疫组织化学染色及其结果评分: IQGAP2的免疫组织化学染色, 采用S-P法. 包含肝癌和癌旁正常组织的组织切片经二甲苯脱蜡, 梯度乙醇水化后, 浸入30 mL/L的H2O2中10 min, 以阻断内源性过氧化物酶活性. 切片经PBS冲洗后, 将其置入0.01 mol/L, pH6.0的柠檬酸缓冲液沸水浴10 min, 以充分暴露抗原. 切片室温冷却30 min后, PBS冲洗, 滴加山羊非免疫血清, 室温封闭15 min, 然后滴加小鼠抗人IQGAP2 mAb(1:50稀释), 4℃孵育过夜. 阴性对照采用小鼠的非免疫血清替代一抗. 切片经PBS冲洗后, 滴加生物素标记的第二抗体, 室温孵育10 min, PBS冲洗, 而后滴加辣根过氧化物酶标记的链亲和素抗体, 室温孵育10 min, PBS冲洗. 切片组织经DAB溶液显色约2-3 min后, PBS终止反应, 再经苏木素复染、自来水冲洗返蓝. 经梯度乙醇脱水、二甲苯透明后, 中性树脂封片.
以细胞膜和细胞质出现均匀分布的棕黄色颗粒为表达阳性, 并用以下标准评价表达程度. 着色强度评分: 未着色(0分)、浅黄色(1分)、浅棕色(2分)和深棕色(3分); 观察结果评分, 即阳性细胞占病变细胞的百分比:<5%(0分); 5%-25%(1分); 26%-50%(2分); 51%-75%(3分)和>75%(4分). 染色强度评分和观察结果评分的乘积为表达程度, ≥2分认为是表达阳性.
统计学处理 数据采用SigmaStat3.5软件进行统计学处理. 计数资料根据适用情况选择Student's t检验或Mann-Whitney秩和检验, 计量资料采用Fisher's精确概率法或χ2检验, 以P<0.05为差异有统计学意义.
IQGAP2蛋白仅在HepG2和Hep3B肝癌细胞中表达, 在SK-HEP-1、Bel-7402、Bel-7404、SMMC-7721、HLE和正常成人肝细胞系HL-7702中均不表达(图1A). 选择IQGAP2表达与不表达的肝癌细胞系HepG2、Hep3B和SK-HEP-1经免疫荧光分析IQGAP2在肝癌细胞中的定位特征. 在HepG2细胞中, IQGAP2主要定位于胞质和胞核, 伴有明显的核膜与核仁定位; Hep3B中IQGAP2定位于胞质, 胞核有少量定位, 未见明显的核膜和核仁定位; SK-HEP-1细胞中基本不表达IQGAP2(图1B).
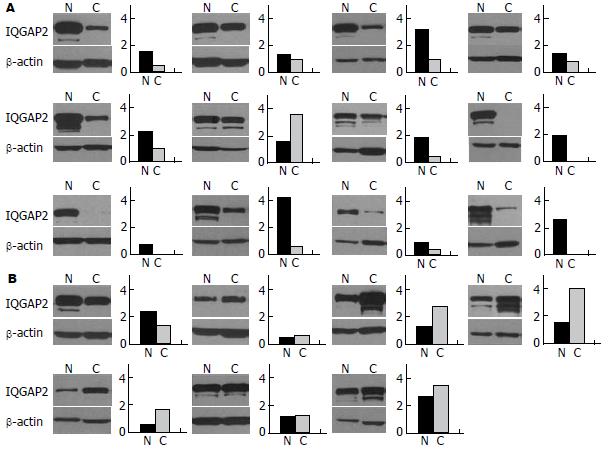
Western blot结果显示, 在19对肝癌配对样本中, 与癌旁正常肝组织相比, IQGAP2在12例肿瘤组织中表达降低, 在7例肿瘤组织中表达升高(图2). 灰度扫描结果显示, IQGAP2在癌旁正常组织中的表达灰度值中位数为1.52, 在肿瘤组织中的中位值为0.98, 经过Mann-Whitney秩和检验, 差异具有显著性(P = 0.044), 表明IQGAP2是一种在肝癌组织中表达下调的蛋白质. Fisher's精确概率检验发现, IQGAP2的表达与性别、年龄、肿瘤分化程度无关, 而与肿瘤大小、AJCC分期和血清AFP表达水平具有明显相关性(P<0.05, 表1), 表明肿瘤长径越大, 肿瘤分期越晚, AFP表达水平越高, IQGAP2越倾向于在肿瘤组织中表达降低.
| 分组 | Western blot分析 | P | 免疫组织化学染色 | P | 两者综合 | P | |||
| n | 下调(%) | n | 下调(%) | n | 下调(%) | ||||
| 性别 | |||||||||
| 男 | 18 | 61.1(11/18) | 1.000 | 34 | 55.9(19/34) | 1.000 | 47 | 57.4(27/47) | 1.000 |
| 女 | 1 | 100.0(1/1) | 4 | 50.0(2/4) | 4 | 50.0(2/4) | |||
| 年龄 | |||||||||
| ≥60 | 5 | 40.0(2/5) | 0.305 | 11 | 36.4(4/11) | 0.167 | 16 | 37.5(6/16) | 0.074 |
| <60 | 14 | 71.4(10/14) | 27 | 63.0(17/27) | 35 | 65.7(23/35) | |||
| 肿瘤长径 | |||||||||
| ≥5 cm | 10 | 90.0(9/10) | 0.020 | 17 | 52.9(9/17) | 1.000 | 23 | 65.2(15/23) | 0.395 |
| <5 cm | 9 | 33.3(3/9) | 21 | 57.1(12/21) | 28 | 50.0(14/28) | |||
| 肿瘤分化 | |||||||||
| 中高分化 | 13 | 53.8(7/13) | 0.333 | 27 | 51.9(14/27) | 0.528 | 37 | 51.4(19/37) | 0.339 |
| 中低分化 | 6 | 83.3(5/6) | 10 | 60.0(6/10) | 13 | 69.2(9/13) | |||
| N/A | 0 | 1 | 100.0(1/1) | 1 | 100.0(1/1) | ||||
| AJCC分期 | |||||||||
| I-II | 12 | 41.7(5/12) | 0.017 | 31 | 74.2(23/31) | 1.000 | 39 | 59.0(26/39) | 0.470 |
| III-Ⅳ | 7 | 100.0(7/7) | 7 | 71.4(5/7) | 12 | 83.3(10/12) | |||
| AFP表达 | |||||||||
| ≥20 μg/L | 12 | 91.7(11/12) | 0.002 | 18 | 44.4(8/18) | 0.328 | 27 | 59.3(16/27) | 0.782 |
| <20 μg/L | 7 | 14.3(1/7) | 20 | 65.0(13/20) | 24 | 54.2(13/24) | |||
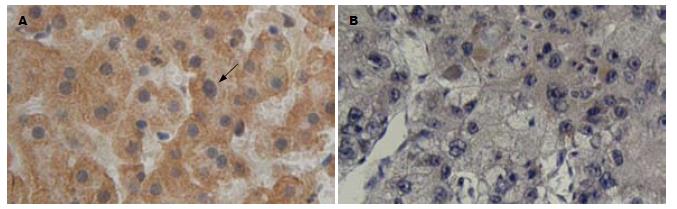
免疫组织化学染色结果显示, IQGAP2在肝癌及其癌旁组织中主要定位于细胞质, 部分细胞伴有胞核和胞膜定位. 呈弥漫性颗粒状分布, 癌旁正常组织中肝细胞染色强度明显高于肝癌细胞(图3). 在38例配对肝癌组织样本中, IQGAP2在肝癌组织表达阳性率为34.2%(13/38), 在癌旁正常肝组织表达阳性率为71.1%(27/38), 经χ2检验, 差异具有显著性(P = 0.003). 部分HCC样本(n = 12)肿瘤组织和癌旁正常组织IQGAP2均表达很弱, 无差异. 经过Fisher's精确概率检验, IQGAP2在肝癌组织中的表达与患者的年龄、性别、肿瘤大小、分化程度、AJCC分期和血清AFP水平间均没有明显相关性(P>0.05, 表1).
综合Western blot和免疫组织化学染色的结果, IQGAP2在肝癌组织中表达下调(56.9%, 29/51), 但与患者年龄、肿瘤大小、分化程度和血清AFP水平没有明显的相关性(表1).
IQGAPs蛋白是真核细胞内一个相对保守的蛋白家族, 从酵母、蠕虫到哺乳动物均有表达, 目前在人类至少发现了3个家族成员, 即IQGAP1、IQGAP2和IQGAP3. IQGAP1和IQGAP2由不同的基因编码, 两者具有62%的序列同源性[6]. 因为具有IQ和Ras GTPase激活蛋白相关(Ras GTPase-activating protein(GAP)-related domain, GRD)结构域, 这类蛋白被命名为IQGAPs. IQ结构域由4个串联排列的IQ模体组成, 能与钙调蛋白、肌球蛋白轻链和S100B结合. GRD结构域可以和Rho GTPase、CDC42、Rac1结合[9]. 此外, IQGAP2的N端还有1个CH(calponin homology)结构域, 其与F-actin结合蛋白结构域高度相似, 可能具有actin结合活性[6]. CH结构域的下游还具有1个WW, 能够结合多聚脯氨酸, 与SH3结构域具有功能相似性.
目前对IQGAP2同源蛋白IQGAP1的功能研究认为该蛋白的主要功能为参与细胞骨架调节作用. IQGAP1可直接结合actin, 另一方面, 他和其他的蛋白分子, 如Ras GTPase, CDC42结合, 间接调节细胞骨架组装[6,10]. IQGAP1可以和E-cadherin和β-catenin相互作用, 减少cadherin分子和细胞骨架系统间的相互作用, 削弱上皮细胞间的黏附. 而CDC42和Rac1可以抑制IQGAP1的这一效应[11-12]. 因此, IQGAP1有可能参与肿瘤的侵袭、转移过程. 而且, IQGAP1是多条信号转导通路的"脚手架"蛋白, 如与MEK1、MEK2、ERK2和B-Raf等蛋白间发生相互作用, 调节EGF刺激的MAPK/ERK信号转导[13-15]. 此外, 他还可以结合VEGF2型受体, 参与组织ROS依赖的VEGF信号转导[16]. 研究发现, IQGAP1在多种肿瘤中过表达. IQGAP1基因敲除小鼠产生胃腺体肥大和息肉[17]. 一些弥散型胃癌病例伴有IQGAP1基因扩增和过表达现象[18]. IQGAP1在结肠癌中表达上调, 特别是肿瘤侵袭前沿, 在高侵袭性的进展期肿瘤尤为明显[19]. Jadeski et al[20]报道, IQGAP1在乳腺癌细胞中高表达, 尤其是高转移细胞系, 高表达的IQGAP1可以促进乳腺癌细胞MCF-7的增生、侵袭和小鼠移植瘤模型中肿瘤血管生成能力. Dong et al[21]发现, 过表达IQGAP1及其肿瘤侵袭前沿的弥漫性表达模式与卵巢腺癌患者不良预后相关.
目前对IQGAP2的功能研究较少, 现有结果显示IQGAP2可以抑制Cdc42和Rac1内源性及RhoGAP活化的GTP水解率, 参与GTPase信号转导. 而且, 作为一种磷酸化蛋白质, 他还可能被[Ca2+]/PKC和cAMP信号调节[6]. 另外, IQGAP2可以中介体内溶酶体/吞噬体的结合过程[22]. 在对非洲爪蟾胚胎的研究发现, IQGAP2对于cadherin中介的细胞-细胞黏接和早期胚胎发育是必须的[23]. Jin et al[24]报道, IQGAP2在9种胃癌细胞系中的5个表达缺失, 而且47%的原发性胃癌组织中存在IQGAP2基因的甲基化, 其与IQGAP2蛋白的失表达高度相关, 敲除IQGAP2增加胃癌细胞系的侵袭能力. IQGAP2基因敲除小鼠表现为年龄依赖性的细胞凋亡和HCC发生. 同时, HCC细胞表现为IQGAP1高表达, 膜E-cadherin表达缺失, β-catenin的细胞质转位和激活等. 这一结果表明, IQGAP2可能是一种潜在的抑癌基因, 通过激活Wnt/β-catenin信号通路而促进肝癌的发生发展[25]. 尚无IQGAP2在人类肝细胞肝癌中表达情况的相关性报道.
本研究显示, IQGAP2蛋白在两个AFP+的肝癌细胞系中高表达, 在几个AFP正常或阴性的肝细胞系不表达, 这一趋势与Brill et al报道的mRNA水平检测结果基本一致[6]. 免疫荧光染色结果显示, IQGAP2主要定位于细胞质, 伴随部分细胞核染色以及在HepG2中还有明显的核膜和核定位, Hep3B和部分肝组织具有细胞膜定位信号. 已有研究认为, IQGAP2是一种胞质和胞膜定位蛋白质, 尚无细胞核定位的报道. 通过生物信息学预测软件PSORT Ⅱ分析(http://psort.ims.u-tokyo.ac.jp/form2.html)发现, IQGAP2具有DNA结合模体Leucine zipper pattern和Myb DNA-binding domain repeat signature 1, 是一种潜在的核蛋白[26]. NucPred软件(http://sbcweb.pdc.kth.se/cgi-bin/maccallr/nucpred/single.pl)分析结果也同样提示, IQGAP2可能是一种高可信的核蛋白[27]. 因而, 核内的IQGAP2可能参与基因的表达调控, 定位于细胞膜的IQGAP2则可能具有与IQGPA1相似的作用, 即影响上皮细胞间的黏附过程, 而胞质内的该蛋白则可能参与多条信号转导通路.
本研究利用Western blot和免疫组织化学染色分析了IQGAP2在肝细胞肝癌组织中的表达. 发现与癌旁正常组织相比, IQGAP2在肝癌组织中表达下调(56.9%, 29/51), 部分病例表达缺失. 这一结果与IQGAP2在胃癌组织中的表达趋势一致, 支持他可能是一种新的抑癌基因. Western blot结果还显示, 随着肿瘤长径的增加, AJCC分期的增高, IQGAP2的正常表达明显降低. 并且, 其表达与血清AFP水平明显负相关, AFP阳性病例表现为更明显的表达下调. 已知, AFP除了结合转运特性以外, 在胚胎期和成人肿瘤发生过程中, 还具有生长分化和细胞凋亡调节作用, 表明他可能是一种癌胚抗原[28-31]. 由于IQGAP2是一种潜在的抑癌基因, 因此可能造成了其与AFP的负相关关系. 但是, 免疫组织化学染色分析没有获得相关性结果, 这可能与免疫组化染色技术较Western blot敏感度低、组织芯片取材范围有限、病例数相对较少有关. 此外, 我们发现部分病例的肿瘤和癌旁正常组织IQGAP2表达均为阴性, 导致其整体下调率不高, 这也可能与上述原因有关. 研究结果提示IQGAP2参与正常肝细胞的细胞间通讯、细胞内信号转导与表达调控作用, 可能是一种新的抑癌基因, 对维持肝细胞正常形态与功能具有重要的作用. 因此, IQGAP2表达降低可能与肝细胞肝癌的发生发展相关, 其精确作用机制尚待阐明.
总之, 本研究探讨了IQGAP2在肝细胞肝癌中的表达和亚细胞定位特征, 发现IQGAP2在肝细胞肝癌组织中表达水平降低与肿瘤长径和血清AFP水平相关. IQGAP2可能在肝癌的发生发展过程中发挥重要作用. 该研究为深入理解肝细胞肝癌的癌变机制, 发现新的肿瘤标志分子以及阐明IQGAP2的功能提供借鉴.
肝细胞肝癌(HCC)的恶性程度高、预后不良, 5年生存率不足10%. 虽然甲胎蛋白(AFP)是目前公认的HCC标志物, 但至少20%的患者血清AFP水平并不高, 因此, 发现新的HCC相关肿瘤标志分子, 与AFP联用提高HCC诊断准确率以及深入理解HCC的分子癌变机制十分必要.
刘成海, 研究员, 上海中医药大学附属曙光医院(东部)肝病研究所.
含IQ模体的GTP酶活化蛋白2(IQGAP2)是近几年新发现的Ras GTPase超家族成员, 目前发现其参与细胞黏附、吞噬和信号转导过程. 基因敲除小鼠的研究结果认为他是一种新的抑癌基因.
在对非洲爪蟾胚胎的研究中发现, IQGAP2对于cadherin中介的细胞-细胞黏接和早期胚胎发育是必须的. 最近, 在胃癌和基因敲除小鼠模型中的研究结果表明, 他可能是一种新的抑癌基因.
本研究结果显示, IQGAP2还可以定位于胞核和胞膜. 核内的IQGAP2可能参与基因的表达调控, 胞膜和胞质内的该蛋白影响细胞间黏附和信号转导过程. IQGAP2在HCC组织中表达下调, 可能在肝癌的发生发展中发挥重要作用.
本研究为深入理解HCC的癌变机制, 发现新的肿瘤标志分子及阐明IQGAP2的功能提供借鉴.
本研究临床资料重要, 方法可靠, 证据可信, 写作规范, 是一篇优秀应用基础论文.
编辑:李军亮 电编:吴鹏朕
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] |
| 2. | Farazi PA, DePinho RA. Hepatocellular carcinoma pathogenesis: from genes to environment. Nat Rev Cancer. 2006;6:674-687. [PubMed] [DOI] |
| 3. | He J, Gu D, Wu X, Reynolds K, Duan X, Yao C, Wang J, Chen CS, Chen J, Wildman RP. Major causes of death among men and women in China. N Engl J Med. 2005;353:1124-1134. [PubMed] [DOI] |
| 4. | Fujiyama S, Tanaka M, Maeda S, Ashihara H, Hirata R, Tomita K. Tumor markers in early diagnosis, follow-up and management of patients with hepatocellular carcinoma. Oncology. 2002;62 Suppl 1:57-63. [PubMed] [DOI] |
| 5. | Spangenberg HC, Thimme R, Blum HE. Serum markers of hepatocellular carcinoma. Semin Liver Dis. 2006;26:385-390. [PubMed] [DOI] |
| 6. | Brill S, Li S, Lyman CW, Church DM, Wasmuth JJ, Weissbach L, Bernards A, Snijders AJ. The Ras GTPase-activating-protein-related human protein IQGAP2 harbors a potential actin binding domain and interacts with calmodulin and Rho family GTPases. Mol Cell Biol. 1996;16:4869-4878. [PubMed] |
| 7. | Schmidt VA, Scudder L, Devoe CE, Bernards A, Cupit LD, Bahou WF. IQGAP2 functions as a GTP-dependent effector protein in thrombin-induced platelet cytoskeletal reorganization. Blood. 2003;101:3021-3028. [PubMed] [DOI] |
| 8. | Chew CS, Okamoto CT, Chen X, Qin HY. IQGAPs are differentially expressed and regulated in polarized gastric epithelial cells. Am J Physiol Gastrointest Liver Physiol. 2005;288:G376-G387. [PubMed] [DOI] |
| 9. | Briggs MW, Sacks DB. IQGAP proteins are integral components of cytoskeletal regulation. EMBO Rep. 2003;4:571-574. [PubMed] [DOI] |
| 10. | Swart-Mataraza JM, Li Z, Sacks DB. IQGAP1 is a component of Cdc42 signaling to the cytoskeleton. J Biol Chem. 2002;277:24753-24763. [PubMed] [DOI] |
| 11. | Kuroda S, Fukata M, Nakagawa M, Fujii K, Nakamura T, Ookubo T, Izawa I, Nagase T, Nomura N, Tani H. Role of IQGAP1, a target of the small GTPases Cdc42 and Rac1, in regulation of E-cadherin- mediated cell-cell adhesion. Science. 1998;281:832-835. [PubMed] [DOI] |
| 12. | Li Z, Kim SH, Higgins JM, Brenner MB, Sacks DB. IQGAP1 and calmodulin modulate E-cadherin function. J Biol Chem. 1999;274:37885-37892. [PubMed] [DOI] |
| 13. | Roy M, Li Z, Sacks DB. IQGAP1 is a scaffold for mitogen-activated protein kinase signaling. Mol Cell Biol. 2005;25:7940-7952. [PubMed] [DOI] |
| 14. | Roy M, Li Z, Sacks DB. IQGAP1 binds ERK2 and modulates its activity. J Biol Chem. 2004;279:17329-17337. [PubMed] [DOI] |
| 15. | Ren JG, Li Z, Sacks DB. IQGAP1 modulates activation of B-Raf. Proc Natl Acad Sci U S A. 2007;104:10465-10469. [PubMed] [DOI] |
| 16. | Yamaoka-Tojo M, Ushio-Fukai M, Hilenski L, Dikalov SI, Chen YE, Tojo T, Fukai T, Fujimoto M, Patrushev NA, Wang N. IQGAP1, a novel vascular endothelial growth factor receptor binding protein, is involved in reactive oxygen species--dependent endothelial migration and proliferation. Circ Res. 2004;95:276-283. [PubMed] [DOI] |
| 17. | Li S, Wang Q, Chakladar A, Bronson RT, Bernards A. Gastric hyperplasia in mice lacking the putative Cdc42 effector IQGAP1. Mol Cell Biol. 2000;20:697-701. [PubMed] [DOI] |
| 18. | Sugimoto N, Imoto I, Fukuda Y, Kurihara N, Kuroda S, Tanigami A, Kaibuchi K, Kamiyama R, Inazawa J. IQGAP1, a negative regulator of cell-cell adhesion, is upregulated by gene amplification at 15q26 in gastric cancer cell lines HSC39 and 40A. J Hum Genet. 2001;46:21-25. [PubMed] [DOI] |
| 19. | Nabeshima K, Shimao Y, Inoue T, Koono M. Immunohistochemical analysis of IQGAP1 expression in human colorectal carcinomas: its overexpression in carcinomas and association with invasion fronts. Cancer Lett. 2002;176:101-109. [PubMed] [DOI] |
| 20. | Jadeski L, Mataraza JM, Jeong HW, Li Z, Sacks DB. IQGAP1 stimulates proliferation and enhances tumorigenesis of human breast epithelial cells. J Biol Chem. 2008;283:1008-1017. [PubMed] [DOI] |
| 21. | Dong P, Nabeshima K, Nishimura N, Kawakami T, Hachisuga T, Kawarabayashi T, Iwasaki H. Overexpression and diffuse expression pattern of IQGAP1 at invasion fronts are independent prognostic parameters in ovarian carcinomas. Cancer Lett. 2006;243:120-127. [PubMed] [DOI] |
| 22. | Stockinger W, Zhang SC, Trivedi V, Jarzylo LA, Shieh EC, Lane WS, Castoreno AB, Nohturfft A. Differential requirements for actin polymerization, calmodulin, and Ca2+ define distinct stages of lysosome/phagosome targeting. Mol Biol Cell. 2006;17:1697-1710. [PubMed] [DOI] |
| 23. | Yamashiro S, Abe H, Mabuchi I. IQGAP2 is required for the cadherin-mediated cell-to-cell adhesion in Xenopus laevis embryos. Dev Biol. 2007;308:485-493. [PubMed] [DOI] |
| 24. | Jin SH, Akiyama Y, Fukamachi H, Yanagihara K, Akashi T, Yuasa Y. IQGAP2 inactivation through aberrant promoter methylation and promotion of invasion in gastric cancer cells. Int J Cancer. 2008;122:1040-1046. [PubMed] [DOI] |
| 25. | Schmidt VA, Chiariello CS, Capilla E, Miller F, Bahou WF. Development of hepatocellular carcinoma in Iqgap2-deficient mice is IQGAP1 dependent. Mol Cell Biol. 2008;28:1489-1502. [PubMed] [DOI] |
| 26. | Horton P, Nakai K. Better prediction of protein cellular localization sites with the k nearest neighbors classifier. Proc Int Conf Intell Syst Mol Biol. 1997;5:147-152. [PubMed] |
| 27. | Brameier M, Krings A, MacCallum RM. NucPred--predicting nuclear localization of proteins. Bioinformatics. 2007;23:1159-1160. [PubMed] [DOI] |
| 28. | Mizejewski GJ. Alpha-fetoprotein structure and function: relevance to isoforms, epitopes, and conformational variants. Exp Biol Med (Maywood). 2001;226:377-408. [PubMed] |
| 29. | Mizejewski GJ. Biological role of alpha-fetoprotein in cancer: prospects for anticancer therapy. Expert Rev Anticancer Ther. 2002;2:709-735. [PubMed] [DOI] |
| 30. | Mizejewski GJ. Levels of alpha-fetoprotein during pregnancy and early infancy in normal and disease states. Obstet Gynecol Surv. 2003;58:804-826. [PubMed] [DOI] |
| 31. | Terentiev AA, Moldogazieva NT. Structural and functional mapping of alpha-fetoprotein. Biochemistry (Mosc). 2006;71:120-132. [PubMed] [DOI] |