修回日期: 2007-10-18
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 研究观察早期生长反应基因-1(EGR-1)在急性胰腺炎(AP)大鼠肺组织与原代培养肺泡巨噬细胞(AM)中表达的作用.
方法: 将♂Wistar大鼠40只, 随机均分为4组, 分别于胆总管内逆行注入生理盐水或不同浓度牛磺胆酸钠溶液. 3 h后处死动物, 取血分离血清, 并剪取胰腺及肺组织. 检测血清TNF-α和IL-1β水平, 胰腺组织病理评分, 肺组织湿质量/干质量比, 并对肺组织进行EGR-1免疫组化染色. 原代培养AM分成4组, 分别采用不同浓度胰弹性蛋白酶进行刺激, 免疫细胞化学染色法检测EGR-1在AM的表达, 并检测培养液中TNF-α和IL-1β浓度. RT-PCR分别检测AM, EGR-1, TNF-α, IL-1β mRNA表达.
结果: 肺组织EGR-1表达随AP病情加重而呈增强趋势, 并与血清TNF-α和IL-1β水平、胰腺组织病理评分、肺组织湿质量/干质量比均呈显著正相关(r = 0.63, 0.58, 0.59, 0.61, P<0.01) AM中EGR-1蛋白. mRNA表达程度与TNF-α和IL-1β蛋白(r = 0.64、0.51, P<0.01)以及mRNA水平均呈显著正相关(r = 0.62, 0.59, P<0.01).
结论: EGR-1可能在AP并发肺损伤中起重要作用, 其机制可能与其介导炎性细胞因子生成有关.
引文著录: 邹树, 田伏洲, 汤礼军, 黎冬暄, 汪涛, 石力. 急性胰腺炎大鼠肺组织与肺泡巨噬细胞早期生长反应基因-1的表达. 世界华人消化杂志 2007; 15(35): 3690-3696
Revised: October 18, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To investigate the possible role of early growth response factor 1 (EGR-1) in a rat model of lung injury complicated by taurocholate sodium-induced acute pancreatitis.
METHODS: Forty male Wistar rats were randomly divided into four groups. Normal saline was injected into the common bile duct (CBD) of rats in group A, and taurocholate sodium was injected into the CBD of rats in groups B, C and D. Three hours after injection, all animals were sacrificed, and blood, pancreas and lungs were harvested. Serum levels of tumor necrosis factor (TNF)-α and interleukin (IL)-1β were measured. Pathological scoring of the pancreas was analyzed, and the pulmonary wet to dry weight ratio was measured. Immunohistochemical staining of EGR-1 on lung paraffin sections was observed and assayed semi-quantitatively. Immunocytochemical staining of EGR-1 of AMs was observed and assayed semi-quantitatively, and the concentration of TNF-α and IL-1β in culture fluid was measured. AMs were divided into four groups and treated with elastase as above. EGR-1, TNF-α and IL-1β mRNA expressions were assessed using RT-PCR.
RESULTS: Pulmonary positive staining of EGR-1 was more intense in the model of severe acute pancreatitis. Furthermore, EGR-1 staining differed among acute pancreatitis models with different severities. EGR-1 expressed in lungs correlated with the parameters that demonstrated pancreatitis severity and pulmonary injury: pathological scoring of pancreatitis (r = 0.59), pulmonary wet to dry weight ratio (r = 0.61), and serum TNF-α (r = 0.63) and IL-1β (r = 0.58). EGR-1 protein and mRNA expressed in AMs were correlated with the TNF-α and IL-1β protein (r = 0.64, 0.51, P < 0.01) and mRNA levels (r = 0.62, 0.59, P < 0.01), and were partly dependent on the ERK 1/2 pathway.
CONCLUSION: EGR-1 may play an important role in lung injury during acute pancreatitis, and the possible mechanism relates to its mediation of production of inflammatory cytokines.
- Citation: Zou S, Tian FZ, Tang LJ, Li DX, Wang T, Shi L. Early growth response factor 1 expression in rat lungs and alveolar macrophages during acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3690-3696
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3690.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3690
肺损伤是急性胰腺炎(acute pancreatiits, AP)尤其是重症急性胰腺炎(severe acute pancreatitis, SAP)最常发生的胰外器官并发症[1-4]. 临床上50%-70%急性胰腺炎患者有肺损害的表现[5]. 在SAP中约30%-50%合并有肺损伤或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS), 是AP引起死亡的重要原因之一. 目前认为单核巨噬细胞系统异常激活是引起AP肺损伤的主要原因之一[3,6]. 我们观察早期生长反应基因-1(early growth response factor 1, EGR-1)在AP大鼠肺组织中的表达, 在原代培养肺泡巨噬细胞(alveolar macrophage, AM)中的表达以及与TNF-α和IL-1β水平的关系, 探讨EGR-1在AP肺损伤中的作用.
♂SPF级Wistar大鼠, 体质量230-250 g, 购自第三军医大学实验动物中心, 牛磺胆酸钠、胰弹力蛋白酶(elastase)、PD98059购自Sigma公司, 兔抗大鼠EGR-1多克隆抗体购自Santa Cruz公司, AMV Reverse Transcriptase购自Promega公司, Taq DNA Polymerase购自大连TaKaRa公司, 大鼠TNF-α及IL-1β ELISA试剂盒购自晶美公司, DMEM培养液购自Gibco公司. S-P试剂盒购自北京中山公司.
1.2.1 在体实验: ♂Wistar大鼠40只, 利用随机数字表将其随机均分为A, B, C, D 4组. 参考文献[7]制造AP动物模型, 分别于胆管内逆行注射生理盐水, 10 g/L、30 g/L和50 g/L牛磺胆酸钠溶液(1 mL/kg). 注射后3 h, 30 g/L戊巴比妥钠ip麻醉后剪开胸腔, 自主动脉先后灌注生理盐水及40 g/L中性甲醛后剪取肺与胰腺组织. 灌注前穿刺右心耳取血分离血清, ELISA法检测TNF-α及IL-1β. 测肺组织测湿质量/干质量比. 肺组织常规石蜡切片, 根据试剂说明书以Envision二步法检测EGR-1蛋白, 以图像分析软件Image pro plus 4.5进行半定量分析. 胰腺组织常规石蜡切片, HE染色, 根据文献[8]行病理评分.
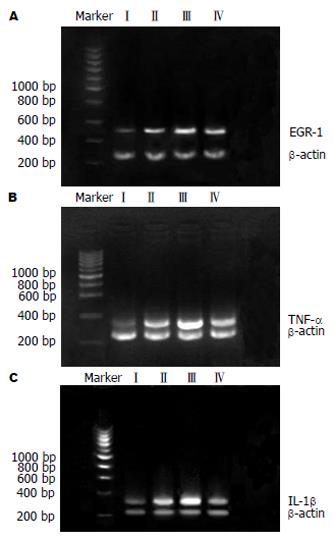
1.2.2 体外实验: 采用在体支气管肺泡灌洗法分离AM[9]. 先将AM放在有24 mm×24 mm玻片的六孔板内培养12 h, 然后换液加入无血清培养液饥饿培养24 h, 2块六孔板即为一组. 具体分组及处理因素如下(elastase处理剂量参考文献[10]): Ⅰ组: AM+生理盐水(30 mL/L培养液), Ⅱ组: AM+elastase(0.5 kU/L培养液), Ⅲ组: AM+elastase(1 kU/L培养液), Ⅳ组: 预处理AM+elastase(1 kU/L 培养液). 其中Ⅳ组先以PD98059预处理2 h, 后均加入无血清DMEM培养液培养2 h, 根据试剂说明书以Envision二步法检测EGR-1蛋白. 取培养液以ELISA法检测TNF-α及IL-1β水平. 另同上法分离及培养AM, 分组及处理方法相同. 各目的基因引物序列、产物长度及退火温度见表1. PCR扩增条件: 94℃ 5 min, 加Taq酶1 mL(41.675 nkat), 94℃变性30 s, 58℃或57℃退火1 min, 72℃延伸1 min, 共32个循环, 72℃温育10 min, 4℃结束反应. 10 g/L琼脂糖凝胶常规电泳, 以Doc Gel 2000图像分析系统分析,PCR产物量以吸光度值×面积表示. 各产物与相应内参的比值作为最终结果.
| Gene | GenBank No. | 长度(bp) | 引物序列(sense/antisense) | 退火温度 |
| EGR-1 | NM_012551 | 549 | CCCGTATGCTTGCCCTGTTGAGTC | 58℃ |
| CCCGTTGAGGTGCTGAAGGAGTTG | ||||
| TNF-α | X66539 | 316 | CATGATCCGAGATGTGGAACTGGC | 57℃ |
| CTGGCTCAGCCACTCCAGC | ||||
| IL-1β | M98820 | 377 | TTGTGGCTGTGGAGAAGCTG | 58℃ |
| GCCGTCTTTCATCACACAG | ||||
| β-actin | NM_031144 | 241 | TAAAGACCTCTATGCCAACACAGT | |
| CACGATGGAGGGGCCGGACTCATC |
统计学处理 数据以mean±SD表示, 采用SPSS12.0软件进行方差分析及双变量相关分析, 以P<0.05为检验水准.
A、B、C、D 4组动物胰腺病理评分分别为1.41±0.38, 5.75±0.82, 7.17±1.13和8.67±0.68, 肺湿质量/干质量比分别为3.62±0.21, 3.77±0.32, 4.16±0.53和4.38±0.37. 这表明AP病情及肺损伤呈逐渐加重趋势.
B、C、D组血清TNF-α、IL-1β显著高于A组(P<0.05或0.01, 表2), 且亦呈逐渐升高趋势.
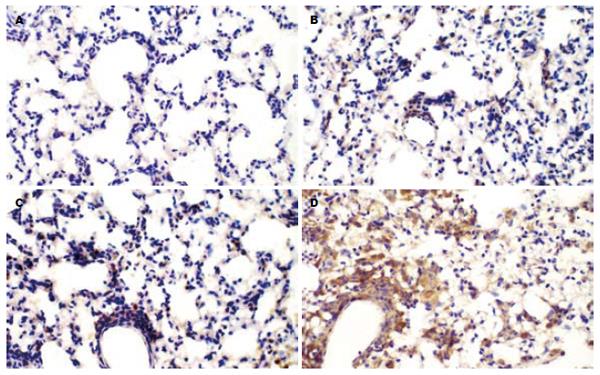
A组EGR-1仅仅在少量肺间质细胞的胞质中有微弱表达. B组可见EGR-1表达明显增强, 主要位于肺间质巨噬细胞(胞质为主, 少量胞核也有表达), 少量毛细血管内皮细胞及肺泡上皮细胞胞质内也有表达. C组显示大量肺间质巨噬细胞表达. D组示肺间质巨噬细胞强烈表达(胞核和胞质均有), 少量可见的肺泡巨噬细胞也有很强表达(图1). EGR-1半定量分析结果为40.3±11.4, 63.8±12.5, 78.2±12.3, 198.0±49.2. 将EGR-1表达结果与胰腺病理评分、肺组织湿质量/干质量比、TNF-α及IL-1β水平分别进行相关分析, 发现均呈显著正相关(r = 0.59, 0.61, 0.63, 0.58, P<0.01), 显示肺组织EGR-1表达程度与反映AP病情及肺损害指标之间有密切正相关.
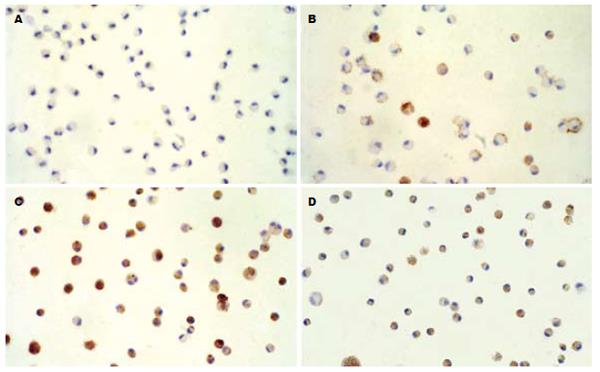
原代培养AM免疫细胞化学染色结果显示, 对照组(Ⅰ组)AM无EGR-1表达; Ⅱ组部分仅在胞质表达, 另有部分细胞胞核和胞质均有表达; Ⅲ组可见绝大部分细胞均有强烈表达, 大部分胞核和胞质均有表达. PD98059预处理组(Ⅳ组)与Ⅲ组相比, 表达明显减弱(图2). 经过图像分析, Ⅰ、Ⅱ、Ⅲ、Ⅳ 4组AM表达EGR-1分别为46.8±8.7, 74.6±11.9, 159.2±28.7, 105.3±14.2. 统计学分析显示, Ⅲ组显著高于Ⅰ组及Ⅱ组(P<0.05及0.01), 而Ⅳ组较以同样浓度胰弹性蛋白酶刺激的Ⅲ组显著减弱(P<0.05). 将各组AM表达EGR-1结果与TNF-α及IL-1β水平(表3)分别进行相关分析, 发现均呈显著正相关(r = 0.64、0.51, P<0.01). RT-PCR结果显示(表3, 图3), Ⅰ、Ⅱ、Ⅲ、Ⅳ 4组AM在分别以不同浓度胰弹力酶刺激或经PD98059预处理再以酶来刺激后, 其EGR-1, TNF-α与IL-1β mRNA变化趋势是完全一致的, 即随着胰弹力酶浓度的升高, 3种基因表达也上升. 而经PD98059预处理再以同样浓度胰弹力酶来刺激, Ⅳ组较Ⅲ组有显著下降. 对EGR-1 mRNA与TNF-α及IL-1β mRNA进行相关分析,发现均呈显著正相关(r = 0.62, 0.59, P<0.01).
EGR-1是立早反应基因家族中最重要的一员, 是一种核转录因子, 与细胞增生、分化、凋亡及炎性反应密切相关. 他偶联细胞外刺激与细胞内信号转导, 介导多种下游致炎因子基因的表达[11-12]. EGR-1的活化成为许多炎症相关性疾病发生发展的重要环节. EGR-1作为一种核转录因子, 调控着30多种与细胞生长分化、细胞凋亡、炎性细胞趋化及免疫刺激有关的靶基因的表达, 有多种是与炎性反应有关的基因, 如血小板源性生长因子(platelet derived growth factor, PDGF)[13-14]、组织因子(tissue factor, TF)[15]、细胞间黏附分子(intercellular adhesion molecule-1, ICAM-1)[16]、纤维连接蛋白(FN)[17]、单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)[18]、纤溶酶原激活剂抑制分子-1(plasminogen activator inhibitor-1, PAI-1)[19]、转化生长因子-β1(transforming growth factor-β1, TGF-β1)[20]、肿瘤坏死因子-a(TNF-α)[21-22]等. 所有这些炎性相关基因均认为与急性胰腺炎有或多或少的关系. 众多炎性介质(主要是TNF-α, IL-1β, PAF等)在急性肺损伤中起重要作用. SAP时胰腺局部的炎症介质不断产生并大量进入血液循环, 形成全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 导致远处脏器内单核细胞巨噬系统激活, 释放毒性物质, 成为继发肺部严重炎性反应的始动因素[23-26]. 多项研究表明腹腔巨噬细胞、枯否细胞等TNF-α基因启动子上存在与EGR-1结合的特异序列, EGR-1与这一序列相结合后参与调控这些细胞TNF-α的表达[27-28]. Ji et al发现, 在EGR-1基因缺失小鼠利用雨蛙素腹腔注射诱导的急性胰腺炎其TF、PAI、IL-6、MCP-1、ICAM-1 mRNA水平较野生型小鼠有显著下降, 因而认为其在急性胰腺炎发病过程中是一种重要的调控因子[29]. 国内曾有Gong et al观察了EGR-1在小鼠急性胰腺炎模型上胰腺组织中的基因与蛋白表达情况[30]. EGR-1作为一种立早反应基因在SAP从最初的局部炎症转变为严重威胁生命的全身病变中有无作用, 如何起作用, 目前国内外研究极少. 在本研究中, 我们首先观察了EGR-1在AP大鼠肺组织中的表达. 我们发现, 其表达细胞类型广泛, 包括肺间质巨噬细胞、肺泡巨噬细胞、肺泡上皮细胞及毛细血管内皮细胞等. EGR-1表达随大鼠AP病情加重而呈增强趋势, 而且在表达细胞类型上也有很大差别. 对于注射生理盐水的对照组, 仅仅在肺间质细胞胞质中有极少量的表达. 在10 g/L牛磺胆酸钠溶液注射组, 可见在肺间质巨噬细胞有较强表达, 大部分位于胞质, 小部分在胞核有表达, 此外还有小部分毛细血管内皮细胞和肺泡上皮细胞胞质内也有表达. 经30 g/L牛磺胆酸钠注射后, 可见有大量的肺间质巨噬细胞表达, 胞核和胞质均有. 而在50 g/L牛磺胆酸钠注射组, 则可见强烈的肺间质巨噬细胞表达, 少量视野中可见的肺泡巨噬细胞中也有表达. 各组AP大鼠肺组织EGR-1表达程度与反映AP程度及肺损伤各指标之间如胰腺病理评分、血清TNF-α和IL-1β水平、肺组织湿质量/干质量比均呈显著正相关. 因此, EGR-1在AP发病过程中可能发挥了重要作用, 并与AP肺损伤有关.
为了进一步了解EGR-1在AP肺损伤中的作用机制, 我们又研究了EGR-1与原代培养AM TNF-α及IL-1β表达的关系. 我们采用在体支气管肺泡灌洗法来分离AM. 在体灌洗法分离AM无需取下肺叶, 操作简便, 另外也减少了因取下肺叶可能造成的污染机会. 多项研究认为, 胰弹性蛋白酶是胰腺局部炎症与全身性炎症反应及胰外器官并发症之间的桥梁和纽带, 在刺激胰外器官炎性细胞因子生成中起主要作用, 在很多方面可以模拟急性胰腺炎所造成的损害[31-32].因此, 我们选用其作为原代培养AM的刺激因子. 免疫细胞化学染色与RT-PCR均表明, 肺泡巨噬细胞EGR-1蛋白与mRNA表达随着胰弹性蛋白酶浓度的升高而呈增强趋势. 染色发现, Ⅱ组与Ⅲ组部分AM胞核内均有强烈表达, 表明有核移位发生, 显示EGR-1可能作为一种核转录因子对目标基因发挥转录调节作用. 为研究其信号转导途径, 我们对Ⅳ组AM先以PD98059行预处理, 再用与Ⅲ组同样剂量弹力酶来进行刺激, 发现EGR-1, TNF-α, IL-1β蛋白表达和mRNA水平均较C组有显著下降. 这表明AM在弹力蛋白酶刺激后EGR-1的表达有ERK1/2信号途径的参与. 对4组肺泡巨噬细胞EGR-1蛋白与mRNA表达分别与TNF-α和IL-1β进行相关分析, 均存在显著正相关. 这提示EGR-1可能与AM受胰弹性蛋白酶刺激后TNF-α与IL-1β生成有关, 并且EGR-1在AM中的表达以及炎性细胞因子TNF-α和IL-1β的生成中有ERK1/2信号途径的参与. 这些表明EGR-1可能在AP并发的肺损伤中起重要作用, 且这种作用可能与其介导炎性细胞因子TNF-α和IL-1β生成有关.
SAP的发病机制一直是研究热点, 而其从"局部炎症"播散成为"全身炎症"是其显著病理生理特征之一. 激活的单核巨噬细胞所产生的炎性细胞因子如TNF-α及IL-1β在急性胰腺炎的发病过程中具有非常重要的作用. EGR-1作为一种核转录因子通过与靶基因启动子或增强子EGR-1结合位点结合而实现对靶基因的表达调控.
本文通过观察EGR-1在AP大鼠肺组织及模拟AP刺激的肺泡巨噬细胞中的表达情况及与TNF-α和IL-1β的关系, 较深入地探讨了EGR-1在AP肺损害中的作用机制.
多项研究表明, 腹腔巨噬细胞和枯否细胞等TNF-α基因启动子上存在与EGR-1结合的特异序列, EGR-1与这一序列相结合参与调控这些细胞TNF-α的表达.
本实验研究肺组织和肺泡的早期生长反应因子-1的表达及其与急性胰腺炎的作用. 研究涉及目前较新的炎症介质和炎症反应过程, 对于了解重症急性胰腺炎的发病机制有较大意义.
本文书写规范, 内容新颖, 设计合理, 图片清晰, 结论可信, 对于了解重症急性胰腺炎的发病机制有较大意义.
编辑: 程剑侠 电编: 刘勇
| 1. | Zhao X, Andersson R, Wang X, Dib M, Wang X. Acute pancreatitis-associated lung injury: pathophysiological mechanisms and potential future therapies. Scand J Gastroenterol. 2002;37:1351-1358. [PubMed] [DOI] |
| 2. | Shields CJ, Winter DC, Redmond HP. Lung injury in acute pancreatitis: mechanisms, prevention, and therapy. Curr Opin Crit Care. 2002;8:158-163. [PubMed] [DOI] |
| 3. | Pastor CM, Matthay MA, Frossard JL. Pancreatitis-associated acute lung injury: new insights. Chest. 2003;124:2341-2351. [PubMed] [DOI] |
| 4. | De Campos T, Deree J, Coimbra R. From acute pancreatitis to end-organ injury: mechanisms of acute lung injury. Surg Infect (Larchmt). 2007;8:107-120. [PubMed] [DOI] |
| 5. | Surbatović M, Jovanović K, Radaković S, Filipović N. [Pathophysiological aspects of severe acute pancreatitis-associated lung injury]. Srp Arh Celok Lek. 2005;133:76-81. [PubMed] [DOI] |
| 8. | Schmidt J, Lewandrowsi K, Warshaw AL, Compton CC, Rattner DW. Morphometric characteristics and homogeneity of a new model of acute pancreatitis in the rat. Int J Pancreatol. 1992;12:41-51. [PubMed] |
| 10. | Murr MM, Yang J, Fier A, Kaylor P, Mastorides S, Norman JG. Pancreatic elastase induces liver injury by activating cytokine production within Kupffer cells via nuclear factor-Kappa B. J Gastrointest Surg. 2002;6:474-480. [PubMed] [DOI] |
| 12. | Khachigian LM, Collins T. Early growth response factor 1: a pleiotropic mediator of inducible gene expression. J Mol Med (Berl). 1998;76:613-616. [PubMed] [DOI] |
| 13. | Midgley VC, Khachigian LM. Fibroblast growth factor-2 induction of platelet-derived growth factor-C chain transcription in vascular smooth muscle cells is ERK-dependent but not JNK-dependent and mediated by Egr-1. J Biol Chem. 2004;279:40289-40295. [PubMed] [DOI] |
| 14. | McCaffrey TA, Fu C, Du B, Eksinar S, Kent KC, Bush H, Kreiger K, Rosengart T, Cybulsky MI, Silverman ES. High-level expression of Egr-1 and Egr-1-inducible genes in mouse and human atherosclerosis. J Clin Invest. 2000;105:653-662. [PubMed] [DOI] |
| 15. | Kamimura M, Bea F, Akizawa T, Katus HA, Kreuzer J, Viedt C. Platelet-derived growth factor induces tissue factor expression in vascular smooth muscle cells via activation of Egr-1. Hypertension. 2004;44:944-951. [PubMed] [DOI] |
| 16. | Abdel-Latif MM, Windle HJ, Fitzgerald KA, Ang YS, Eidhin DN, Li-Weber M, Sabra K, Kelleher D. Helicobacter pylori activates the early growth response 1 protein in gastric epithelial cells. Infect Immun. 2004;72:3549-3560. [PubMed] [DOI] |
| 17. | Gaggioli C, Deckert M, Robert G, Abbe P, Batoz M, Ehrengruber MU, Ortonne JP, Ballotti R, Tartare-Deckert S. HGF induces fibronectin matrix synthesis in melanoma cells through MAP kinase-dependent signaling pathway and induction of Egr-1. Oncogene. 2005;24:1423-1433. [PubMed] [DOI] |
| 18. | Pawlinski R, Pedersen B, Kehrle B, Aird WC, Frank RD, Guha M, Mackman N. Regulation of tissue factor and inflammatory mediators by Egr-1 in a mouse endotoxemia model. Blood. 2003;101:3940-3947. [PubMed] [DOI] |
| 19. | Aljada A, Ghanim H, Mohanty P, Kapur N, Dandona P. Insulin inhibits the pro-inflammatory transcription factor early growth response gene-1 (Egr)-1 expression in mononuclear cells (MNC) and reduces plasma tissue factor (TF) and plasminogen activator inhibitor-1 (PAI-1) concentrations. J Clin Endocrinol Metab. 2002;87:1419-1422. [PubMed] [DOI] |
| 20. | Wilder PJ, Bernadt CT, Kim JH, Rizzino A. Stimulation of the murine type II transforming growth factor-beta receptor promoter by the transcription factor Egr-1. Mol Reprod Dev. 2002;63:282-290. [PubMed] [DOI] |
| 21. | Shi L, Kishore R, McMullen MR, Nagy LE. Chronic ethanol increases lipopolysaccharide-stimulated Egr-1 expression in RAW 264.7 macrophages: contribution to enhanced tumor necrosis factor alpha production. J Biol Chem. 2002;277:14777-14785. [PubMed] |
| 22. | Guha M, O'Connell MA, Pawlinski R, Hollis A, McGovern P, Yan SF, Stern D, Mackman N. Lipopolysaccharide activation of the MEK-ERK1/2 pathway in human monocytic cells mediates tissue factor and tumor necrosis factor alpha expression by inducing Elk-1 phosphorylation and Egr-1 expression. Blood. 2001;98:1429-1439. [PubMed] [DOI] |
| 23. | Bhatia M, Brady M, Shokuhi S, Christmas S, Neoptolemos JP, Slavin J. Inflammatory mediators in acute pancreatitis. J Pathol. 2000;190:117-125. [PubMed] [DOI] |
| 24. | Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome. J Pathol. 2004;202:145-156. [PubMed] [DOI] |
| 25. | Puneet P, Moochhala S, Bhatia M. Chemokines in acute respiratory distress syndrome. Am J Physiol Lung Cell Mol Physiol. 2005;288:L3-L15. [PubMed] |
| 26. | Yamauchi J, Shibuya K, Sunamura M, Arai K, Shimamura H, Motoi F, Takeda K, Matsuno S. Cytokine modulation in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2001;8:195-203. [PubMed] [DOI] |
| 27. | Faour WH, Alaaeddine N, Mancini A, He QW, Jovanovic D, Di Battista JA. Early growth response factor-1 mediates prostaglandin E2-dependent transcriptional suppression of cytokine-induced tumor necrosis factor-alpha gene expression in human macrophages and rheumatoid arthritis-affected synovial fibroblasts. J Biol Chem. 2005;280:9536-9546. [PubMed] [DOI] |
| 28. | Shi L, Kishore R, McMullen MR, Nagy LE. Lipopolysaccharide stimulation of ERK1/2 increases TNF-alpha production via Egr-1. Am J Physiol Cell Physiol. 2002;282:C1205-C1211. [PubMed] |
| 29. | Ji B, Chen XQ, Misek DE, Kuick R, Hanash S, Ernst S, Najarian R, Logsdon CD. Pancreatic gene expression during the initiation of acute pancreatitis: identification of EGR-1 as a key regulator. Physiol Genomics. 2003;14:59-72. [PubMed] [DOI] |
| 30. | Gong LB, He L, Liu Y, Chen XQ, Jiang B. Expression of early growth response factor-1 in rats with cerulein-induced acute pancreatitis and its significance. World J Gastroenterol. 2005;11:5022-5024. [PubMed] [DOI] |
| 31. | Jaffray C, Yang J, Carter G, Mendez C, Norman J. Pancreatic elastase activates pulmonary nuclear factor kappa B and inhibitory kappa B, mimicking pancreatitis-associated adult respiratory distress syndrome. Surgery. 2000;128:225-231. [PubMed] [DOI] |
| 32. | Jaffray C, Yang J, Norman J. Elastase mimics pancreatitis-induced hepatic injury via inflammatory mediators. J Surg Res. 2000;90:95-101. [PubMed] [DOI] |