修回日期: 2006-08-10
接受日期: 2006-08-15
在线出版日期: 2006-11-08
目的: 探讨胃癌淋巴结转移的螺旋CT特征, 从而指导临床合理地制订治疗方案和进行预后分析.
方法: 回顾性分析经手术病理证实的45例胃癌全阴组和全阳组淋巴结的影像资料, 并与病理进行对照研究.
结果: 螺旋CT检出病理诊断为全阳组和全阴组的各组淋巴结共267个, 其中阳性淋巴结有123个, 阴性淋巴结有144个. 如以平扫CT值≥25 Hu或动脉期CT值≥70 Hu或静脉期CT值≥80 Hu为诊断阳性淋巴结标准, 则阳性淋巴结的敏感性高达98.4%, 阳性预测值为70.0%; 特异性为69.3%, 阴性预测值为97.9%.
结论: 螺旋CT对判断胃癌有无淋巴结转移有重要作用. 如以平扫CT值≥25 Hu或动脉期CT值≥70 Hu或静脉期CT值≥80 Hu为诊断阳性淋巴结标准, 则将大大提高对淋巴结转移的诊断.
引文著录: 赵志清, 郑可国, 沈静娴, 王伟, 李子平, 许达生. 螺旋CT对胃癌淋巴结转移的评价. 世界华人消化杂志 2006; 14(31): 3060-3064
Revised: August 10, 2006
Accepted: August 15, 2006
Published online: November 8, 2006
AIM: To investigate the manifestation characteristics of spiral computed tomography (SCT) for lymph nodes metastases in gastric cancer, and to provide the evidence for clinicians to make appropriate treatment strategies and prognosis analysis.
METHODS: The SCT findings for lymph nodes in 45 gastric cancer patients with or without metastasis were confirmed by surgical pathology, and then retrospectively analyzed.
RESULTS: A total of 267 lymph nodes (positive 123, negative 144) were detected by SCT and confirmed by pathology in metastasis-positive or metastasis-negative patients. If the attenuation values, more than or equal to 25 Hu in plain scan or 70 Hu in arterial phase or 80 Hu in venous phase, were used as the threshold to detect the metastasis-positive lymph nodes, the sensitivity, the positive predictive value, the negative predictive value and the specificity were 98.4%, 70.0%, 97.9% and 69.3%, respectively.
CONCLUSION: SCT is valuable in judging the metastasis in gastric cancer. The application of attenuation values more than or equal to 25 Hu in plain scan or 70 Hu in arterial phase or 80 Hu in venous phase can dramatically improve the diagnosis for lymph node metastasis in gastric cancer.
- Citation: Zhao ZQ, Zheng KG, Shen JX, Wang W, Li ZP, Xu DS. Evaluation of lymph node metastases in gastric cancer with spiral computed tomography. Shijie Huaren Xiaohua Zazhi 2006; 14(31): 3060-3064
- URL: https://www.wjgnet.com/1009-3079/full/v14/i31/3060.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i31.3060
胃癌是世界上最常见的恶性肿瘤, 根治性手术仍是其主要的治疗手段[1-5], 能否彻底清除已有转移的淋巴组织是决定患者预后的主要因素之一, 但如果广泛切除无转移的淋巴结, 可能影响到机体的免疫功能, 增加手术创伤, 无益于手术疗效的提高[6-10]. 因此术前确定胃癌淋巴结转移存在与否对胃癌的术前分期、临床治疗方案的制订、估计预后等有着非常重要的意义[11-13]. 我们对45例胃癌患者螺旋CT检查与临床手术病理结果进行对照分析, 探讨胃癌淋巴结转移的螺旋CT特征.
2003-2004年我院胃癌患者45例, 男31例, 女14例. 年龄30-78(平均56.6)岁. 所有病例术前均经胃镜活检证实, 并于螺旋CT检查后10 d行根治性手术, 术后病理报告均为腺癌. 手术摘取的淋巴结按照日本胃癌研究会淋巴结部位分类法标记其位置、大小与数目, 送病理科检查, 并报告淋巴结转移阳性或阴性. CT检查采用的是东芝Xpress/sx螺旋CT机.
CT检查前患者禁食8-12 h, 扫描前口服饮用水800-1000 mL, 扫描层厚0.5 cm, 扫描条件120 kV, 250 mAs, 矩阵512×512, 螺距为1. 先行平扫然后行双期增强扫描, 对比剂用碘普胺注射液, 浓度为300 g/L, 总量按1.5 mL/kg, 采用EN vision CT高压注射器, 流率3 mL/s, 经肘静脉注射对比剂后27 s开始动脉期扫描, 60 s开始静脉期扫描. 术后选择病理报告为全阴组或全阳组的淋巴结作为观察对象, 由2位腹部放射学高年资医师在PACS系统终端(安科公司)上对位于相应组的所有淋巴结测量, 测量时先对CT图像进行放大, 再进行测量(尤其是对小淋巴结进行测量时), 力求所得数据准确可靠, 内容包括淋巴结短径、长径、平扫CT值、增强后动脉期及静脉期CT值, 探讨淋巴结转移的CT征象. 由于CT观察到的淋巴结与病理证实的淋巴结完全一一对应较困难, 但同一组淋巴结CT与术后病理对应则较准确, 本研究设定如果术后病理报告手术切除的同一组淋巴结转移为全阴或全阳, 则在CT图像上观察到的对应组的所有淋巴结转移亦为全阴或全阳.
统计学处理 测量所得的数据用SPSS 11.0统计学软件进行处理, 各组间的数据以mean±SD表示, 计量资料各组间均数比较用t检验, 计数资料的比较用R×C表资料的χ2检验, 以P<0.01表示差异有统计学意义.
本组45例胃癌行根治性手术共摘取淋巴结869个. 病理证实淋巴结转移阳性308个, 阳性率为35.4%. CT共检出493个淋巴结, 其中术后病理诊断为全阳性和全阴性的各组淋巴结共267, 阳性123个(46.1%), 阴性144个(53.9%). 阳性和阴性淋巴结的短径、长径、平扫CT值、增强后动脉期CT值、静脉期CT值的范围和均数见表1, 阳性和阴性淋巴结的短径、长径、平扫CT值、增强后动脉期CT值、静脉期CT值均数间的差别都有统计学意义(t = 6.83, 6.09, 11.6, 11.72, 11.62, P<0.01), 而阳性和阴性淋巴结的短长径比均数间的差异没有统计学意义(t = 0.74, P>0.01).
本组267个淋巴结中长径<1.0 cm的淋巴结有198个(74.2%), 其中阳性有74个(37.4%), 阴性124个(62.6%); 长径≥1.0 cm的淋巴结共有69个(25.8%), 其中阳性有49个(71%), 阴性有20个(29%), 两者之间的差异有统计学意义(χ2 = 23.3, P<0.01).
平扫CT值<25 Hu的淋巴结有136个(51%), 其中阳性有20个(14.7%), 阴性有116个(85.3%); CT值≥25 Hu的淋巴结有131个(49%), 其中阳性有103个(78.6%), 阴性有28个(21.4%), 两者之间的差异有统计学意义(χ2 = 109.73, P<0.01). 平扫CT值<5 Hu的淋巴结有45个(16.85%), 全为阴性.
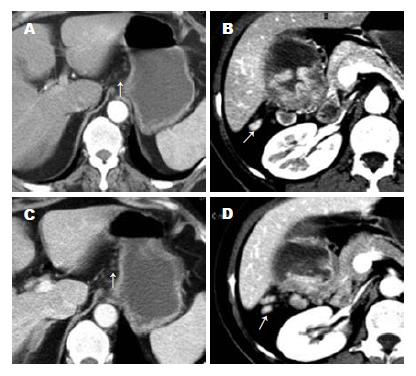
增强后动脉期CT值<70 Hu的共有139个(52.1%), 其中阳性有28个(20.1%), 阴性有111个(79.9%)(图1A); CT值≥70 Hu的淋巴结有128个(47.9%), 其中阳性有95个(74.2%)(图1B), 阴性有33个(25.8%), 两者之间的差异有统计学意义(χ2 = 78.43, P<0.01). 增强后动脉期CT值<40 Hu的淋巴结有51个(19.1%), 全为阴性.
淋巴结转移是胃癌的主要转移方式, 也是影响胃癌分期、手术方式选择和预后的一个重要因素, 因而术前影像学判断有无淋巴结转移具有重要的临床意义[3-16]. 文献报道螺旋CT判断有无淋巴结转移主要是依靠淋巴结最大直径、短轴与长轴之比、增强时有无强化等为标准. 多数以淋巴结直径≥1.0 cm为阳性标准, 亦有以淋巴结直径≥0.5 cm为标准者[10-19], 事先设定淋巴结的直径大于一定的阈值为转移, 再评价胃癌淋巴结的转移情况. 众所周知, 标准以上的淋巴结不全都是转移, 而标准以下的淋巴结亦不全都是阴性. 为了提高胃癌淋巴结转移的CT诊断符合率, 本研究对病理诊断为全阳性和全阴性的各组淋巴结进行回顾性多因素分析.
淋巴结的大小是判断淋巴结有无转移的主要指标, 也是影响淋巴结能否检出的主要因素, 随着淋巴结直径的增加, 转移率明显升高. 本组267个淋巴结如以淋巴结长径1.0 cm为域值, 则阳性淋巴结的敏感性为39.8%(49/123), 阳性预测值为71%(49/69), 阴性预测值为62.6%(124/198), 特异性为86.1%(124/144), 阳性淋巴结的误诊率为60.2%(74/123). 显然, 单纯依据淋巴结直径(≥1.0 cm)诊断有无转移, 无法同时保证敏感性和特异性, 是不全面、不可取的. 因此, 在淋巴结转移的诊断中, 不能只注重直径较大的淋巴结, 亦应重视小淋巴结转移的问题, 这对于提高诊断的敏感性和特异性有重要意义. 另外, 本组267个淋巴结中, 阳性淋巴结与阴性淋巴结的短长径之比均数之间的差异没有统计学意义(t = 0.74, P>0.01). 与Fukuya et al[20]报道的不一致, 这可能是因为本组淋巴结中短长径之比为1的个数太多的原故(共169个).
正常淋巴结中因含脂肪成分较多, 密度相对较低, 可为负值, 与周围脂肪组织的密度差别小, 且体积亦相对较小, 不易被CT检出, 当出现炎性反应或癌转移等时其密度相对增高, 且不均匀, 体积增大或融合, 易被CT检出[16-22]. 本组267个淋巴结如以平扫CT值25 Hu为域值, 则阳性淋巴结的敏感性为83.7%(103/123), 阳性预测值为78.6%(103/131); 阴性预测值为85.3%(116/136), 特异性为80.6%(116/144), 阳性淋巴结的误诊率为16.3%(20/123), 各项指标均较理想. 故判断胃癌淋巴是否结转移, 就平扫CT值而言, 建议以25 Hu为标准.
一般认为, 正常淋巴结血供不丰富, 增强后表现为轻度强化或无强化. 而当发生转移时, 因血供相对较丰富, 增强后的强化多较明显, 且密度不均匀[20-25]. 本组267个淋巴结如以动脉期CT值70 Hu为域值, 则阳性淋巴结的敏感性为77.2%(95/123), 阳性预测值为74.2%(95/128); 阴性预测值为79.9%(111/139), 特异性为77.1%(111/144), 阳性淋巴结的误诊率为22.8%(28/123), 各项指标均较理想. 因此, 判断胃癌淋巴结是否有转移, 就增强后动脉期CT值而言, 建议以70 Hu为标准.
胃癌淋巴结转移增强后静脉期对比动脉期, 淋巴结多进一步强化, 且阳性淋巴结多强化更加明显, 其强化特征在门脉期显示更为清楚[23-27]. 本组267个淋巴结如以静脉期CT值80 Hu为域值, 则阳性淋巴结的敏感性为72.4%(89/123), 阳性预测值为71.8%(89/124); 阴性预测值为76.2%(109/143), 特异性为75.7%(109/144), 阳性淋巴结的误诊率为27.6%(34/123). 因此, 判断胃癌淋巴结是否转移, 就增强后静脉期淋巴结的CT值而言, 建议以80 Hu为标准.
由此可见, 以单一的标准判断胃癌淋巴结转移阳性和阴性, 螺旋CT的敏感性、特异性均不理想. 因此, 我们试图通过多因素综合判断胃癌淋巴结的转移情况. 我们由表2可知, 本组267个淋巴结如以平扫CT值≥25 Hu或动脉期CT值≥70 Hu或静脉期CT值≥80 Hu为诊断阳性淋巴结标准, 则阳性淋巴结的敏感性高达98.4%(121/123), 阳性预测值为70%(121/173); 阴性预测值高达97.9%(92/94), 特异性为69.3%(92/144), 阳性淋巴结的误诊率仅为1.6%, 各项指标均较理想. 因此, 判断胃癌有无淋巴结转移, 以平扫CT值≥25 Hu或动脉期CT值≥70 Hu或静脉期CT值≥80 Hu为诊断阳性淋巴结标准, 各项指标较为理想, 值得推广.
淋巴结转移是胃癌的主要转移方式, 因而术前影像学判断有无淋巴结转移具有重要的临床意义. 文献报道螺旋CT判断有无淋巴结转移主要是依靠淋巴结最大直径、短轴与长轴之比、增强时有无强化等为标准.
本文旨在探讨胃癌淋巴结转移的螺旋CT特征, 以提高胃癌淋巴结转移的CT诊断符合率. 该文结果显示在平扫CT值≥25Hu、动脉期CT值≥70Hu、静脉期CT值≥80Hu时, 判断胃癌淋巴转移的敏感性最高.
本文通过回顾性对比病理证实全组阴性或全组阳性淋巴结的术前螺旋CT图像, 探讨胃癌淋巴结转移的螺旋CT特征, 有一定的价值, 具有可读性.
编辑:张焕兰 电编:张敏
| 1. | Takahashi I, Maehara Y, Koga T, Sumiyoshi Y, Oshiro T, Baba H, Kohnoe S, Okamura T, Uike N, Matsusaka T. Role of surgery in the patients with stage I and II primary gastric lymphoma. Hepatogastroenterology. 2003;50:877-882. [PubMed] |
| 2. | Kim JP. Surgical results in gastric cancer. Semin Surg Oncol. 1999;17:132-138. [PubMed] |
| 3. | Kim JP, Yu HJ, Lee JH. Results of immunochemo-surgery for gastric carcinoma. Hepatogastroenterology. 2001;48:1227-1230. [PubMed] |
| 4. | Kim JP, Lee JH, Kim SJ, Yu HJ, Yang HK. Clinicopathologic characteristics and prognostic factors in 10 783 patients with gastric cancer. Gastric Cancer. 1998;1:125-133. [PubMed] |
| 5. | Alici S, Kaya S, Izmirli M, Tuncer I, Dogan E, Ozbek H, Sayarlioglu H. Analysis of survival factors in patients with advanced-stage gastric adenocarcinoma. Med Sci Monit. 2006;12:CR221-229. [PubMed] |
| 6. | Yokota T, Ishiyama S, Saito T, Teshima S, Narushima Y, Murata K, Iwamoto K, Yashima R, Yamauchi H, Kikuchi S. Lymph node metastasis as a significant prognostic factor in gastric cancer: a multiple logistic regression analysis. Scand J Gastroenterol. 2004;39:380-384. [PubMed] |
| 7. | Kendal WS. Lymph node-based prognostics: limitations with individualized cancer treatment. Am J Clin Oncol. 2006;29:298-304. [PubMed] |
| 8. | Ichikura T, Tomimatsu S, Okusa Y, Uefuji K, Tamakuma S. Comparison of the prognostic significance between the number of metastatic lymph nodes and nodal stage based on their location in patients with gastric cancer. J Clin Oncol. 1993;11:1894-1900. [PubMed] |
| 9. | Tunaci M. Carcinoma of stomach and duodenum: radiologic diagnosis and staging. Eur J Radiol. 2002;42:181-192. [PubMed] |
| 10. | Lim JS, Yun MJ, Kim MJ, Hyung WJ, Park MS, Choi JY, Kim TS, Lee JD, Noh SH, Kim KW. CT and PET in stomach cancer: preoperative staging and monitoring of response to therapy. Radiographics. 2006;26:143-156. [PubMed] |
| 11. | Kunisaki C, Shimada H, Nomura M, Matsuda G, Otsuka Y, Ono H, Akiyama H. Distribution of lymph node metastasis in gastric carcinoma. Hepatogastroenterology. 2006;53:468-472. [PubMed] |
| 12. | Yoo CH, Noh SH, Kim YI, Min JS. Comparison of prognostic significance of nodal staging between old (4th edition) and new (5th edition) UICC TNM classification for gastric carcinoma.International Union Against Cancer. World J Surg. 1999;23:492-497. [PubMed] |
| 13. | Sohn KM, Lee JM, Lee SY, Ahn BY, Park SM, Kim KM. Comparing MR imaging and CT in the staging of gastric carcinoma. AJR Am J Roentgenol. 2000;174:1551-1557. [PubMed] |
| 14. | Motohara T, Semelka RC. MRI in staging of gastric cancer. Abdom Imaging. 2002;27:376-383. [PubMed] |
| 15. | Yun M, Lim JS, Noh SH, Hyung WJ, Cheong JH, Bong JK, Cho A, Lee JD. Lymph node staging of gastric cancer using (18)F-FDG PET: a comparison study with CT. J Nucl Med. 2005;46:1582-1588. [PubMed] |
| 16. | Tatsumi Y, Tanigawa N, Nishimura H, Nomura E, Mabuchi H, Matsuki M, Narabayashi I. Preoperative diagnosis of lymph node metastases in gastric cancer by magnetic resonance imaging with ferumoxtran-10. Gastric Cancer. 2006;9:120-128. [PubMed] |
| 17. | Rossi M, Broglia L, Maccioni F, Bezzi M, Laghi A, Graziano P, Mingazzini PL, Rossi P. Hydro-CT in patients with gastric cancer: preoperative radiologic staging. Eur Radiol. 1997;7:659-664. [PubMed] |
| 18. | Gamon Giner R, Escrig Sos J, Salvador Sanchis JL, Ruiz del Castillo J, Garcia Vila JH, Marcote Valdivieso E. Helical CT evaluation in the preopera-tive staging of gastric adenocarcinoma. Rev Esp Enferm Dig. 2002;94:593-600. [PubMed] |
| 19. | Matsushita M, Oi H, Murakami T, Takata N, Kim T, Kishimoto H, Nakamura H, Okamoto S, Okamura J. Extraserosal invasion in advanced gastric cancer: evaluation with MR imaging. Radiology. 1994;192:87-91. [PubMed] |
| 20. | Fukuya T, Honda H, Hayashi T, Kaneko K, Tateshi Y, Ro T, Maehara Y, Tanaka M, Tsuneyoshi M, Masuda K. Lymph-node metastases: efficacy for detection with helical CT in patients with gastric cancer. Radiology. 1995;197:705-711. [PubMed] |
| 21. | Lee DH, Seo TS, Ko YT. Spiral CT of the gastric carcinoma: staging and enhancement pattern. Clin Imaging. 2001;25:32-37. [PubMed] |
| 22. | Cereceda Perez CN, Urbasos Pascual MI, Romero Castellanos C, Carreira Gomez C, Pinto Varela JM. Helical CT of the stomach: differentiation between benign and malignant pathologies, together with the staging of gastric carcinoma. Rev Esp Enferm Dig. 2002;94:601-612. [PubMed] |
| 23. | de Manzoni G, Verlato G, di Leo A, Guglielmi A, Laterza E, Ricci F, Cordiano C. Perigastric lymph node metastases in gastric cancer: comparison of different staging systems. Gastric Cancer. 1999;2:201-205. [PubMed] |
| 24. | Habermann CR, Weiss F, Riecken R, Honarpisheh H, Bohnacker S, Staedtler C, Dieckmann C, Schoder V, Adam G. Preoperative staging of gastric adenocarcinoma: comparison of helical CT and endoscopic US. Radiology. 2004;230:465-471. [PubMed] |
| 25. | Chen F, Ni YC, Zheng KE, Ju SH, Sun J, Ou XL, Xu MH, Zhang H, Marchal G. Spiral CT in gastric carcinoma: comparison with barium study, fiberoptic gastroscopy and histopathology. World J Gastroenterol. 2003;9:1404-1408. [PubMed] |
| 26. | Ichikura T, Furuya Y, Tomimatsu S, Okusa Y, Ogawa T, Mukoda K, Mochizuki H, Tamakuma S. Relationship between nodal stage and the number of dissected perigastric nodes in gastric cancer. Surg Today. 1998;28:879-883. [PubMed] |
| 27. | Tschmelitsch J, Weiser MR, Karpeh MS. Modern staging in gastric cancer. Surg Oncol. 2000;9:23-30. [PubMed] |