修回日期: 2004-06-09
接受日期: 2004-07-06
在线出版日期: 2004-09-15
目的: 探讨河南省食管癌高发区青年(≤40岁)与中老年(≥50岁)食管癌患者的P53和Rb蛋白表达变化特征及其意义.
方法: 采用免疫组化卵白素-生物素-过氧化物酶复合物(ABC)法和组织病理学方法, 分析72例青年和73例中老年患者食管鳞癌组织中P53和Rb蛋白的表达及其与病变程度和年龄之间的关系.
结果: 青年组和中老年组患者从正常食管上皮→基底细胞过度增生→间变→鳞状细胞癌演变过程中, 随着病变程度的加重, P53和Rb蛋白阳性表达率呈上升趋势, 青年组P53免疫阳性反应的百分率在正常上皮和各级病变组织中均低于中老年组(13% vs 47%, χ2 = 19.162, 21% vs 60%, χ2 = 19.380, 43% vs 93%, χ2 = 16.512, 36% vs 85%, χ2 = 36.213, 以上P值均<0.01), 青年组Rb蛋白阳性表达率在正常上皮和各级病变组织中也均低于中老年组, 但二者无统计学差异(P >0.05). 青年组P53和Rb表达共阳性率为25%, 共阴性率为49%, 二者表达具有明显的一致性(Kappa值=0.442, P <0.01).
结论: P53和Rb可能共同参与青年患者食管上皮的癌变过程, 并在食管癌发生中发挥相互协同的作用; 该地区不同年龄组食管癌变过程中P53蛋白表达变化差异可能与其接触环境致癌原时间长短有关.
引文著录: 孙超, 王立东, 王启鸣, 李定国. 食管癌前病变和癌组织P53和Rb蛋白表达与年龄的关系. 世界华人消化杂志 2004; 12(9): 2222-2225
Revised: June 9, 2004
Accepted: July 6, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2222-2225
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2222.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2222
食管癌具有显著的地域性分布差异, 发病率可相差500倍. 河南省林州市及其毗邻的安阳、辉县等地是食管癌发病率和死亡率最高的地区之一. 食管上皮癌变是由多种致癌因素长期作用, 并由多种基因变化参与的多阶段进行性发展过程[1], 以中老年最常见.然而, 该地区青年食管癌患者并非罕见, 且近年发生率有升高趋势, 与中老年食管癌患者相比, 青年食管癌患者的癌细胞分化差, 易发生浸润性生长和淋巴结转移, 预后差[2]. p53-Rb系统变化是河南食管癌高发区人群食管癌变过程中发生频率最高的分子生物学改变, 且P53和Rb系统相互协同作用共同影响细胞增生状况和癌变[3]. P53和Rb在青年与中老年患者的对比研究尚无报道.我们分析青年与中老年食管癌患者P53和Rb蛋白表达变化特征, 籍以进一步探讨该地区青年人食管癌变的机制.
青年食管癌72例和中老年食管癌73例来自河南省林州市人民医院、姚村食管癌医院和安阳肿瘤医院, 青年组平均年龄6.7±3.3岁(24-40岁); 中老年组59.5±6.2 (50-74岁). 所有患者术前均未接受放化疗. 标本离体后立即用850 mL/L酒精固定, 常规组织学脱水, 石蜡包埋, 5 mm切片, 进行组织病理学诊断和免疫组织化学分析. 诊断标准见参考文献[4]. 根据细胞形态、组织结构和分化程度, 将食管上皮分为: 正常食管上皮(normal epithelium, NOR)、基底细胞过度增生(basal cell hyperplasia, BCH)、不典型增生(dysplasia, DYS)、鳞状细胞癌(squamous cell carcinoma, SCC). P53和Rb鼠抗人mAb购自美国Santa Cruz Biochenology公司; ABC试剂盒和DAB底物试剂盒购自美国Vector公司; 小牛血清白蛋白(bovine serum albumin, BSA)购自美国 Sigma 公司.
采用ABC法, 石蜡切片脱蜡, 梯度酒精脱水; 5 mL/L H2O2室温下孵育20 min; 加正常马血清(1:50)置湿盒内室温下孵育20 min; PBS-BSA (20 g/L) 稀释第一抗体, P53(1:1 000)和Rb(1:100), 湿盒内4 ℃中孵育12 h; PBS-BSA (20 g/L) 稀释生物素标记的鼠二抗1:200, 室温下孵育45 min; ABC室温中孵育60 min (使用前30 min配制); DAB和5 mL/L H2O2混合孵育, 显微镜下观察结果, 适时终止反应; 苏木素复染1 min; 酒精梯度脱水, 二甲苯透明, 中性树胶封片. P53和Rb均以每高倍视野(×400倍)出现≥10%细胞胞核呈棕黄色而胞质不着色为阳性反应[4-5]. 采用生产第二抗体的正常动物血清封闭非特异性免疫球蛋白反应, 采用省略第一抗体作为阴性对照, 已知的阳性切片作为阳性对照. 采用SPSS 10.0统计软件处理, 各组间率的比较采用χ2检验, 线性趋势检验, Kappa检验, 检验标准取a=0.05.
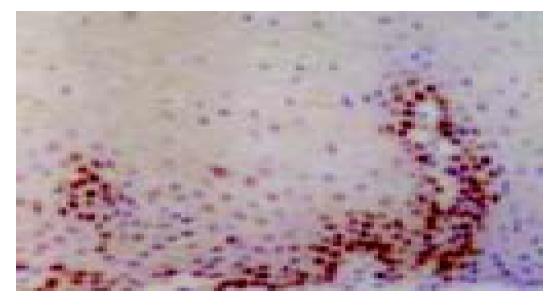
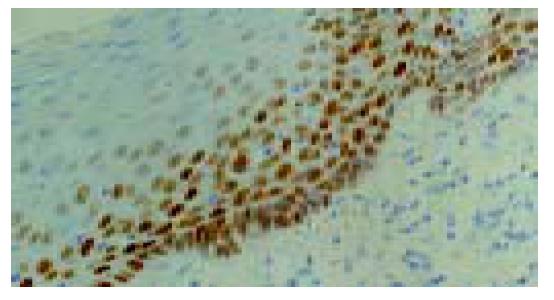
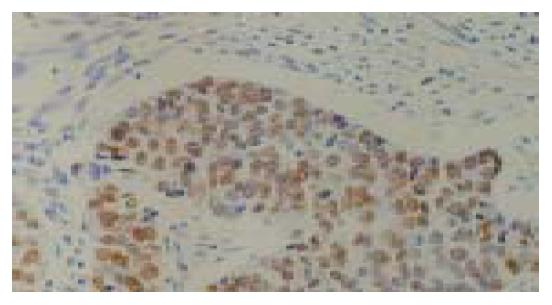
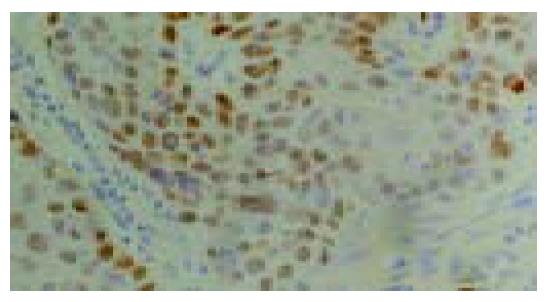
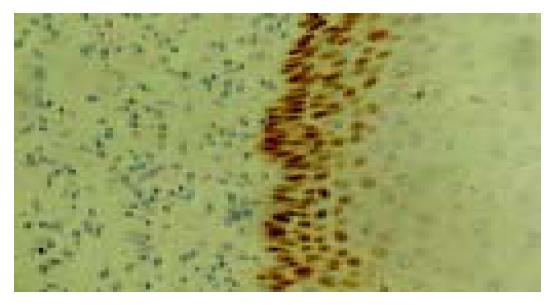
P53免疫阳性反应定位于细胞核, 棕黄色染色, 在正常食管黏膜上皮, 阳性反应细胞多数分布于1-2层基底细胞和乳头区的基底细胞, 间质未见阳性反应(图1-4). 青年组患者从NOR→BCH→DYS→SCC, 随着病变程度的加重, P53蛋白阳性表达率呈上升趋势, 分别为13%、21%、43%和36%. SCC、DYS组与NOR组比较具有非常显著的统计学差异(P <0.01). 中老年组从NOR到各级病变, P53蛋白阳性表达率分别为47%、60%、93%和85%, 各组间具有非常显著的统计学差异(P <0.01). 青年组与中老年组比较, 青年组P53免疫阳性反应的百分率在形态学相似的各组中均低于中老年组(P <0.01). Rb免疫阳性反应定位于细胞核(图5, 6). 青年组和中老年组患者从NOR→BCH→DYS→SCC, 随着病变程度的加重, Rb蛋白阳性表达率均呈上升趋势(P<0.01). 青年组与中老年组比较, 青年组Rb蛋白阳性表达率(12%、20%、35%和40%)在NOR和各级病变组织中均低于中老年组(17%、34%、48%和52%), 但二者无显著差异(P >0.05).
青年组患者P53和Rb表达共阳性率为25%, 共阴性率为49%, 二者表达具有明显的一致性(Kappa值=0.442, P <0.01).
p53-Rb肿瘤抑制基因系统包括p53, Rb, p16, p15, p14, cyclinD1及p21waf等[6-7]. p53与Rb系统相互协同作用共同影响细胞增生状况和癌变[8-10]. 我们先前发现, p53-Rb系统变化是河南食管癌高发区人群食管癌变过程中发生频率最高的分子生物学改变;食管癌组织同时发生p53-Rb基因功能丧失的频率约为59%[3]. 我们及其他实验室以往研究发现, P53和Rb蛋白的阳性表达均随着食管癌变的加重而增加, 提示p53-Rb基因突变可能导致其蛋白抑癌功能的丧失, 细胞周期失去调控, 从而促进肿瘤的发生[11-13]. 本研究表明, 随着病变加重, 青年组和中老年组患者的P53和Rb阳性表达率均呈上升趋势, 具有非常显著的统计学差异(P <0.01), 且青年组P53和Rb在食管癌组织中的表达具有较高的一致性改变, 提示P53 和Rb蛋白参与青年食管上皮的癌变过程, 是青年食管癌重要的分子学变化. p53-Rb系统可能在青年食管癌发生中发挥相互协同的作用, 导致细胞增生调节紊乱, 诱发肿瘤.
我们还发现, 青年组P53免疫阳性反应的百分率在形态学相似的各组中均低于中老年组, 提示该地区不同年龄组食管癌变过程中P53蛋白表达变化差异可能与其接触环境致癌原时间长短有关. 与中老年组比较, 青年组接触环境致癌原时间相对短, p53突变机率可能低, 而p53基因突变是P53蛋白聚集的主要原因[3]. 我们先前对该地区食管癌p53基因突变谱分析表明, 该地区食管癌p53 CpG位点G:C→A:T的发生率高于其他地区食管癌, 而此位点的突变可能主要由亚硝基化合物诱导形成, 提示林州食管癌的发生与环境致癌因素(进食霉变食物)引起的p53基因突变有密切关系[14]. 因此在基因水平进一步分析p53基因的突变, 可能更好地判断P53与青年食管癌患者的关系. 此外, 同一地区青年与中老年暴露于相似的环境, 而青年比中老年患癌提前数十年, 提示个体遗传易感因素在青年食管癌的发生中也起着重要的作用. 青年食管癌患者可能存在代谢环境中致癌因素有关的酶或DNA损伤修复酶功能的改变, 如基因多态变化等, 这些遗传因素的改变可能是导致在同一环境下的青年人较之中老年人更早、更快发生癌变的关键因素. 作者近年的研究证实该地区人群存在O6-烷基鸟嘌呤-DNA烷基转移酶(O6-alkylguanine-DNA alkyltransferase,AGT)、谷胱甘肽S-转移酶(glutathione S-tranferase, GST)以及细胞色素P4501A1等基因多态改变[15-16], 这些酶的改变, 提高该地区人群对食管癌的易感性. 进一步扩大样本量, 了解这些相关酶基因变化与不同年龄人群的关系, 将有助于探讨青年食管癌患者的高易感分子基础. 青年组患者Rb免疫阳性反应的百分率在形态学相似的各组中与中老年组比较无统计学差异, 提示Rb为青年和中老年食管癌变共有的分子学改变; Rb可能协同其他分子共同影响青年食管癌的发生. 本研究对象在年龄范围上与中老年组差距不够大, 可能影响Rb的特异性表达. 有关Rb与青年食管癌变的确切关系尚需进一步研究.
| 4. | Shi ST, Yang GY, Wang LD, Xue Z, Feng B, Ding W, Xing EP, Yang CS. Role of p53 gene mutations in human esophageal carcinogenesis: results from immunohistochemical and mutation analyses of carcinomas and nearby non-cancerous lesions. Carcinogenesis. 1999;20:591-597. [PubMed] [DOI] |
| 5. | Xing EP, Yang GY, Wang LD, Shi ST, Yang CS. Loss of heterozygosity of the Rb gene correlates with pRb protein expression and associates with p53 alteration in human esophageal cancer. Clin Cancer Res. 1999;5:1231-1240. [PubMed] |
| 6. | Xing EP, Nie Y, Song Y, Yang GY, Cai YC, Wang LD, Yang CS. Mechanisms of inactivation of p14ARF, p15INK4b, and p16INK4a genes in human esophageal squamous cell carcinoma. Clin Cancer Res. 1999;5:2704-2713. [PubMed] |
| 7. | Cai YC, Yang GY, Nie Y, Wang LD, Zhao X, Song YL, Seril DN, Liao J, Xing EP, Yang CS. Molecular alterations of p73 in human esophageal squamous cell carcinomas: loss of heterozygosity occurs frequently; loss of imprinting and elevation of p73 expression may be related to defective p53. Carcinogenesis. 2000;21:683-689. [PubMed] [DOI] |
| 8. | Mawrin C, Kirches E, Boltze C, Dietzmann K, Roessner A, Schneider-Stock R. Immunohistochemical and molecular analysis of p53, RB, and PTEN in malignant peripheral nerve sheath tumors. Virchows Arch. 2002;440:610-615. [PubMed] [DOI] |
| 9. | Gregorc V, Darwish S, Ludovini V, Pistola L, De Angelis V, Mihaylova Z, Bellezza G, Sidoni A, Cavaliere A, Bucciarelli E. The clinical relevance of Bcl-2, Rb and p53 expression in advanced non-small cell lung cancer. Lung Cancer. 2003;42:275-281. [PubMed] [DOI] |
| 10. | Cordon-Cardo C. p53 and RB: simple interesting correlates or tumor markers of critical predictive nature? J Clin Oncol. 2004;22:975-977. [PubMed] [DOI] |
| 11. | Dong Wang L, Bin Yue W, Zhou Y, Wei Feng C, Liu B, Zhou Q, Ying Jia Y, Zheng S, Gao SS, Ji Xie X. Endoscopic screening and determination of p53 and proliferating cell nuclear antigen in esophageal multistage carcinogenesis: a comparative study between high- and low-risk populations in Henan, northern China. Dis Esophagus. 2002;15:80-84. [PubMed] [DOI] |
| 12. | 靳 玉兰, 张 伟, 刘 伯齐, 王 洪平, 韩 志楷, 韩 双廷, 曲 平, 李 茉, 丁 镇伟, 林 培中. 食管癌前病变及原位癌组织中Ki67、p53、iNOS的异常表达. 中华肿瘤杂志. 2001;23:129-131. |
| 13. | Mandard AM, Hainaut P, Hollstein M. Genetic steps in the development of squamous cell carcinoma of the esophagus. Mutat Res. 2000;462:335-342. [PubMed] [DOI] |
| 15. | 王 立东, 邹 建湘, 洪 钧言, 周 琦, Deng CJ, Xie DW, Capasso H. 食管癌患者O6-烷基鸟嘌呤-DNA烷基转移酶基因多态性研究. 华人消化杂志. 1998;6:560-563. |
| 16. | Wang LD, Zheng S, Liu B, Zhou JX, Li YJ, Li JX. CYP1A1, GSTs and mEH polymorphisms and susceptibility to esophageal carcinoma: study of population from a high- incidence area in north China. World J Gastroenterol. 2003;9:1394-1397. [PubMed] [DOI] |