修回日期: 2004-09-13
接受日期: 2004-09-19
在线出版日期: 2004-11-15
目的: 观察脆性组氨酸三联体(FHIT)基因和nm23基因在胃癌中的表达, 探讨其与胃癌临床病理因素的关系.
方法: 采用PV9000免疫组化二步法检测98例胃癌组织中FHIT和nm23蛋白的表达.
结果: FHIT和nm23在胃癌中表达率分别为38.8%(38/98)和33%(28/87). FHIT蛋白的缺失在胃癌中占62.1%. 胃癌中FHIT的缺失与组织学类型, Lauren分型和淋巴结转移相关(P<0.05);临床病理分期愈晚, FHIT蛋白表达缺失率愈高, 但无显著差异(P>0.05). nm23蛋白阳性表达与临床病理分期, 淋巴结转移呈负相关(P<0.05).
结论: 胃癌组织中FHIT蛋白的缺失是频发事件, FHIT可能是胃癌发生中重要的侯选抑癌基因. FHIT及nm23基因编码蛋白在胃癌中的表达与胃癌淋巴结转移密切相关, 且可能共同起作用, 可作为临床预测转移及估计预后的重要指标.
引文著录: 高余佳, 毛晓韵, 吴东瑛, 张淑敏, 辛彦. FHIT及nm23-H1基因编码蛋白表达与胃癌临床病理生物学行为. 世界华人消化杂志 2004; 12(11): 2534-2538
Revised: September 13, 2004
Accepted: September 19, 2004
Published online: November 15, 2004
AIM: To explore the expression of fragile histidine triad (FHIT) and non-metastasis 23-H1 (nm23-H1) and to investigate their relations with clinicopathological behaviors of gastric cancer.
METHODS: PV9000 two-step immunohistochemical method was employed to detect the expression of FHIT and nm23-H1 in 98 cases of gastric cancer.
RESULTS: The positive rates of FHIT and nm23-H1 expression were 38.8% (38/98) and 33% (28/87) respectively. The FHIT expression related to the histological classification, Lauren classification and lymph node metastasis of gastric cancer (P < 0.05). The positive rate of FHIT protein expression became higher with the development of gastric cancer, but there was no significance (P > 0.05). The nm23-H1 expression was negatively related to clinical staging and lymph node metastasis (P < 0.05).
CONCLUSION: FHIT may be an important candidate of tumor suppressor gene in gastric cancer. The expression of FHIT and nm23-H1 protein has close relations with lymph node metastasis in gastric cancer, and they may work synergistically and can be important markers for predicting metastasis and evaluating prognosis of gastric cancer.
- Citation: Gao YJ, Mao XY, Wu DY, Zhang SM, Xin Y. Protein expression of fragile histidine triad and non-metastasis 23-H1 and their clinicopathological significance in gastric cancer. Shijie Huaren Xiaohua Zazhi 2004; 12(11): 2534-2538
- URL: https://www.wjgnet.com/1009-3079/full/v12/i11/2534.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i11.2534
胃癌是我国发病率和死亡率最高的恶性肿瘤之一[1-4], 胃癌的发生发展涉及多种原癌基因的激活[5-8]和抑癌基因的失活[9-12]. 脆性组氨酸三联体基因(fragile histidine triad, FHIT)在许多肿瘤中有改变[13-16], 以缺失为主, 还有外源性序列的插入[21]. nm23(non-metastasis 23)基因的表达与多种人类恶性肿瘤的发生发展呈负相关[17-25], 提示他是一种能抑制肿瘤转移表型的转移抑制基因[26-28]. 二者与肿瘤的发生、侵袭及转移抑制有一定的关系. 我们采用免疫组化方法对FHIT及nm23-H1基因在胃癌发生发展过程中的作用.
1991-01/1992-02中国医科大学附属第一医院肿瘤科及辽宁省肿瘤医院外科手术切除胃癌标本98例. 其中早期6例, 中期16例, 晚期76例, 术前未放化疗, 平均年龄54岁, 男69例, 女29例. 组织学类型(按WHO胃癌组织学分型标准)包括乳头状腺癌12例; 管状腺癌60例, 其中高分化3例, 中分化12例, 低分化45例; 未分化癌4例; 印戒细胞癌17例; 黏液腺癌5例. 在98例胃癌标本中, 有相应癌旁黏膜者94例, 其中39例可观察到癌旁黏膜肠上皮化生, 4例可观察到癌旁胃黏膜不典型增生.
标本以40 g/L甲醛固定, 石蜡包埋, 4 μm切片, 而后进行HE染色以确定其病理诊断和病理学特征并进行免疫组化染色.本实验免疫组化染色采用美国GBI技术有限公司近年推出的免疫组化检测二步法, Immuno-Bridge+试剂盒, 兔抗人FHIT多克隆抗体(工作浓度1:50)和鼠抗人nm23单克隆抗体(工作浓度1:100)均购自北京中山生物技术有限公司, 用PBS代替一搞作阴性对照, 以中山公司赠送阳性切片为阳性对照, FHIT和nm23-H1蛋白免疫染色阳性信号定位于细胞质, 呈棕黄色颗粒. 每个标本随机观察5个有代表性的高倍视野, 每个视野计数200个细胞确定其染色强度并取平均值. 阳性细胞数<5%为阴性(-), 5-25%为弱阳性(+), 25-50%为中度阳性(++), >50%为强阳性(+++).
统计学处理 计数资料采用χ2检验. P<0.05视为有显著统计学差异.
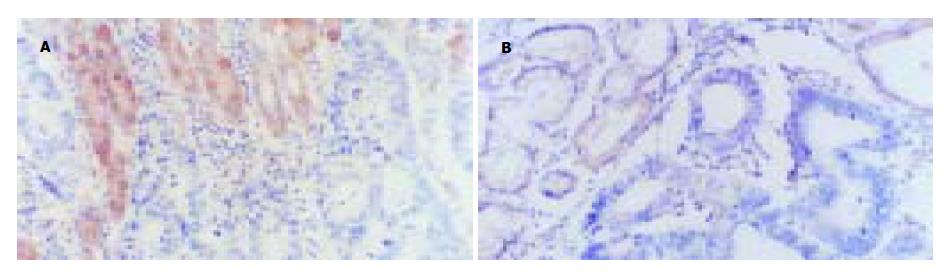
正常胃黏膜的胃体腺, 胃窦腺及癌旁黏膜组织的肠上皮化生FHIT蛋白阳性表达率高, 而在表层上皮, 不典型增生及胃癌中FHIT蛋白阳性表达率低, 且有显著差异(P<0.05). 在98例胃癌组织中60例(61.2%)FHIT蛋白缺失(表达阴性), 其余为强弱不等的阳性(38.8%). 阳性表达者乳头状腺癌9例; 管状腺癌18例(其中高分化2例, 中分化6例, 低分化10例); 未分化2例; 印戒细胞癌6例, 黏液腺癌3例. Lauren分型中: 71例弥漫型胃癌中有21例呈阳性, 27例肠型胃癌中有17例呈阳性. 淋巴结转移阳性组FHIT蛋白表达率(30.1%, 22/73)显著低于未转移者(64.0%, 16/25)(P<0.05). 早期胃癌FHIT蛋白阳性率66.7%(4/6), 中期胃癌阳性率43.8%(7/16), 晚期胃癌阳性率35.5%(27/76), 无明显统计学差异(P>0.05). 淋巴结转移灶FHIT蛋白表达阴性37例中, 其原发灶FHIT蛋白表达阳性5例(表1, 图1).
| 分组 | n | FHIT表达 | 阳性率% | P | |
| +~+++ | - | ||||
| 正常表层胃黏膜 | 13 | 1 | 12 | 7.7 | <0.05 |
| 正常胃体腺 | 31 | 31 | 0 | 100 | |
| 正常胃窦腺 | 7 | 6 | 1 | 85.7 | |
| 肠上皮化生 | 39 | 39 | 0 | 100 | |
| 不典型增生 | 4 | 2 | 2 | 50 | |
| 胃癌 | 98 | 38 | 60 | 38.8 | |
| 乳头状腺癌 | 12 | 9 | 3 | 75 | <0.05 |
| 高分化管状腺癌 | 3 | 2 | 1 | 66.7 | |
| 中分化管状腺癌 | 12 | 6 | 6 | 50 | |
| 低分化管状腺癌 | 45 | 10 | 35 | 22.2 | |
| 未分化癌 | 4 | 2 | 2 | 50 | |
| 印戒细胞癌 | 17 | 6 | 11 | 35.3 | |
| 黏液腺癌 | 5 | 3 | 2 | 60 | |
| 弥漫型 | 71 | 21 | 50 | 29.6 | <0.01 |
| 肠 型 | 27 | 17 | 10 | 63 | |
| 胃癌原发灶 | 50 | 14 | 36 | 28.0 | >0.05 |
| 淋巴转移灶 | 50 | 13 | 37 | 26.0 | |
| 胃癌伴淋巴转移 | 73 | 22 | 51 | 30.1 | <0.05 |
| 胃癌不伴淋巴转移 | 25 | 16 | 9 | 64 | |
| 弥漫型原发灶 | 29 | 29 | 0 | 100 | >0.05 |
| 癌旁肠化生 | 29 | 29 | 0 | 100 | |
| 肠型原发灶 | 10 | 10 | 0 | 100 | >0.05 |
| 癌旁肠化生 | 10 | 10 | 0 | 100 | |
| 合计 | 39 | 39 | 0 | 100 | |
胃癌标本中nm23-H1蛋白阳性表达率为33%(29/87). nm23-H1蛋白在Lauren分型中: 弥漫型表达率为34%(23/67), 肠型阳性表达率为30%(6/20), 其差异无显著性(P>0.05), nm23-H1蛋白的表达随肿瘤的临床病理分期的演进而降低, 有显著的差异(P<0.05). nm23蛋白阳性表达的病例中只有12例出现淋巴结转移, 转移率41%, 而在58例nm23-H1阴性表达的病例中淋巴结转移率高达91%, nm23-H1阳性表达者淋巴结转移率明显低于阴性表达者(P<0.05, 图2).
FHIT(fragile histidine triad)基因存在于大多数正常组织中[16-17], 而多种肿瘤组织中FHIT表达降低或丢失, 提示FHIT基因为多种肿瘤的候选抑制基因[18-20]. 由于在染色体3p14.2上发现原发性胃癌存在着高机率的杂合子缺失和胃癌细胞株纯合子缺失, 而FHIT基因正是位于这个位点, 因此认为FHIT基因在胃癌的发生发展过程中起着重要作用[29]. Huiping et al[30]检测50例胃癌患者FHIT基因的改变, 发现84%患者存在该部位一个或多个微卫星标记的杂合性缺失, 导致FHIT等位基因全部或部分缺失. 87%患者RT-PCR产物有异常FHIT转录本. 测序结果显示, 异常的FHIT转录本的产生均符合"GT-AG"的剪切原则, 因此, 该位点高度的不稳定性致FHIT mRNA前体剪切异常可能是FHIT异常转录本高频率出现的主要原因. 78%胃癌患者FHIT蛋白表达减少或完全缺失. 此外, 27%患者癌细胞内存在由细胞错配修复机制的异常微卫星不稳定性(MSI), 其中77%MSI位于FHIT基因第4, 5内含子, 内含子MSI的出现可致FHIT的mRNA前体异常剪切或FHIT基因转录功能降低, 而使FHIT蛋白表达减少, 晚期胃癌患者FHIT蛋白表达水平与局部淋巴结转移率呈负相关. Baffa et al对原发性胃癌的研究发现, 51%的标本存在FHIT基因的缺失或重排, 而67%的癌组织缺乏FHIT蛋白的表达. 胃癌是长期暴露于致癌因素中发展而来, FHIT基因中包含脆性位点FRA3B和t(3;8)易位的断裂位点. 因此对致癌因素诱导的改变极其敏感. 这可能是胃癌中FHIT基因异常率高的原因. Lee et al[31-32]实验表明, FHIT蛋白缺失率表达62.9%且与年龄, 性别, 肿瘤部位, 临床分期等临床因素无相关性. Capuzzi et al对55例胃腺癌的研究表明, 49%的病例显示FHIT蛋白完全缺失, 胃癌中FHIT蛋白表达缺失与Lauren分型, 肿瘤浸润, 核分级无关, 而与分级, 分期, 生存期相关, 分级愈高, 分期愈晚, FHIT基因缺失率愈高. FHIT蛋白表达阴性患者存活时间明显低于FHIT蛋白表达阳性患者. 我们研究结果FHIT蛋白缺失率为61.2%, 与文献报道相近, FHIT蛋白表达缺失与肿瘤的组织学类型, Lauren分型及淋巴结转移由显著相关性(P<0.05), 亦与临床病理分期有关, 分期愈晚, FHIT蛋白缺失率愈高, 但并无统计学意义, 只可能是由于本组资料中早期胃癌例数太少所致. 表明FHIT基因及其表达产物的异常是胃癌中常见的肿瘤抑制机制: ApnA-FHIT聚合物细胞调亡传导信号假说, Sard和Ji et al的转基因研究提示FHIT基因可能参与了调节细胞调亡型号的传导, 从结构和功能上看FHIT蛋白均是一种典型的ApnA水解酶, 而ApnA又是参与细胞内增值的调亡信号传导的重要因子, 以上研究提示FHIT基因, ApnA细胞增值和调亡之间可能存在某种内在的联系.
nm23基因是1988年由Steeg et al首先分离并鉴定的一种与肿瘤转移表型抑制相关的基因, 与核苷二磷酸激酶(NDPK)有高度同源性[33-34]. 近年来已分离到人的两个nm23DNA克隆, 即nm23-H1和nm23-H2型, nm23-H1和nm23-H2为两个完全不相同的基因, 而且他们受两个独立的调控系统所调节. nm23-H1低表达者癌组织浸润深度和淋巴结转移率大于表达高者. Wang et al[35]对胃癌患者nm23-H1mrna水平检测结果表明T3, T4期胃癌的nm23-H1mRNA水平较T1, T2期明显降低. 有淋巴结转移的mRNA水平低于无淋巴结转移组, 分化好的胃癌mRNA水平高于分化差的胃癌; nm23-H1RNA水平低的患者总生存时间缩短. 本组研究表明, nm23蛋白阳性表达与临床病理分期及淋巴结转移显负相关(P<0.05). 提示nm23-H1基因的缺失和突变与胃癌淋巴列转移有关, nm23基因在胃癌淋巴结转移中发挥负性调节作用. nm23-H1很可能是通过NDPK相似的途径调节细胞信号的传递, 细胞分化等过程中发挥作用. NDPK是细胞二磷酸核苷的供给者, 通过信号转导影响肿瘤细胞微管聚合从而调节细胞骨架蛋白的活动, 抑制癌的转移, 此外, NDPK参与影响G蛋白的信号传递发挥负调节作用, 影响构型, 运动, 黏附及有丝分裂纺锤体的形成, 最终控制细胞增值. 所有这些作用直接影响了肿瘤形成和转移表型的表达. Steeg et al认为Ela基因抑制ras基因激活的癌细胞转移是通过促进细胞内nm23基因而实现的. 因此, nm23基因的变化绝不是单一的变化, 是多个基因之间的协调作用, 从而影响肿瘤的形成与转移. 另外, 本研究发现, 在nm23-H1阳性表达26例中, FHIT阳性表达率为61.5%(16/26), 而nm23-H1阴性表达52例中, FHIT阴性表达率为71.2%(37/52), 表明FHIT和nm23-H1蛋白表达有明显正相关性P<0.05, 说明FHIT, nm23-H1基因在胃癌细胞的浸润, 转移中可能共同起作用. 其确切机制尚待进一步深入研究.
编辑:N/A
| 1. | Yu Y, Zhang YC, Zhang WZ, Shen LS, Hertzog P, Wilson TJ, Xu DK. Ets1 as a marker of malignant potential in gastric carcinoma. World J Gastroenterol. 2003;9:2154-2159. [PubMed] [DOI] |
| 2. | Wang MC, Yang YM, Li XH, Dong F, Li Y. Maspin expression and its clinicopathological significance in tumorigenesis and progression of gastric cancer. World J Gastroenterol. 2004;10:634-637. [PubMed] [DOI] |
| 3. | Fu YG, Qu YJ, Wu KC, Zhai HH, Liu ZG, Fan DM. Apoptosis-inducing effect of recombinant Caspase-3 expressed by constructed eukaryotic vector on gastric cancer cell line SGC7901. World J Gastroenterol. 2003;9:1935-1939. [PubMed] [DOI] |
| 4. | Zhao XH, Gu SZ, Liu SX, Pan BR. Expression of estrogen receptor and estrogen receptor messenger RNA in gastric carcinoma tissues. World J Gastroenterol. 2003;9:665-669. [PubMed] [DOI] |
| 5. | Li HX, Chang XM, Song ZJ, He SX. Correlation between expression of cyclooxygenase-2 and angiogenesis in human gastric adenocarcinoma. World J Gastroenterol. 2003;9:674-677. [PubMed] [DOI] |
| 6. | Lan J, Xiong YY, Lin YX, Wang BC, Gong LL, Xu HS, Guo GS. Helicobacter pylori infection generated gastric cancer through p53-Rb tumor-suppressor system mutation and telomerase reactivation. World J Gastroenterol. 2003;9:54-58. [DOI] |
| 7. | Xin Y, Li XL, Wang YP, Zhang SM, Zheng HC, Wu DY, Zhang YC. Relationship between phenotypes of cell-function differentiation and pathobiological behavior of gastric carcinomas. World J Gastroenterol. 2001;7:53-59. [PubMed] [DOI] |
| 8. | Han CB, Li F, Zhao YJ, Ma JM, Wu DY, Zhang YK, Xin Y. Variations of mitochondrial D-loop region plus downstream gene 1 2S rRNA-tRNA(phe) and gastric carcinomas. World J Gastroenterol. 2003;9:1925-1929. [PubMed] [DOI] |
| 9. | Lan J, Xiong YY, Lin YX, Wang BC, Gong LL, Xu HS, Guo GS. Helicobacter pylori infection generated gastric cancer through p53-Rb tumor-suppressor system mutation and telomerase reactivation. World J Gastroenterol. 2003;9:54-58. [PubMed] [DOI] |
| 10. | Zhang XM, Sheng SR, Wang XY, Bin LH, Wang JR, Li GY. Expression of tumor related gene NAG6 in gastric cancer and restriction fragment length polymorphism analysis. World J Gastroenterol. 2004;10:1361-1364. [PubMed] |
| 11. | Zhao GH, Li TC, Shi LH, Xia YB, Lu LM, Huang WB, Sun HL, Zhang YS. Relationship between inactivation of p16 gene and gastric carcinoma. World J Gastroenterol. 2003;9:905-909. [PubMed] [DOI] |
| 12. | Han CB, Li F, Yang XF, Mao XY, Wu DY, Xin Y. Alteration of mtDNA copy number in gastric carcinoma. Shijie Huaren Xiaohua Zazhi. 2004;12:258-261. |
| 13. | Kuroki T, Trapasso F, Yendamuri S, Matsuyama A, Alder H, Williams NN, Kaiser LR, Croce CM. Allelic loss on chromosome 3p21.3 and promoter hypermethylation of semaphorin 3B in non-small cell lung cancer. Cancer Res. 2003;63:3352-3355. [PubMed] |
| 14. | Kuwai T, Tanaka S, Kaio E, Hiyama T, Ito M, Kitadai Y, Sumii M, Yoshihara M, Haruma K, Chayama K. Clinical significance of Fhit expression in development of colorectal carcinoma of various macroscopic types. Int J Mol Med. 2003;12:437-442. [PubMed] [DOI] |
| 15. | Mady HH, Melhem MF. FHIT protein expression and its relation to apoptosis, tumor histologic grade and prognosis in colorectal adenocarcinoma: an immunohistochemical and image analysis study. Clin Exp Metastasis. 2002;19:351-358. [PubMed] [DOI] |
| 16. | Yendamuri S, Kuroki T, Trapasso F, Henry AC, Dumon KR, Huebner K, Williams NN, Kaiser LR, Croce CM. WW domain containing oxidoreductase gene expression is altered in non-small cell lung cancer. Cancer Res. 2003;63:878-881. [PubMed] |
| 17. | Zhao P, Song X, Nin YY, Lu YL, Li XH. Loss of fragile histidine triad protein in human hepatocellular carcinoma. World J Gastroenterol. 2003;9:1216-1219. [PubMed] [DOI] |
| 18. | Huang LW, Chao SL, Chen TJ. Reduced Fhit expression in cervical carcinoma: correlation with tumor progression and poor prognosis. Gynecol Oncol. 2003;90:331-333. [DOI] |
| 19. | Yang Q, Nakamura Y, Nakamura M, Yoshimura G, Suzuma T, Umemura T, Mori I, Sakurai T, Kakudo K. Loss of Msh2 is not associated with FHIT deletion in breast carcinomas. Anticancer Res. 2002;22:2591-2595. [PubMed] |
| 20. | Tsujiuchi T, Sasaki Y, Kubozoe T, Konishi Y, Tsutsumi M. Alterations in the Fhit gene in pancreatic duct adenocarcinomas induced by N-nitrosobis(2-oxopropyl)amine in hamsters. Mol Carcinog. 2003;36:60-66. [PubMed] [DOI] |
| 21. | Sükösd F, Kuroda N, Beothe T, Kaur AP, Kovacs G. Deletion of chromosome 3p14.2-p25 involving the VHL and FHIT genes in conventional renal cell carcinoma. Cancer Res. 2003;63:455-457. [PubMed] |
| 22. | Wang YF, Chow KC, Chang SY, Chiu JH, Tai SK, Li WY, Wang LS. Prognostic significance of nm23-H1 expression in oral squamous cell carcinoma. Br J Cancer. 2004;90:2186-2193. [PubMed] [DOI] |
| 23. | Soliani P, Ziegler S, Romani A, Corcione L, Campanini N, Dell'Abate P, Del Rio P, Sianesi M. Prognostic significance of nm23 gene product expression in patients with colorectal carcinoma treated with radical intent. Oncol Rep. 2004;11:1193-1200. [PubMed] [DOI] |
| 24. | Goncharuk VN, del-Rosario A, Kren L, Anwar S, Sheehan CE, Carlson JA, Ross JS. Co-downregulation of PTEN, KAI-1, and nm23-H1 tumor/metastasis suppressor proteins in non-small cell lung cancer. Ann Diagn Pathol. 2004;8:6-16. [PubMed] [DOI] |
| 25. | Niitsu N, Nakamine H, Okamoto M, Akamatsu H, Higashihara M, Honma Y, Okabe-Kado J, Hirano M. Clinical significance of intracytoplasmic nm23-H1 expression in diffuse large B-cell lymphoma. Clin Cancer Res. 2004;10:2482-2490. [PubMed] [DOI] |
| 26. | Nanashima A, Yano H, Yamaguchi H, Tanaka K, Shibasaki S, Sumida Y, Sawai T, Shindou H, Nakagoe T. Immunohistochemical analysis of tumor biological factors in hepatocellular carcinoma: relationship to clinicopathological factors and prognosis after hepatic resection. J Gastroenterol. 2004;39:148-154. [PubMed] [DOI] |
| 27. | Chen JQ, Zhan WH, He YL, Peng JS, Wang JP, Cai SR, Ma JP. Expression of heparanase gene, CD44v6, MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinomas. World J Gastroenterol. 2004;10:776-782. [PubMed] |
| 28. | D'Angelo A, Garzia L, Andre A, Carotenuto P, Aglio V, Guardiola O, Arrigoni G, Cossu A, Palmieri G, Aravind L. Prune cAMP phosphodiesterase binds nm23-H1 and promotes cancer metastasis. Cancer Cell. 2004;5:137-149. [DOI] |
| 29. | Rocco A, Schandl L, Chen J, Wang H, Tulassay Z, McNamara D, Malfertheiner P, Ebert MP. Loss of FHIT protein expression correlates with disease progression and poor differentiation in gastric cancer. J Cancer Res Clin Oncol. 2003;129:84-88. [PubMed] |
| 30. | Huiping C, Kristjansdottir S, Bergthorsson JT, Jonasson JG, Magnusson J, Egilsson V, Ingvarsson S. High frequency of LOH, MSI and abnormal expression of FHIT in gastric cancer. Eur J Cancer. 2002;38:728-735. [PubMed] [DOI] |
| 31. | Lee SH, Kim WH, Kim HK, Woo KM, Nam HS, Kim HS, Kim JG, Cho MH. Altered expression of the fragile histidine triad gene in primary gastric adenocarcinomas. Biochem Biophys Res Commun. 2001;284:850-855. [PubMed] [DOI] |
| 32. | Lee SH, Kim CJ, Park HK, Koh JW, Cho MH, Baek MJ, Lee MS. Characterization of aberrant FHIT transcripts in gastric adenocarcinomas. Exp Mol Med. 2001;33:124-130. [PubMed] [DOI] |
| 33. | Postel EH. Multiple biochemical activities of NM23/NDP kinase in gene regulation. J Bioenerg Biomembr. 2003;35:31-40. [PubMed] [DOI] |
| 34. | Roymans D, Willems R, Van Blockstaele DR, Slegers H. Nucleoside diphosphate kinase (NDPK/NM23) and the waltz with multiple partners: possible consequences in tumor metastasis. Clin Exp Metastasis. 2002;19:465-476. [PubMed] [DOI] |
| 35. | Wang CS, Lin KH, Hsu YC. Alterations of thyroid hormone receptor alpha gene: frequency and association with Nm23 protein expression and metastasis in gastric cancer. Cancer Lett. 2002;175:121-127. [DOI] |